Las tasas de mortalidad y morbilidad de la enfermedad pulmonar obstructiva crónica (EPOC) han aumentado mundialmente de forma significativa durante las últimas décadas. A pesar de que el humo de tabaco se sigue considerando el principal factor etiopatogénico para el desarrollo de la enfermedad, se estima que entre una tercera y una cuarta parte de los pacientes con EPOC son no fumadores. De todos los factores de riesgo que pueden incrementar la probabilidad de sufrir EPOC en estos sujetos se ha propuesto al humo de biomasa como uno de los más importantes, afectando sobre todo a mujeres y a niños de países emergentes.
Aunque existen numerosas evidencias epidemiológicas que relacionan la exposición al humo de biomasa con efectos nocivos para la salud, todavía no se conocen bien los mecanismos celulares y moleculares específicos mediante los cuales este contaminante puede suponer una noxa para los sistemas respiratorio y cardiovascular. En esta revisión se recogen los mecanismos patogénicos propuestos hasta la fecha que sitúan al humo de biomasa como uno de los principales factores de riesgo para la EPOC.
Chronic obstructive pulmonary disease (COPD) mortality and morbidity have increased significantly worldwide in recent decades. Although cigarette smoke is still considered the main risk factor for the development of the disease, estimates suggest that between 25% and 33% of COPD patients are non-smokers. Among the factors that may increase the risk of developing COPD, biomass smoke has been proposed as one of the most important, affecting especially women and children in developing countries.
Despite the epidemiological evidence linking exposure to biomass smoke with adverse health effects, the specific cellular and molecular mechanisms by which this pollutant can be harmful for the respiratory and cardiovascular systems remain unclear. In this article we review the main pathogenic mechanisms proposed to date that make biomass smoke one of the major risk factors for COPD.
La enfermedad pulmonar obstructiva crónica (EPOC) es un proceso patológico lento y progresivo caracterizado por la obstrucción permanente, y no totalmente reversible, del flujo de aire en los bronquiolos y por la destrucción del parénquima pulmonar, conocida como enfisema1. El origen de la EPOC se asocia a una exposición crónica a gases nocivos y partículas, especialmente al humo del tabaco, que provoca una respuesta inflamatoria anormal en pulmones y a nivel sistémico2-5. Sin embargo, las causas de la patología son multifactoriales, y pueden incluir tanto trastornos genéticos como factores ambientales1.
A pesar de que el humo de tabaco sigue siendo considerado el principal factor de riesgo para desarrollar la enfermedad6, cada vez hay más datos que indican que entre una tercera y una cuarta parte de todos los casos de EPOC se dan en sujetos no fumadores7. Así, estimaciones basadas en los criterios espirométricos de la Iniciativa Global para la Enfermedad Pulmonar Obstructiva Crónica (GOLD) apuntan que el 17-38,8% de pacientes con EPOC en todo el mundo son no fumadores7, con valores como un 23% en Estados Unidos8, un 22,9% en el Reino Unido9 o un 23,4% en España10. Estudios epidemiológicos realizados en países emergentes también han revelado una alta prevalencia de EPOC en no fumadores. Así, el estudio PLATINO11, desarrollado en 5 ciudades latinoamericanas, mostró que los no fumadores representaban el 26% de todos los sujetos con obstrucción de flujo aéreo no reversible. Por su parte, un estudio de similares características metodológicas llevado a cabo en China reportó que la prevalencia global de la EPOC entre los no fumadores era del 5,2%12.
Entre los diversos factores de riesgo que pueden contribuir al desarrollo de la EPOC en estos sujetos destacan la predisposición genética, la exposición laboral a polvos y productos químicos, la dieta, infecciones respiratorias recurrentes durante la niñez y la contaminación del aire, tanto en ambientes exteriores como en interiores13. Dentro de este último grupo, durante los últimos años ha habido un creciente interés hacia el humo de biomasa como un importante elemento contaminante susceptible de causar EPOC13.
El humo de biomasa como contaminanteSe entiende por biomasa como fuente de energía toda aquella materia orgánica procedente de animales o vegetales que puede ser usada como combustible. Esta definición cubre un amplio rango de materiales, siendo los más usados la madera, los residuos agrícolas como ramas y hierbas secas, el estiércol y el carbón14. Estos elementos son quemados habitualmente en chimeneas y estufas con un sistema de ventilación deficiente, generando cantidades sensibles de contaminantes perjudiciales para la salud que pueden llegar a niveles de exposición entre 10 y 20 veces superiores a las recomendaciones de la Organización Mundial de la Salud (OMS)15.
El humo emitido en la quema de biomasa contiene más de 250 compuestos orgánicos que pueden variar en función del tipo de material y de las condiciones de la combustión16. Así, se puede generar un amplio espectro de contaminantes gaseosos (monóxido de carbono, amoníaco, ácido cianhídrico, formaldehído, óxidos de nitrógeno y azufre, etc.) además de compuestos orgánicos volátiles como el benceno e hidrocarburos aromáticos policíclicos (PAH) como el benzopireno, estos 2 últimos potentes carcinógenos para humanos17,18. Por otro lado, el humo de biomasa contiene una mezcla de partículas sólidas y líquidas de número, tamaño, superficie y composición química variables, llamadas partículas de materia (PM)18. Algunas de ellas pueden llegar a ser respiradas y se clasifican según su diámetro aerodinámico en PM10 (partículas gruesas, de diámetro aerodinámico de 10μm o menos), PM2,5 (partículas finas, de diámetro aerodinámico de 2,5μm o menos) y PM0,1 (partículas ultrafinas, de diámetro aerodinámico de 0,1μm o menos). De manera general, las PM10 son partículas minerales con componentes cristalinos o amorfos y elementos adsorbidos de origen diverso como hongos, bacterias o endotoxinas19. Por su parte, las PM2,5 son ricas en metales de transición, lo que les confiere gran capacidad de generar estrés oxidativo, y suelen consistir en un núcleo de carbono con componentes orgánicos e inorgánicos adsorbidos a su superficie20. Finalmente, las partículas ultrafinas son ricas en PAH, por lo que también poseen un gran potencial de inducir estrés oxidativo20,21.
Existen multitud de estudios que respaldan la hipótesis de que la inhalación de estos contaminantes tiene efectos nocivos para la salud y constituye un factor de riesgo de padecer no solo EPOC, sino también infecciones respiratorias, asma, cáncer de pulmón, afecciones cardiovasculares, cataratas, accidentes vasculares encefálicos e incluso efectos adversos en el desarrollo neonatal22.
Población de riesgoEn la actualidad, se calcula que aproximadamente el 50% de la población mundial y el 90% de los hogares en zonas rurales recurren a la quema de biomasa como principal fuente de energía doméstica para cocinar o para calefacción23. Más del 80% de los hogares en China, India y el África subsahariana usan biomasa como combustible, mientras que en áreas rurales de Latinoamérica la proporción oscila entre el 30 y el 75%24. A pesar de que este uso está especialmente extendido en países emergentes, el aumento de los precios de combustibles fósiles como el petróleo o el gas natural, junto con las preocupaciones medioambientales por las emisiones de CO2, han resultado en un incremento del uso de la biomasa como combustible también en países desarrollados como Alemania, Finlandia, Canadá, Australia o Estados Unidos24-27.
El hecho de que alrededor de 3.000 millones de personas en todo el mundo estén expuestas al humo de biomasa, en comparación a los 1.000 millones que fuman tabaco, ha llevado a plantear la idea de que el humo de biomasa podría ser el factor de riesgo más importante para desarrollar EPOC a nivel global14. Sin embargo, existen razones socioculturales que hacen de las mujeres y los niños los principales grupos de población expuestos a este contaminante, el cual se estima que contribuye a la muerte de 2 millones de mujeres y niños al año en todo el mundo28. Esto es así porque en muchos países emergentes es común que las mujeres, acompañadas por sus niños, permanezcan en las viviendas durante muchas horas cocinando o cerca de las estufas.
En este contexto, se estima que las mujeres pasan un promedio de más de 60.000 horas de su vida cocinando cerca de una estufa de biomasa, período durante el cual inhalan un volumen total de más de 25 millones de litros de aire contaminado23. Este dato es significativo, dado que se ha demostrado que los síntomas respiratorios y la limitación al flujo de aire se incrementan con el tiempo de exposición al humo de biomasa29,30. Consecuentemente, diversos estudios han mostrado que las mujeres que usan biomasa como combustible para cocinar tienen una mayor prevalencia de síntomas respiratorios de EPOC que aquellas que no usan este tipo de combustible31-39. De hecho, el 50% de muertes por EPOC en países en vías de desarrollo son atribuibles al humo de biomasa, y el 75% de estas muertes se da en mujeres40.
Por otro lado, a pesar de que la EPOC afecta mayormente a personas adultas, diversos estudios muestran que el origen de muchas enfermedades crónicas puede estar en el desarrollo fetal y en los primeros años de vida41. En un estudio reciente, Epstein et al.42 demostraron que aquellos niños cuyas madres usaban biomasa en sus hogares tenían un peso al nacer menor que aquellos cuyas madres usaban otro tipo de combustible. Estos resultados son relevantes, puesto que se conoce que un bajo peso al nacer es un factor de riesgo independiente para el desarrollo de la EPOC, asociado a un desarrollo y función pulmonares deficientes durante la niñez y la etapa adulta43. En otro estudio desarrollado en una zona rural de la India, los escolares en cuyas viviendas se usaban combustibles de biomasa presentaron unos valores del volumen espiratorio forzado en el primer segundo (VEF1) y de capacidad vital forzada (CVF) significativamente inferiores que aquellos en cuyas residencias se usaba gas licuado de petróleo44. Además, se sabe que la contaminación por humo de biomasa en ambientes interiores aumenta el riesgo de sufrir infecciones respiratorias45-47, lo cual es un factor a tener en cuenta puesto que las infecciones sufridas durante la niñez pueden predisponer a la EPOC en el adulto24.
A pesar de que mujeres y niños constituyen la población con mayor exposición al humo de biomasa, un estudio reciente desarrollado en 922 pacientes con EPOC de 7 ciudades asiáticas mostró que el 31% de los hombres también habían estado expuestos a este tipo de contaminación48. Aunque el porcentaje es menor que el encontrado en mujeres (44,8%), la cifra es relevante. En este sentido, los resultados de un metaanálisis llevado a cabo en población asiática y no asiática revelaron que las personas expuestas al humo de biomasa tienen 2,44 veces más probabilidad de desarrollar EPOC comparadas con las no expuestas49. Esta exposición fue identificada como factor de riesgo tanto en hombres (OR: 4,30; IC95%: 1,85-10,01) como en mujeres (OR: 2,73; IC95%: 2,28-3,28)49. Datos de otro estudio reciente confirman la asociación entre la obstrucción al flujo de aire en no fumadores y cocinar con carbón en ambos sexos50.
Mecanismos patogénicos del humo de biomasa en la enfermedad pulmonar obstructiva crónicaTeniendo en cuenta que el humo de biomasa contiene múltiples compuestos similares a los del humo del tabaco51, se espera que desde el punto de vista clínico y radiológico los pacientes de EPOC por ambos tipos de humo presenten características similares52,53. Sin embargo, existen algunas diferencias entre las características de la EPOC por humo de biomasa y por humo de tabaco53-60 (tabla 1). A nivel histopatológico, por ejemplo, los pacientes con EPOC por humo de biomasa presentan un fenotipo con más bronquiolitis, con más antracosis y fibrosis pulmonar, así como mayor engrosamiento de la pared arterial que los pacientes con EPOC fumadores, cuyo fenotipo presentaría un mayor enfisema pulmonar55,57-59. En este sentido, un trabajo reciente desarrollado por Krimmer et al.61 ha puesto de manifiesto que fibroblastos en cultivo expuestos a humo de biomasa incrementan su producción de fibronectina.
Características diferenciales entre la enfermedad pulmonar obstructiva crónica (EPOC) por humo de tabaco y por humo de biomasa
| Rasgo | EPOC humo de biomasa | EPOC humo de tabaco | Referencia |
|---|---|---|---|
| Reducción de la capacidad de difusión pulmonar a CO | + | +++ | 54 |
| Saturación de oxígeno en reposo y durante ejercicio | + | +++ | 55 |
| Hiperactividad bronquial a la prueba con metacolina | +++ | + | 56 |
| Hiperplasia de células caliciformes | + | +++ | 57 |
| Enfisema | + | +++ | 55-60 |
| Engrosamiento de la pared de las vías aéreas | +++ | + | 57, 58 |
| Presencia de antracosis | +++ | + | 57 |
| Hiperplasia de la íntima de la arteria pulmonar | +++ | + | 57 |
A pesar de las evidencias epidemiológicas que relacionan el humo de biomasa con la EPOC, se sabe poco acerca de los mecanismos celulares y moleculares por los cuales la exposición a este tipo de contaminante puede producir efectos adversos para la salud. Actualmente se ha propuesto que el humo de biomasa contribuiría a la génesis de la EPOC propiciando un estado de inflamación pulmonar y sistémica, así como un aumento del estrés oxidativo con consecuencias genotóxicas, entre otros daños celulares (figs. 1 y 2).
Mecanismos pro-inflamatoriosExisten múltiples evidencias de que la exposición a humo de biomasa promueve un estado inflamatorio en el pulmón. Las mujeres expuestas a humo de biomasa presentan un mayor número de neutrófilos, eosinófilos, monocitos, mastocitos, linfocitos y macrófagos alveolares, así como niveles superiores de interleucina (IL)-6, IL-8 y factor de necrosis tumoral (TNF)-α en esputo comparadas con aquellas que usan otro tipo de combustible62-64. La expresión génica de algunos de estos mediadores pro-inflamatorios, como la IL-8, el TNF-α, la metaloproteinasa de matriz (MMP)-9 y la MMP-12, aumenta al incrementar la exposición al humo de biomasa, como se ha demostrado en un estudio reciente de Guarnieri et al.65, mientras que otro estudio muestra que este contaminante altera la expresión de genes asociados a la activación de los linfocitosT CD8+66. Los efectos pro-inflamatorios del humo de biomasa no se restringen al compartimento pulmonar, ya que se ha reportado un aumento de linfocitos T CD8+, células natural killer (NK), IL-6, IL-8, TNF-α, proteína C reactiva (PCR) y de proteína quimiotáctica de monocitos (MCP)-1 en sangre de sujetos expuestos67-69. Por otro lado, estudios realizados sobre muestras de esputo inducido, líquido del lavado broncoalveolar (BAL) y sangre muestran que los pacientes con EPOC expuestos a humo de biomasa presentan unos niveles mayores de células inflamatorias (neutrófilos y eosinófilos), IL-8, PCR y MMP-12, así como un aumento de la actividad de la MMP-9, comparados con sujetos control23,70,71.
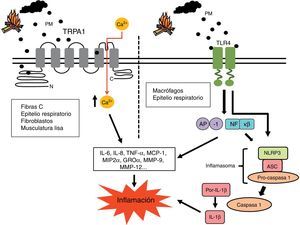
Se ha propuesto que el humo de biomasa podría provocar una respuesta inflamatoria a través de los canales iónicos Transient Potential Receptor (TRP)72 de las células pulmonares (fig. 1). Estos canales son capaces de activarse mediante una gran variedad de estímulos, entre ellos las PM, permitiendo a las células responder ante cambios en su entorno. Cuando un canal TRP se activa, media el flujo de Na+ y Ca2+ a través de la membrana plasmática hacia el citoplasma, estimulando otros canales dependientes de voltaje e influenciando eventos celulares como la transcripción, la traducción, la contracción y la migración73,74. La superfamilia de canales TRP se divide en 7 subfamilias, siendo los receptores TRPA1, V1, V4 y M8 los que han mostrado capacidad de regular respuestas inflamatorias72. Así, se ha reportado que los receptores TRPA1 que se encuentran en las fibrasC de vías aéreas, células del epitelio bronquiolar, fibroblastos y células musculares lisas pueden inducir la producción de IL-6 e IL-8, e incrementar la expresión de la proteína inflamatoria macrofágica (MIP)2α y la citosina oncogén relacionada con crecimiento (GRO)α en bronquiolos tras la exposición a humo de biomasa74-78.
Mecanismos pro-inflamatorios del humo de biomasa. Las células estimuladas por PM generan numerosos mediadores inflamatorios como IL-6, IL-8, TNF-α, MCP-1, MIP2α y GROα, entre otros. Estos pueden generar una segunda oleada de mediadores que incluyen enzimas como la MMP-9 y la MMP-12, implicadas en el remodelado tisular característico de la EPOC. Se ha propuesto que las PM presentes en el humo de biomasa pueden activar los canales iónicos TRP de diversas células pulmonares, provocando un incremento del Ca2+ en el citoplasma y una cascada de señalización intracelular cuyas consecuencias traerían un aumento de la producción de dichos mediadores pro-inflamatorios. También se ha descrito que el material biológico presente en las PM del humo de biomasa (por ejemplo, la endotoxina) puede activar los factores de transcripción pro-inflamatorios AP-1 y NF-κβ a través de la señalización iniciada en los receptores TLR. Este tipo de receptores, así como agentes de lesión intracelulares como los ERO, son también capaces de activar el inflamasoma NLRP3, constituyendo otra posible vía pro-inflamatoria desencadenada por el humo de biomasa.
AP-1: proteína activadora-1; EROs: especies reactivas del oxígeno; GROα: citosina oncogén relacionada con crecimiento α; IL-6: interleucina-6; IL-8: interleucina-8; MCP-1: proteína quimiotáctica de monocitos1; MIP2α: proteína inflamatoria macrofágica2α; MMP-9: metaloproteinasa de matriz9; MMP-12: metaloproteinasa de matriz12; NF-κβ: factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas; PMs: partículas de materia respirables; TLR4: receptores tipo toll like4; TNF-α: factor de necrosis tumoralα; TRP1: canal iónico Transient Potential Receptor1.
Otro de los mecanismos pro-inflamatorios propuestos para el humo de biomasa dependería de la activación de receptores «toll-like» (TLR) en macrófagos y células epiteliales de vías aéreas, lo que induciría una activación de los factores de transcripción del factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-κβ) y proteína activadora-1 (AP-1)20 (fig. 1). Según esta hipótesis, las pequeñas porciones de material biológico (como endotoxina, esporas fúngicas, etc.) que pueden estar presentes en las PM activarían esta vía. Becker et al.79 mostraron que mediante antagonistas o anticuerpos bloqueantes de los TLR4 y TLR2 se podía inhibir la producción de IL-6 e IL-8 observada en macrófagos alveolares y células epiteliales expuestas a PM. En otro estudio se observó que los macrófagos de ratones deficientes en TLR4 y TLR2 presentaban una menor producción de TNF-α e IL-6 tras ser expuestos a PM80.
En otro estudio reciente, Hirota et al.81 han propuesto el inflamasoma NLRP3, un complejo proteico capaz de iniciar una respuesta inflamatoria ante agentes de lesión celulares, como otro mecanismo molecular clave para la respuesta inflamatoria inducida por PM (fig. 1). Los autores reportaron evidencias in vivo e in vitro de un aumento de la producción de IL-1β y de la neutrofilia en vías aéreas a través de la activación de este complejo molecular tras la exposición a PM.
Por otra parte, Kido et al.82 evidenciaron el enlace entre la inflamación pulmonar y sistémica mediada por humo de biomasa. En otro estudio llevado a cabo en ratones, los autores mostraron que mediadores pro-inflamatorios como la IL-6 pasan de los pulmones a la circulación sanguínea tras la exposición a PM10.
Mecanismos oxidativos y genotoxicidadDiversos estudios llevados a cabo en muestras de esputo y sangre de mujeres y niños expuestos crónicamente a humo de biomasa han puesto de manifiesto un incremento en la producción de especies reactivas del oxígeno (ERO) y un decremento de los mecanismos antioxidantes como la superóxido dismutasa (SOD), el glutatión (GSH) y el ácido ascórbico63,64,69,83-85. Otros estudios han reportado un aumento de productos de peroxidación lipídica como el malondialdehído (MDA) en sangre de sujetos expuestos a humo de biomasa85-88, y una correlación entre los niveles de este compuesto y una disminución de la VEF1/CVF83. También se ha descrito un incremento de marcadores de lesiones oxidativas en ADN a partir de muestras de esputo89 y leucocitos mononucleares de sangre periférica (PBMC)87,90 de sujetos expuestos crónicamente a humo de biomasa, así como una reducción de la capacidad de reparar estas lesiones en dichos sujetos85,90,62. Diversos trabajos realizados con modelos animales91-94 o células en cultivo89,95-104 respaldan estos resultados, al encontrarse un aumento de la producción de ERO, citoquinas, productos de peroxidación lipídica y lesiones oxidativas en ADN o un decremento de los mecanismos antioxidantes con la exposición a humo de biomasa. Así, el estrés oxidativo se presenta como una vía importante para los efectos nocivos de este tipo de contaminante.
Los ERO y las especies reactivas del nitrógeno (RNS) pueden contribuir a la patogénesis de la EPOC y de otras enfermedades pulmonares como el asma o la bronquiectasia105-107 mediante la oxidación de proteínas, lípidos, hidratos de carbono y ADN108. Algunos componentes del humo de biomasa, como las PM, son capaces de inducir estrés oxidativo mediante diversos mecanismos, como la generación directa de ERO causada por las características fisicoquímicas de las partículas, por efecto de sus componentes solubles (por ejemplo, compuestos orgánicos o metales de transición) o bien de forma indirecta, mediante la activación de células inflamatorias capaces de generar a su vez ERO o RNS20,64,96.
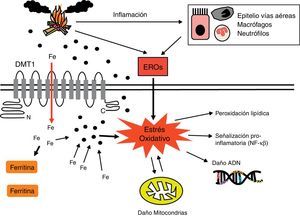
Algunos autores han propuesto que uno de los mecanismos oxidativos más importantes del humo de biomasa pasa por la alteración de la homeostasis del hierro que provoca en células pulmonares72 (fig. 2). Cuando las PM quedan retenidas en el tracto respiratorio inferior, secuestran el hierro de los tejidos, disminuyendo la disponibilidad de este metal para las células. Los intentos por parte de las células de restablecer su disponibilidad producen un incremento de la importación y la reducción del hierro mediante la reacción de Fenton (Fe2++H2O2→Fe3++•OH+OH−), generando ERO en el proceso72,109,110. Por otro lado, se sabe que los ERO derivados de estas reacciones pueden activar factores de transcripción como el NF-κβ, incrementando la producción de mediadores pro-inflamatorios111. Además, las lesiones inducidas por oxidación en mitocondrias pueden afectar el potencial de membrana de estos orgánulos e incrementar a su vez la producción de ERO112 (fig. 2).
Mecanismos oxidativos y genotoxicidad del humo de biomasa. El estrés oxidativo generado por los ERO del humo de biomasa puede dañar de forma directa macromoléculas celulares como proteínas o lípidos, así como representar un factor genotóxico capaz de provocar lesiones en el ADN. El potencial de membrana mitocondrial también puede verse alterado por lesiones oxidativas, lo que se traduce en un incremento de la producción de ERO por parte de estos orgánulos. Algunos autores61 han propuesto que las PM secuestran el hierro de las células pulmonares, afectando a la homeostasis de este metal. Cuando las células detectan una deficiencia de hierro, intentan restablecer su disponibilidad generando ERO para reducirlo e incrementando la expresión de importadores del hierro como el DMT1. Como consecuencia del aumento de la concentración del hierro intracelular, se incrementa la cantidad de ferritina. Por otro lado, se conoce que estas moléculas oxidantes pueden activar factores de transcripción pro-inflamatorios como el NF-κβ. Finalmente, las células inflamatorias activadas por el humo de biomasa constituyen otra fuente de ERO.
DMT1: transportador de metales divalentes1; ERO: especies reactivas del oxígeno; NF-κβ: factor nuclear potenciador de las cadenas ligeras kappa de las célulasB activadas.
Algunas evidencias que apoyan esta hipótesis son el aumento del número de macrófagos cargados de hierro (siderófagos) en esputo de mujeres expuestas a humo de biomasa63, así como un incremento de la expresión del transportador de metales divalentes1 (DMT1, uno de los principales importadores de hierro) y de las concentraciones de ferritina en células epiteliales expuestas a este contaminante72.
ConclusionesA pesar de que la biomasa puede representar una fuente de energía renovable y sostenible, su quema supone una de las mayores fuentes de contaminación, tanto en ambientes interiores como en exteriores. Existen múltiples evidencias epidemiológicas, clínicas y experimentales que demuestran que la exposición al humo de biomasa provoca efectos adversos para la salud y predispone a sufrir diversas enfermedades, entre ellas la EPOC.
Los mecanismos patogénicos propuestos hasta la fecha incluyen un incremento de la inflamación pulmonar y sistémica, así como la promoción de un estado de estrés oxidativo que puede dañar macromoléculas celulares, entre ellas el ADN.
Se hace necesario aumentar los esfuerzos para incrementar la conciencia respecto al riesgo que conlleva la exposición a humo de biomasa. En este sentido, existen algunos datos relevantes sobre los beneficios que supone reducir la exposición a este contaminante gracias a la sustitución de la biomasa por biogás o mediante mejoras en los sistemas de combustión y ventilación de chimeneas y cocinas113-116. En un informe sobre la plataforma HUMAN117 se pone de manifiesto que la construcción de cocinas que disminuyan la contaminación domiciliaria en poblaciones de riesgo es factible y poco costosa. Por otro lado, fomentar el uso de energías poco contaminantes como la eléctrica mediante incentivos, especialmente en las poblaciones más desposeídas de países en desarrollo durante los meses invernales, podría ser una medida acertada.
AutoríaLos doctores Rafael Silva y Miguel Oyarzún llevaron a cabo una revisión crítica del manuscrito.
El doctor Jordi Olloquequi ideó y escribió el manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Srta. Carmen Gloria Muñoz Pincheira su apoyo administrativo en la gestación de este artículo de revisión.