Numerosos estudios han puesto de manifiesto que la interacción entre la enfermedad pulmonar obstructiva crónica (EPOC) y la comorbilidad cardiovascular es compleja y bidireccional, puesto que cada una de estas entidades complica el pronóstico de la otra.
El avance en las técnicas de imagen ha dado paso a una mejor caracterización de las cavidades cardíacas, hecho que ha permitido el estudio de la relación que existen entre ciertos parámetros de función cardíaca con variables clínicas y funcionales en la EPOC.
A pesar de que las alteraciones cardíacas en la EPOC han sido adscritas fundamentalmente al ventrículo derecho, diversos estudios han descrito que el ventrículo izquierdo también se puede afectar en esta enfermedad. Una mejor compresión de los mecanismos involucrados y de sus implicaciones clínicas permitirá establecer estrategias de abordaje diagnóstico y terapéutico en los pacientes donde coexistan estas 2 entidades.
Several studies have shown that the interaction between chronic obstructive pulmonary disease (COPD) and cardiovascular comorbidity is complex and bidirectional, since each of these diseases complicates the prognosis of the other.
Recent advances in imaging technology have led to better characterization of cardiac chambers and allowed the relationship between certain cardiac function parameters and COPD clinical and functional variables to be explored.
Although cardiac abnormalities in COPD have been mainly associated with the right ventricle, several studies have reported that the left ventricle may also be affected in this disease. A better understanding of the mechanisms involved and their clinical implications will establish diagnostic and therapeutic strategies for patients with both these conditions.
La relación anatómica y funcional existente entre el corazón y el pulmón es tan estrecha que la disfunción de uno de ellos puede tener consecuencias en el otro1. Entre ambos órganos existen interacciones neurológicas, humorales y mecánicas, pudiendo coexistir en un mismo paciente con enfermedad respiratoria diversos mecanismos que conllevan a una alteración estructural o funcional ventricular. Diversos estudios evidencian que los eventos cardiovasculares son más frecuentes en los pacientes diagnosticados de EPOC en comparación con los fumadores sin la enfermedad2-4. Al respecto, existe la controversia si este hecho se debe simplemente a la mayor prevalencia en los pacientes EPOC de factores de riesgo cardiovascular (FRCV) tradicionales (HTA, diabetes mellitus, baja actividad física y dislipidemia)5 o que exista una conexión fisiopatológica particular. Algunos autores proponen la inflamación sistémica como posible vía etiológica vinculante con la ateroesclerosis; sin embargo, datos recientes indican que la inflamación sistémica sostenida se produce solo en una proporción de pacientes con EPOC6. Así pues, la asociación entre las enfermedades cardiovasculares (ECV) y la EPOC es mucho más compleja y en ella pueden intervenir otra serie de factores tanto biológicos (hipoxemia, disfunción endotelial, incremento de la activación plaquetaria, rigidez arterial)7-9, factores mecánicos y/o funcionales (deterioro del volumen espiratorio forzado en el primer segundo, enfisema, hiperinsuflación)10,11, neurohumorales (exceso de actividad nerviosa simpática)12 y genéticos (polimorfismos de las metaloproteinasas, acortamiento de los telómeros)13,14.
La contribución de los factores cardiovasculares a la sintomatología de la EPOC, como la disnea y la intolerancia al ejercicio, está poco caracterizada, aunque está generando un interés científico creciente. De hecho, disponemos de varios estudios con cohortes amplias de pacientes que identifican un fenotipo cardiovascular en la EPOC que cursa con distinta evolución clínica y pronóstico15–17.
Tradicionalmente, la alteración cardíaca relacionada con la EPOC ha sido la disfunción del VD, a pesar de contar con publicaciones del siglo pasado que ya reportaban cambios patológicos del VI en autopsias de pacientes con EPOC18. Actualmente, gracias a los avances en las técnicas de imagen, se ha podido certificar varias alteraciones que sufre el VI en estos pacientes, las cuales parecen tener influencia en ciertas variables clínicas y funcionales de la enfermedad. En la presente revisión, analizaremos los mecanismos descritos entre la disfunción del VI y la EPOC, su traducción en las técnicas de imagen y sus consecuencias clínicas.
Mecanismos implicadosEstrés fisiológicoLos pacientes con EPOC pueden presentar hipoxia mantenida (pacientes con insuficiencia respiratoria crónica) o intermitente (durante el ejercicio, las exacerbaciones o durante el sueño). La hipoxia puede producir alteración de la relajación y contracción ventricular por cambios en el metabolismo celular del miocito19. La hipoxia también influye en la patogenia de la ateroesclerosis por varios mecanismos, entre los que se incluyen: incremento de la inflamación vascular y sistémica, aumento de la proteína C reactiva y del estrés oxidativo20,21. Además, puede inducir un estrés hemodinámico por incremento de la frecuencia cardíaca y activación del sistema nervioso simpático22,23. Finalmente, la hipoxia está involucrada en los cambios del remodelado vascular pulmonar que inducen un aumento de la resistencia vascular pulmonar, la cual puede influir negativamente en el llenado diastólico del VI mediante el fenómeno de la dependencia interventricular, como se describirá más adelante.
Enfermedad coronariaLa enfermedad coronaria (EC) o aterosclerótica es el resultado final de la acumulación de placas de ateroma en las paredes de las arterias coronarias. Numerosos estudios epidemiológicos demuestran que los pacientes con EPOC tienen un riesgo elevado de desarrollar EC con las complicaciones derivadas de la misma (cardiopatía isquémica, ictus, muerte súbita), aumentando este riesgo durante las exacerbaciones24-26. Esta asociación en algunos estudios es independiente del tabaquismo y de otros factores confusores, como la edad. La ateroesclerosis subclínica (fase «precoz» de la EC) también se ha descrito en pacientes fumadores con limitación al flujo aéreo y en pacientes con enfisema27,28.
La etiología de la EC y la EPOC es compleja y multifactorial, ya que comparten factores etiológicos comunes aparte del tabaquismo (liberación de micropartículas endoteliales, alteraciones de la hemostasia y estrés oxidativo, entre otros)29-31.
La prevalencia de la EC en la EPOC no se conoce con exactitud, puesto que los estudios publicados hasta la fecha presentan una gran variabilidad (4,7%-60%)32. Sin embargo, datos procedentes de estudios poblacionales indican que puede ser elevada33-35.
Otra evidencia que resalta la estrecha relación entre EC y EPOC es el hecho de que esta última es un factor independiente de peor evolución y mortalidad tras la revascularización coronaria36-38. El diagnóstico de EPOC se constituyó junto a otras 5 variables clínicas tan importantes como la edad, el sexo y la fracción de eyección del VI (FEVI) como una variable predictora de mortalidad a los 4 años de revascularización en el score SYNTAX II (índice que puntúa la complejidad de la EC mediante angiografía y que ayuda a decidir el método óptimo de revascularización en pacientes con EC compleja)39.
La EC puede afectar a la relajación miocárdica por disminución de la distensibilidad arterial, aumento de la presión arterial central y de la poscarga del VI40, mientras que la ateroesclerosis subclínica se ha asociado negativamente a parámetros de disfunción diastólica por alteración de la reserva coronaria29.
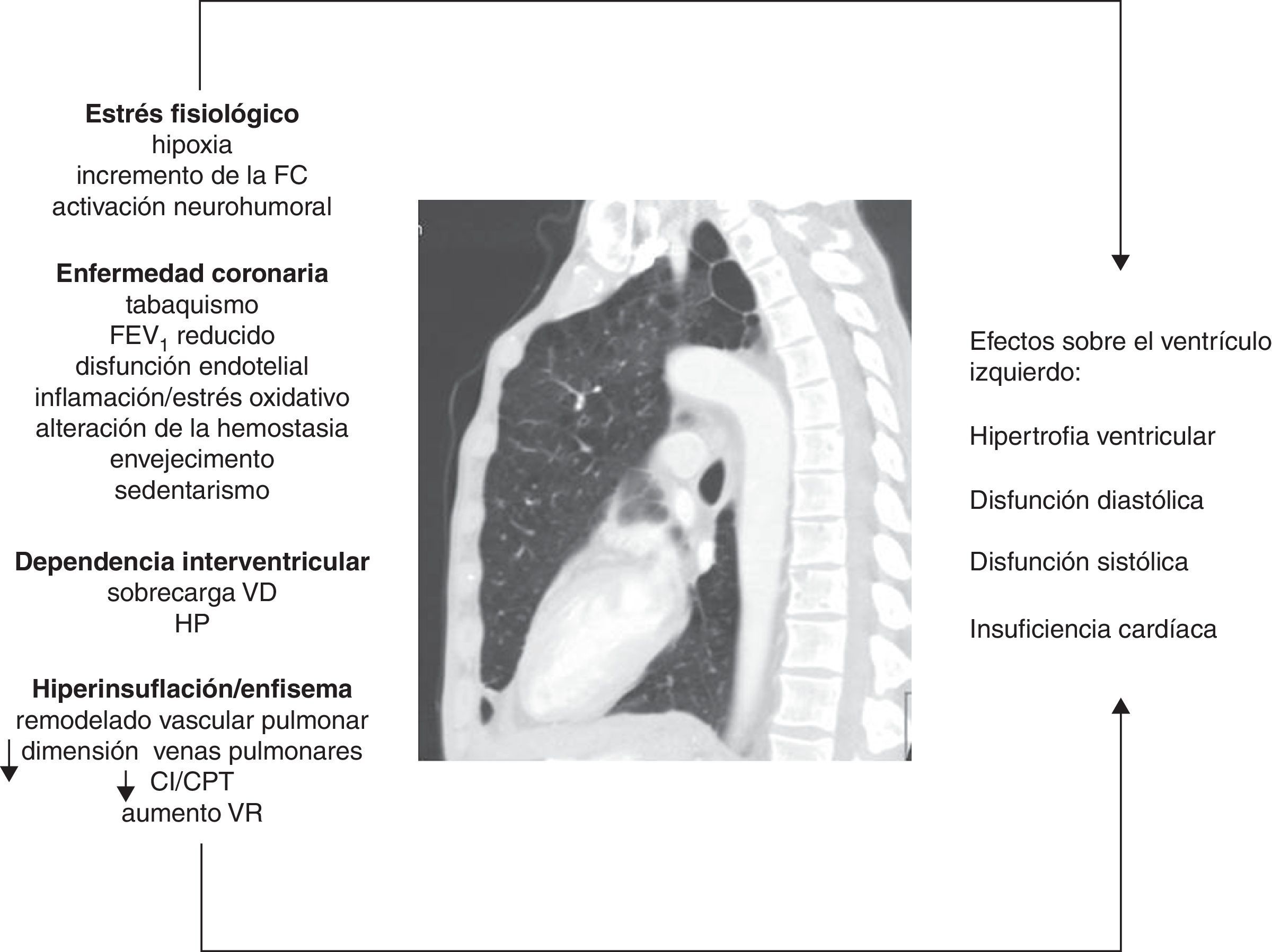
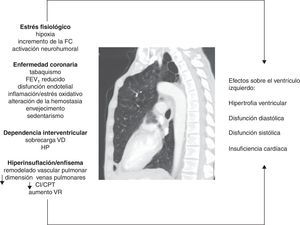
Dependencia interventricularLa disfunción ventricular derecha y la hipertensión pulmonar (HP) son frecuentes en la EPOC, aunque, en general, el incremento en la presión arterial pulmonar tiende a ser de leve a moderada magnitud. Tanto las alteraciones vasculares pulmonares como los cambios patológicos en el VD se han encontrado incluso en fases tempranas de la enfermedad7,41. El fenómeno de la dependencia interventricular alude al hecho de que tanto la sobrecarga de presión del VD, como la de volumen, producen un desplazamiento del septo interventricular hacia el VI que modifica su geometría (morfología en «D»). Los mecanismos fisiopatológicos involucrados se resumen en la figura 1. La dilatación del VD aumenta además el efecto constrictivo del pericardio. Todo esto puede producir secundariamente una reducción de la distensibilidad y del llenado del VI42. Este mecanismo puede explicar el motivo por el cual se puede observar una fracción de eyección preservada en el VI, a pesar de una fase de llenado subóptimo.
Figura que resume los mecanismos fisiopatológicos involucrados y sus efectos sobre el ventrículo izquierdo en la EPOC.
CI/CPT: ratio entre la capacidad inspiratoria y la capacidad pulmonar total; FC: frecuencia cardíaca; FEV1: volumen espiratorio forzado en el primer segundo; HP: hipertensión pulmonar; VD: ventrículo derecho; VR: volumen residual.
Gracias al avance y la mayor difusión de las técnicas de imagen, se ha podido conocer con más precisión la influencia del enfisema y de la hiperinsuflación sobre la disfunción ventricular izquierda (DVI). Hace 10 años, Jörgensen et al.43-45 plantearon la hipótesis de que existe una precarga reducida por la hipovolemia intratorácica derivada de la presencia de hiperinsuflación pulmonar y el mantenimiento de una presión positiva al final de la espiración, lo cual determina una «diástole hipovolémica». Estos autores demostraron, a través de varios estudios, que pacientes con enfisema grave presentaban diversas alteraciones funcionales y hemodinámicas, tales como disminución de los volúmenes telesistólico y telediastólico del VI, menor índice cardíaco y menor volumen latido comparado con un grupo control y que, además, estos parámetros podían mejorar tras la cirugía de reducción de volumen47.
En este sentido, Watz et al.11, en un estudio ecocardiográfico sobre 138 pacientes con EPOC de distinta gravedad, observaron que la hiperinsuflación pulmonar (medida por el índice capacidad inspiratoria/capacidad pulmonar total [CI/CPT]) tenía una correlación más potente con la disminución del tamaño de las cavidades cardíacas y con el deterioro del patrón de llenado diastólico del VI que la obstrucción al flujo aéreo o la capacidad de difusión del monóxido de carbono.
Barr et al.10 aportan una sólida evidencia acerca del efecto del enfisema sobre el llenado ventricular mediante el estudio MESA, un extenso estudio poblacional en pacientes sin FRCV. La presencia de enfisema detectada por tomografía computarizada (TC) y de obstrucción al flujo aéreo se correlacionó de forma lineal e inversa con la reducción en el volumen telediastólico del VI, el volumen sistólico y el gasto cardíaco medido a través de resonancia magnética (RM). Estas asociaciones fueron de mayor magnitud entre los fumadores activos que entre los exfumadores y aquellos que nunca habían fumado. Estos datos indican que incluso en fases tempranas de la EPOC se afectan el volumen sistólico y el tamaño del VI46. En otros 2 trabajos procedentes del estudio MESA, Smith et al.47 describen una asociación entre 2 parámetros de hiperinsuflación pulmonar (volumen residual y el ratio entre el volumen residual y la CPT) con una mayor masa del VI en 119 pacientes con EPOC, mientras que en otra publicación del mismo grupo se demuestra que el porcentaje de enfisema se correlaciona inversamente con el diámetro de las venas pulmonares48. La disminución del calibre fue mayor en los pacientes EPOC estudiados (GOLD I-III) que en los controles, aunque no alcanzó la significación estadística (p=0,06). Esta alteración estructural también puede actuar en detrimento del llenado del VI.
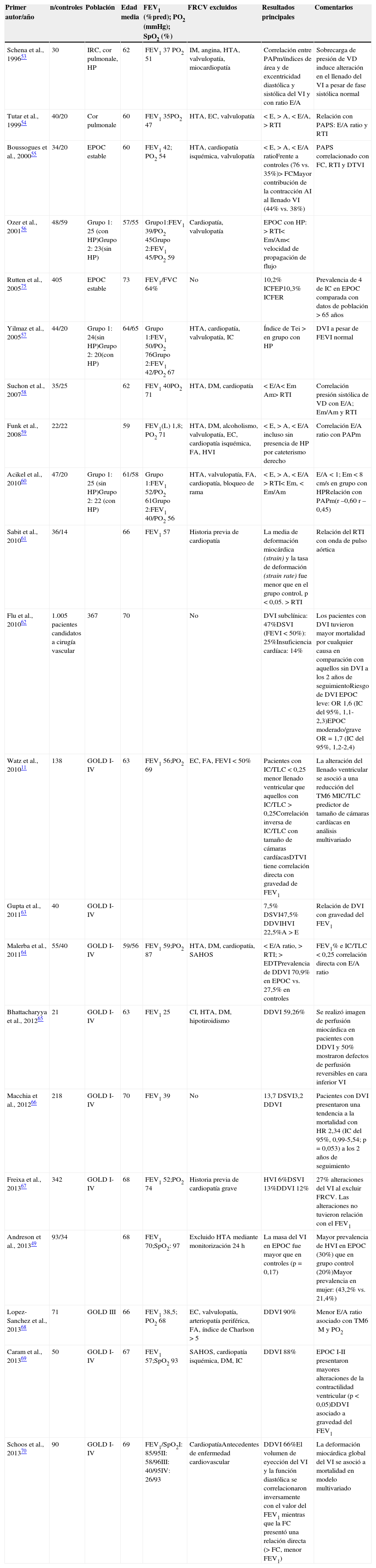
Alteraciones del ventrículo izquierdo en la enfermedad pulmonar obstructiva crónica y sus consecuencias clínicasLa descripción morfológica de las cavidades cardíacas en la EPOC a través de la ecocardiografía plantea el problema de una calidad subóptima si coexiste hiperinsuflación y aplanamiento diafragmático. A pesar de ello, en los últimos 20 años se han publicado diversas series ecocardiográficas que han demostrado alteraciones en parámetros estructurales y funcionales en todo el espectro de gravedad de la enfermedad (tabla 1). La variabilidad de los hallazgos reportados depende, en algunos casos, de la inclusión de pacientes «seleccionados» (sin FRCV excepto el tabaquismo), de la presencia de HP asociada, del ámbito en donde han sido llevados a cabo (consulta especializada/atención primaria) y del grado de obstrucción al flujo aéreo. También existen estudios con otras técnicas de imagen menos extendidas en la práctica clínica diaria, como la RM y técnicas de medicina nuclear.
Estudios ecocardiográficos que analizan el ventrículo izquierdo en pacientes con EPOC
| Primer autor/año | n/controles | Población | Edad media | FEV1 (%pred); PO2 (mmHg); SpO2 (%) | FRCV excluidos | Resultados principales | Comentarios |
|---|---|---|---|---|---|---|---|
| Schena et al., 199653 | 30 | IRC, cor pulmonale, HP | 62 | FEV1 37 PO2 51 | IM, angina, HTA, valvulopatía, miocardiopatía | Correlación entre PAPm/índices de área y de excentricidad diastólica y sistólica del VI y con ratio E/A | Sobrecarga de presión de VD induce alteración en el llenado del VI a pesar de fase sistólica normal |
| Tutar et al., 199954 | 40/20 | Cor pulmonale | 60 | FEV1 35PO2 47 | HTA, EC, valvulopatía | < E, > A, < E/A, > RTI | Relación con PAPS: E/A ratio y RTI |
| Boussogues et al., 200055 | 34/20 | EPOC estable | 60 | FEV1 42; PO2 54 | HTA, cardiopatía isquémica, valvulopatía | < E, > A, < E/A ratioFrente a controles (76 vs. 35%)> FCMayor contribución de la contracción AI al llenado VI (44% vs. 38%) | PAPS correlacionado con FC, RTI y DTVI |
| Ozer et al., 200156 | 48/59 | Grupo 1: 25 (con HP)Grupo 2: 23(sin HP) | 57/55 | Grupo1:FEV1 39/PO2 45Grupo 2:FEV1 45/PO2 59 | Cardiopatía, valvulopatía | EPOC con HP: > RTI< Em/Am< velocidad de propagación de flujo | |
| Rutten et al., 200575 | 405 | EPOC estable | 73 | FEV1/FVC 64% | No | 10,2% ICFEP10,3% ICFER | Prevalencia de 4 de IC en EPOC comparada con datos de población > 65 años |
| Yilmaz et al., 200557 | 44/20 | Grupo 1: 24(sin HP)Grupo 2: 20(con HP) | 64/65 | Grupo 1:FEV1 50/PO2 76Grupo 2:FEV1 42/PO2 67 | HTA, cardiopatía, valvulopatía, IC | Índice de Tei > en grupo con HP | DVI a pesar de FEVI normal |
| Suchon et al., 200758 | 35/25 | 62 | FEV1 40PO2 71 | HTA, DM, cardiopatía | < E/A< Em Am> RTI | Correlación presión sistólica de VD con E/A; Em/Am y RTI | |
| Funk et al., 200859 | 22/22 | 59 | FEV1(L) 1,8; PO2 71 | HTA, DM, alcoholismo, valvulopatía, EC, cardiopatía isquémica, FA, HVI | < E, > A, < E/A incluso sin presencia de HP por cateterismo derecho | Correlación E/A ratio con PAPm | |
| Acikel et al., 201060 | 47/20 | Grupo 1: 25 (sin HP)Grupo 2: 22 (con HP) | 61/58 | Grupo 1:FEV1 52/PO2 61Grupo 2:FEV1 40/PO2 56 | HTA, valvulopatía, FA, cardiopatía, bloqueo de rama | < E, > A, < E/A > RTI< Em, < Em/Am | E/A<1; Em<8cm/s en grupo con HPRelación con PAPm(r –0,60 r –0,45) |
| Sabit et al., 201061 | 36/14 | 66 | FEV1 57 | Historia previa de cardiopatía | La media de deformación miocárdica (strain) y la tasa de deformación (strain rate) fue menor que en el grupo control, p<0,05. > RTI | Relación del RTI con onda de pulso aórtica | |
| Flu et al., 201062 | 1.005 pacientes candidatos a cirugía vascular | 367 | 70 | No | DVI subclínica: 47%DSVI (FEVI<50%): 25%Insuficiencia cardíaca: 14% | Los pacientes con DVI tuvieron mayor mortalidad por cualquier causa en comparación con aquellos sin DVI a los 2 años de seguimientoRiesgo de DVI EPOC leve: OR 1,6 (IC del 95%, 1,1-2,3)EPOC moderado/grave OR = 1,7 (IC del 95%, 1,2-2,4) | |
| Watz et al., 201011 | 138 | GOLD I-IV | 63 | FEV1 56;PO2 69 | EC, FA, FEVI<50% | Pacientes con IC/TLC < 0,25 menor llenado ventricular que aquellos con IC/TLC>0,25Correlación inversa de IC/TLC con tamaño de cámaras cardíacasDTVI tiene correlación directa con gravedad de FEV1 | La alteración del llenado ventricular se asoció a una reducción del TM6MIC/TLC predictor de tamaño de cámaras cardíacas en análisis multivariado |
| Gupta et al., 201163 | 40 | GOLD I-IV | 7,5% DSVI47,5% DDVIHVI 22,5%A>E | Relación de DVI con gravedad del FEV1 | |||
| Malerba et al., 201164 | 55/40 | GOLD I-IV | 59/56 | FEV1 59;PO2 87 | HTA, DM, cardiopatía, SAHOS | < E/A ratio, > RTI;>EDTPrevalencia de DDVI 70,9% en EPOC vs. 27,5% en controles | FEV1% e IC/TLC < 0,25 correlación directa con E/A ratio |
| Bhattacharyya et al., 201265 | 21 | GOLD I-IV | 63 | FEV1 25 | CI, HTA, DM, hipotiroidismo | DDVI 59,26% | Se realizó imagen de perfusión miocárdica en pacientes con DDVI y 50% mostraron defectos de perfusión reversibles en cara inferior VI |
| Macchia et al., 201266 | 218 | GOLD I-IV | 70 | FEV1 39 | No | 13,7 DSVI3,2 DDVI | Pacientes con DVI presentaron una tendencia a la mortalidad con HR 2,34 (IC del 95%, 0,99-5,54; p = 0,053) a los 2 años de seguimiento |
| Freixa et al., 201367 | 342 | GOLD I-IV | 68 | FEV1 52;PO2 74 | Historia previa de cardiopatía grave | HVI 6%DSVI 13%DDVI 12% | 27% alteraciones del VI al excluir FRCV. Las alteraciones no tuvieron relación con el FEV1 |
| Andreson et al., 201349 | 93/34 | 68 | FEV1 70;SpO2: 97 | Excluido HTA mediante monitorización 24 h | La masa del VI en EPOC fue mayor que en controles (p=0,17) | Mayor prevalencia de HVI en EPOC (30%) que en grupo control (20%)Mayor prevalencia en mujer: (43,2% vs. 21,4%) | |
| Lopez-Sanchez et al., 201368 | 71 | GOLD III | 66 | FEV1 38,5; PO2 68 | EC, valvulopatía, arteriopatía periférica, FA, índice de Charlson>5 | DDVI 90% | Menor E/A ratio asociado con TM6M y PO2 |
| Caram et al., 201369 | 50 | GOLD I-IV | 67 | FEV1 57;SpO2 93 | SAHOS, cardiopatía isquémica, DM, IC | DDVI 88% | EPOC I-II presentaron mayores alteraciones de la contractilidad ventricular (p<0,05)DDVI asociado a gravedad del FEV1 |
| Schoos et al., 201370 | 90 | GOLD I-IV | 69 | FEV1/SpO2I: 85/95II: 58/96III: 40/95IV: 26/93 | CardiopatíaAntecedentes de enfermedad cardiovascular | DDVI 66%El volumen de eyección del VI y la función diastólica se correlacionaron inversamente con el valor del FEV1 mientras que la FC presentó una relación directa (> FC, menor FEV1) | La deformación miocárdica global del VI se asoció a mortalidad en modelo multivariado |
A: onda de contracción auricular en el flujo Doppler mitral; AI: aurícula izquierda; Am: velocidad diastólica del miocardio obtenida por Doppler tisular durante la contracción auricular; CI: cardiopatía isquémica; DDVI: disfunción diastólica ventricular izquierda; DM: diabetes mellitus; DSVI: disfunción sistólica ventricular izquierda; DTVI: diámetro telediastólico del ventrículo izquierdo; DVI: disfunción ventricular izquierda; E: onda de llenado protodiastólico en el flujo Doppler mitral; EC: enfermedad coronaria; EDT: tiempo de desaceleración de la onda de llenado ventricular temprano; Em: velocidad diastólica del miocardio obtenida por Doppler tisular durante el llenado precoz; E/A: ratio entre la onda E y la onda A en flujo Doppler mitral; Em/Am: ratio entre la onda Em y la onda Am; FA: fibrilación auricular; FC: frecuencia cardíaca; FEV1: volumen espiratorio forzado en el primer segundo; FEVI: fracción de eyección de ventrículo izquierdo; FRCV: factores de riesgo cardiovascular; HP: hipertensión pulmonar; HR: hazard ratio; HTA: hipertensión arterial sistémica; HVI: hipertrofia del ventrículo izquierdo; IC: insuficiencia cardíaca; IC/TLC: ratio entre la capacidad inspiratoria y la capacidad pulmonar total; ICFEP: insuficiencia cardíaca con fracción de eyección preservada; ICFER: insuficiencia cardíaca con fracción de eyección reducida; IM: infarto de miocardio; IRC: insuficiencia respiratoria crónica; OR: odds ratio; PAPm: presión media de arteria pulmonar; PAPS: presión sistólica de arteria pulmonar; PO2: presión arterial de oxígeno; RTI: relajación isovolumétrica del ventrículo izquierdo; SAHOS: síndrome de apnea-hipopnea del sueño; SpO2: saturación arterial de oxígeno; TM6M: test de la marcha de 6 min; VD: ventrículo derecho; VI: ventrículo izquierdo.
Como se ha señalado en párrafos anteriores, estudios de ventriculografía y de autopsias de pacientes con bronquitis crónica y enfisema demuestran hipertrofia del VI (HVI) y aumento de la masa ventricular18. Además del estudio de Smith et al.47, que describe una asociación entre la hiperinsuflación pulmonar y masa del VI independiente de otros FRCV, Anderson et al.49 comunicaron una prevalencia de HVI del 21,4% en hombres y del 43,2% en mujeres con EPOC normoxémicos sin HTA subyacente a través de la ecocardiografía, siendo la masa del VI significativamente mayor que en los controles. Estos hallazgos indican un efecto independiente de la EPOC sobre la HVI no relacionado con la HTA. Los autores postulan la activación simpática como posible mecanismo vinculante, principalmente por medio del sistema renina-angiotensina-aldosterona.
La HVI es un factor pivotal de eventos cardiovasculares y el tratamiento para prevenirla ha demostrado reducir en gran medida la morbimortalidad cardiovascular50. Se considera la HVI como un factor arritmogénico y que puede condicionar la aparición ulterior de disfunción ventricular, tanto diastólica como sistólica, dilatación y fibrilación auricular (FA). Además, la HVI reduce la reserva coronaria aumentando el riesgo de cardiopatía isquémica51. Por lo tanto, controlar en lo posible el remodelado ventricular se ha convertido en una de las dianas terapéuticas en el manejo de enfermedades crónicas donde la HVI es prevalente, como por ejemplo la diabetes mellitus y la insuficiencia renal crónica.
Disfunción ventricular diastólicaDurante la diástole, el VI recibe sangre de la aurícula izquierda, que se expulsa posteriormente en la circulación sistémica. En términos simples, la eficiencia de llenado del VI se traduce en la capacidad de recibir un gran volumen de sangre a una velocidad de llenado rápida pero a bajas presiones52. Por consiguiente, varios parámetros fisiológicos interactúan en la diástole de VI, siendo los más importantes la relajación, la distensibilidad ventricular y la contracción auricular (tabla 2). Dentro de las causas más comunes de disfunción diastólica se encuentran la HTA, la senilidad y la EC.
Aplicación del Doppler en el diagnóstico de la disfunción diastólica y parámetros observados en el patrón de relajación lenta
| Normal | Relajación lenta | |
|---|---|---|
| E/A (cm/s) | > 1 | < 1 |
| EDT (ms) | < 220 | > 220 |
| Vp (cm/s)a | > 50 | < 45 |
| Em (cm/s)a | < 10 | < 8 |
E/A: relación entre onda de llenado ventricular temprano y contracción auricular; EDT: tiempo de desaceleración de la onda de llenado ventrícular temprano; Em: velocidad diastólica del miocardio obtenida por Doppler tisular durante el llenado temprano; Vp: pendiente de la velocidad de propagación del flujo ventrícular por modo M color.
Modificada de García et al.40
Diversos estudios en series de pacientes con EPOC describen una alta frecuencia de disfunción diastólica de VI (DDVI) en comparación con controles de la misma edad e incluso en aquellos sin FRCV53-70. Existe también una gran variabilidad en cuanto a la prevalencia, alcanzando hasta un 90% en los pacientes con EPOC con limitación grave al flujo aéreo68. El patrón frecuentemente descrito es el patrón de relajación lenta, que se caracteriza entre otros parámetros por una onda E reducida (por disminución de la velocidad de relajación de las fibras miocárdicas) y una onda A (de contracción auricular) aumentada, con una relación E/A<140. Esta alteración del llenado ventricular puede constituir una complicación importante en los pacientes con FA —arritmia muy prevalente en la EPOC—, tanto por pérdida de la sístole auricular como por acortamiento en el período de llenado59.
El fenómeno de la dependencia interventricular era el principal mecanismo atribuido a esta alteración por los diferentes autores, sin embargo Funk et al.59 describieron DDVI en pacientes EPOC sin HP, poniendo de manifiesto que pueden interactuar otros mecanismos para su desarrollo, como se ha descrito previamente.
La alteración del llenado ventricular se ha asociado negativamente a la tolerancia al ejercicio medida a través del test de la marcha de 6 min11,68 y con reducción de la actividad física71.
Bhattacharyya et al.65 realizaron un estudio para determinar si la DDVI podría ser secundaria a lesiones isquémicas no detectadas mediante las exploraciones convencionales (electrocardiograma y ecocardiografía). Se incluyó a pacientes con EPOC GOLD III y IV sin factores de riesgo para desarrollar DDVI (HTA, diabetes mellitus, historia de cardiopatía isquémica e hipotiroidismo). Los pacientes diagnosticados de DDVI por ecocardiografía fueron sometidos a TC por emisión de fotón único de perfusión miocárdica, evidenciándose defectos de perfusión reversibles en 7 de los 14 estudiados (50%). Sobre la base de estos hallazgos, los autores proponen la hipótesis de que la cardiopatía isquémica en estos pacientes podría ser también una causa de DDVI. Se necesitan estudios adicionales con una muestra más amplia de pacientes que repliquen estos resultados.
Disfunción ventricular sistólicaLa disfunción sistólica ventricular izquierda (DSVI) se define por una FEVI<50%72. La prevalencia reportada de DSVI en pacientes con EPOC estable presenta una amplia variabilidad y está en relación con la exclusión de FRCV en las diferentes series (siendo del 0-16% en pacientes EPOC sin FRCV)73. La frecuencia de esta alteración oscila en pacientes no seleccionados entre el 8 y el 25%62,63,66,67.
El análisis de la deformación ventricular o strain y la tasa de deformación ventricular o strain rate constituyen nuevos parámetros que valoran cuantitativamente la contractilidad segmentaria del VI, independientemente de una FEVI normal. Esto es factible con Doppler tisular y, más recientemente, también con ecografía bidimensional mediante el rastreo de señales miocárdicas (speckle tracking). Sabit et al.61 reportaron que estos parámetros se encontraban disminuidos significativamente en una serie de 36 pacientes con EPOC con respecto a los controles, mientras que Schoos et al.70 comunicaron que estos parámetros eran predictores de mortalidad mediante un análisis multivariado en una serie de 90 pacientes con EPOC de distinta gravedad.
La DVI (sistólica y diastólica) ha sido descrita como predictor de supervivencia en una cohorte de pacientes EPOC candidatos a cirugía vascular que fueron seguidos durante un período de 2 años62. Macchia et al.66 encontraron mayor mortalidad en pacientes con EPOC que mostraban esta alteración con respecto a aquellos pacientes que no la presentaban; sin embargo, esta diferencia no alcanzó la significación estadística.
Insuficiencia cardíacaEl diagnóstico de la IC puede no sospecharse en los pacientes con EPOC debido a que los signos y los síntomas que presentan son comunes y se solapan en ambas enfermedades. La prevalencia de IC en pacientes con EPOC en las diferentes series oscila entre el 7,1 y el 31,3%4,32-35,62,74.
Existen 2 patrones de IC, uno con función sistólica preservada (ICFEP), más asociado a la HTA, edad avanzada y enfermedades extracardíacas, y otro con fracción de eyección reducida (ICFER), más relacionado con la cardiopatía isquémica.
Rutten et al.75 comunicaron una prevalencia de IC del 20,5% en una cohorte de pacientes EPOC en fase estable. Durante un período de seguimiento de 4 años, los pacientes con diagnóstico de IC presentaron mayor mortalidad, independientemente de otros factores como la edad, el sexo, la historia de cardiopatía isquémica o la HTA76. Aunque la información al respecto es limitada, el pronóstico en los pacientes EPOC con IC parece ser independiente de la FEVI77.
En sentido inverso, la EPOC representa una comorbilidad frecuente en pacientes con IC, describiéndose hasta en un tercio de estos pacientes78. Se ha señalado que la EPOC actúa como una comorbilidad que imprime peor pronóstico en la IC y que las exacerbaciones de la EPOC están reconocidas como factores causales y/o precipitantes de IC aguda72. En un estudio en donde se comparaba el impacto en el pronóstico de diferentes comorbilidades en 2.843 pacientes diagnosticados de ICFEP y 6599 con ICFER, la EPOC fue la única comorbilidad que actuó con variable independiente de la mortalidad para ambos grupos79. Llama la atención que, a pesar del peso de la EPOC como comorbilidad en la IC, en las últimas guías de IC no se incluya la realización de la espirometría dentro del conjunto de pruebas complementarias recomendadas en el manejo de esta entidad.
ConclusionesLas alteraciones del VI pueden presentarse en pacientes con EPOC en todo su espectro de gravedad. Los mecanismos fisiopatológicos implicados pueden actuar de manera independiente o sinérgica, dada la compleja interacción corazón-pulmón. Aunque la información de momento es limitada, existen estudios que demuestran que la alteración del VI en la EPOC influye negativamente sobre parámetros tan importantes como la capacidad de esfuerzo, la actividad física y la mortalidad. Estos datos abren las puertas a futuras investigaciones y a nuevas estrategias diagnósticas y terapéuticas, sin olvidar que el tratamiento y la prevención del tabaquismo constituyen la medida que mayor impacto tiene sobre la historia natural en la coexistencia de la EPOC y la ECV. A la vista de las recientes investigaciones, parece importante la implicación de otras especialidades en el estudio de esta asociación, buscando un abordaje integral de la enfermedad y en el convencimiento de que no solo de cor pulmonale vive (o muere) la EPOC.
Conflicto de interesesLos autores no presentan ninguno.
Al Dr. Ignasi Guasch, por la aportación de la imagen radiológica.