La molécula antígeno leucocitario humano G (HLA-G), en sus formas unida a membrana y soluble, tiene como función principal inhibir la respuesta inmune actuando sobre los linfocitos T/CD4+, T/citotóxicos, células NK y células dendríticas. El cáncer de pulmón es una de las principales causas de muerte en el mundo, con una alta tasa de incidencia anual tanto en mujeres como en hombres. Algunos estudios han reportado un incremento de HLA-G sérica en el cáncer de pulmón, probablemente como un mecanismo de escape de la célula tumoral a la respuesta inmune antitumoral. En este estudio se midió la concentración de HLA-G soluble, en el lavado broncoalveolar (LBA), en pacientes con cáncer de pulmón primario y metastásico para determinar su relación con el tipo histológico tumoral y estado general del paciente usando la escala de Karnofsky.
MétodosSe incluyeron 31 pacientes con diagnóstico de cáncer de pulmón y mediante fibrobroncoscopia se tomó biopsia de la neoplasia para determinar el tipo de tumor usando la coloración de hematoxilina y eosina, y líquido del lavado broncoalveolar para medir la concentración de la molécula HLA-G soluble mediante un ELISA tipo sándwich.
ResultadosEl valor medio de la HLA-G soluble fue de 49,04ng/ml. No se observó ninguna correlación entre los niveles de HLA-G soluble y la edad, género o índice de tabaquismo. Se observó una diferencia altamente significativa en los niveles de HLA-G soluble en LBA de pacientes con diversos tipos histológicos de cáncer de pulmón, principalmente en tumores metastásicos. El índice de Karnofsky mostró una correlación significativa e inversa con el nivel de HLA-G soluble en LBA.
ConclusionesLa proteína HLA-G soluble puede ser útil como marcador pronóstico del cáncer pulmonar al asociarse significativamente a los tumores metastásicos y a los pacientes con menor índice de Karnofsky.
The main function of the HLA-G molecule in its membrane-bound and soluble forms is to inhibit the immune response by acting on CD4+ T cells, cytotoxic T cells, NK cells and dendritic cells. Lung cancer is a leading cause of death worldwide, and annual incidence is high in both women and men. Some studies have reported an increase of HLA-G serum levels in lung cancer, probably generated by tumor cells escaping the antitumor immune response. In this study the concentration of soluble HLA-G in bronchoalveolar lavage (BAL) in patients with primary and metastatic lung cancer was measured to determine its relation with tumor histological type and overall patient status according to the Karnofsky scale.
MethodsThirty-one lung cancer patients were included. A tumor biopsy was obtained by bronchoscopy and the tumor type was determined by hematoxylin and eosin staining. BAL samples were obtained to measure soluble HLA-G concentrations in an ELISA sandwich assay.
ResultsThe average value of soluble HLA-G was 49.04ng/mL. No correlation between soluble HLA-G levels and age, gender or smoking was observed. A highly significant difference was observed in the levels of soluble HLA-G in BAL from patients with different histological types of lung cancer, especially in metastatic tumors. The Karnofsky index showed a significant and inverse correlation with soluble HLA-G levels in BAL.
ConclusionsSoluble HLA-G protein is significantly associated with metastatic tumors and patients with lower Karnofsky index and may be useful as a prognostic marker in lung cancer.
El antígeno leucocitario humano G (HLA-G) es una molécula que pertenece a la familia de proteínas que integran el complejo mayor de histocompatibilidad de clase I (MHC-I). Su función es, principalmente, suprimir la respuesta inmune (RI), la cual realiza a través de la interacción con receptores expresados en la membrana de las células efectoras del sistema inmune: células NK, linfocitos T, células dendríticas y linfocitos B1-3. La HLA-G está expresada en el tejido placentario (citotrofoblasto extravelloso) donde inhibe la RI contra los antígenos fetales, ayudando al desarrollo del embarazo4,5. El timo, la cámara anterior del ojo, el cordón umbilical, las células eritroides inmaduras, el páncreas y los macrófagos activados, entre otros, son tejidos donde se ha descrito la presencia de la HLA-G, la cual puede encontrarse unida a la membrana celular o en forma soluble2. Esta molécula, al interactuar con sus ligandos, traduce señales inhibitorias al interior de la célula que se manifiestan como supresión de la proliferación de las células T CD4+, inhibición de la citotoxicidad de las células NK y los linfocitos T citotóxicos (LTC), así como una disminución en la maduración de las células dendríticas presentadoras de antígenos6-8.
El cáncer de pulmón es una de las principales causas de muerte en el mundo, alcanzando la cifra de 1,18millones de muertes por año. Asimismo, se estima que el número de casos nuevos por año es de 900.000 en hombres y 300.000 en mujeres, por lo que estudiar los mecanismos que favorecen su desarrollo, en los estadios iniciales, podría tener utilidad diagnóstica, terapéutica y pronóstica9. En este sentido, el MHC-I juega un papel esencial en la eliminación de células malignas por el sistema inmune, ya que participa en el reconocimiento de las células tumorales por las células efectoras, células NK y células T, que infiltran el sitio del tumor para destruirlas.
Al mismo tiempo, las células tumorales han desarrollado estrategias para evadir su detección y eliminación por el sistema inmune, favoreciendo así el crecimiento tumoral; una de estas estrategias es la expresión aberrante de proteínas del MHC inmunorreguladoras, como la HLA-G, por parte del tumor que podría afectar la inmunovigilancia10. La expresión de HLA-G ha sido detectada en el suero y tejido de neoplasias de diverso origen que incluyen al cáncer de pulmón, colon y recto, esófago y la leucemia linfoide crónica de células B, entre otras11-14. Las evidencias señalan que la molécula HLA-G, unida a la membrana o soluble (sHLA-G), determina en buena parte el crecimiento y la invasividad tumoral, por lo que se postula que su medición es de ayuda en la oncología15,16.
El objetivo de este trabajo fue determinar los niveles de sHLA-G en el lavado broncoalveolar (LBA) de pacientes con cáncer primario o metastásico de pulmón, y correlacionarlos con el tipo histológico y las condiciones del paciente, usando la escala de valoración funcional de Karnofsky17. Así, el estudio de la sHLA-G directamente en el compartimento tumoral podría reflejar mejor los valores de esta molécula en esta enfermedad, que los obtenidos midiendo las concentraciones séricas.
Material y métodosPacientesPrevio consentimiento informado y firmado, se seleccionaron al azar 31 pacientes de ambos sexos y mayores de 18años, con cáncer —primario o metastásico— de pulmón, basado en criterios clínicos, imagenológicos (Rx de tórax o tomografía axial computarizada de tórax) y microscópicos de la lesión, que asistieron al Instituto Autónomo «Hospital Universitario de Los Andes», en Mérida,Venezuela. Se excluyeron de participar en el estudio los pacientes con: infección respiratoria al momento del ingreso, enfermedad pulmonar intersticial difusa, inmunodeficiencias primaria y secundaria, embarazo o abortos recurrentes, contraindicación para realizar la fibrobroncoscopia (FBC), tratamiento con drogas inmunosupresoras y antineoplásicas. Se realizó a cada paciente el test de valoración funcional de Karnofsky. El estudio fue aprobado por el comité de ética local.
Recolección del lavado broncoalveolar y toma de biopsia de tejido pulmonar mediante fibrobroncoscopiaPrevia anestesia local, se usó un broncoscopio (Olympus BF, type P10) y se instilaron 3 alícuotas de 20ml de solución salina estéril, a temperatura de 37°C. Esta solución salina fue inmediatamente aspirada a una presión negativa de 5 a 120mmHg y luego transferida a un tubo de ensayo que contenía 1ml de etilen-diamino-tetra-acetato (EDTA) para su ulterior análisis. Se avanzó con el broncoscopio hasta el segmento sospechoso (ubicado por los métodos imagenológicos) o al más comprometido a la visualización directa, y se procedió a tomar biopsia transbronquial (4 fragmentos) de los segmentos afectados o de las lesiones. En los casos donde no se pudo obtener un diagnóstico anatomopatológico definitivo del tipo de la neoplasia, se programó la obtención de una nueva muestra mediante punción y aspirado con aguja fina guiada por ultrasonografía, o biopsia a «cielo abierto» en área de quirófano, obteniendo una muestra significativa y adecuada de la lesión según el criterio del cirujano de tórax.
Determinación del tipo histológico del tumor pulmonarLas muestras de tumor de pulmón fueron mantenidas en una solución de formol al 10% hasta su estudio. Una vez retiradas de esta solución, el tejido fue incrustado en parafina y cortado a un grosor de 0,3-0,4μm. Los cortes fueron colocados en láminas y coloreados con hematoxilina y eosina (H&E) siguiendo un protocolo previamente descrito18. El tejido coloreado fue observado por microscopia óptica (microscopio Nikon Labofhot 2, Alemania) usando aumentos de 20× y 40×. Las alteraciones histológicas observadas permitieron clasificar las lesiones en benignas y malignas, así como establecer el tipo de neoplasia (adenocarcinoma, carcinoma epidermoide, cáncer de células pequeñas y no pequeñas, y tumores metastásicos).
Cuantificación de los niveles de antígeno leucocitario humano-G soluble en el lavado broncoalveolar mediante la técnica de enzimoinmunoensayoLa sHLA-G fue cuantificada usando un ensayo comercial (Human sHLA-G, elisa IBL, Alemania), basado en la técnica de ELISA tipo sándwich o de captura, siguiendo las especificaciones del fabricante. Las muestras LBA fueron colocadas sin diluir en pozos de la placa de poliestireno recubiertos con un anticuerpo monoclonal anti-HLA-G de humano; este anticuerpo captura la HLA-G presente en el LBA de los sujetos en estudio. Posteriormente se agregó un segundo anticuerpo anti-HLA-G conjugado con biotina que se incubó por 2h a temperatura ambiente. Transcurrido este tiempo, las placas fueron lavadas 3 veces con solución de lavado y luego se añadió la estreptavidina conjugada con la enzima peroxidasa de rábano (HRP). Después de una hora de incubación y 3 lavados, se adicionó el sustrato 3,3′, 5,5′-tetrametilbenzidina (TMB) y se incubó durante 10min en la oscuridad. Al final se añadió la solución de parada (H2SO4 2N), y la reacción colorimétrica desarrollada fue medida con un espectrofotómetro modelo Sunrise (Tecan, Austria), usando una longitud de onda de 450nm. Los valores, expresados en densidades ópticas fueron transformados en ng/ml usando una curva de referencia y el programa Magellan V 3.0.
Análisis estadísticoLos resultados obtenidos fueron agrupados en tablas de doble o triple entrada, según el caso. Se calcularon los promedios, las desviaciones estándares y se usaron el test de Chi-cuadrado y la prueba a posteriori de Duncan para establecer diferencias estadísticamente significativas entre las variables. Un valor de p <0,05 fue considerado estadísticamente significativo.
Para comparar los niveles de sHLA-G en los pacientes que presentaron los diversos tipos de cáncer de pulmón, se procedió a ajustar un modelo lineal general o generalizado (GLM) en el que se evaluó la significación de este factor mediante un diseño de efecto fijo19. En el modelo se incorporaron adicionalmente los factores género e índice de tabaquismo como efectos fijos, mientras que el efecto de la edad sobre los valores de sHLA-G se estimó como una covariante. El mismo modelo GLM se usó para estimar la correlación entre el índice de Karnofsky y los niveles de sHLA-G en el LBA.
ResultadosLa concentración de antígeno leucocitario humano-G soluble en el lavado broncoalveolar de los pacientes con cáncer de pulmón no está asociada con la edad, sexo o síntomas de la enfermedadEn el grupo de estudio encontramos que la edad promedio al momento del diagnóstico fue de 59,2años. Se observó una tendencia a una mayor frecuencia de cáncer pulmonar en las mujeres que en los hombres (relación mujer/hombre: 1,22). Solo el 26% de los pacientes en estudio admitió no fumar. Finalmente, los niveles de sHLA-G en el LBA no mostraron diferencias estadísticamente significativas cuando se compararon con el índice —leve, moderado y severo— de tabaquismo, edad, sexo y síntomas (tabla 1).
Características generales de los pacientes (n=31)
| Variable | Valor | sHLA-G |
|---|---|---|
| Edad (años) | 59,2 (DE:±11) | NS |
| Género (%): | NS | |
| F | 17 (54,8) | |
| M | 14 (45,2) | |
| Índice de tabaquismo (%): | NS | |
| Severo | 58,1 | |
| Moderado | 3,2 | |
| Leve | 13 | |
| No fuma (%) | 26 | NS |
| Paquete cigarrillo-año | 29,6 (DE: ±36,2) | NS |
| sHLA-G en LBA (ng/ml) | 49 (DE:±27,4) |
DE: desviación estándar, F: femenino; M: masculino; NS: no significativo; sHLA-G: antígeno leucocitario humano tipo G soluble.
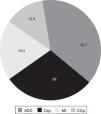
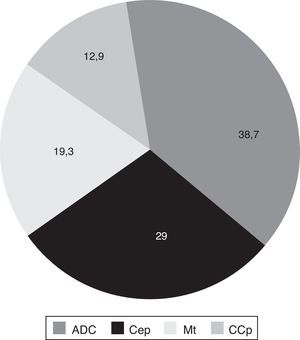
El tejido neoplásico fue obtenido principalmente por la FBC (87,1% de las muestras), seguido de la toracotomía o biopsia a «cielo abierto» (6,4%) y la punción transtorácica guiada (6,4%). El adenocarcinoma representó el 38,7% de los tumores localizados en el pulmón, seguido del carcinoma epidermoide, los tumores metastásicos y el cáncer de células pequeñas, respectivamente (fig. 1).
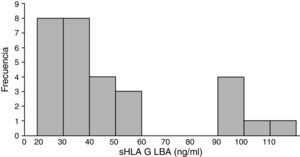
El antígeno leucocitario humano-G soluble está presente en el lavado broncoalveolar proveniente de tumores de pulmón en concentración variableLos valores de sHLA-G en el compartimento pulmonar fueron altamente fluctuantes, con una concentración mínima de 22ng/ml y una máxima de 115ng/ml, con un promedio para todo el grupo de 49,04ng/ml (DE ±27,4ng/ml). Estos niveles se distribuyeron de manera asimétrica y marcadamente bimodal. El primer grupo (80% de los pacientes) tuvo valores de sHLA-G entre 22 y 60ng/ml, y el segundo grupo presentó niveles entre 90 y 115ng/ml. Se observó que todos los pacientes en la categoría de tumor metastásico tuvieron valores de sHLA-G iguales o mayores a 90ng/ml, con un promedio de 98,1ng/ml (fig. 2).
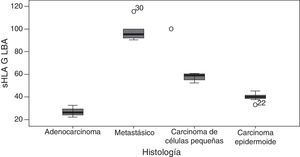
El GLM mostró diferencias altamente significativas entre los niveles de sHLA-G y el tipo histológico del tumor (p <0,001). En primer lugar, se encontraron niveles significativamente más elevados de sHLA-G en los tumores metastásicos en comparación con los tumores primarios de pulmón. En segundo lugar, la distribución de los niveles promedio de esta molécula fue: adenocarcinoma (los menores niveles de sHLA-G en el estudio, con una media de 26,49ng/ml), carcinoma epidermoide (40,03ng/ml), carcinoma de células pequeñas (57,60ng/ml) y tumores metastásicos en pulmón con la media aritmética más alta (fig. 3).
Se determinó una correlación entre los niveles de antígeno leucocitario humano-G soluble y la valoración funcional del pacientePara estudiar la correlación entre los valores de sHLA-G en el LBA y el índice de valoración funcional de Karnofsky, el primero fue agrupado en 2 categorías: moderadamente alto para aquellos valores de sHLA-G igual o menor a 50ng/ml, y muy alto cuando los valores eran superior a 50ng/ml. Estas 2 categorías fueron comparadas con el índice de Karnofsky, encontrando una correlación significativa e inversa entre los niveles de sHLA-G y este índice (p <0,05). Los pacientes con valores muy altos de sHLA-G tenían índices de Karnofsky más bajos y viceversa (tabla 2).
Niveles de antígeno leucocitario humano-G soluble en cáncer de pulmón y su correlación con el índice de Karnofsky
| Índice de Karnofsky | sHLA-G en LBA | |||
|---|---|---|---|---|
| Alta (≤50ng/ml) | Muy alta (>50ng/ml) | Total | ||
| I | 20 | 0 (0) | 1 (10) | 1 |
| K | 30 | 0 (0) | 1 (10) | 1 |
| B | 40 | 0 (0) | 2 (20) | 2 |
| 50 | 5 (23,8) | 3 (30) | 8 | |
| I | 60 | 5 (23,8) | 3 (30) | 8 |
| K | 70 | 2 (9,5) | 0 (0) | 2 |
| A | 80 | 9 (42,9) | 0 (0) | 9 |
| Total | 21 | 10 | 31 | |
IKA: índice de Karnofsky alto; IKB: índice de Karnofsky bajo; LBA: lavado broncoalveolar; sHLA-G: antígeno leucocitario humano tipo G soluble.
Los porcentajes se expresan entre paréntesis.
En general, las neoplasias son una causa importante de morbimortalidad a nivel mundial y es por ello que se realizan estudios para encontrar marcadores de diagnóstico y pronóstico adicionales y útiles en las fases iniciales de la enfermedad, donde la terapia antineoplásica es más efectiva. Es por esto que algunos estudios han señalado que los niveles de la molécula sHLA-G, medidos en suero/plasma, parecen estar relacionados con diferentes tipos de tumores, pudiendo ser un biomarcador tumoral útil15.
En este estudio se cuantificaron los niveles de sHLA-G en pacientes con cáncer de pulmón, pero en lugar de usar suero/plasma, se usó el LBA; encontramos que esta molécula está presente —en diferentes concentraciones— en el microambiente tumoral y que además parece estar directamente relacionada con el tipo histológico del tumor, ya que los valores medios más bajos fueron para el adenocarcinoma, seguidos del carcinoma epidermoide y, finalmente, el cáncer de células pequeñas del pulmón. Los valores más altos correspondieron a los tumores metastásicos. Probablemente, el fenómeno de invasión tumoral requiera mayores niveles de inmunosupresión, y por esto los tumores metastásicos de pulmón producen mayor cantidad de sHLA-G. Se conoce que esta molécula inhibe la respuesta inmune antitumoral tras la unión a los inmunorreceptores ILT-2, ILT-4 y KIR2DL4 expresados en las células efectoras del sistema inmunológico2. Dicha inhibición, para el caso de la forma soluble de la HLA-G, ocurriría incluso antes del contacto célula tumoral-linfocito, lo que favorecería la invasión tumoral.
La medición de sHLA-G en suero/plasma tiene algunas desventajas. Primero, los sujetos normales muestran niveles de esta molécula en sangre, con rangos altamente variables entre 4,40 y 14ng/ml, dependiendo del estudio20,21. Segundo, algunas situaciones fisiológicas como el embarazo y el trasplante de órganos elevan los niveles de sHLA-G, y finalmente, un número de enfermedades benignas (infección viral, asma y enfermedades autoinmunes) también modifican la sHLA-G en el suero4,22-27. Estas variables intervinientes, que podrían estar presentes en los pacientes con neoplasia pulmonar, harían difícil evaluar la cantidad de sHLA-G producida exclusivamente por el tumor y su impacto en el diagnóstico y pronóstico del cáncer de pulmón. La medición directa de sHLA-G en el LBA podría eliminar estos errores y hacer a este marcador más sensible y específico para el diagnóstico de la enfermedad maligna pulmonar, como ocurre en la ascitis maligna por cáncer de ovario28. La desventaja sería el uso de un método invasivo —como la FBC— para la obtención de la muestra, pero esta suele ser un procedimiento rutinario en la mayoría de los pacientes con sospecha de cáncer de pulmón para tomar muestras de manera precisa de la lesión tumoral y realizar los estudios histopatológicos. Entonces, no representaría un estudio adicional la obtención de LBA en este grupo. Otros métodos resultan útiles en la localización de HLA-G, como son la detección de su ARNm en las células tumorales o la identificación de la isoforma unida a la membrana por inmunohistoquímica11.
La escala de Karnofsky ha sido usada para valorar el estado funcional de pacientes oncológicos y su relación con la sobrevida y el riesgo de mortalidad; incluso su uso se ha extendido a otras áreas, como la gerontología, para establecer la calidad de vida de estos pacientes17,29. En este estudio se encontró una correlación significativa entre puntajes más bajos en la escala de Karnofsky y mayores niveles de sHLA-G en el LBA. Esta molécula podría influir en las condiciones generales del paciente, debido a su ya conocida acción inmunosupresora, que empeoran las condiciones de vida del paciente y el tiempo de sobrevida al favorecer la aparición de neumonías o reactivación de patógenos latentes. La secuencia de eventos dada por: elevación local de HLA-G e inmunosupresión con sobreinfección a nivel pulmonar, se pueden reflejar en una reducción del índice de Karnofsky y un mayor riesgo de mortalidad. El diseño de terapias que permitan corregir la hiperproducción de HLA-G en el microambiente tumoral podría romper dicha secuencia y rescatar la respuesta inmune antitumor. La HLA-G no es un antígeno especifico de tumores de pulmón, pues está presente en una diversidad de neoplasias —mama, colon y recto, esófago y otros—, pero podría ser un marcador pronóstico y un medidor de las condiciones clínicas del paciente, junto con la escala de Karnofsky.
Aunque hacen falta más estudios que confirmen nuestros hallazgos, resulta interesante seguir evaluando la utilidad de la sHLA-G, junto a otras moléculas parecidas (como la HLA-E y HLA-F), como marcadores de pronóstico en los pacientes con enfermedad neoplásica pulmonar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.