Alrededor del 40% de la población mundial sigue utilizando combustibles sólidos, entre ellos la leña, para cocinar o calentar sus hogares. La exposición crónica al humo de leña es un factor de riesgo para el desarrollo de enfermedad pulmonar obstructiva crónica (EPOC). En algunas zonas del mundo este factor puede ser más importante que la exposición al humo de tabaco, generalmente inhalado como humo de cigarrillo, como causa de EPOC.
Se han descrito diferencias significativas entre la EPOC relacionada con humo de leña (EPOC-L) y la EPOC causada por humo de tabaco (EPOC-T) que han llevado a plantear por algunos autores que la EPOC-L pueda ser considerada un nuevo fenotipo de la EPOC. Presentamos una revisión de las diferencias entre la EPOC-L y la EPOC-T. Basados en que el humo de la leña y el humo del tabaco no son iguales, y que podrían inducir mecanismos fisiopatológicos en algún punto diferentes, hacemos un análisis acerca de si la EPOC-L debe considerarse un fenotipo diferente de la EPOC o una entidad nosológica distinta.
Around 40% of the world's population continue using solid fuel, including wood, for cooking or heating their homes. Chronic exposure to wood smoke is a risk factor for developing chronic obstructive pulmonary disease (COPD). In some regions of the world, this can be a more important cause of COPD than exposure to tobacco smoke from cigarettes.
Significant differences between COPD associated with wood smoke (W-COPD) and that caused by smoking (S-COPD) have led some authors to suggest that W-COPD should be considered a new COPD phenotype. We present a review of the differences between W-COPD and S-COPD. On the premise that wood smoke and tobacco smoke are not the same and the physiopathological mechanisms they induce may differ, we have analyzed whether W-COPD can be considered as another COPD phenotype or a distinct nosological entity.
Fenotipo es el conjunto de características observables en un individuo resultantes de la interacción de su genotipo y el ambiente1,2. Dichas características no solo se refieren a rasgos físicos sino también a características bioquímicas y funcionales. Genotipo hace referencia a la constitución genética (combinación de genes) de cada individuo. La forma en que la información contenida en los genes (genotipo) se convierte en características observables (fenotipo) depende de diversos factores entre los cuales destacan su dominancia y su interacción compleja con el ambiente1,2.
En el contexto clínico, el concepto de fenotipo ha sido utilizado para identificar grupos de pacientes que comparten atributos comunes que permiten diferenciarlos de otros conformando subgrupos clínicos3. En la enfermedad pulmonar obstructiva crónica (EPOC) —en la cual, salvo el caso de la deficiencia de alfa1-antitripsina, los genes subyacentes son desconocidos— aplica bien esta acepción de fenotipo. Con el propósito de que la diferenciación fenotípica tenga implicaciones clínicas se ha propuesto el término «fenotipo clínico», que se define como «aquellos atributos de la enfermedad que, solos o en combinación, describen las diferencias entre individuos con EPOC en relación con desenlaces clínicamente importantes (síntomas, exacerbaciones, respuesta al tratamiento, tasa de progresión de la enfermedad o muerte)»4.
El término EPOC se comenzó a utilizar hace cerca de 50años5 e incluyó principalmente 2 entidades que compartían como rasgos comunes un factor de riesgo (tabaquismo) y una alteración funcional (obstrucción persistente al flujo de aire): la bronquitis crónica y el enfisema6,7. Los casos más puros de estas 2 entidades tenían características clínicas suficientemente diferentes para permitir su separación en los 2 fenotipos clásicos de la EPOC: bronquítico crónico o «abotagado azul» y enfisematoso o «soplador rosado». Sin embargo, la falta de claridad acerca de que esta diferenciación condujera a intervenciones terapéuticas y desenlaces diferentes restó importancia a la separación e impulsó el uso del término genérico EPOC.
El seguimiento a largo plazo de cohortes de pacientes y el avance de la tecnología han permitido retomar el concepto de fenotipos clínicos en la EPOC3,4,8,9. Aunque persiste el debate sobre las implicaciones de la separación por fenotipos, algunas guías clínicas han propuesto su utilización10. Los fenotipos más aceptados son: enfisematoso, bronquítico crónico, exacerbador frecuente y superposición asma-EPOC3,4,8-10.
La información creciente acerca de las diferencias que tienen los pacientes con EPOC relacionada con humo de biomasa, particularmente humo de leña, con la EPOC relacionada con humo de tabaco11,12, ha llevado a proponer que la EPOC por biomasa se constituya en un fenotipo adicional13,14. Esta propuesta es controvertible, lo que justifica revisar la información existente acerca de estas diferencias y de la aplicabilidad del término fenotipo en presencia de factores de riesgo que podrían considerarse distintos.
En esta revisión presentaremos las diferencias entre la EPOC por humo de leña (EPOC-L) y la EPOC por humo de tabaco (EPOC-T). Usaremos la denominación general de EPOC-T, aunque la denominación más precisa sería la de EPOC por humo de cigarrillo, el cual contiene, además de los productos derivados de la combustión del tabaco, un número adicional de sustancias químicas15,16. Puesto que el papel de estas en la patogénesis de la EPOC no es claramente separable del papel del tabaco, usaremos el término genérico de EPOC-T.
Para esta revisión consultamos las bases de datos Medline, LILACS y Cochrane usando los términos biomasa (biomass), combustibles de biomasa (biomass fuels), leña (wood), humo de leña (woodsmoke), contaminación intradomiciliaria (indoor air pollution), enfermedad respiratoria (respiratory diseases), bronquitis crónica (chronic bronchitis) y enfermedad pulmonar obstructiva crónica (chronic obstructive pulmonary disease), y los conectores Y/O (AND/OR).
La exposición a humo de leña como factor de riesgo de enfermedad pulmonar obstructiva crónicaAlrededor del 40% de la población mundial, especialmente en países en vía de desarrollo, sigue utilizando combustibles sólidos, sea carbón o biomasa (leña, residuos vegetales y estiércol), para cocinar o calentar los hogares17,18. En algunos de estos países más del 70% de la población rural los utiliza como principal fuente de energía17,18. En países donde el desplazamiento desde zonas rurales hacia las ciudades es alto, la población mayor de 40años residente en zonas urbanas tiene con frecuencia historia de exposición significativa a combustibles de biomasa. Un ejemplo es el de Colombia, donde el 39% de la población mayor de 40años residente en las 5 principales ciudades había cocinado con leña durante más de 10años antes de llegar a la ciudad19. En 2010, la contaminación intradomiciliaria por combustibles sólidos fue el tercer factor de riesgo de mortalidad en el mundo (3,5 millones de muertes al año)20.
Un volumen creciente de publicaciones sustenta que la exposición a combustibles sólidos, incluida la leña, es un factor de riesgo de enfermedad respiratoria: infección respiratoria aguda en niños, EPOC, bronquitis crónica, obstrucción al flujo de aire, hiperreactividad bronquial, asma, tuberculosis y cáncer pulmonar21-39. Nuestro grupo ha documentado la asociación entre la exposición a humo de leña durante más de 10años y la presencia de asma en población mayor de 40años39.
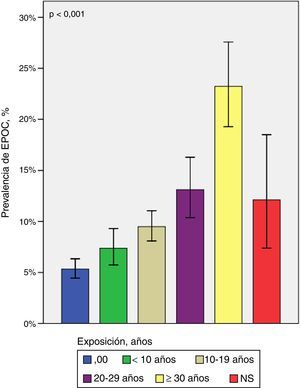
Tres revisiones sistemáticas y metaanálisis confirman que las personas expuestas crónicamente a combustibles sólidos en su domicilio tienen mayor riesgo de desarrollar EPOC36-38. En el caso del humo de leña, el riesgo de EPOC aumenta significativamente con el tiempo de exposición (fig. 1)40 y con la exposición simultánea a humo de tabaco40,41. Aunque el riesgo es consistentemente mayor en mujeres, un estudio poblacional (n=5.539) mostró que, después de ajustar por edad, tabaquismo, nivel de educación y exposición ocupacional, los hombres expuestos a humo de leña durante más de 10años tienen mayor riesgo de EPOC (OR [odds ratio] mujeres: 1,84; OR hombres: 1,53)40. Es de destacar que la exposición a humo de leña se ha descrito también como factor de riesgo de EPOC en países desarrollados33.
Prevalencia de EPOC según años de exposición al humo de leña40. La prevalencia de EPOC en expuestos a leña aumenta significativamente a mayor número de años de exposición.
NS: no sabe (expuestos a humo de leña que no informaron años de exposición).
Se considera que la contaminación domiciliaria por combustibles sólidos es el principal factor de riesgo de EPOC a nivel global42,43, aunque la prevalencia de EPOC por biomasa no ha sido definida con precisión. En el estudio PREPOCOL se encontró una prevalencia de EPOC-L del 6,7%, frente al 7,8% de EPOC-T40.
Es de mencionar que algunos estudios poblacionales no han encontrado asociación entre la exposición a combustibles de biomasa y EPOC44,45. La mayor parte de las poblaciones evaluadas en estos estudios se encuentran a bajas alturas sobre el nivel del mar, donde se suele cocinar por fuera del domicilio o con mejores condiciones de ventilación. Por el contrario, buena parte de los estudios que documentan esta asociación provienen de zonas situadas a alturas grandes o intermedias, donde, por la baja temperatura, se cocina a lo largo de todo el año dentro de los domicilios, con mala ventilación, como sucede durante el invierno en zonas con estaciones.
Aunque la exposición al humo de leña ha sido relacionada con enfermedades respiratorias diferentes de la EPOC24,46-48, esta revisión se enfoca en las diferencias entre la EPOC-L y la EPOC-T.
Diferencias entre la enfermedad pulmonar obstructiva crónica por humo de leña y la enfermedad pulmonar obstructiva crónica por humo de tabacoAunque el riesgo de EPOC ha sido comprobado para todos los tipos de combustibles sólidos, los estudios que caracterizan mejor la EPOC secundaria a este tipo de exposición se han enfocado en la EPOC por inhalación de humo de leña11-14,24,32,34,47,49. Varios estudios muestran que la EPOC-L tiene diferencias significativas y similitudes con la EPOC-T13,40,47,49-62. A continuación presentamos las principales diferencias descritas, que se resumen en la tabla 1.
Diferencias entre la EPOC por leña y la EPOC por tabaco
| Características | EPOC por leña | EPOC por tabaco |
|---|---|---|
| Demográficas40,47,49-51,54-56 | ||
| Sexo | Predominio mujeres | Predominio hombres |
| Edad | Mayor | Menor |
| Talla | Menor | Mayor |
| IMC | Mayor | Menor |
| Clínicas38,49 | ||
| Tos y expectoración | Muy frecuente | Frecuente |
| Bronquitis crónica | Frecuente | Frecuente |
| Roncus y sibilancias | Frecuente | Menos frecuente |
| Funcionales13,40,47,49-51,54-56 | ||
| PaCO2 | Más alta (algunos estudios) | Menos alta |
| PaO2 y SaO2 | Más baja | Menos baja |
| Obstrucción (FEV1 − FEV1/FVC) | Leve | Más grave |
| Declinación del FEV1 | Menor | Mayor |
| Hiperreactividad bronquial | Mayor | Menor |
| DLCO y DLCO/VA | Normal o poco disminuida | Más disminuida |
| Radiográficas-tomográficas13,47,49,51,54,59 | ||
| Enfisema | Infrecuente y leve | Frecuente y más grave |
| Engrosamiento bronquial | Frecuente | Menos frecuente |
| Bronquiectasias | Frecuentes | Poco frecuentes |
| Atelectasias | Frecuentes | Poco frecuentes |
| Histopatológicas58 | ||
| Enfisema | Leve | Más grave |
| Antracosis | Frecuente | Menos frecuente |
| Fibrosis de las vías aéreas | Frecuente | Menos frecuente |
| Engrosamiento de la íntima de las arteriolas | Frecuente | Menos frecuente |
| Desenlaces y fenotipos clínicos13,51,56,61,62 | ||
| Hipertensión pulmonar | Más frecuente | Menos frecuente |
| Calidad de vida | Similar o más afectada en síntomas y actividades | Similar o menos afectada en síntomas y actividades |
| Supervivencia | Similar después de ajustar por edad Menor antes de ajuste | Similar |
| Fenotipo exacerbador | Similar | Similar |
| Fenotipo mixto asma - EPOC | Más frecuente | Menos frecuente |
| Fenotipo enfisematoso | Poco frecuente | Más frecuente |
DLCO: difusión de monóxido de carbono; FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; PaCO2: presión arterial de dióxido de carbono; PaO2: presión arterial de oxígeno; SaO2: saturación arterial de oxígeno; VA: volumen alveolar.
La EPOC-L predomina en mujeres por su dedicación más frecuente al oficio de cocinar11. Es consistente la observación de que las mujeres con EPOC-L son de menor estatura y mayor índice de masa corporal (IMC) que las mujeres con EPOC-T40,47,49-51,54-56. Dado que la mayor parte de las mujeres con EPOC-L son de origen rural y la mayor parte de aquellas con EPOC-T son de origen urbano, las diferencias en estatura e IMC podrían explicarse por razones étnicas y ambientales que requieren investigación. Adicionalmente, las mujeres con EPOC-L son de mayor edad, lo que puede reflejar que el tipo de exposición requiere más tiempo para generar enfermedad, o que el diagnóstico es más tardío40,49-51,55,56.
Diferencias clínicasAunque varios estudios muestran que la frecuencia de síntomas respiratorios (tos, expectoración y disnea) y bronquitis crónica es elevada en expuestos a biomasa36,38, los estudios comparativos entre EPOC-L y EPOC-T no son consistentes en encontrar una diferencia significativa. Algunos estudios muestran mayor frecuencia o impacto de los síntomas en la EPOC-L13,49,62 y otros no51,53,56. En cuanto al examen físico, González-García et al.49 encontraron mayor frecuencia de roncus y sibilancias en la EPOC-L. Los hallazgos funcionales y tomográficos mencionados adelante, que documentan mayor compromiso bronquial, apoyan los estudios que muestran mayor frecuencia de tos, expectoración, roncus y sibilancias en la EPOC-L.
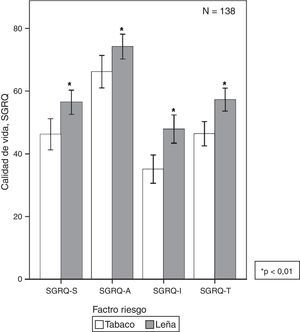
Diferencias en calidad de vidaUn estudio en 138 mujeres con EPOC mostró que, para un mismo grado de obstrucción, las mujeres con EPOC-L tienen mayor compromiso del estado de salud (peor calidad de vida y mayor disnea) que las mujeres con EPOC-T sin tener diferencias en comorbilidades (fig. 2)62. Así mismo, Camp et al., al aplicar el cuestionario de Saint George, encontraron mayor compromiso en síntomas y actividades en las mujeres con EPOC-L13.
Calidad de vida en EPOC por humo de leña o tabaco62. En EPOC-L se observa mayor compromiso de la calidad de vida (SGRQ) en la puntuación total y en todos los dominios (p<0,01).
SGRQ: Cuestionario de calidad de vida de Saint George.
En comparación con la EPOC-T, en la EPOC-L la alteración obstructiva es más leve, de manera general y al ajustar por edad13,40,47,49-51,56, y la declinación del volumen espiratorio forzado en un segundo (FEV1) es menor y más homogénea que en la EPOC-T50. Algunos estudios muestran que la presión arterial de dióxido de carbono (PaCO2) es más alta (menor ventilación) y la presión arterial de oxígeno (PaO2) y la saturación arterial de oxígeno (SaO2) más bajas en la EPOC-L que en la EPOC-T13,49,50,56. Los índices de oxigenación más bajos en la EPOC-L podrían explicarse en parte por la hipoventilación. Es necesario estudiar si este comportamiento se relaciona con el mayor IMC de estas pacientes, la mayoría mujeres mayores de 50años.
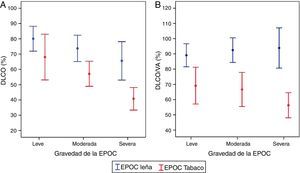
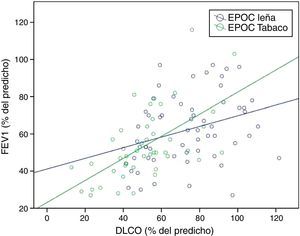
Es consistente la observación de una capacidad de difusión (DLCO) y una DLCO relacionada al volumen alveolar (DLCO/VA) normales o poco afectadas en la EPOC-L en comparación con la EPOC-T, en la cual se encuentran significativamente disminuidas49,54. Este hallazgo se correlaciona con el menor grado de enfisema encontrado en la TAC en pacientes con EPOC-L13,54,59, y ocurre en todos los niveles de gravedad de la EPOC (fig. 3A,B)49. La DLCO levemente disminuida con DLCO/VA normal observada en las mujeres con EPOC-L se ha descrito en casos de compromiso significativo de las pequeñas vías aéreas con poco enfisema («enfisema pseudofisiológico»)63. El compromiso de la difusión se correlaciona mejor con la disminución del FEV1 en las mujeres con EPOC-T que en aquellas con EPOC-L, lo cual apoya la mayor contribución del enfisema a la obstrucción al flujo de aire en la EPOC-T (fig. 4)49.
A)DLCO (%) según exposición y grado de obstrucción49. B)DLCO/VA (%) según exposición y grado de obstrucción49. En la EPOC por tabaco hay mayor compromiso de la DLCO y de la DLCO/VA. La DLCO/VA es normal en la EPOC por leña en todos los grados de gravedad.
DLCO: difusión de monóxido de carbono; VA: volumen alveolar.
Correlación entre FEV1 (%) y DLCO (%) según exposición49. Se observa una mejor correlación entre el FEV1 y la DLCO en la EPOC por tabaco (p<0,001, r=0,599) que en la EPOC por leña (p=0,014, r=0,320).
DLCO: difusión de monóxido de carbono; FEV1: volumen espiratorio forzado en un segundo.
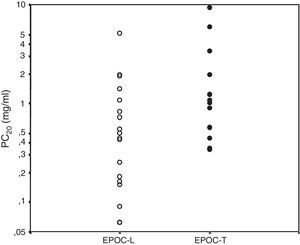
Las mujeres con EPOC-L tienen mayor hiperreactividad bronquial que las mujeres con EPOC-T (fig. 5)55. Es necesario investigar si esto se correlaciona con la mayor frecuencia del fenotipo mixto asma-EPOC observada en la EPOC relacionada con biomasa51. Teniendo en cuenta el papel preponderante que pueden tener los corticoides inhalados en los enfermos con superposición asma-EPOC9,10, es presumible que estos medicamentos tengan un efecto diferente en la EPOC-L que en la EPOC-T.
Hiperreactividad bronquial evaluada por PC20 según exposición55. Círculos blancos: EPOC-L; círculos negros: EPOC-T. Media geométrica de la PC20: EPOC leña versus EPOC tabaco: 0,39 (0,06-5,13) versus 1,24 (0,34-9,39), p=0,028.
PC20: concentración de metacolina que provoca una disminución del FEV1 ≥20%.
Algunos estudios han utilizado la prueba de marcha de 6min sin encontrar diferencias significativas entre pacientes con EPOC-L y EPOC-T en la distancia caminada13,56,62. En el estudio de Camp et al.13 se encontró una menor saturación de oxígeno arterial medida por pulsioximetría (SpO2) al final de la prueba en las mujeres con EPOC-L, pero esto no se ha descrito en otros estudios.
Diferencias tomográficas e histopatológicasLos pacientes con EPOC-L tienen consistentemente menos enfisema y más alteraciones de la vía aérea (engrosamiento y fibrosis bronquial, bronquiectasias y atelectasias) que los pacientes con EPOC-T tanto en las tomografías del tórax como en los estudios histopatológicos13,51,52,54,59. Estas diferencias morfológicas se pueden relacionar con el menor compromiso de la DLCO y, probablemente, con la mayor hiperreactividad bronquial55 y frecuencia de fenotipo asmático observado en la EPOC-L51.
Diferencias en hipertensión pulmonarUn estudio reciente mostró una mayor frecuencia de hipertensión pulmonar (HP) evaluada por ecocardiografía en pacientes con EPOC-L en comparación con EPOC-T60. Previamente, nuestro grupo, mediante evaluación radiográfica, había sugerido lo mismo en pacientes con EPOC grave49, y Sandoval et al.61 habían mostrado una frecuencia alta de HP en personas expuestas a humo de leña en comparación con personas con EPOC por humo de tabaco. El origen de la HP en pacientes con EPOC-L no parece estar solamente relacionado con la vasoconstricción pulmonar hipóxica sino también con efectos directos causados por el material inhalado o efectos indirectos mediados por inflamación64.
Diferencias en la ocurrencia de fibroantracosis bronquialNo hay estudios que evalúen prospectivamente la frecuencia de fibroantracosis bronquial y su gravedad en personas expuestas a humo de leña o humo de tabaco, y se desconoce si hay diferencias. Sin embargo, es frecuente encontrar fibroantracosis de la vía aérea, que puede acompañarse de estenosis bronquial, en personas expuestas a humo de leña65-67. En una proporción significativa de ellas se puede documentar obstrucción al flujo de aire65, a la cual podría contribuir la estenosis observada en la vía aérea central de estos pacientes. No es posible definir actualmente si la fibroantracosis bronquial es un rasgo más de la EPOC-L, más frecuente y grave que la observada en la EPOC-T, o si es una entidad específica que se acompaña de obstrucción.
Diferencias en desenlaces clínicos relevantesDespués de ajustar por edad, sexo y gravedad de la enfermedad no se han encontrado diferencias en supervivencia entre la EPOC-L y la EPOC-T56,57. Tampoco se ha encontrado diferencia en la frecuencia de exacerbaciones entre los 2 grupos51, pero es de anotar que no hay información prospectiva consistente al respecto.
Diferencias en la distribución de fenotipos clínicosGolpe et al.51, al evaluar la frecuencia de los fenotipos clínicos definidos por la Guía española de la EPOC10 en pacientes con EPOC causada por biomasa o por tabaco, encontraron, en el mismo sentido de lo descrito antes, una mayor frecuencia de fenotipo enfisematoso en la EPOC-T. El fenotipo mixto EPOC-asma fue más frecuente en la EPOC por biomasa, pero la diferencia desapareció al ajustar por sexo. No hubo diferencia en la frecuencia de fenotipo bronquitis crónica o exacerbador51.
Posibles explicaciones de las diferencias entre la enfermedad pulmonar obstructiva crónica por humo de leña y la enfermedad pulmonar obstructiva crónica por humo de tabacoEs esperable que el mayor compromiso inflamatorio de la vía aérea y la menor frecuencia de enfisema encontrados en la EPOC-L en comparación con la EPOC-T tengan una explicación etiológica, patogénica y fisiopatológica razonable. Sin embargo, la información que pueda sustentar las diferencias es muy limitada.
La composición del humo de leña es tan compleja (cientos de compuestos químicos y material particulado)23,68 como la del humo de cigarrillo15,16. La combustión de la leña es generalmente incompleta, lo cual genera una mayor concentración de algunas sustancias como CO, benceno e hidrocarburos policíclicos como benzopireno en relación con el humo de cigarrillo23. Prácticamente el 100% del material particulado en el humo de cigarrillo tiene un tamaño inferior a 2,5μm69. Esta proporción es cercana al 90% en el humo de la leña68; el restante 10% de partículas tiene un tamaño entre 2,5 y 10μm. El papel de esta distribución de tamaño de partículas en el mayor compromiso de la vía aérea y la presencia frecuente de fibroantracosis en la EPOC-L no se ha determinado.
Silva et al.70 revisaron recientemente los mecanismos patogénicos implicados en la EPOC por biomasa. Muchos de estos mecanismos, como en la EPOC-T, se relacionan con activación inflamatoria y estrés oxidativo, sin que sean evidentes diferencias significativas en los mecanismos involucrados en la generación del daño respiratorio en la EPOC-L. Aunque la menor frecuencia —o la ausencia— de enfisema en la EPOC-L podría sugerir menor actividad proteolítica ante la exposición al humo de biomasa, un estudio reciente no encontró diferencias en este sentido al comparar la exposición a humo de biomasa con la exposición a humo de cigarrillo64. Algunos autores sugieren que las diferencias entre la EPOC-L y la EPOC-T podrían ser determinadas en parte por diferencias en las características de la exposición11, pero se requiere investigación para sustentar este concepto.
En resumen, no hay claridad sobre los mecanismos fisiopatológicos involucrados en la EPOC-L, pero es esperable que la activación inflamatoria en la vía aérea sea diferente y de mayor magnitud y la actividad proteolítica inductora de enfisema menor.
Enfermedad pulmonar obstructiva crónica por humo de leña, ¿nuevo fenotipo de enfermedad pulmonar obstructiva crónica o entidad distinta?La evidencia presentada sustenta consistentemente que la EPOC-L es diferente de la EPOC-T por mayor compromiso inflamatorio de la vía aérea y mucho menor o ningún grado de enfisema. Dado que los factores etiológicos —humo de leña o humo de cigarrillo—, aunque agrupables bajo la denominación de partículas o gases nocivos, son también diferentes23, es razonable plantear que la EPOC-L se trata de una enfermedad distinta más que identificarla como un nuevo fenotipo de EPOC13,14. Adicionalmente, el reconocimiento de que la exposición a humo de leña puede relacionarse con manifestaciones radiológicas, funcionales e histopatológicas, diferentes de las descritas bajo la definición de EPOC, como infiltrados pulmonares, patrones restrictivos y depósito de material particulado en el pulmón24,46-48, puede considerarse un argumento más para su separación como entidad nosológica distinta.
Aun aceptando que, con la definición actual, la enfermedad obstructiva causada por la exposición a leña cabe bajo el término EPOC, la separación de la EPOC-L en un fenotipo clínico diferente no es contundente en la actualidad, puesto que sus diferencias clínicas, funcionales, histopatológicas y radiográficas no se traducen en diferencias en desenlaces relevantes como exacerbaciones y mortalidad como lo plantea la definición de fenotipo clínico4.
Bajo un enfoque nosológico, el modelo de la enfermedad respiratoria causada por humo de leña nos plantea la discusión sobre la definición de EPOC71. En ausencia de un factor etiológico único o de un rasgo altamente específico o patognomónico, la EPOC se ha definido por una característica funcional inespecífica (limitación irreversible al flujo de aire [obstrucción posbroncodilatador]) en presencia de una exposición poco precisa (partículas o gases nocivos)72.
Cuando existe un factor etiológico único o un rasgo definitorio altamente específico de una enfermedad, la identificación de fenotipos clínicos es una aproximación válida en el camino de la individualización del manejo de los enfermos3,9. Cuando el factor etiológico de una enfermedad no está identificado o no es único, como en el caso de la EPOC (partículas o gases nocivos), y la enfermedad está definida por un rasgo inespecífico, las características y desenlaces diferentes de un grupo podrían representar una entidad distinta y separable más que otra expresión fenotípica.
Independientemente de su consideración como un nuevo fenotipo o como una entidad distinta, lo relevante son las implicaciones en pronóstico y tratamiento. Se puede presumir que los mecanismos fisiopatológicos de la EPOC-L son diferentes, y que el tratamiento puede tener focos distintos. Al predominar el componente inflamatorio de la vía aérea es esperable un mayor papel de antiinflamatorios, como los esteroides inhalados. Es necesario ampliar la investigación en los mecanismos fisiopatológicos y el tratamiento de la enfermedad por humo de leña. El mejor entendimiento de estas diferencias puede aplicarse a otros casos de EPOC no relacionados con el humo de cigarrillo o de la leña y que no son una fracción insignificante73,74. Condiciones derivadas de la contaminación laboral y ambiental que caben dentro de la EPOC podrían ser mejor caracterizadas.
El término EPOC ha tenido una importancia incontrovertible. En el camino hacia la personalización, más allá de que la fenotipificación tiene un papel central, la diferenciación por el agente etiológico o causal sigue siendo fundamental71,75. El concepto de la EPOC como un síndrome que cobija diversas entidades específicas está en desarrollo y probablemente sea tiempo de replantear la definición de la EPOC3.
ConclusionesLa EPOC-L es diferente de la EPOC-T. El hecho de que el factor causal (humo de leña) y las características de la exposición sean también distintos puede determinar que los mecanismos fisiopatológicos y/o su intensidad se diferencien en algunos puntos y expliquen el mayor compromiso inflamatorio de la vía aérea y la ausencia de enfisema que caracteriza la EPOC-L. Las opciones terapéuticas serían también diferentes, con un mayor papel de antiinflamatorios como los esteroides inhalados. Bajo este enfoque, la EPOC-L se entiende mejor como una enfermedad distinta que como un nuevo fenotipo de EPOC cuestionando la falta de especificidad de la definición de EPOC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.