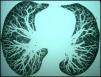
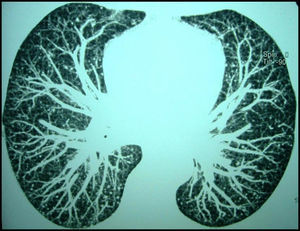
El bacilo de Calmette-Guérin (BCG) es una cepa viva atenuada de Mycobacterium bovis, una especie del grupo Mycobacterium tuberculosis complex. Las instilaciones de BCG han sido utilizadas en el tratamiento de los carcinomas in situ y superficiales de vejiga desde la década de los 701–3. Su eficacia ha sido demostrada en numerosos estudios, aunque su uso no está exento de complicaciones, habiéndose descrito reacciones locales y sistémicas. Aunque muy infrecuente, pero con una elevada mortalidad, una de estas complicaciones es la tuberculosis miliar (TBM)1,2. Reportamos un caso excepcional de un paciente que en ausencia de síntomas respiratorios o generales fue diagnosticado de una TBM tras la instilación intravesical de BCG. Se trataba de un varón de 62 años sin hábitos tóxicos y sin antecedentes respiratorios de interés. Tras consultar por hematuria fue diagnosticado en un estudio endoscópico transuretral de un carcinoma papilar de transición estadío I, por lo que tres semanas después se inició un tratamiento con instilaciones endovesicales mensuales de BCG (cepa Connaught, 109 unidades formadoras de colonias por dosis). No se realizó profilaxis antituberculosa previa al tratamiento. Después del sexto ciclo se realizó una colono-TC para el control de una enfermedad polipomatosa intestinal previa que mostró en los cortes más superiores un patrón micronodular. El paciente negaba cualquier tipo de sintomatología respiratoria o general siendo el estudio analítico completo, incluyendo serología VIH y reactantes de fase, estrictamente normal. Ante los hallazgos radiológicos, se completó el estudio con una TC de tórax (fig. 1) que confirmó la existencia de un patrón micronodular bilateral difuso sin objetivarse otro tipo de lesiones parenquimatosas o mediastínicas. La radiografía de tórax en ese momento fue informada como normal. Se llevó a cabo una broncoscopia con biopsias transbronquiales (BTB) y lavado broncoalveolar (LBA). La descripción microscópica de las BTB fue de granulomas epiteloides no necrotizantes. Las tinciones y cultivos para micobacterias y las técnicas de amplificación del DNA y RNA de M. tuberculosis fueron negativas en el LBA. Las técnicas de PCR específicas para M. tuberculosis fueron positivas en las biopsias. Se estableció el diagnóstico de probable TBM secundaria a la instilación endovesical de BCG. Se inició tratamiento antituberculoso con rifampicina e isoniazida durante 9 meses, añadiéndose etambutol los dos primeros, sin presentarse durante el seguimiento efectos adversos de la medicación. En la TC torácica de control a los 3 meses se observó una disminución en el número de nódulos con desaparición completa en algunos segmentos pulmonares.
Aunque la instilación intravesival de BCG suele ser bien tolerada por la mayoría de los pacientes, se han descrito múltiples complicaciones locales como cistitis, prostatitis, orquitis, obstrucción ureteral, pero también sistémicas, como fiebre, y menos frecuentemente (<1%) exantema, poliartralgias y artritis, hepatitis granulomatosa y diversas formas de afectación respiratoria1–4. Entre éstas deben destacarse diversos tipos de afectación parenquimatosa como la TBM, la neumonitis intersticial o incluso daño alveolar difuso, siendo en la mayoría de los casos de carácter grave1,2,4. La etiopatogenia de la afectación sistémica es controvertida. Mientras que hay autores que opinan que se trata de una infección sistémica mediante siembra hematógena a partir de la vejiga, otros defienden un mecanismo de hipersensibilidad tipo IV a la BCG, basándose en la negatividad de la tinción Ziehl-Neelsen y los cultivos2–4. Los factores que orientan al diagnóstico de diseminación de la infección son la tinción o cultivo de micobacterias positivos y la presencia de granulomas no caseificantes en lugares distantes3,4. En el presente caso, aunque la tinción y el cultivo de micobacterias fueron negativos, se hallaron granulomas no caseificantes y se detectó ácido nucleico del grupo de M. tuberculosis complex por la técnica de PCR en las BTB, lo que añadido al antecedente de instilación de BCG hace el diagnóstico de TBM por BCG muy probable. Sin embargo, los hallazgos histológicos y de PCR también podrían deberse a una afectación por M. tuberculosis u otra especie del grupo M. tuberculosis complex.
La excepcionalidad del caso presentado es que el paciente no presentaba ningún tipo de sintomatología respiratoria o general, siendo el hallazgo totalmente casual al realizar una exploración radiológica por otro motivo. En todos los casos descritos en la literatura de TBM tras instilaciones intravesicales de BCG, estos presentaban un importante síndrome general incluyendo fiebre, que en muchos casos progresó hacia el fracaso respiratorio y muerte, a pesar de un tratamiento correcto en algunos casos4,5. Sin embargo, éste es el primer caso asintomático de TBM secundaria a la instilación endovesical de BCG reportado en la literatura médica, lo que podría ser debido a un hallazgo casual en una fase precoz de la enfermedad o a la posibilidad no descrita hasta el momento de un subtipo de afectación miliar silente autolimitada por este bacilo atenuado en un sujeto inmunocompetente.