La linfangioleiomiomatosis (LAM) es una enfermedad pulmonar rara que afecta a mujeres jóvenes y que suele progresar hacia el fracaso del sistema respiratorio. No existe evidencia científica suficiente que justifique el uso de ningún fármaco en la LAM. El único tratamiento efectivo en los casos graves es el trasplante pulmonar. En la LAM se ha observado una activación de mammalian target of rapamycin (mTOR). La administración de sirolimus, un inhibidor de mTOR, parece reducir los angiomiolipomas renales que se asocian a la LAM. Además, algunos trabajos sugieren una mejoría de la función pulmonar con este fármaco. Presentamos tres mujeres con LAM que manifestaron un deterioro clínico y funcional respiratorio rápidamente progresivo y que fueron tratadas con sirolimus.
Lymphangioleiomyomatosis (LAM) is a rare lung disease, that predominantly affects young females and generally progresses to respiratory failure. There is not sufficient evidence to support the routine use of any treatment in LAM. The only treatment for severe LAM is currently lung transplantation. Activation of mammalian target of rapamycin (mTOR) signalling pathway has been observed in LAM. LAM is often associated with angiomyolipoma in the kidneys. mTOR inhibitor sirolimus reduces angymiolipoma volumes. Some reports have shown improvement in lung function with sirolimus in LAM.
We report 3 women with LAM, with a rapid decline in lung function and symptoms and who were treated with sirolimus.
La linfangioleiomiomatosis (LAM) es una enfermedad pulmonar rara que afecta a mujeres jóvenes en edad fértil. Se caracteriza por la proliferación de células musculares lisas atípicas («células LAM») en el intersticio pulmonar y alrededor de las estructuras broncovasculares y por la formación de quistes a nivel del parénquima, lo que conlleva una pérdida progresiva de la función pulmonar1. Se distinguen dos formas clínicas, una forma esporádica y otra asociada a esclerosis tuberosa (ET).
No existe hasta la fecha ningún tratamiento farmacológico que haya demostrado modificar el curso de la enfermedad. Durante años la progesterona ha sido la terapia más usada en esta enfermedad, aunque no existía evidencia científica suficiente que recomendara su uso de forma rutinaria.
Los pacientes con LAM en una clase funcional III o IV de la New York Heart Association (NYHA) con hipoxemia en reposo y con un deterioro funcional significativo deben ser remitidos a un centro de referencia en trasplante pulmonar.
Los nuevos avances en el campo de la biología celular en LAM muestran la existencia de mutaciones somáticas en los genes de la ET. El sirolimus, un inhibidor de mTOR, podría contrarrestar las anormalidades celulares resultantes. Un ensayo clínico en fase III con sirolimus está en marcha actualmente.
Se describe la evolución funcional respiratoria de tres pacientes con LAM, dos con LAM esporádica y una con LAM asociada a ET que recibieron tratamiento con sirolimus como uso compasivo.
Observación clínicaCaso 1Mujer de 44 años, exfumadora, con LAM esporádica, diagnosticada por biopsia pulmonar quirúrgica en el año 2007. No había tenido neumotórax, quilotórax ni presentaba angiomiolipomas renales en la TC de abdomen. Clínicamente refería disnea de esfuerzo progresiva que se había intensificado en los últimos meses. Las pruebas funcionales respiratorias al diagnóstico mostraron un FEV1 de 1.730ml (66,1%), una FVC de 3.720ml (122%) y una DLCO de 3,35 mmol/ min/ kPa (40,9%). Cuatro meses después se observó un empeoramiento funcional respiratorio significativo, siendo el FEV1 de 1.380ml (52%) y la DLCO de 2,37 mmol/ min/ kPa (29%), aunque la FVC era de 3.870ml (127%). La prueba de la marcha de los 6 minutos mostró una distancia recorrida de 486 metros, una saturación de oxígeno basal de inicio del 94% y final del 87%. Se decidió tratamiento con sirolimus, 2mg al día por vía oral como uso compasivo. Se realizaron niveles del fármaco y controles analíticos seriados. La función pulmonar 35 meses después del inicio del tratamiento mostró un FEV1 de 2.100ml (82,7%), una FVC de 4.810ml (161%) y DLCO de 3,91 mmol/ min/ kPa (48,7%) (tabla 1). Igualmente la prueba de la marcha de los 6 minutos mostró una mejoría, con una distancia total de 542 metros, una saturación de O2 inicial del 95% y final del 90%. Durante el seguimiento los únicos efectos secundarios presentados han sido úlceras bucales y cefalea.
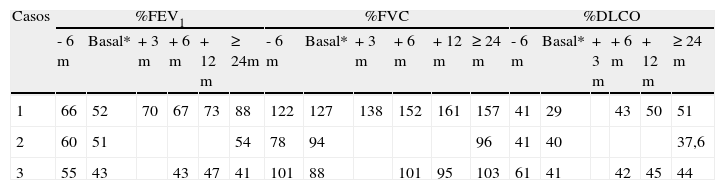
Evolución de la función pulmonar
| Casos | %FEV1 | %FVC | %DLCO | |||||||||||||||
| - 6 m | Basal* | + 3 m | + 6 m | + 12 m | ≥ 24m | - 6 m | Basal* | + 3 m | + 6 m | + 12 m | ≥ 24 m | - 6 m | Basal* | + 3 m | + 6 m | + 12 m | ≥ 24 m | |
| 1 | 66 | 52 | 70 | 67 | 73 | 88 | 122 | 127 | 138 | 152 | 161 | 157 | 41 | 29 | 43 | 50 | 51 | |
| 2 | 60 | 51 | 54 | 78 | 94 | 96 | 41 | 40 | 37,6 | |||||||||
| 3 | 55 | 43 | 43 | 47 | 41 | 101 | 88 | 101 | 95 | 103 | 61 | 41 | 42 | 45 | 44 | |||
%DLCO: porcentaje sobre el valor predicho de la difusión pulmonar; %FEV1: porcentaje sobre el valor predicho del volumen espiratorio en el primer segundo; %FVC: porcentaje sobre el valor predicho de la capacidad vital forzada; *basal: previa a la instauración del tratamiento con sirolimus.
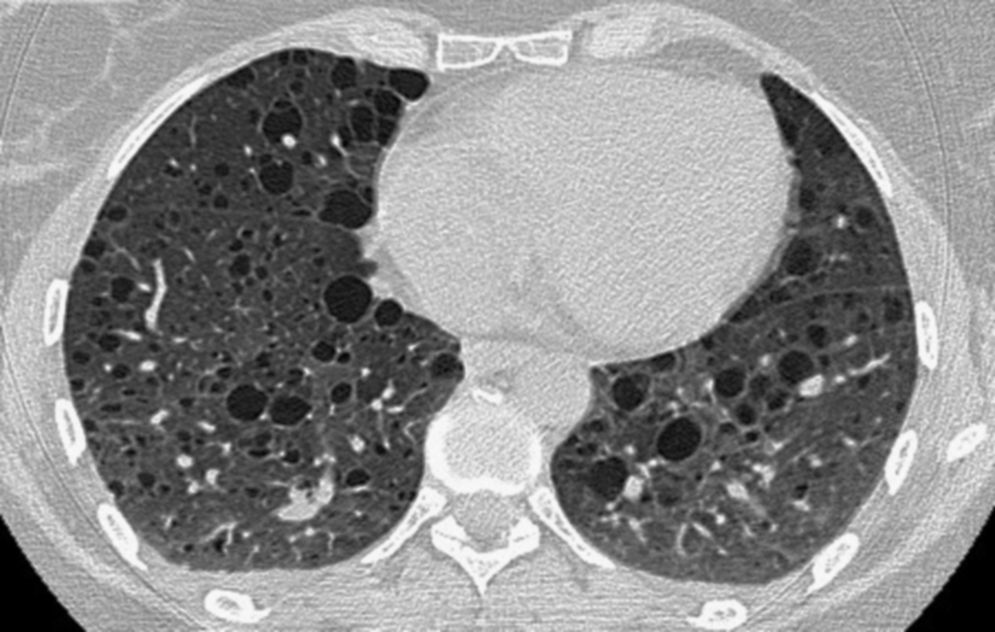
Mujer de 40 años, sin antecedentes de tabaquismo, diagnosticada de ET en el año 1982. En octubre de 2006 la paciente consultó por disnea de esfuerzo progresiva. Se realizó TC de tórax que evidenció la presencia de múltiples lesiones quísticas de pared fina distribuidas por ambos campos pulmonares de forma difusa (fig. 1), estableciéndose el diagnóstico de LAM asociada a ET. Tenía angiomiolipomas renales bilaterales. En octubre de 2007 tuvo un episodio de quilotórax que precisó la colocación de un tubo de drenaje endotorácico. Las pruebas funcionales mostraron un FEV1 de 1.680ml (60%), una FVC de 2.540ml (78%) y DLCO 3,5 mmol/ min/ kPa (41,1%), habiendo experimentado en un intervalo de 8 meses un descenso de 200ml en el FEV1, así como un empeoramiento clínico de la disnea. Se decidió, de acuerdo con la paciente, iniciar tratamiento con sirolimus a dosis de 2mg/ día por vía oral. Durante los 24 meses de seguimiento se ha estabilizado la clínica y el deterioro de la función pulmonar, presentando en la actualidad un FEV1 de 1.460ml (53,6%), una FVC de 3.050ml (94%) y una DLCO 3,15 mmol/ min/ kPa (37,6%) (tabla 1). La enferma no ha mostrado ningún efecto secundario de la medicación, a pesar del incremento de la misma a 3mg.
Caso 3Mujer de 37 años, exfumadora, con historia previa de neumotórax en abril de 2004 y diciembre de 2006, fue diagnosticada de LAM por biopsia pulmonar en enero de 2007. La función pulmonar en ese momento era de un FEV1 de 2.010ml (70,3%), FVC de 3.470ml (99%) y DLCO 4,63 mmol/ min/ kPa (55,9%). No tenía angiomiolipomas renales y nunca había presentado quilotórax. Tras el diagnóstico comenzó tratamiento con progesterona a dosis de 5mg/ día vía oral, que tomó durante 10 meses. La enfermedad fue progresando con empeoramiento clínico y funcional, mostrando un FEV1 de 1.540 (54,5%), por lo que la progesterona fue suspendida, al no observar mejoría en enero de 2008. En junio de ese mismo año se decidió iniciar tratamiento con sirolimus a dosis de 2mg/ día vía oral como uso compasivo; en ese tiempo el FEV1 era de 1.230ml (43,4%), la FVC de 3.080ml (88%) y DLCO de 3,39 mmol/ min/ kPa (41,1%), el descenso funcional que se había observado en 13 meses fue de 780ml en FEV1, 390ml en la FVC y de 1,24 mmol/ min/ kPa. Tras 28 meses de la instauración de la terapia se ha ralentizado el deterioro funcional, siendo la función pulmonar en la actualidad de un FEV1 de 1.050ml (38,01%), la FVC de 3.260 (95%) y la DLCO de 4,16 mmol/ min/ kPa (50,7%) (tabla 1). Los únicos efectos secundarios presentados han sido la presencia de úlceras bucales y uñas quebradizas.
DiscusiónEl presente trabajo analiza los efectos del tratamiento con sirolimus (rapamicina) en tres pacientes con LAM, dos con LAM esporádica y una con LAM asociada a ET.
Durante años el tratamiento de la LAM se ha centrado en el uso de terapias antiestrogénicas. El hecho de que afecte casi exclusivamente a mujeres, pueda exacerbarse durante el embarazo o con la toma de anticonceptivos y la identificación de receptores de estrógenos en el tejido pulmonar ha preconizado el uso de diferentes opciones terapéuticas como la ooforectomía, el tratamiento con tamoxifeno, progesterona y análogos de la hormona liberadora de gonadotrofinas, con resultados variables y parciales. Se han publicado series de casos en los cuales se describe una mejoría funcional respiratoria tras la administración de progesterona2,3. Estudios más recientes, como el de Taveira-Dasilva A et al, analizaron de forma retrospectiva a 275 pacientes con LAM, comparando el FEV1 y DLCO de las pacientes que habían sido tratadas con progesterona intravenosa o con progesterona por vía oral frente a las que no habían recibido ningún tratamiento. Teniendo en cuenta las limitaciones de un estudio retrospectivo, los autores concluyen que la progesterona no ralentizaba el deterioro de la función pulmonar en la LAM4. A pesar de no haberse llevado a cabo ningún ensayo clínico controlado con placebo de tratamiento con progesterona en la LAM, esta sigue siendo la opción terapéutica más utilizada. Sin embargo, las guías de la European Respiratory Society sobre el diagnóstico y manejo de la LAM no recomiendan el uso de progesterona de forma rutinaria, salvo en aquellas pacientes que manifiesten un rápido deterioro tanto clínico como funcional respiratorio5.
El trasplante de pulmón constituye la única opción terapéutica cuando la enfermedad progresa. Un trabajo reciente observó una mediana de supervivencia tras el trasplante de pulmón en la LAM de 86% al año, 76% a los dos años y 65% a los 5 años6.
Existe una estrecha relación entre la LAM y el complejo esclerosis tuberosa (TSC). La ET es una enfermedad autosómica dominante, caracterizada por una mutación en uno de los genes: TSC1 o TSC27. Estos genes codifican dos proteínas: hamartina (TSC1) y tuberina (TSC2) que regulan el tamaño y el crecimiento celular. La LAM esporádica se asocia a mutaciones somáticas en los genes del TSC. Las proteínas TSC1 y TSC2 regulan su señal a través de mTOR (mammalian target of rapamycin), controlando el crecimiento celular, el ciclo celular, la apoptosis y la autofagia8.
Las «células LAM», unas células musculares lisas atípicas características de la LAM muestran mutaciones en estos genes (TSC1 y TSC2), lo que conlleva un déficit de las proteínas hamartina-tuberina9. La pérdida de estas proteínas produce una activación anómala de mTOR, dando lugar a un crecimiento celular descontrolado.
El sirolimus, un agente inmunosupresor aprobado por la FDA, podría remedar la función de la tuberina en pacientes con LAM, impidiendo la activación anómala de mTOR, como ha sido demostrado en modelos celulares y animales. Se conoce que inhibe la proliferación de células musculares lisas en las arterias coronarias tras la colocación de un stent. Estudios preclínicos han demostrado que el tratamiento con análogos de sirolimus (CCI-779) reduce el tamaño de los tumores en modelos animales (ratones) con ET10. Dada la eficacia y seguridad de sirolimus en estudios preclínicos, y sus potenciales efectos beneficiosos, se han diseñado estudios en humanos.
Los angiomiolipomas renales son unos tumores benignos, ricos en grasa, tejido muscular y vasos sanguíneos, presentes en el 40% de las pacientes, tanto en la LAM esporádica como en LAM asociada a ET11. Están asociados a mutaciones en los genes TSC1 y TSC2. Se han descrito casos clínicos con reducción del tamaño de los angiomiolipomas renales tras el tratamiento con sirolimus12. En el año 2008 se publicaron los resultados del primer ensayo clínico en fase II con sirolimus para el tratamiento de los angiomiolipomas renales en pacientes con ET y en pacientes con LAM13. Incluyeron en el estudio a 25 enfermas: 6 con LAM esporádica, 12 con ET y LAM y 7 con ET sin LAM. Tras 12 meses de tratamiento con sirolimus hubo una reducción del 53,2±26,6% del volumen medio de los angiomiolipomas con respecto al volumen basal. Cuando se analizaron las variables funcionales respiratorias en las 11 pacientes con LAM, observaron un incremento medio del FEV1 de 118±330ml y de la FVC de 390±570ml tras 12 meses de tratamiento. Ocho de los 11 enfermos tenían un incremento de al menos 250ml en la FVC durante el año de tratamiento con sirolimus. Estos efectos beneficiosos tendían a revertir tras la retirada del fármaco. Entre los efectos adversos más frecuentes destacan úlceras bucales, diarrea e infecciones del tracto respiratorio superior, como ocurrió en los casos presentados, en los que dos de ellos presentaron úlceras bucales. Los autores concluyen que el tratamiento con sirolimus durante un año reduce el tamaño de los angiomiolipomas renales y puede mejorar la función pulmonar en pacientes con ET y LAM.
En este trabajo se observó que en el segundo y en el tercer caso el tratamiento con sirolimus ralentizó la caída de la función pulmonar, y en el primero se evidenció una mejoría significativa. Así, tras dos años de tratamiento con sirolimus la primera paciente mejoró en 870ml el FEV1, la segunda en 30ml y la tercera perdió sólo 80ml en el FEV1. Sin embargo, es preciso esperar a los resultados del ensayo clínico MILES (The Sirolimus Multicenter International Lymphangioleiomyomatosis Efficacy and Safety trial), realizado en EE.UU., en fase III, aleatorizado, doble-ciego, controlado con placebo, para vislumbrar si verdaderamente el sirolimus retrasa la pérdida de capacidad pulmonar de los pacientes con LAM.