Aunque las bacterias son los principales patógenos involucrados en la neumonía adquirida en la comunidad, algunos virus son responsables directos o en coinfección de un importante número de neumonías adquiridas en la comunidad. La clínica de estas neumonías puede ser muy similar, en el caso de los virus afectan más frecuentemente a la población infantil y geriátrica, con frecuencia no elevan la cifra de leucocitos, la fiebre es inconstante y frecuentemente se acompañan de síntomas de vías respiratorias altas. Característicamente no elevan la procalcitonina. Durante años el diagnóstico ha recaído en cultivos celulares y en detección de antígenos; desde la incorporación en la clínica de la PCR, la identificación de estos patógenos ha aumentado, descubriéndose nuevos microorganismos como el bocavirus. En general, el virus influenza A y el virus respiratorio sincitial siguen siendo los principales virus implicados. Sin embargo, la irrupción en los últimos años de epidemias con alta letalidad de coronavirus y de zoonosis de virus influenza hace que sea necesario mostrarse alerta ante estos nuevos patógenos emergentes. Los inhibidores de la neuraminidasa para neumonías víricas han demostrado disminuir la transmisión en casos expuestos y mejorar la evolución clínica en pacientes en Cuidados Intensivos; su uso en infecciones banales no está recomendado. La ribavirina ha sido utilizada en niños con infecciones por virus respiratorio sincitial, así como en inmunodeprimidos. Fuera de estos fármacos, ningún otro antiviral ha probado su eficacia. Las medidas de prevención con vacunación para virus influenza y con anticuerpos monoclonales para virus respiratorio sincitial podrían disminuir la incidencia de neumonía.
Although bacteria are the main pathogens involved in community-acquired pneumonia, a significant number of community-acquired pneumonia are caused by viruses, either directly or as part of a co-infection. The clinical picture of these different pneumonias can be very similar, but viral infection is more common in the pediatric and geriatric populations, leukocytes are not generally elevated, fever is variable, and upper respiratory tract symptoms often occur; procalcitonin levels are not generally affected. For years, the diagnosis of viral pneumonia was based on cell culture and antigen detection, but since the introduction of polymerase chain reaction techniques in the clinical setting, identification of these pathogens has increased and new microorganisms such as human bocavirus have been discovered. In general, influenza virus type A and syncytial respiratory virus are still the main pathogens involved in this entity. However, in recent years, outbreaks of deadly coronavirus and zoonotic influenza virus have demonstrated the need for constant alert in the face of new emerging pathogens. Neuraminidase inhibitors for viral pneumonia have been shown to reduce transmission in cases of exposure and to improve the clinical progress of patients in intensive care; their use in common infections is not recommended. Ribavirin has been used in children with syncytial respiratory virus, and in immunosuppressed subjects. Apart from these drugs, no antiviral has been shown to be effective. Prevention with anti-influenza virus vaccination and with monoclonal antibodies, in the case of syncytial respiratory virus, may reduce the incidence of pneumonia.
Basados en las estimaciones de la OMS para 2012, se producen alrededor de 450 millones de casos de neumonía al año en el mundo –con 3 millones de muertes– lo que representa un 5,5% de la mortalidad mundial global1,2. Es la 4.ª causa de muerte en todo el mundo y constituye una grave amenaza especialmente para niños y ancianos1,3.
Por su frecuencia, las infecciones más comúnmente estudiadas son las bacterianas. En cambio las neumonías adquiridas en la comunidad (NAC) víricas, pese a su importancia epidemiológica creciente en los países en vías de desarrollo y en la población infantil, han sido infravaloradas4. Se calcula que se producen alrededor de 200 millones de casos de neumonía viral en el mundo al año (la mitad en población infantil), asumiendo que su diagnóstico continúa siendo menor a su incidencia real5. El campo de las neumonías víricas tiene enorme interés por el impacto en la mortalidad infantil, por su efecto facilitador de infecciones bacterianas (coinfecciones), y por su facilidad de transmisión, lo que las convierte en una amenaza global.
En esta revisión nos centraremos en las NAC producidas por diferentes virus respiratorios en pacientes inmunocompetentes.
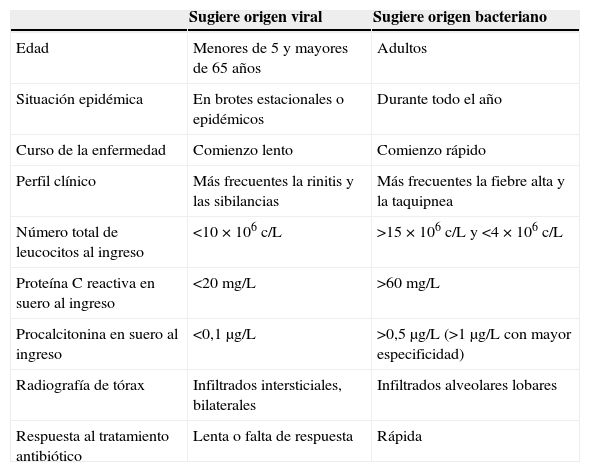
Diferenciación entre neumonía vírica y bacterianaDistinguir entre ambas etiologías de la NAC tiene importantes implicaciones. Las variables clínicas, radiológicas y de laboratorio que comúnmente se han utilizado como diferenciadoras se muestran en la tabla 1.
Características diferenciales entre neumonía de origen vírico y neumonía de origen bacteriano
| Sugiere origen viral | Sugiere origen bacteriano | |
|---|---|---|
| Edad | Menores de 5 y mayores de 65 años | Adultos |
| Situación epidémica | En brotes estacionales o epidémicos | Durante todo el año |
| Curso de la enfermedad | Comienzo lento | Comienzo rápido |
| Perfil clínico | Más frecuentes la rinitis y las sibilancias | Más frecuentes la fiebre alta y la taquipnea |
| Número total de leucocitos al ingreso | <10×106 c/L | >15×106 c/L y <4×106 c/L |
| Proteína C reactiva en suero al ingreso | <20mg/L | >60mg/L |
| Procalcitonina en suero al ingreso | <0,1μg/L | >0,5μg/L (>1μg/L con mayor especificidad) |
| Radiografía de tórax | Infiltrados intersticiales, bilaterales | Infiltrados alveolares lobares |
| Respuesta al tratamiento antibiótico | Lenta o falta de respuesta | Rápida |
Adaptada de Ruuskanen et al.3.
Muchos autores han realizado sus aportaciones en diferentes estudios epidemiológicos. Ruiz-González et al.6 incluyeron dentro del mismo grupo a pacientes con neumonías víricas y con neumonías por bacterias intracelulares, y concluyeron que estas neumonías («patógenos intracelulares») afectaban a pacientes de mayor edad, cursaban de forma más insidiosa, y con frecuencia no producían leucocitosis. Johstone et al.7 observaron que los pacientes con neumonías víricas tenían más comorbilidad cardiaca y eran más ancianos; para Ma et al.8 estar institucionalizado era lo que conllevaba un mayor riesgo de NAC vírica. Liu et al.9 vieron que las neumonías víricas producían más tos y menos dolor pleurítico, en cambio para Jennings et al.10 el síntoma más frecuentemente relacionado con la etiología viral fue la mialgia. A pesar de todo lo aportado y según lo publicado recientemente por Viasus et al.11, la predicción de la etiología viral en función de variables clínicas es difícil y a menudo imprecisa.
En relación con los cambios radiológicos, tradicionalmente se han relacionado los infiltrados alveolares focales con la etiología bacteriana y los intersticiales bilaterales con la vírica12. Sin embargo, estudios recientes que han utilizado la TC torácica destacan que la aparición de infiltrados alveolares localizados no solo no excluye la etiología vírica, sino que puede ser la forma de inicio de muchas de estas infecciones13.
Respecto a los reactantes de fase aguda, las infecciones víricas no suelen modificar la cifra de leucocitos, por lo que el uso de biomarcadores como la procalcitonina puede ser de gran ayuda en la aproximación diagnóstica14. La producción de procalcitonina depende de la presencia del factor de necrosis tumoral circulante (TNF-α); en las infecciones víricas los macrófagos producen interferón-α capaz de inhibir el TNF-α, lo que condiciona la no elevación de procalcitonina, sugiriendo el origen viral15.
A pesar de lo expuesto, no existe una regla de oro para diferenciar la etiología de la neumonía16. Además, no debemos olvidar que la NAC, viral o bacteriana, es una enfermedad dinámica: los diferentes valores de los biomarcadores o el aspecto de los infiltrados radiológicos son tan solo instantáneas de un proceso activo, que consecuentemente puede presentar variaciones día a día.
Tipos de virusLa lista de virus capaces de producir una infección respiratoria es amplia (tabla 2). En esta revisión se hará hincapié en los virus respiratorios estacionales.
Virus relacionados con el desarrollo de neumonía viral en la comunidad, en niños y adultos
| Virus respiratorio sincitial |
| Rinovirus |
| Virus influenza A, B y C |
| Metapneumovirus humano |
| Virus parainfluenza tipo 1, 2, 3 y 4 |
| Bocavirus humano |
| Coronavirus tipo 229E, OC43, NL63, HKU1, SARS y MERS-CoV |
| Adenovirus |
| Enterovirus |
| Virus varicela-zoster, virus Epstein-Barr, herpesvirus humanos 6 y 7, citomegalovirus |
| Hantavirus |
| Parechovirus |
| Mimivirus |
| Virus del sarampión |
Adaptado de Ruuskanen et al.3
Otros virus que últimamente se han hecho muy populares a través de los medios de comunicación, como el virus de influenza H5N1 o los coronavirus (responsable del síndrome respiratorio agudo grave, o del síndrome respiratorio de Oriente Medio, MERS-CoV), serán tratados de forma más superficial.
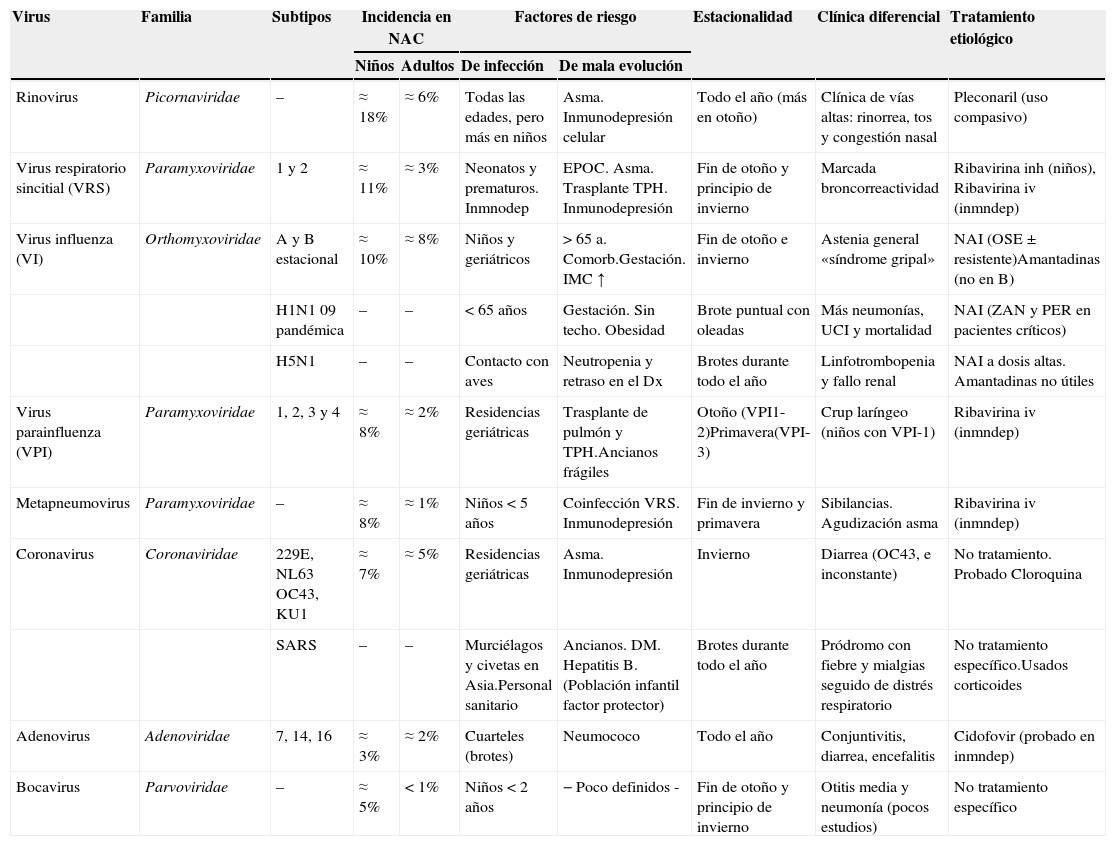
En la tabla 3 se detallan la incidencia relativa y las características clínico-epidemiológicas de los diferentes virus respiratorios.
Características de los principales patógenos implicados en las neumonías víricas
| Virus | Familia | Subtipos | Incidencia en NAC | Factores de riesgo | Estacionalidad | Clínica diferencial | Tratamiento etiológico | ||
|---|---|---|---|---|---|---|---|---|---|
| Niños | Adultos | De infección | De mala evolución | ||||||
| Rinovirus | Picornaviridae | – | ≈ 18% | ≈ 6% | Todas las edades, pero más en niños | Asma. Inmunodepresión celular | Todo el año (más en otoño) | Clínica de vías altas: rinorrea, tos y congestión nasal | Pleconaril (uso compasivo) |
| Virus respiratorio sincitial (VRS) | Paramyxoviridae | 1 y 2 | ≈ 11% | ≈ 3% | Neonatos y prematuros. Inmnodep | EPOC. Asma. Trasplante TPH. Inmunodepresión | Fin de otoño y principio de invierno | Marcada broncorreactividad | Ribavirina inh (niños), Ribavirina iv (inmndep) |
| Virus influenza (VI) | Orthomyxoviridae | A y B estacional | ≈ 10% | ≈ 8% | Niños y geriátricos | > 65 a. Comorb.Gestación. IMC ↑ | Fin de otoño e invierno | Astenia general «síndrome gripal» | NAI (OSE±resistente)Amantadinas (no en B) |
| H1N1 09 pandémica | – | – | < 65 años | Gestación. Sin techo. Obesidad | Brote puntual con oleadas | Más neumonías, UCI y mortalidad | NAI (ZAN y PER en pacientes críticos) | ||
| H5N1 | – | – | Contacto con aves | Neutropenia y retraso en el Dx | Brotes durante todo el año | Linfotrombopenia y fallo renal | NAI a dosis altas. Amantadinas no útiles | ||
| Virus parainfluenza (VPI) | Paramyxoviridae | 1, 2, 3 y 4 | ≈ 8% | ≈ 2% | Residencias geriátricas | Trasplante de pulmón y TPH.Ancianos frágiles | Otoño (VPI1-2)Primavera(VPI-3) | Crup laríngeo (niños con VPI-1) | Ribavirina iv (inmndep) |
| Metapneumovirus | Paramyxoviridae | – | ≈ 8% | ≈ 1% | Niños<5 años | Coinfección VRS. Inmunodepresión | Fin de invierno y primavera | Sibilancias. Agudización asma | Ribavirina iv (inmndep) |
| Coronavirus | Coronaviridae | 229E, NL63 OC43, KU1 | ≈ 7% | ≈ 5% | Residencias geriátricas | Asma. Inmunodepresión | Invierno | Diarrea (OC43, e inconstante) | No tratamiento. Probado Cloroquina |
| SARS | – | – | Murciélagos y civetas en Asia.Personal sanitario | Ancianos. DM. Hepatitis B. (Población infantil factor protector) | Brotes durante todo el año | Pródromo con fiebre y mialgias seguido de distrés respiratorio | No tratamiento específico.Usados corticoides | ||
| Adenovirus | Adenoviridae | 7, 14, 16 | ≈ 3% | ≈ 2% | Cuarteles (brotes) | Neumococo | Todo el año | Conjuntivitis, diarrea, encefalitis | Cidofovir (probado en inmndep) |
| Bocavirus | Parvoviridae | – | ≈ 5% | < 1% | Niños<2 años | − Poco definidos - | Fin de otoño y principio de invierno | Otitis media y neumonía (pocos estudios) | No tratamiento específico |
Comorb: comorbilidad; Dx: diagnóstico; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; inh: inhalado; Inmnodep: inmunodepresión; iv: intravenoso; NAI: inhibidores de la neuraminidasa (OSE: oseltamivir; PER: peramivir; ZAN: zanamivir). TPH: trasplante de precursores hematopoyéticos.
De forma global, el virus respiratorio sincitial (VRS) se mantiene como el primer agente causal de NAC en niños, y constituye la principal causa de neumonía grave en este grupo de población17,18. Desde que se han popularizado las técnicas de PCR, los rinovirus cada vez se detectan con más frecuencia como agente causal en la neumonía viral infantil19–22. No obstante, su papel etiológico no deja de estar cuestionado por su frecuente detección en individuos asintomáticos (15%), si bien pudiera tratarse de verdaderas infecciones subclínicas23. Con menos frecuencia se encuentran patógenos identificados en los últimos años, como el metapneumovirus y los bocavirus humanos24–27. Aunque la prevalencia de neumonía viral por adenovirus es baja (2-12%), es importante reconocerla porque puede desembocar en ocasiones en una neumonía necrotizante28. En este caso, las técnicas de PCR son mucho más sensibles que las técnicas de detección de antígeno29.
En el caso de los adultos, a pesar de que su incidencia varía según las técnicas diagnósticas empleadas, los virus más comúnmente detectados son virus influenza (VI), VRS y parainfluenza5,10,30,31. En España estos virus también serían los más importantes32. Con menor frecuencia se han comunicado neumonías por otros virus: brotes de rinovirus33,34, adenovirus35 (especialmente el serotipo 14 en instituciones militares36), coronavirus37, metapneumovirus38 e incluso de bocavirus, en este caso en pacientes inmunocomprometidos39.
CoinfecciónEn muchas ocasiones tienen lugar infecciones coexistentes de bacterias y virus respiratorios, o de dos virus diferentes. La hipótesis más aceptada es que primero se produciría la infección viral, seguida de la bacteriana. La activación por parte del virus de moléculas proinflamatorias tales como la interleucina-10, produciría la atracción de un gran número de neutrófilos y macrófagos hacia el pulmón; la llegada de estas citoquinas amplificaría la respuesta inmune, causando daño inflamatorio e impidiendo el correcto aclaramiento bacteriano40. Esta sobreinfección empeoraría el pronóstico de la infección viral original. Así, las investigaciones sobre las pandemias gripales de 1918, 1957 y 1968, indican que la mayoría de las muertes durante estos episodios se habrían producido debido a una infección bacteriana secundaria41. En los pacientes con la infección por H1N1 pandémica del 2009, se produjo una infección bacteriana secundaria en el 4-24% de los casos42–44. Por el contrario, en infecciones por otros virus, en particular por influenza aviar H5N1, la neumonía asociada parece ser producida (más frecuentemente) por la acción viral directa45.
En la práctica clínica, este tipo de coinfección es particularmente frecuente en niños (hasta en el 45% de los casos de NAC), fundamentalmente por neumococo46–49, lo que puede condicionar una mayor gravedad50. También parece frecuente la aparición de Mycoplasma pneumoniae y varias especies de Chlamydophila51; la coinfección de 2-3 virus simultáneamente tampoco es excepcional52.
En adultos, las NAC de etiología mixta han sido menos caracterizadas que en niños, con una frecuencia estimada menor del 5%7,31. Las combinaciones más descritas son las del rinovirus -neumococo y la del virus influenza A - neumococo. También se han identificado infecciones combinadas de mayor gravedad entre virus y Legionella pneumophila53.
Respecto a la morbimortalidad de este tipo de coinfección, existen datos contradictorios. Según Hong et al.54 estas infecciones no serían más graves que las puramente bacterianas, y afectarían a pacientes mayores y con neumopatías crónicas. En cambio para Johansson et al.55 y para Seki et al.56 este tipo de neumonías tendrían mayor puntuación en las escalas de gravedad y peor evolución.
Brotes de virus respiratorios: la experiencia con el virus influenza H1N1 de 2009, la gripe aviar (H5N1 y H7N9), el SARS y el coronavirus de Oriente Medio (MERS-CoV)En algunas familias bien conocidas de virus respiratorios han aparecido nuevas especies y serotipos muy virulentos, que han provocado en los últimos años epidemias con gran morbimortalidad asociada57.
La gran pandemia de 2009 por VI-A H1N1 fue especial: su transmisión se vio favorecida por la falta de inmunidad previa, lo que supuso un importante problema de salud en todo el mundo42. Estudios realizados con posterioridad demostraron mayor impacto en la población joven y en determinados grupos de riesgo, con muchos años potenciales de vida perdidos58. Sin embargo, desde una perspectiva intergeneracional, no se encontraron tasas de mortalidad ni de complicaciones mayores a las de la gripe estacional habitual59,60.
En 2003 hubo un brote de coronavirus en el Extremo Oriente, que fue el causante del síndrome respiratorio agudo severo. En Oriente Medio en 2012, se produjo otro brote de un nuevo coronavirus denominado MERS-CoV (Middle East Respiratory Syndrome Coronavirus)61. En ambas epidemias, la incidencia se redujo a unos cientos de casos –en parte debido a las medidas de protección llevadas a cabo62–, pero su virulencia produjo una alta mortalidad63. La clínica no se limitaba solo a una neumonía bilateral de rápida evolución, sino que se acompañaba de fallo renal agudo y alteraciones hematológicas graves63,64.
Un desafío global son las recombinaciones en animales de diferentes subtipos de VI, con potencial capacidad para pasar la barrera de especie y, ocasionalmente, propagarse entre humanos65. Los graves casos de gripe aviar H5N1 registrados en 2005 en el Sudeste Asiático66, o los más recientes de H3N2-variante porcina en Estados Unidos (2012)67 y de gripe aviar H7N9 en China (2013)68, dan muestra de esta nueva amenaza. Afortunadamente, están mejorando las medidas para su control a partir de la vigilancia de los reservorios animales y de una rápida respuesta sanitaria69.
Diagnóstico microbiológicoClásicamente, se ha basado en la detección del virus o de los antígenos virales en muestras del tracto respiratorio superior (aspirados nasofaríngeos), e inferior (lavado broncoalveolar o esputo inducido), mediante cultivo o microscopía de inmunofluorescencia. Además, desde hace años se está utilizando la detección de anticuerpos generados en el proceso de la infección vírica; la seroconversión en dos muestras recogidas a lo largo del tiempo es sugestiva de una nueva exposición al patógeno. La introducción de las técnicas de reacción en cadena de la polimerasa (PCR) ha aumentado la capacidad de detectar virus respiratorios, sobre todo con las técnicas de PCR en tiempo real3.
Dentro de las muestras del tracto respiratorio superior, el aspirado nasofaríngeo es el tipo de muestra preferida, especialmente en niños, ya que permite recoger la mezcla de secreciones nasales y retrofaríngeas70. La utilización de hisopos de algodón estéril alcanza una sensibilidad similar para la mayoría de los virus, a excepción del VRS71,72. Los dispositivos que combinan hisopo de fibra de nylon y contenedor con medio de trasporte universal proporcionan un alto rendimiento diagnóstico en todas las edades, comparable a los lavados nasofaríngeos30,73.
Las muestras procedentes del tracto respiratorio inferior tienen ventajas obvias a la hora de establecer la causa de la neumonía, por recogerse en el lugar mismo de la infección. No obstante, en su obtención se puede producir contaminación a su paso por las vías altas. En el caso de los niños el esputo inducido es una muestra habitual, pero en adultos se prefiere el lavado broncoalveolar3. En cambio, otras formas de diagnóstico como la punción transtorácica se han abandonado por ser cruentas70.
En relación con el procesamiento de la muestra, los sistemas basados en PCR son 2-5 veces más sensibles que los métodos convencionales para la detección de virus respiratorios30. Esta técnica es especialmente útil en los ancianos, quienes suelen portar en la nasofaringe menor carga viral que los niños74,75. Además, algunos virus son difícilmente cultivables (como el bocavirus), o equívocamente detectables a través de antígeno (como el virus parainfluenza o el adenovirus), por lo que solo pueden ser adecuadamente identificados por PCR76–78. Se han desarrollado test de identificación estándar, que a través de la PCR acoplada a microarrays, son capaces de determinar simultáneamente más de 15 virus respiratorios diferentes79. Estos sistemas son los que se usan con más frecuencia en nuestros hospitales actualmente80.
Tratamiento etiológicoDesde finales del siglo pasado, el tratamiento antibiótico empírico de la NAC debe iniciarse lo antes posible, puesto que esta medida ha demostrado disminuir la morbimortalidad81.
Sin embargo, no existen estudios prospectivos sobre la utilidad del uso de antibióticos en neumonías con alto grado de sospecha de origen vírico. La posibilidad de sobreinfección bacteriana o de origen mixto virus-bacteria, la progresiva mejor tolerancia a los antibióticos, y la máxima médico-legal del «uso de todos los medios disponibles», hacen difícil la no prescripción de antibióticos al inicio del cuadro de neumonía. Solo en niños se ha investigado esta disyuntiva de forma prospectiva, en contexto de epidemias de bronquiolitis por VRS; los resultados, con reservas, no apoyaron el uso de antibióticos de forma generalizada82.
Respecto al uso de fármacos antivirales, la experiencia en virus respiratorios puede dividirse en tres apartados: a) el tratamiento para el virus influenza, relativamente efectivo y bien documentado, gracias entre otras cosas a los estudios llevados a cabo durante la pandemia de 200983, b) el tratamiento para el VRS, especialmente estudiado en niños y en inmunocomprometidos, pero sin resultados definitivos84, y c) el tratamiento del resto de virus respiratorios, poco investigado y poco validado85.
a) Tratamiento del virus influenza
La neuraminidasa, enzima presente en la cápside del VI, es indispensable para la propagación del virus entre células. Los inhibidores selectivos de esta enzima (oseltamivir, zanamivir y peramivir) han demostrado contener la infección durante el pico de replicación viral –entre las primeras 24-72 horas– mejorando la clínica y disminuyendo la morbimortalidad86,87. Estudios retrospectivos sobre pacientes diagnosticados de gripe han probado la disminución de la incidencia de neumonía, en aquellos tratados de forma precoz88. Aunque estos fármacos son activos para ambos subtipos, se han descrito epidemias estacionales de VI-A H1N1 resistentes a oseltamivir, por lo que en algunas guías se recomienda zanamivir de primera elección83; la cepa pandémica H1N1 de 2009 no tenía en general estas resistencias, siendo ampliamente tratada con oseltamivir sin haberse observado peores resultados89. En niños, el efecto clínico está menos demostrado, aunque su administración parece segura90. El laninamivir octanoato (nuevo inhibidor de la neuraminidasa) de administración única inhalada, se ha mostrado efectivo en el tratamiento de la infección por VI, también de las cepas resistentes a oseltamivir91.
En cuanto a los adamantanes (amantadina y rimantadina) –grupo de fármacos clásicamente utilizados en la infección por VI– su especificidad exclusiva por el VI tipo A, los posibles efectos secundarios y la rápida aparición de resistencias, han hecho que en la práctica se hayan dejado de utilizar92. Se están investigando fármacos capaces de bloquear la producción de RNA y otros que limitan la integración del virus; sin embargo, aún no existen ensayos en fase clínica93. Además, se están realizando estudios con fármacos inmunomoduladores, con el objetivo de disminuir la inflamación producida por el virus y mejorar su efecto sobre el huésped94.
b) Tratamiento del virus respiratorio sincitial
Ninguno de los tratamientos ensayados ha sido significativamente útil para afrontar el episodio agudo de neumonía, ni para mejorar parámetros respiratorios en el seguimiento. Según el mayor metaanálisis realizado en población infantil hasta la fecha, el uso de ribavirina inhalada durante la neumonía podría disminuir el tiempo de hospitalización y el de ventilación mecánica, sin significativa mejora de la mortalidad global95. El tratamiento intravenoso u oral con ribavirina se ha utilizado casi exclusivamente en inmunodeprimidos severos (trasplantados de médula ósea o de pulmón) con resultados positivos, pero no aplicables al resto de pacientes96. La utilización de inmunoglobulinas en niños no ha demostrado beneficios respecto al tratamiento exclusivo de soporte97. En las guías pediátricas americanas de bronquiolitis por VRS, el tratamiento con broncodilatadores, corticosteroides o antibióticos no se recomienda de forma generalizada98. Actualmente, productos nuevos como la catelicidina LL37 (derivado de la vitamina D)99, o el concentrado Dingchuan, procedente de la medicina alternativa china100, se están probando con resultados prometedores.
c) Tratamiento para otros virus respiratorios
Las medidas de soporte han sido su único tratamiento hasta hace poco tiempo. No obstante, en la actualidad hay tratamientos antivirales que están en proceso de experimentación. El análogo citidínico cidofovir, desarrollado inicialmente como terapia contra el CMV, se ha probado in vitro para adenovirus con éxito, aunque su uso en varias neumonías graves en inmunodeprimidos tuvo una pobre respuesta101. Se ha utilizado con éxito ribavirina intravenosa en infecciones respiratorias por metapneumovirus en trasplantados pulmonares102. El pleconaril, capaz de integrarse en la cápside de Rhinovirus y Enterovirus, se ha utilizado con éxito en limitadas series de casos; actualmente no se comercializa y solo se puede administrar como uso compasivo103. No quedan dudas respecto a la utilidad del aciclovir intravenoso en los raros casos de neumonía por el virus varicella-zoster en inmuncompetentes85,104. Por último, aunque su uso sigue siendo controvertido, el tratamiento con corticoides a dosis altas podría mejorar la evolución de las NAC virales85.
Medidas de prevenciónEn las enfermedades infectocontagiosas, especialmente en las respiratorias, los métodos de barrera son fundamentales para controlar la infección. La utilización de mascarilla, el uso de guantes y el lavado de manos, han demostrado ser medidas válidas para disminuir la tasa de transmisión en la esfera sanitaria105. También se ha recomendado enérgicamente el aislamiento social de los pacientes durante la fase clínica de la enfermedad, con una reducción de la incidencia global106. Sin embargo, estas medidas son difíciles de llevar a cabo de forma adecuada106.
La inmunización desempeña un papel muy importante en la prevención, aunque solo está disponible para unos pocos virus. Las vacunas para el virus influenza A y B han demostrado disminuir la transmisión durante las epidemias de gripe estacional sobre la población general107, aunque su efecto sobre el desarrollo de neumonía o sobre la mortalidad no está tan claro108; tampoco en niños menores de 2 años, aunque se sigue aplicando en muchos países109. En cambio, en ancianos institucionalizados su efectividad parece muy alta110. Actualmente en España se recomienda a pacientes con comorbilidades respiratorias o inmunodepresión, a mayores de 65 años y a trabajadores sanitarios111.
Además de las vacunas, se ha ensayado con éxito la quimioprofilaxis con inhibidores de la neuroaminidasa durante las epidemias de gripe estacional112. Para el VRS aún no hay una vacuna eficaz, pero sí un fármaco utilizado como quimioprofilaxis: se trata del palivizumab, un anticuerpo monoclonal humanizado, que administrado en neonatos con alto riesgo de infección, ha demostrado disminuir hasta el 50% el número de ingresos relacionados, así como la incidencia de neumonías113.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.