El Registro español de pacientes con déficit de alfa-1 antitripsina (REDAAT) se formó con el objetivo de mejorar el conocimiento sobre del DAAT. En este trabajo se evalúa el registro y se analiza la población de pacientes incluida en él.
MétodosDispone de una base de datos alojada en la Web: www.redaat.es. Su base de datos recoge información clínica y funcional de individuos portadores de los fenotipos PiSZ, ZZ y variantes raras.
ResultadosEn la actualidad reúne información sobre 511 individuos procedentes de 103 centros sanitarios, gracias a la colaboración de 124 médicos. De ellos, 348 (74,2%) son homocigotos Pi*ZZ y 100 (19,5%) heterocigotos Pi*SZ. Existe una mayor concentración de casos en hospitales universitarios de tercer nivel. El 81% de los casos tiene enfermedad pulmonar y en menor proporción el DAAT se detectó por cribado familiar o enfermedad hepática. Se dispone de datos de seguimiento en el 45% de los casos, y un 35% recibieron tratamiento sustitutivo con alfa-1 antitripsina.
ConclusionesEl REDAAT es una herramienta útil para obtener información de calidad sobre esta enfermedad minoritaria en condiciones de práctica clínica habitual, aunque obtener datos de seguimiento es difícil y no es posible conocer la representatividad de la muestra incluida.
REDAAT, the Spanish Registry of Patients with Alpha-1 Antitrypsin Deficiency, was set up in order to improve knowledge of this disease. This study is an evaluation of the registry and an analysis of its patient population.
MethodsThe registry has a database hosted on the website www.redaat.es. It collects clinical and functional data on patients with PiSZ, ZZ phenotypes and other rare variants.
ResultsThanks to the collaboration of 124 physicians, the registry currently contains information on 511 individuals from 103 healthcare centers. Of these 511, 348 (74.2%) are Pi*ZZ homozygotes, and 100 (19.5%) are Pi*SZ heterozygotes. More cases are seen in tertiary level hospitals. A total of 81% of the cases have respiratory disease, and a lower proportion of AATD cases were detected by family screening or liver disease. Follow-up data are available for 45% of the cases, and 35% received alpha-1 antitripsin replacement therapy.
ConclusionsThe REDAAT registry is a useful tool for obtaining quality information about this minority disease in routine clinical practice conditions, although it is difficult to obtain follow-up data, and the representativeness of the sample included cannot be determined.
El Registro Español de pacientes con déficit de alfa-1 antitripina (REDAAT) se fundó en 1993 como grupo de trabajo del área de insuficiencia respiratoria y trastornos de sueño, y posteriormente del área de enfermedad pulmonar obstructiva crónica (EPOC) de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) a raíz de los primeros casos diagnosticados en Barcelona y Asturias1–4.
Desde su constitución los objetivos del REDAAT se han orientado a profundizar en el conocimiento sobre el DAAT mediante el estímulo de la investigación y facilitar el diagnóstico.
El REDAAT forma parte del Registro internacional de alfa-1 antitripsina (AIR), que fue fundado en 1996 siguiendo las recomendaciones de la Organización Mundial de la Salud (OMS) al respecto5. Así mismo, está integrado dentro de la Red española de registros de enfermedades raras por su participación en el Registro Nacional de Enfermedades Raras del Instituto de Investigación de Enfermedades raras (Instituto de Salud ISCIII)6,7.
En este estudio se ha evaluado el registro como herramienta para la recogida sistemática de datos en condiciones de práctica clínica habitual y el perfil de los médicos registradores, y se han analizado las características demográficas, fenotípicas, clínicas y funcionales de los pacientes incluidos en sus primeros 20 años de funcionamiento.
MétodoOrganización del RegistroEl REDAAT está constituido por un comité asesor formado por 10 neumólogos, 3 pediatras y 3 investigadores básicos, además de los responsables del laboratorio de referencia y el personal que se encarga del soporte informático. El principal recurso técnico es el sitio Web: www.redaat.es, que pertenece a la Fundación Española del Pulmón-Respira. Dispone de un área de acceso público con información general y un área de acceso restringido para profesionales sanitarios que incluye la ficha de recogida de datos de los pacientes, así como datos a tiempo real de los casos registrados y características globales de la población incluida. También se facilita información sobre el diagnóstico y el tratamiento sustitutivo7.
La inclusión de casos en el REDAAT ha pasado por 3 fases. En la primera, desde su fundación hasta el año 2001; la ficha de recogida de datos de cada caso se remitía en papel al centro coordinador, que en ese momento era el Hospital Universitari Vall d’Hebron de Barcelona. La segunda fase supuso la puesta en marcha del registro on line, e incluye el periodo desde 2001 hasta la finalización de la actualización de los datos en papel a finales de 2005, y una tercera fase de gestión exclusiva a través de la Web desde 2006 a la actualidad8.
Estructura de la base de datosLa base de datos del REDAAT se encuentra alojada en la Web; www.redaat.es, y es accesible también a través de la Web; www.separ.es, de la Web: https://spainrdr.isciii.es y de la de AIR (www.antitrypsindeficiency.org). Incluye el cuestionario de recogida de datos que se adaptó a partir del existente en el AIR en formato HTML y se enlaza a una base de Oracle.
Cada registro individual consta de un número de 3 dígitos acompañado de las iniciales del paciente y el médico responsable, de manera que únicamente este último conoce la información personal que permite identificar al sujeto registrado. Además, el paciente debe firmar un consentimiento informado para la inclusión de sus datos.
Además del registro inicial del caso, el REDAAT contiene fichas de seguimiento semestrales que permiten obtener datos de la evolución de los pacientes hasta el cierre del caso, que sucede cuando el paciente fallece o se somete a trasplante pulmonar.
Población de estudioLa muestra analizada está constituida por todos los individuos incluidos en el REDAAT hasta el 1 de enero de 2014. Los criterios de inclusión en el registro son los siguientes: individuos con déficit grave de AAT, portadores de los fenotipos Pi*ZZ, Pi*SZ u otras variantes raras deficitarias. Se excluyeron los individuos con déficit intermedio y fenotipos Pi*MZ, Pi*MS y Pi*SS.
Análisis estadísticoEn primer lugar se realizó una revisión de cada variable y del porcentaje de cumplimiento como medida de calidad de la recogida de los datos. Posteriormente se comparó el número de pacientes incluidos en el REDAAT con los datos de prevalencia del déficit estimados para España para conocer la magnitud del infradiagnóstico.
Se llevó a cabo un estudio descriptivo de las características de los individuos incluidos en la base de datos, y en el caso de las variables cualitativas se determinó su frecuencia y porcentaje válido. Para las variables cuantitativas se utilizaron medidas de tendencia central (media y mediana), medidas de posición (cuartiles) y de dispersión (desviación típica).
La comparación en función de la condición de «caso índice» y «no índice» se realizó clasificando los casos según la siguiente definición: se consideró «caso índice» aquel en el que la existencia de enfermedad pulmonar o hepática motivó el diagnóstico del DAAT, mientras que se definió como «caso no índice» aquel en el que el diagnóstico se realizó por algún tipo de cribado. En relación con el tratamiento se consideró que habían recibido tratamiento sustitutivo aquellos pacientes en los que en cualquier momento desde su registro se había notificado el inicio del tratamiento, con independencia de la dosis o duración de la prescripción.
Las comparaciones entre ambos grupos se realizaron mediante el test de Chi-cuadrado para las variables cualitativas, test de Fisher en el caso de frecuencias observadas <5 y mediante el test «t» de Student para las variables cuantitativas. Para comprobar la heterogeneidad de 2 muestras ordinales en el caso de las variables no paramétricas de muestras independientes, se utilizó la prueba U de Mann Whitney. En el caso de las variables con más de 2 categorías se utilizó el test de ANOVA. Los análisis se realizaron con el software estadístico (SPSS versión 19, IBM Corp., Armonk, NY).
ResultadosPacientes registrados frente a esperados según la prevalencia del déficitLa población incluida en el REDAAT estaba formada por 511 individuos de los cuales 469 (91,8%) fueron diagnosticados en la edad adulta y 42 (8,2%) en la edad infantil9. De ellos 348 casos tenían fenotipo PiZZ. Este número de casos representa aproximadamente el 3% de los casos esperados de acuerdo con las estimaciones epidemiológicas disponibles del DAAT en España10.
Centros y médicos registradoresLos pacientes fueron registrados por 124 médicos de 103 centros sanitarios. La distribución de centros fue: 97 centros hospitalarios del Sistema Nacional de Salud (94,2%), 3 centros de atención primaria (2,9%), 2 centros médicos de especialidades privados (1,9%) y un hospital privado (1%). Los 10 centros con mayor número de casos registrados eran centros públicos acreditados para la docencia de posgrado en la licenciatura de medicina.
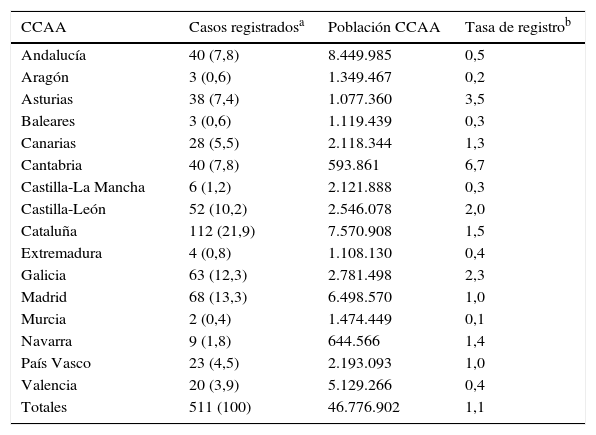
La media de casos registrados por médico fue de 4 (DE: 8). Sin embargo, 3 médicos reunían el 26,2% de toda la población de pacientes registrados con 48, 44 y 42 casos cada uno y pertenecían a hospitales universitarios de tercer nivel, con programa de trasplante pulmonar. La distribución de casos registrados por comunidad autónoma se presenta en la tabla 1.
Distribución geográfica de los casos registrados
| CCAA | Casos registradosa | Población CCAA | Tasa de registrob |
|---|---|---|---|
| Andalucía | 40 (7,8) | 8.449.985 | 0,5 |
| Aragón | 3 (0,6) | 1.349.467 | 0,2 |
| Asturias | 38 (7,4) | 1.077.360 | 3,5 |
| Baleares | 3 (0,6) | 1.119.439 | 0,3 |
| Canarias | 28 (5,5) | 2.118.344 | 1,3 |
| Cantabria | 40 (7,8) | 593.861 | 6,7 |
| Castilla-La Mancha | 6 (1,2) | 2.121.888 | 0,3 |
| Castilla-León | 52 (10,2) | 2.546.078 | 2,0 |
| Cataluña | 112 (21,9) | 7.570.908 | 1,5 |
| Extremadura | 4 (0,8) | 1.108.130 | 0,4 |
| Galicia | 63 (12,3) | 2.781.498 | 2,3 |
| Madrid | 68 (13,3) | 6.498.570 | 1,0 |
| Murcia | 2 (0,4) | 1.474.449 | 0,1 |
| Navarra | 9 (1,8) | 644.566 | 1,4 |
| País Vasco | 23 (4,5) | 2.193.093 | 1,0 |
| Valencia | 20 (3,9) | 5.129.266 | 0,4 |
| Totales | 511 (100) | 46.776.902 | 1,1 |
La Rioja y las ciudades autónomas de Ceuta y Melilla no están representadas en la tabla debido a que no hay ningún caso registrado de esta procedencia.
CCAA: comunidades autónomas.
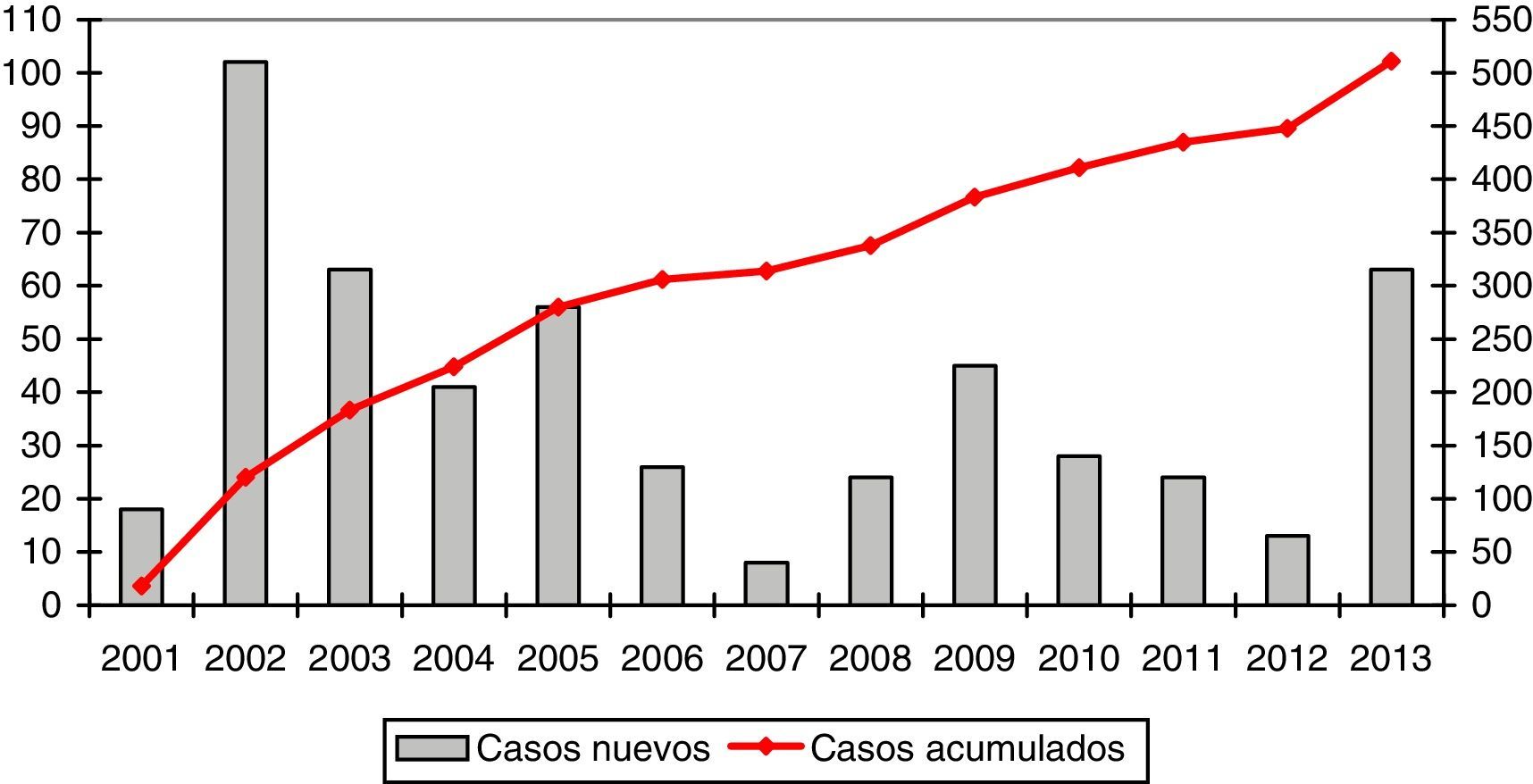
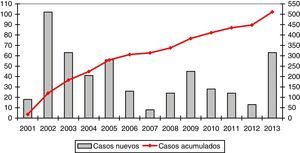
La media de casos registrados por año fue de 39,3 (rango: 8-102). La evolución en el reclutamiento se representa gráficamente en la figura 1.
Se observó un elevado porcentaje de formularios correctamente completados para la mayoría de las variables. Sin embargo, los porcentajes fueron menores en los parámetros de función pulmonar. En la tabla 2 se describe la notificación de datos por variables.
Descripción de la notificación de datos por variables
| Variable | Recogidos | % | |
|---|---|---|---|
| Variables demográficas | Iniciales | 511 | 100 |
| Fecha de nacimiento | 511 | 100 | |
| Sexo | 511 | 100 | |
| Altura | 489 | 96 | |
| Peso | 481 | 94 | |
| Variables clínicas | Motivo determinación | 510 | 100 |
| Fenotipo | 511 | 100 | |
| Fecha diagnóstico | 464 | 91 | |
| Presentación clínica | 511 | 100 | |
| Edad inicio de los síntomas | 362 | 71 | |
| Síntoma principal | 439 | 86 | |
| Tratamiento | Medicación EPOC | 511 | 100 |
| OCD | 511 | 100 | |
| ¿Ha recibido TS alguna vez? | 511 | 100 | |
| ¿Dejó el tratamiento? | 511 | 100 | |
| Trasplante pulmonar | 511 | 100 | |
| PFR | FEV1 preBD basal (L) | 462 | 90 |
| FVC preBD basal (L) | 441 | 86 | |
| FEV1 posBD basal (L) | 427 | 84 | |
| FVC posBD basal (L) | 408 | 80 | |
| FEV1 preBD seguimiento (L) | 369 | 72 | |
| FVC preBD seguimiento (L) | 366 | 72 | |
| FEV1 posBD seguimiento (L) | 390 | 76 | |
| FVC posBD seguimiento (L) | 386 | 76 | |
| KCO (%) | 144 | 28 | |
| Otras variables | Determinación de enzimas hepáticas | 511 | 100 |
| Situación laboral | 485 | 95 | |
| Fallecimiento (Sí/no) | 511 | 100 | |
| Totales | 511 |
BD: broncodilatador; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; KCO: índice de Krogh o coeficiente de transferencia (DLCO/VA); OCD: oxigenoterapia crónica domiciliaria; PFR: pruebas de función respiratoria; TS: terapia sustitutiva.
Se dispuso de datos de seguimiento de 225 individuos (44%). La mediana de seguimientos por paciente fue de 2 seguimientos (rango intercuartílico [RIC]:1-4) y la mediana de tiempo de seguimiento fue de 36 meses (RIC: 12-84). Los investigadores con un mayor número de casos notificaron el seguimiento de sus pacientes con mayor frecuencia, y acumularon un tiempo de seguimiento mayor (media de 64,4 meses para los investigadores con más de 40 casos frente a 34,7 meses para los investigadores con 1-2 casos). Ambas diferencias fueron estadísticamente significativas (p=0,001).
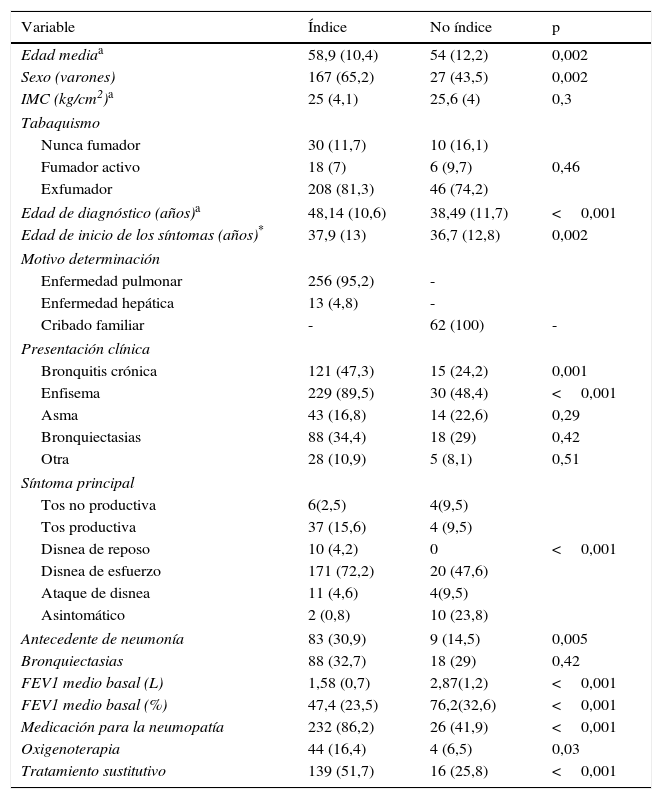
Características de los pacientes incluidos en el Registro español de pacientes con déficit de alfa-1 antitripsinaLa población adulta portadora de los fenotipos Pi*ZZ o Pi*SZ estaba formada por 448 individuos (348 Pi*ZZ y 100 Pi*SZ), el resto eran portadores de variantes raras. La edad media en el momento del diagnóstico era de 47,3 años (12,7) y la edad media en el momento de realizarse el análisis era de 57,4 años (12,1). Al margen del motivo que llevó al estudio del DAAT, un total de 364 (81%) de los individuos adultos incluidos en el REDAAT presentaba alguna enfermedad pulmonar, especialmente la población Pi*ZZ: 305 (87,6%) frente a 59 (59%) de los Pi*SZ (p<0,001). Los 348 adultos Pi*ZZ representaron el 74,2% del total de casos registrados. Los casos índice ascendieron a 269 (77,2%), mientras que 62 (17,8%) eran casos no índice. En la tabla 3 se presentan las características de los individuos Pi*ZZ divididos en función de su condición de caso índice o no índice. Los casos índice presentaban mayor edad en el momento del diagnóstico del DAAT, peor función pulmonar y mayor mortalidad.
Características de la población PiZZ en función de su condición de caso índice o no índice
| Variable | Índice | No índice | p |
|---|---|---|---|
| Edad mediaa | 58,9 (10,4) | 54 (12,2) | 0,002 |
| Sexo (varones) | 167 (65,2) | 27 (43,5) | 0,002 |
| IMC (kg/cm2)a | 25 (4,1) | 25,6 (4) | 0,3 |
| Tabaquismo | |||
| Nunca fumador | 30 (11,7) | 10 (16,1) | |
| Fumador activo | 18 (7) | 6 (9,7) | 0,46 |
| Exfumador | 208 (81,3) | 46 (74,2) | |
| Edad de diagnóstico (años)a | 48,14 (10,6) | 38,49 (11,7) | <0,001 |
| Edad de inicio de los síntomas (años)* | 37,9 (13) | 36,7 (12,8) | 0,002 |
| Motivo determinación | |||
| Enfermedad pulmonar | 256 (95,2) | - | |
| Enfermedad hepática | 13 (4,8) | - | |
| Cribado familiar | - | 62 (100) | - |
| Presentación clínica | |||
| Bronquitis crónica | 121 (47,3) | 15 (24,2) | 0,001 |
| Enfisema | 229 (89,5) | 30 (48,4) | <0,001 |
| Asma | 43 (16,8) | 14 (22,6) | 0,29 |
| Bronquiectasias | 88 (34,4) | 18 (29) | 0,42 |
| Otra | 28 (10,9) | 5 (8,1) | 0,51 |
| Síntoma principal | |||
| Tos no productiva | 6(2,5) | 4(9,5) | |
| Tos productiva | 37 (15,6) | 4 (9,5) | |
| Disnea de reposo | 10 (4,2) | 0 | <0,001 |
| Disnea de esfuerzo | 171 (72,2) | 20 (47,6) | |
| Ataque de disnea | 11 (4,6) | 4(9,5) | |
| Asintomático | 2 (0,8) | 10 (23,8) | |
| Antecedente de neumonía | 83 (30,9) | 9 (14,5) | 0,005 |
| Bronquiectasias | 88 (32,7) | 18 (29) | 0,42 |
| FEV1 medio basal (L) | 1,58 (0,7) | 2,87(1,2) | <0,001 |
| FEV1 medio basal (%) | 47,4 (23,5) | 76,2(32,6) | <0,001 |
| Medicación para la neumopatía | 232 (86,2) | 26 (41,9) | <0,001 |
| Oxigenoterapia | 44 (16,4) | 4 (6,5) | 0,03 |
| Tratamiento sustitutivo | 139 (51,7) | 16 (25,8) | <0,001 |
Datos expresados como n (%).
FEV1: volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal.
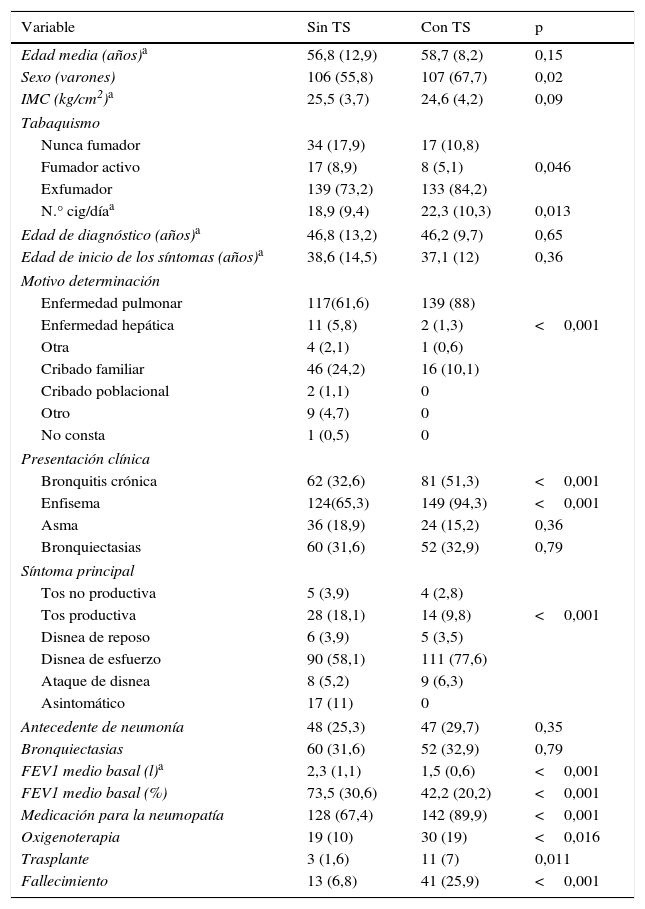
Un total de 158 (35,3%) pacientes recibió en algún momento de su seguimiento tratamiento sustitutivo con AAT endovenosa. Las características de los pacientes que habían recibido o no tratamiento sustitutivo se muestran en la tabla 4. Los pacientes en tratamiento presentaban una peor función pulmonar y más síntomas en el momento de ser registrados.
Características de la población adulta PiZZ en función de la prescripción de tratamiento sustitutivo
| Variable | Sin TS | Con TS | p |
|---|---|---|---|
| Edad media (años)a | 56,8 (12,9) | 58,7 (8,2) | 0,15 |
| Sexo (varones) | 106 (55,8) | 107 (67,7) | 0,02 |
| IMC (kg/cm2)a | 25,5 (3,7) | 24,6 (4,2) | 0,09 |
| Tabaquismo | |||
| Nunca fumador | 34 (17,9) | 17 (10,8) | |
| Fumador activo | 17 (8,9) | 8 (5,1) | 0,046 |
| Exfumador | 139 (73,2) | 133 (84,2) | |
| N.° cig/díaa | 18,9 (9,4) | 22,3 (10,3) | 0,013 |
| Edad de diagnóstico (años)a | 46,8 (13,2) | 46,2 (9,7) | 0,65 |
| Edad de inicio de los síntomas (años)a | 38,6 (14,5) | 37,1 (12) | 0,36 |
| Motivo determinación | |||
| Enfermedad pulmonar | 117(61,6) | 139 (88) | |
| Enfermedad hepática | 11 (5,8) | 2 (1,3) | <0,001 |
| Otra | 4 (2,1) | 1 (0,6) | |
| Cribado familiar | 46 (24,2) | 16 (10,1) | |
| Cribado poblacional | 2 (1,1) | 0 | |
| Otro | 9 (4,7) | 0 | |
| No consta | 1 (0,5) | 0 | |
| Presentación clínica | |||
| Bronquitis crónica | 62 (32,6) | 81 (51,3) | <0,001 |
| Enfisema | 124(65,3) | 149 (94,3) | <0,001 |
| Asma | 36 (18,9) | 24 (15,2) | 0,36 |
| Bronquiectasias | 60 (31,6) | 52 (32,9) | 0,79 |
| Síntoma principal | |||
| Tos no productiva | 5 (3,9) | 4 (2,8) | |
| Tos productiva | 28 (18,1) | 14 (9,8) | <0,001 |
| Disnea de reposo | 6 (3,9) | 5 (3,5) | |
| Disnea de esfuerzo | 90 (58,1) | 111 (77,6) | |
| Ataque de disnea | 8 (5,2) | 9 (6,3) | |
| Asintomático | 17 (11) | 0 | |
| Antecedente de neumonía | 48 (25,3) | 47 (29,7) | 0,35 |
| Bronquiectasias | 60 (31,6) | 52 (32,9) | 0,79 |
| FEV1 medio basal (l)a | 2,3 (1,1) | 1,5 (0,6) | <0,001 |
| FEV1 medio basal (%) | 73,5 (30,6) | 42,2 (20,2) | <0,001 |
| Medicación para la neumopatía | 128 (67,4) | 142 (89,9) | <0,001 |
| Oxigenoterapia | 19 (10) | 30 (19) | <0,016 |
| Trasplante | 3 (1,6) | 11 (7) | 0,011 |
| Fallecimiento | 13 (6,8) | 41 (25,9) | <0,001 |
Datos expresados como n (%).
FEV1: volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal; TS: tratamiento sustitutivo.
El REDAAT recoge los datos clínicos y funcionales de más de 500 individuos con DAAT, fundamentalmente portadores de fenotipos PiZZ y PiSZ, que en su mayoría padecen enfermedad pulmonar. Un 35% de los mismos recibieron tratamiento sustitutivo con AAT y se dispone de datos de seguimiento en cerca de la mitad de los casos. Esta infranotificación de seguimientos se puede deber a diferentes razones: los pacientes asintomáticos y sin evidencia de enfermedad pulmonar o hepática no suelen acudir rutinariamente a visitas hospitalarias. Los candidatos a trasplante se derivan a las unidades de transplante y pueden perder el contacto con el neumólogo que les diagnosticó en el centro de origen. La adherencia de los profesionales al registro es heterogénea por motivos diversos, pero debido a que lleva funcionando más de 20 años existe una considerable movilidad, tanto de profesionales como de pacientes (jubilaciones, traslados, fusión de centros, cambios de domicilio) que hace que muchos casos se pierdan.
El análisis de los datos del REDAAT muestra una gran heterogeneidad en la proporción de casos registrados por médico, y también una distribución geográfica muy irregular de los casos notificados, que no se justifica por las diferencias en población, prevalencia del déficit ni disponibilidad de recursos sanitarios entre las diferentes CCAA. Su procedencia parece determinada por el perfil del investigador y el tamaño del centro más que por la prevalencia del DAAT en cada área geográfica. La base de datos dispone de información de calidad, y es una herramienta útil para el estudio de las características de los pacientes y de la historia natural del DAAT.
Se observa una marcada tendencia a la acumulación de casos en centros hospitalarios de tercer nivel. Este hecho puede estar en relación con la disponibilidad de técnicas de diagnóstico, la gravedad de la neumopatía y la edad de los afectados de enfermedad pulmonar, que les permite acceder a programas de trasplante. El 18% de todos los registrados procede del centro en el que se fundó el REDAAT y donde se inició el tratamiento sustitutivo en España3,4. Podría deducirse que el interés mantenido en esta enfermedad repercute en una mayor tasa de diagnóstico, aunque también hay un efecto de mayor derivación a ese centro por parte de otros especialistas.
Parece además que los centros con mayor número de casos registrados son los que actualizan más los datos. Una posible razón para ello es que, aunque cada vez con más frecuencia centros pequeños detectan nuevos casos, debido a que se trata de una enfermedad rara y a la gravedad de la situación funcional, es probable que se deriven a otros centros de nivel superior y que el médico que realizó el diagnóstico inicial no disponga de los datos de seguimiento.
En la actualidad, no disponemos de datos epidemiológicos fiables del Sistema Nacional de Salud que nos permitan conocer con certeza el número real de individuos diagnosticados, de manera que no podemos asegurar que la muestra incluida en el REDAAT sea representativa, ni podemos descartar que existan sesgos de selección en los pacientes registrados. Por tanto, aunque asumimos que no todos los diagnosticados están registrados, la única referencia en España en la que podemos basarnos para estimar el infradiagnóstico son los datos aquí expuestos, y que indican que disponemos de información sobre un pequeño porcentaje de los individuos esperados según los estudios de prevalencia.
En España se ha estimado que puede haber unos 12.000 Pi*ZZ, de los que 471 (3,9%) estaban registrados en el REDAAT en diciembre del año 2015. Este porcentaje es superior al calculado por Stoller (2,4%) a partir de los datos de AIR y el registro americano11,12. También se ha estimado que de los 12.000 sujetos portadores de genotipos PiZZ, 2.500 de ellos (21%) padecerían EPOC. En el REDAAT hay registrados 440 Pi*ZZ con EPOC, lo que supone un 18% de los EPOC-ZZ estimados10.
Sin embargo, aunque sin duda tiene interés conocer la evolución de los todos individuos con DAAT por su variable expresión clínica, es especialmente importante profundizar en el conocimiento del subgrupo de pacientes que presenta enfermedad pulmonar asociada, por ser la que tiene un mayor impacto en la morbimortalidad, y esto añade valor a nuestra población, que incluye un elevado porcentaje de individuos con neumopatía, principalmente EPOC, con un fenotipo enfisematoso seguido del perfil de bronquitis crónica. En cuanto a los fenotipos más frecuentes, los individuos Pi*ZZ presentaron una peor función pulmonar, incluso con un menor consumo acumulado de tabaco que los Pi*SZ9,13.
Con respecto a la integridad de los datos, se observa un elevado porcentaje de variables correctamente recogidas, con excepción de los parámetros funcionales de seguimiento. Esto traduce un buen diseño de la base de datos y un buen control de calidad de los datos que se efectúa a tiempo real, desde la actualización de la Web en 20085. Desde esa fecha, cada nuevo caso incluido es revisado por la administradora del registro antes de su validación e incorporación final a la base. Esto permite detectar y corregir errores o datos incompletos en un periodo muy breve de tiempo.
El diseño de la base de datos del REDAAT tiene algunas limitaciones. La simplicidad de la ficha facilita la recogida de datos en un corto periodo de tiempo (inferior a 10min), pero no permite añadir información detallada sobre algunos aspectos que son importantes. La falta de información sobre la medicación empleada, la ausencia de descripción de los hallazgos radiológicos para confirmar el diagnóstico de neumonía, bronquiectasias o la extensión del enfisema, o la ausencia de confirmación de la calidad de las espirometrías o su falta de estandarización pueden considerarse debilidades que reducirían la fiabilidad de los resultados obtenidos. Por este motivo, las conclusiones extraídas a partir del análisis de la base de datos no tendrían la validez que se podría atribuir a un estudio o ensayo clínico prospectivo diseñado específicamente para evaluar estos parámetros. Sin embargo, los datos recogidos nos permiten conocer el perfil de los pacientes y constituyen una información muy importante para el posible diseño de estudios más detallados sobre aspectos determinados del DAAT.
La media anual de casos nuevos registrados es de 39, pero existe una gran heterogeneidad en función del año. Esto se debe en gran medida a las diferentes etapas de desarrollo del REDAAT. En el año 2001 se puso en marcha el registro on line, de manera que, en el año siguiente se traspasaron a la base electrónica los casos que ya existían en el registro en papel8. Entre los años 2007 y 2008 se produjo un cambio de servidor y una actualización de la Web que aloja la base de datos, lo que conllevó que el registro no estuviera operativo durante unos meses. Durante los años 2012 y 2013 se llevó a cabo una campaña de difusión por la SEPAR con motivo del Año SEPAR de las enfermedades minoritarias, que incluyó actividades específicamente orientadas al DAAT y que podría haber contribuido a un mayor número de registros.
En nuestra población, la edad de inicio de los síntomas tiene lugar entre la 3.ª y 4.ª décadas de la vida, como había sido descrito previamente por otros autores14. La demora desde el inicio de los síntomas hasta el diagnóstico del déficit es casi de una década de media. Este hallazgo es similar a los datos aportados por el Registro americano15. Sin embargo, hay que resaltar que existe un elevado infradiagnóstico en la EPOC, la mayoría de los pacientes diagnosticados de DAAT presentan esta enfermedad pulmonar, y posiblemente se suman ambos efectos: retraso en el diagnóstico de la EPOC al que se añade la falta de sospecha del DAAT, hasta alcanzar estadios avanzados del enfisema16.
Un hallazgo de nuestro estudio es el hecho de que entre los casos catalogados como no-índice existe un elevado número que presentaban enfermedad pulmonar, pero no se sospechó la posible existencia del DAAT hasta que se detectó en otro familiar. Este dato refleja la falta de concienciación o desconocimiento sobre el DAAT que todavía existe entre los profesionales de la salud, a pesar de las recomendaciones de instituciones como la Organización Mundial de la Salud y las sociedades científicas5,17–19.
Un 45,4% de los pacientes había recibido tratamiento sustitutivo en algún momento desde su inclusión en el REDAAT. Estos pacientes tenían en mayor proporción enfisema y bronquitis crónica, estaban más sintomáticos y tenían peor función pulmonar, mayor mortalidad e indicación de trasplante. La mayor gravedad de estos pacientes está en relación con los criterios de indicación del tratamiento y no permite obtener conclusiones sobre la eficacia del fármaco. Sin embargo, otro registro obtuvo información sobre la efectividad del mismo: el registro americano, diseñado con este fin, contaba con información sobre 1.048 individuos, seguidos entre 3,5 y 7 años, y se detectó una reducción significativa de la mortalidad, además de una ralentización en la caída del FEV1 en los enfermos con un FEV1 entre 35-49% que recibieron tratamiento de forma continuada o intermitente20.
ConclusionesEl REDAAT es una herramienta útil para el estudio de la realidad del DAAT en España. Los datos de que dispone el registro son bastante completos, aunque resulta difícil que los médicos participantes tengan una actividad mantenida en el tiempo que permita recoger datos de seguimiento. La cohorte de pacientes incluida tiene una edad parecida a la de las cohortes de otros registros, y la mayor parte de los individuos padecen enfermedad pulmonar.
Conflicto de interesesBeatriz Lara ha recibido honorarios por asesoría científica y/o impartir conferencias de Bayer, Glaxo Smithkline, Boehringer Ingelheim, Novartis, Grifols, Talecris, Menarini, Laboratorios Rovi y Pfizer.
Francisco Casas ha recibido honorarios por asesoría científica y/o por impartir conferencias de Almirall, AstraZeneca, Boehringer Ingelheim, Grupo Ferrer, GlaxoSmithKline, Grifols, Laboratorios Esteve, Pfizer, Teva, Menarini, Novartis, Gebro Pharma y Takeda.
Sergio Cadenas ha recibido honorarios por impartir conferencias de Almirall, Astra Zeneca, Boehringer Ingelheim, GlaxoSmithKline, Grifols y Novartis.
Sergio Curi ha recibido honorarios por impartir conferencias de Boehringer Ingelheim, Almirall y GlaxoSmithKline.
Francisco Dasí ha recibido honorarios por impartir conferencias de Grifols.
Marc Miravitlles ha recibido honorarios por asesoría científica y/o por impartir conferencias de Almirall, AstraZeneca, Boehringer Ingelheim, CSL Behring, Grupo Ferrer, GlaxoSmithKline, Grifols, Laboratorios Esteve, Teva, Cipla, Menarini, Novartis, Gebro Pharma y Takeda.
A los 124 médicos que a lo largo de los años han dedicado su tiempo a introducir los datos de sus pacientes en el REDAAT; sin ellos este trabajo no habría sido posible.
Al Dr. Ferran Barbé por sus aportaciones en la realización de este proyecto y manuscrito.