La venlafaxina es un antidepresivo que inhibe de forma selectiva la recaptación de serotonina, noradrenalina y dopamina. Los efectos secundarios son infrecuentes y excepcionalmente se ha asociado a neumonitis por hipersensibilidad. Describimos el caso de una mujer de 61 años diagnosticada de síndrome depresivo y tratada con Dobupal® (venlafaxina), a dosis de 150mg/24h, desde hacía 18 meses, que presentó un deterioro de su enfermedad, por lo que se incrementó la dosis de venlafaxina hasta 225mg/día. Tres semanas después desarrolló síntomas de tos no productiva, disnea a esfuerzos moderados y astenia. El cuadro clinicorradiológico, los hallazgos en la función pulmonar, el lavado broncoalveolar y la histología de las biopsies pulmonares eran indicativos de neumonitis por hipersensibilidad. Se descartaron otras etiologías y se retiró la venlafaxina sin utilizar corticoides ni otros inmunomoduladores, con lo que desaparecieron tanto la clínica como los hallazgos radiológicos y funcionales, que se normalizaron a los 3 meses.
Venlafaxine is a selective serotonin, noradrenalin, and dopamine reuptake inhibitor. Although side effects are rare, venlafaxine has very occasionally been associated with hypersensitivity pneumonitis. We report the case of a 61-year-old woman diagnosed with depressive disorder and treated with venlafaxine (Dobupal) at a dose of 150mg/d for 18 months. When depression worsened, the dose was increased to 255mg/d. Three weeks later she complained of nonproductive cough, shortness of breath with moderate effort, and asthenia. Clinical and radiologic findings, lung function, bronchoalveolar lavage, and histology of lung biopsies all indicated a diagnosis of hypersensitivity pneumonitis. Other causes were ruled out and venlafaxine was discontinued. Clinical, radiologic, and lung function findings then resolved without the use of corticosteroids or nonsteroid immune modulators. All findings were normal on follow-up after 3 months.
La venlafaxina es un antidepresivo que inhibe de forma selectiva la recaptación de serotonina, noradrenalina y dopamina, sin desencadenar significativos efectos muscarínicos o alfaadrenérgicos. Su metabolismo es hepático y tanto los metabolitos como el fármaco residual no metabolizado se eliminan por vía renal1,2. Los efectos secundarios son infrecuentes y se han descrito anorexia, diarrea, insomnio, náuseas, nerviosismo, somnolencia, sudación, arritmias e hipertensión en menos del 3% de los pacientes. Se ha considerado excepcional la incidencia de toxicidad pulmonar, que queda limitada a unos pocos casos en que se ha comunicado asma3, aparición de infiltrados pulmonares con eosinofilia4,5 o neumonitis intersticial6,7.
Aunque la neumonitis por hipersensibilidad tradicionalmente se ha asociado a la inhalación de sustancias orgánicas y a algunos productos químicos industriales, en los últimos años se ha descrito su asociación con algunos fármacos8,9. Exponemos el caso de una mujer diagnosticada de síndrome depresivo que, tras incrementar la dosis de venlafaxina, desarrolló un cuadro clínico de tos no productiva, disnea de reposo, alteraciones radiológicas, funcionales y hallazgos histológicos indicativos de neumonitis por hipersensibilidad, que desaparecieron tras la retirada del fármaco, sin que pudieran relacionarse estos hallazgos con otra etiología.
Observación clínicaMujer de 61 años, exfumadora de 20 paquetes/año, sin alergias conocidas, diagnosticada de síndrome depresivo con síntomas psicóticos y en tratamiento con Dobupal® (venlafaxina) en dosis de 150 mg/24 h desde hacía 18 meses. En los últimos 6 meses, debido a la presencia de ideas paranoides, se habían añadido Loramet® (lormetacepam) y Zypresa® (olanzapina), a dosis de 5 mg/día. Ante la persistencia de los síntomas se incremento la dosis de venlafaxina a 225 mg/24 h. Seis semanas después, la paciente consultó por la instauración progresiva, durante las últimas 3 semanas, de tos no productiva, disnea a esfuerzos moderados y astenia. En la exploración estaba afebril, con una presión arterial de 130/85 mmHg, frecuencia cardíaca de 70 lat/min y frecuencia respiratoria de 22 respiraciones/min. Se auscultaron estertores crepitantes en las zonas medias e inferiores de ambos campos pulmonares, sin otros hallazgos de interés.
La gasometría arterial respirando aire ambiente (fracción inspiratoria de oxígeno: 21%) presentó los siguientes valores: pH de 7,47, presión arterial de oxígeno de 66 mmHg, presión arterial de anhídrido carbónico de 36 mmHg y bicarbonato de 26 mEq/l. En la analítica, el hemograma mostró 6.100 leucocitos/μl (un 35% neutrófilos, un 2% eosinófilos y un 55% linfocitos), velocidad de sedimentación globular de 17 mm en la primera hora, enzima de conversión de la angiotensina de 91 U/ml, factor reumatoide de 235 U/ml, proteína C reactiva de 10 mg/l e inmunocomplejos circulantes de 5,7 μg/ml. El resto de determinaciones analíticas (parámetros hematológicos, coagulación, bioquímica general, inmunoglobulinas, autoanticuerpos y marcadores tumorales) estaban dentro de los valores considerados normales. Los hemocultivos, los antígenos en orina frente a Legionella pneumophila y Streptococcus pneumoniae, las serologías frente a gérmenes atípicos y virus respiratorios, las precipitinas a aves y hongos y la prueba del Mantoux fueron negativos. Los estudios bacteriológicos y de citología de esputo no mostraron datos relevantes. El electrocardiograma y un ecocardiograma no objetivaron anomalías. Las pruebas cutáneas frente a una batería de neumoalérgenos fueron negativas. En la radiografía de tórax se visualizaron un patrón en vidrio deslustrado y zonas de afectación micronodular. La tomografía computarizada de tórax evidenció hallazgos similares, con algún infiltrado parcheado en las bases y zonas de atenuación, sin observarse adenopatías mayores de 1 cm. En las pruebas de función respiratoria fue patente la presencia de síndrome restrictivo –capacidad vital forzada (FVC): 1,85 l (58%); volumen espiratorio forzado en el primer segundo (FEV1): 1,76 l/sg (75%); FEV1/FVC: 95; pico de flujo espiratorio: 250 l/min (85%); capacidad pulmonar total: 3,45 l (73%)–, sin que se lograra realizar una medición de la difusión adecuada, aunque el test de la marcha de 6 min mostró desaturación tras recorrer 338 m (saturación arterial de oxígeno basal del 90% y frecuencia cardíaca de 87/min; al final de la prueba, saturación arterial de oxígeno del 85% y frecuencia cardíaca de 115/min).
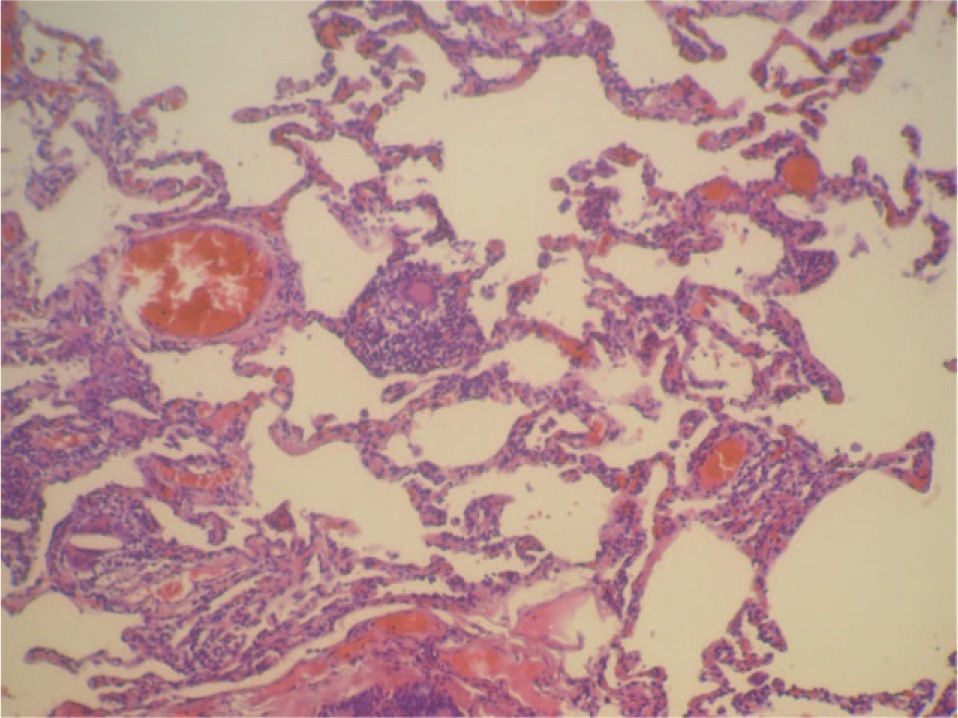
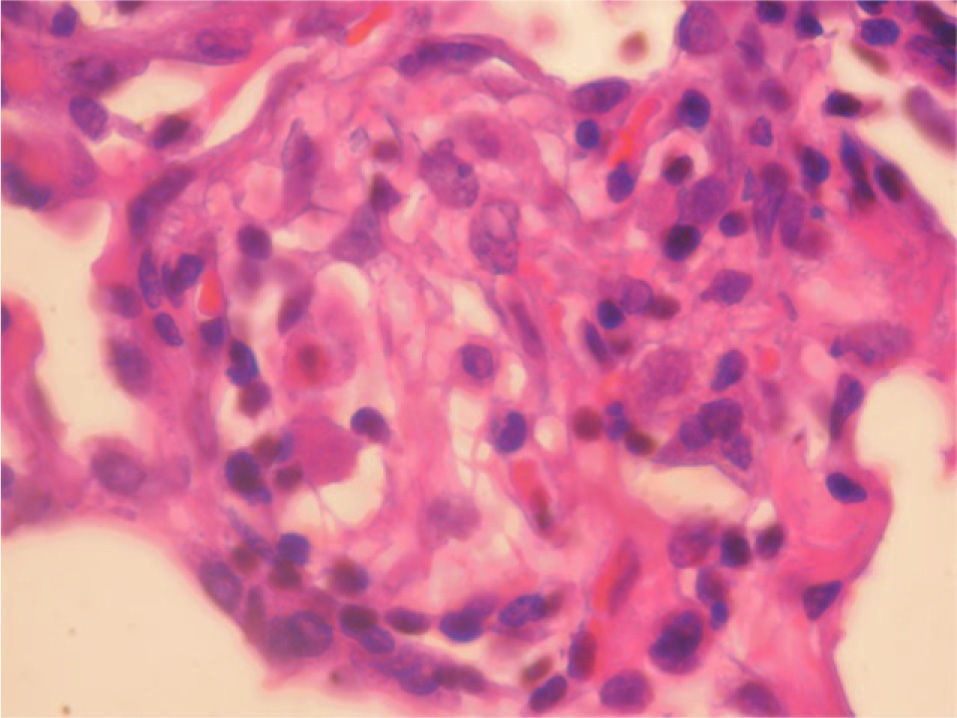
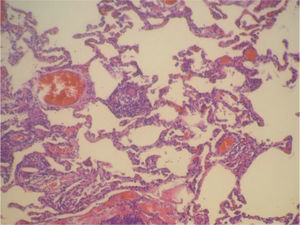
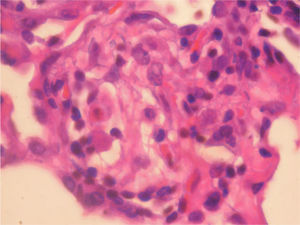
En la fibrobroncoscopia no se visualizaron anomalías macroscópicas y los estudios microbiológicos del aspirado bronquial y lavado broncoalveolar (BAL), que incluyeron cultivos y técnicas de amplificación genética a Mycobacterium tuberculosis y virus, fueron negativos. En el BAL se objetivó un recuento celular con un 45% de neutrófilos, un 5% de eosinófilos y un 50% de linfocitos, con CD2 (linfocitos T) del 65%, CD4 del 35%, CD8 del 30%, CD56 (citolíticos) del 20% y CD22 del 1%. Las biopsias mediante toracoscopia mostraron una neumonitis intersticial sin fibrosis de la pared alveolar y con zonas de bronquiolitis, granulomas de células epitelioides y cristales de colesterol en las células gigantes. La afectación era indicativa de neumonitis por hipersensibilidad (figs. 1 y 2). Ante la sospecha de que fuera debido a la toma de venlafaxina, se sustituyó ésta por mirtazapina, manteniendo el resto de la medicación (olanzapina y lormetacepam), y no se pautaron corticoides ni inmunodepresores. A los 15 días la mejoría clínica era evidente, y una tomografía computarizada realizada a los 3 meses de retirar la venlafaxina mostró la resolución de las alteraciones y la normalización de la función pulmonar, que se mantenía a los 9 meses.
DiscusiónLa venlafaxina se utiliza en todos los tipos de depresión, incluida la asociada con ansiedad social. Su metabolismo predominante lo realiza la enzima CYP2D6 del citocromo P450 en el hígado y su metabolito O-desmetilvenlafaxina inhibe la recaptación de serotonina y tiene una vida media de 11 h1,2. Aunque la toxicidad pulmonar por venlafaxina parece infrecuente, ya que sólo se han publicado unos pocos casos desde 20005-7, se desconoce su verdadera incidencia. Sin embargo, otros antidepresivos, como los tricíclicos dotiepina e imipramina, se han relacionado con una incidencia mayor de alveolitis fibrosante criptogenética10,11, y la fluoxetina y paroxetina, inhibidores de la recaptación de la serotonina, también se han asociado de forma ocasional a fibrosis pulmonar, daño alveolar difuso12 y neumonitis13,14. Se desconocen los mecanismos implicados en esta asociación, pero se ha conjeturado que entre ellos podrían figurar mecanismos de hipersensibilidad del huésped a alguno de los metabolitos6 y/o la presencia de determinados polimorfismos genéticos del citocromo P450 presentes en el 5-10% de la población caucásica. Estos últimos tienen un metabolismo más lento y presentan concentraciones séricas más elevadas de la venlafaxina, lo que favorece su toxicidad15,16. No obstante, a diferencia de otras publicaciones, no objetivamos toxicidad cardíaca o en otros órganos.
La aparición de la clínica coincidiendo con el incremento de la dosis de venlafaxina y los hallazgos clínicos, radiológicos e histológicos son superponibles a los descritos por Turner et al7, aunque en nuestro caso no fue preciso instaurar tratamiento con corticoides. La elevación de los inmunocomplejos circulantes, la linfocitosis tanto en el hemograma como en el BAL y los hallazgos histológicos apuntan a un mecanismo de hipersensibilidad y son similares a los escasos casos descritos hasta ahora con infiltrado intersticial de predominio linfocitario, bronquiolitis y granulomas no necrosantes con células gigantes6,7. También se han descrito con otros inhibidores de la recaptación de serotonina como la fluoxetina14.
Pichler8 ha propuesto una clasificación de las reacciones por hipersensibilidad a fármacos tipo IV. La clase de lesiones dependería del tipo de linfocito T que predomina en las lesiones, las citocinas implicadas y el mecanismo efector. Aunque los estudios se han realizado mayoritariamente en biopsias de piel, este autor defiende los mismos mecanismos implicados en otros órganos como el pulmón, riñón o hígado. Si se aplicaran los criterios de esta clasificación a los hallazgos de la biopsia y la clínica de la paciente descrita, el tipo de reacción sería una respuesta de hipersensibilidad tardía tipo IVa, en la que estaría implicado un mecanismo por linfocitos T helper-117. Recientemente Capelozzi et al18 han desarrollado un modelo experimental animal para el estudio de la toxicidad pulmonar por fármacos antidepresivos.
A pesar de que la paciente había iniciado el tratamiento con el fármaco 18 meses antes, la clínica apareció a las 2 semanas de incrementar la dosis, como en otros casos7. Se decidió realizar una biopsia debido a la cronicidad de su enfermedad psiquiátrica, los efectos secundarios que un tratamiento innecesario con corticoides podía conllevar, la escasez de casos por venlafaxina comunicados y la posibilidad de un diagnóstico alternativo como la sarcoidosis. La desaparición del cuadro clínico, radiológico y funcional tras interrumpir la venlafaxina, sin modificar el resto del tratamiento ni instaurar fármacos antiinflamatorios, inmunodepresores o inmunomoduladores, indicaría que la relación causaefecto es sumamente probable y, a pesar de que por motivos éticos no se reintrodujo el fármaco, de acuerdo con la escala de probabilidad de Naranjo et al19, la asociación del efecto secundario y el fármaco se considera probada.
Los fármacos son una causa frecuente de iatrogenia y originan una morbilidad y mortalidad considerables. En un estudio realizado en el Reino Unido20, el 6,5% de los ingresos hospitalarios se relacionó con reacción a fármacos y el 2% de estos pacientes fallecieron, lo que suponía un 0,15% de todas las admisiones en el hospital. El número de fármacos que se relacionan con la aparición de enfermedad pulmonar infiltrativa se ha incrementado de forma notable en los últimos años, y la gravedad del cuadro clínico es muy variable. Aunque realizar un diagnóstico es a menudo difícil, en cualquier paciente con enfermedad pulmonar infiltrativa se debe evaluar de forma sistemática la posible relación con la toma de fármacos, ya que su retirada conlleva en muchas ocasiones la mejoría clínica e incluso la curación del paciente, evitando tratamientos innecesarios9,10.