Se describen 3 casos de empiema pleural por microorganismos del género Gemella, 2 por la especie G. morbillorum y uno por G. haemolysans. Se revisan las características microbiológicas, los factores predisponentes y las pautas de tratamiento, y se exponen los casos publicados en la literature médica.
Three cases of pleural empyema caused by Gemella species—2 caused by Gemella morbillorum and 1 caused by G haemolysans—are reported. Microbiological characteristics, predisposing factors, and treatment are reviewed and all cases published in the literature are analyzed.
Los microorganismos del género Gemella1 son cocos grampositivos, facultativos anaerobios, que, como otras bacterias comensales de los humanos, son patógenos oportunistas y pueden causar una grave infección localizada y generalizada, principalmente en pacientes inmunocomprometidos. Las especies G. morbillorum y G. haemolysans son las más importantes patógenas. G. haemolysans es capaz de producir endocarditis2 y meningitis3, mientras que G. morbillorum causa endocarditis sobre todo de válvula nativa4,5, artritis séptica6 y meningitis7, entre otras. Las infecciones del aparato respiratorio por el género Gemella se han descrito raramente, pero son capaces de producir absceso de pulmón8,9, neumonías necrosantes10,11 y empiemas pleurales8,10,12-19, mientras que las publicaciones respecto de la afectación pleural son escasas y de casos aislados.
Presentamos 3 casos de empiema pleural producido por microorganismos del género Gemella, 2 por G. morbillorum y uno por G. haemolysans, y revisamos los artículos publicados en la literatura médica hasta la fecha.
Los criterios de identificación fueron los siguientes: la tinción de Gram reveló cocos grampositivos agrupados en cadenas. Las muestras se cultivaron en los medios agar sangre Columbia y agar chocolate y se incubaron en una cámara anaerobia. Tras 48h de incubación se obtuvieron colonias alfahemolíticas, catalasa negativas, con mejor crecimiento en el medio anaerobio. Los microorganismos se identificaron como G. morbillorum y G. haemolysans mediante el sistema API 20 Strep (CAPI System, BioMerieux, La Balme Les Crottes, Montalienvercien, Francia). La susceptibilidad antimicrobiana se determinó con la técnica de difusión en disco de Kirby-Bauer.
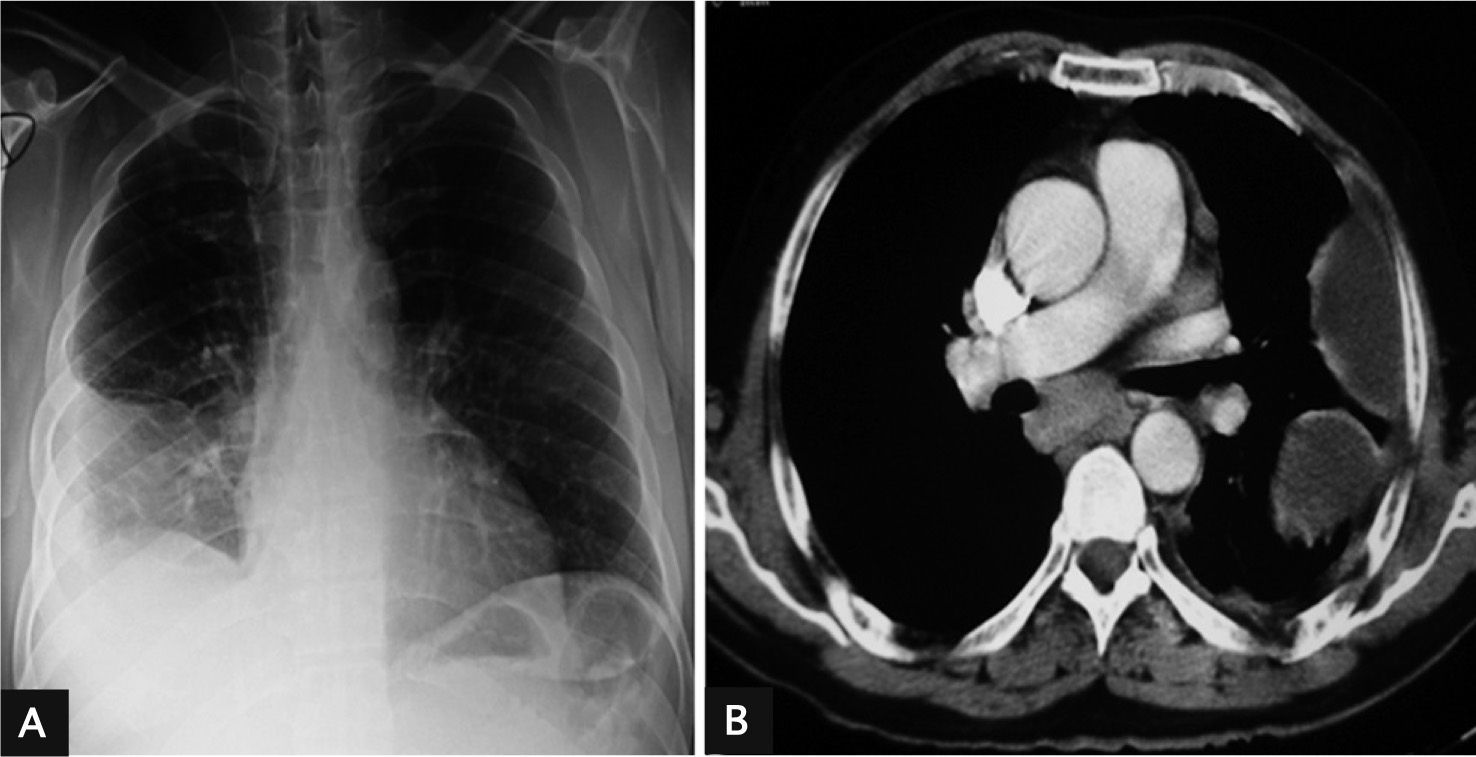
Observaciones clínicasCaso 1Varón de 45 años, exfumador (30 paquetes/año), bebedor de 30g de alcohol al día, con antecedentes de hipertensión arterial y fibrilación auricular de reciente diagnóstico. Ingresó por cuadro de 25 días de evolución consistente en fiebre, dolor en el costado derecho de tipo pleurítico, escalofríos y malestar general. En la exploración destacaban obesidad y semiología de derrame pleural derecho. La radiografía de tórax y la tomografía computarizada (TC) mostraron derrame pleural derecho, loculado, con pleura visceral engrosada y condensación subyacente en el lóbulo inferior derecho (fig. 1a). Se realizó una toracocentesis diagnóstica y se obtuvo un líquido purulento, verdoso, con olor pútrido, en cuyo cultivo creció G. morbillorum sensible a penicilina, cefalosporinas y aminoglucósidos. Se instauró tratamiento con tubo de drenaje torácico (volumen total de 1.200ml), fibrinolíticos y cefotaxima a dosis de 1g cada 6h por vía intravenosa (i.v.), junto con levofloxacino (500mg cada 12h, i.v.), durante 16 días. Posteriormente, se añadió cefuroxima (500mg cada 12h por vía oral) hasta completar 26 días. En una revisión posterior se apreció un mínimo engrosamiento pleural basal en el pulmón derecho de carácter residual. Durante su ingreso presentó un absceso perianal que precisó drenaje quirúrgico, del que no se remitieron muestras microbiológicas.
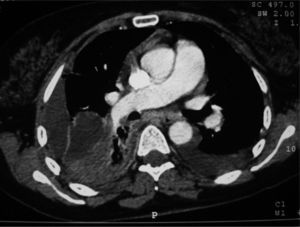
A) Radiografía posteroanterior de tórax del caso 1, en la que se aprecia un derrame pleural derecho, loculado, con pleura visceral engrosada y condensación subyacente en el lóbulo inferior derecho; B) Tomografía computarizada de tórax del caso 2, que muestra derrame pleural izquierdo, loculado, que forma 3 colecciones, y adenopatías mediastínicas patológicas.
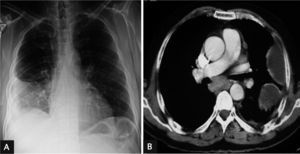
Varón de 59 años, con antecedentes de tabaquismo activo (40 paquetes/año), bebedor de 40g de alcohol al día, trastorno de personalidad con distimia y somatización, abuso de benzodiacepinas, que requirió 2 ingresos hospitalarios por coma farmacológico y un episodio de broncoaspiración. Presentaba síndrome de apneas-hipopneas durante el sueño sin tratamiento, criterios de bronquitis crónica y hepatopatía crónica de origen enólico. Ingresó por fiebre de 40°C de 15 días de evolución, dolor torácico de características pleuríticas en el hemitórax izquierdo, escalofríos y malestar general. En la exploración física destacaba semiología de derrame pleural en la mitad inferior de hemitórax izquierdo. La radiografía de tórax y la TC mostraron un derrame pleural en el pulmón izquierdo, loculado, que formaba 3 colecciones (basal posterior, lateral y apicoposterior), y adenopatías mediastínicas patológicas (fig. 1b). En la toracocentesis diagnóstica se obtuvo un líquido verdoso, espeso y pútrido, con crecimiento de G. morbillorum sensible a penicilinas, cefalosporinas e intermedia a aminoglucósidos. Fue tratado inicialmente con tubo de drenaje torácico (volumen total de 1.270ml), fibrinolíticos e imipenem (500mg i.v. cada 6h) durante 4 días. Más tarde, ante los resultados microbiológicos se introdujo amoxicilina-ácido clavulánico (2g i.v. cada 8h) durante 4 días y posteriormente de forma oral (875/125mg cada 8h) hasta completar 24 días de tratamiento, con favorable evolución tanto clínica como radiológica.
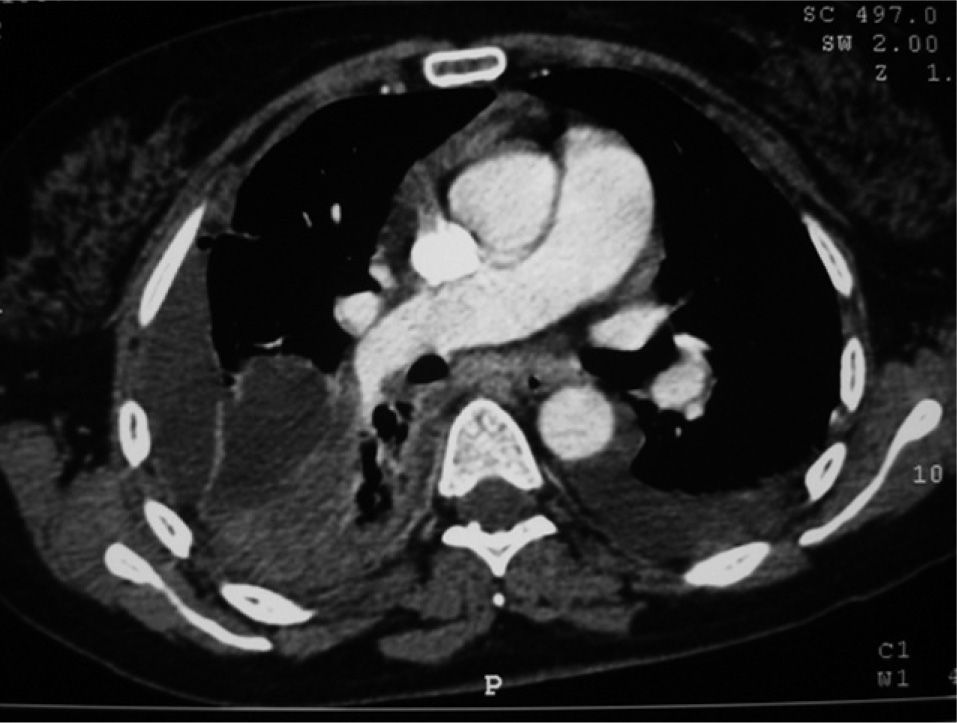
Caso 3Mujer de 50 años, exfumadora, con antecedentes de carcinoma de colon en estadio IV, intervenido quirúrgicamente 7 años atrás, con varias líneas de quimioterapia y en progresión. Ingresó por un cuadro de 3 días de evolución consistente en fiebre de 39°C, tos, expectoración purulenta y dolor de tipo pleurítico en el hemitórax derecho, con semiología de derrame en los 2 tercios inferiores de hemitórax. La radiografía de tórax y la TC mostraban derrame pleural bilateral, de predominio derecho, con loculaciones en su porción superior, infiltrado pulmonar en el lóbulo inferior derecho con áreas de abscesificación y múltiples nódulos pulmonares en relación con metástasis ya conocidas (fig. 2). La toracocentesis mostró un líquido serohemático, espeso, con crecimiento de G. haemolysans sensible a penicilina, cefalosporinas y aminoglucósidos. La paciente fue tratada con tubo torácico (1.670ml) y fibrinolíticos junto con amoxicilina-ácido clavulánico (1g i.v. cada 8h) y levofloxacino (500mg cada 12h, i.v.) durante 10 días, tras los cuales se pasó a la administración oral (amoxicilinaácido clavulánico: 875/125mg cada 8h; levofloxacino: 500mg cada 24h), hasta completar un total de 21 días. La evolución tanto clínica como radiológica fue favorable.
Tomografía computarizada de tórax del caso 3, en la que se objetiva derrame pleural bilateral, de predominio derecho, con loculaciones en su porción superior, infiltrado pulmonar en el lóbulo inferior derecho con áreas de abscesificación y múltiples nódulos pulmonares en relación con metástasis ya conocidas.
Los microorganismos del género Gemella son cocos grampositivos, facultativos anaerobios, catalasa negativos, que fueron descritos por primera vez en 1917 por Tunnicliff20. El género Gemella fue oficialmente propuesto por Berger en 19611 e incluía en ese momento una sola especie, G. haemolysans, que se conocía previamente como Neissera haemolysans21. En 1988 se añadió un segundo miembro del género Gemella22, G. morbillorum, que antes pertenecía al género Streptococcus. Hoy día comprende las especies G. haemolysans, G. morbillorum, G. bergeriae y G. sanguinis, sobre la base de la hibridación del ADN y la secuencia genética 16S del ARN ribosómico21.
En población sana, G. haemolysans se ha encontrado en la cavidad bucal hasta en el 30% de los frotis faríngeos23 y aparato respiratorio superior, mientras que G. morbillorum se ha encontrado además como componente de la flora humana intestinal y aparato urogenital21,24.
Por su comportamiento oportunista, son capaces de producir infecciones como septicemia25, infecciones del sistema nervioso3,26, artritis6, abscesos hepáticos27 y endocarditis4,5 entre las más frecuentes. Se han descrito casos de infecciones del aparato respiratorio como neumonía necrosante10,11, abscesos de pulmón8,9 e incluso colonización de la cavidad tuberculosa28. No obstante, la aparición de empiema pleural se considera excepcional. En una revisión de la literatura médica mediante MEDLINE sólo encontramos 12 casos de empiema por G. morbillorum8,10,12,13,15-19 y uno por G. haemolysans14. En la tabla I se indican las características de los 13 casos. Nuestra serie de 3 casos es una de las más extensas de la literatura médica, a excepción de la revisión de García-Lechutz et al19, que en un período de 4 años encuentran 4 empiemas por este género de microorganismos. No obstante, el caso descrito por Signes-Costa et al10 fue tratado en nuestro servicio, aunque no lo incluimos en la presente serie al estar publicado, por lo que hubiéramos tratado 4 casos en un período de 7 años.
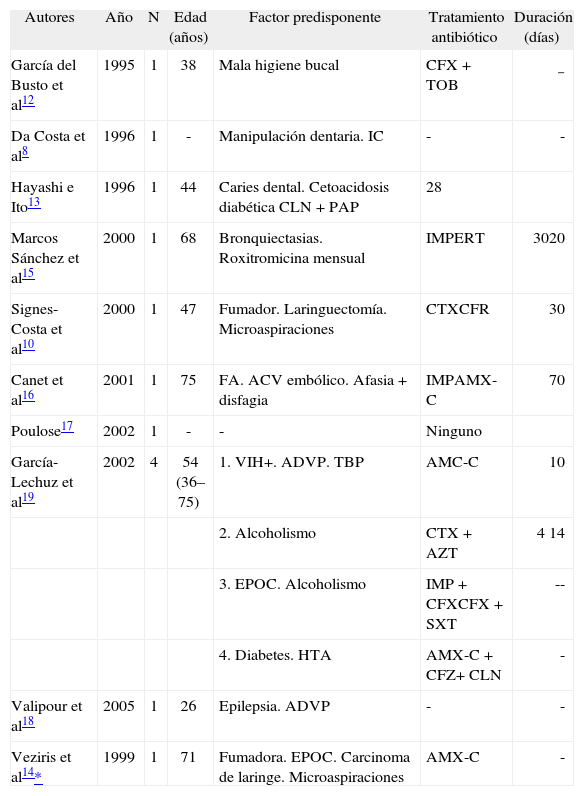
Revisión de los casos de empiema pleural por Gemella morbillorum publicados
| Autores | Año | N | Edad (años) | Factor predisponente | Tratamiento antibiótico | Duración (días) |
| García del Busto et al12 | 1995 | 1 | 38 | Mala higiene bucal | CFX+TOB | − |
| Da Costa et al8 | 1996 | 1 | - | Manipulación dentaria. IC | - | - |
| Hayashi e Ito13 | 1996 | 1 | 44 | Caries dental. Cetoacidosis diabética CLN+PAP | 28 | |
| Marcos Sánchez et al15 | 2000 | 1 | 68 | Bronquiectasias. Roxitromicina mensual | IMPERT | 3020 |
| Signes-Costa et al10 | 2000 | 1 | 47 | Fumador. Laringuectomía. Microaspiraciones | CTXCFR | 30 |
| Canet et al16 | 2001 | 1 | 75 | FA. ACV embólico. Afasia+disfagia | IMPAMX-C | 70 |
| Poulose17 | 2002 | 1 | - | - | Ninguno | |
| García-Lechuz et al19 | 2002 | 4 | 54 (36–75) | 1. VIH+. ADVP. TBP | AMC-C | 10 |
| 2. Alcoholismo | CTX+AZT | 4 14 | ||||
| 3. EPOC. Alcoholismo | IMP+CFXCFX+SXT | -- | ||||
| 4. Diabetes. HTA | AMX-C+CFZ+ CLN | - | ||||
| Valipour et al18 | 2005 | 1 | 26 | Epilepsia. ADVP | - | - |
| Veziris et al14* | 1999 | 1 | 71 | Fumadora. EPOC. Carcinoma de laringe. Microaspiraciones | AMX-C | - |
ACV: accidente cerebrovascular; ADVP: adicto a drogas por vía parenteral; AMX-C: amoxicilina-ácido clavulánico; AZT: aztreonam; CFR: cefuroxima; CFX: ciprofloxacino; CFZ: cefazolina; CLN: clindamicina; CTX: cefotaxima; EPOC: enfermedad pulmonar obstructiva crónica; ERT: eritromicina; FA: fibrilación auricular; HTA: hipertensión arterial; IC: insuficiencia cardíaca; IMP: imipenem; PAP: panimipenem; SXT: cotrimoxazol; TBP: tuberculosis pulmonar; TOB: tobramicina; VIH+: virus de la inmunodeficiencia humana positivo.
Entre las condiciones subyacentes de los pacientes con este tipo de infecciones destacan la adicción a drogas por vía parenteral5,18,19, la diabetes13,19, la enfermedad cardiovascular8, el alcoholismo19, como en los 2 pacientes de esta serie infectados por G. morbillorum, y cáncer29, como en el último caso aquí descrito, teniendo todos el rasgo común de la inmunodepresión. Entre los factores predisponentes se reconocen la mala higiene bucal y la manipulación dental previa, que debido a la disrupción de la mucosa podría facilitar su diseminación hematógena8,12,13, así como microaspiraciones de secreciones orfaríngeas, que facilitarían su diseminación broncógena10,16, que pensamos pudo estar presente en el caso 2, dados los antecedentes y la ingesta de fármacos.
Cabe destacar que el caso 2 presentó un absceso anal, que fue drenado quirúrgicamente durante su evolución y que consideramos pudo estar en relación con la diseminación hematógena por G. morbillorum, si bien no se cultivaron las muestras. La aparición de absceso perianal por este microorganismo no se ha descrito previamente.
La respuesta al tratamiento es habitualmente favorable18, como en nuestros 3 casos, si bien puede complicarse con situaciones de sepsis y shock11,24, sobre todo en pacientes inmunodeprimidos.
La información acerca de la sensibilidad antimicrobiana de este género es limitada. Se han descrito un grado bajo de resistencia a aminoglucósidos y elevada resistencia a trimetropim-sulfametoxazol11. Se compara la sensibilidad antibiótica con la de Streptococcus viridans30, por lo que la penicilina o la ampicilina son fármacos de elección. De hecho, hay autores que recomiendan el tratamiento empírico con penicilina G sódica16, aunque también se argumenta la ocasional resistencia a penicilina para iniciar tratamiento con betalactámicos y aminoglucósidos o, en su defecto, vancomicina18. Respecto a la duración del tratamiento en casos de empiema, la información es insuficiente, por lo que se recomienda prolongarlo durante un mínimo de 4 semanas10,13 o hasta completar la evacuación del mismo16, ya que el drenaje del empiema con toracocentesis evacuadora12 o tubo torácico10,13,15,16,18 constituye el pilar fundamental sobre el que descansa el manejo de estos pacientes, de modo que se ha descrito incluso la curación tras la aplicación de esta medida sin necesidad de tratamiento antibiótico17. En nuestros casos no se encontró resistencia a penicilina y los pacientes siguieron tratamiento antibiótico con betalactámicos durante 3 a 4 semanas, con evolución clínica y radiológica favorable. En los 3 casos de nuestra serie se procedió al drenaje torácico y fibrinolíticos, que excedió de los 1.000ml de volumen en todos ellos.
Podemos concluir que, ante un paciente con empiema, hay que considerar la posibilidad de infección por microorganismos del género Gemella, sobre todo en pacientes inmunodeprimidos o con manipulación reciente del tubo digestivo o dentaria, o en los que se sospechen microaspiraciones nasofaríngeas.