Polisomnografía convencional
La fiabilidad del diagnóstico de síndrome de apneas-hipopneas del sueño (SAHS) basado exclusivamente en la historia clínica o en modelos predictivos que emplean una combinación de diferentes variables fluctúa de manera considerable de unos estudios a otros1-6. Es muy posible que en algunos casos pueda servir de ayuda; sin embargo, no es suficiente para establecer el diagnóstico con certeza. La polisomnografía convencional (PSG) es el método recomendado para realizar el diagnóstico de los pacientes con sospecha de SAHS7-12. Consiste en el registro simultáneo de variables neurofisiológicas y respiratorias que nos permiten evaluar la cantidad y la calidad del sueño, así como identificar los diferentes eventos respiratorios y su repercusión cardiorrespiratoria y neurofisiológica. El registro de la actividad electroencefalográfica debe incluir al menos dos derivaciones (habitualmente las centrales derecha e izquierda: conocidas como C3 y C4 en el sistema 10-20) y preferiblemente también de derivaciones occipitales (O1 y O2) que permiten caracterizar mejor la actividad alfa y la transición de la vigilia al sueño. Además, para reconocer las fases de sueño se necesita registrar los movimientos oculares o electrooculograma (EOG) y el tono muscular, o electromiograma (EMG), habitualmente en el mentón. Con estos parámetros se identifican las diferentes fases de sueño en períodos de 20 o 30 s (llamados épocas) según los criterios internacionalmente aceptados13 para la estadificación del sueño humano. Además, es muy conveniente emplear electrodos (de cazoleta o piezoeléctricos) que nos permitan recoger los movimientos de las extremidades inferiores. Asimismo, también se considera necesario incluir sensores que permitan establecer la posición corporal.
Los modernos sistemas digitales de PSG difieren sustancialmente de los antiguos equipos analógicos de registro en papel, ya que es más fácil registrar períodos prolongados, analizar y tratar las señales adquiridas en crudo y registrarlas de forma ambulatoria. A pesar de todos estos avances, los registros deben ser revisados y analizados manualmente, ya que hasta el momento ningún sistema automático de lectura de sueño ha ofrecido resultados fiables.
El estudio de los parámetros respiratorios y cardíacos incluye el registro de la SaO2 mediante un pulsioxímetro, el registro del esfuerzo respiratorio mediante bandas toracoabdominales y la medida del flujo nasobucal mediante neumotacógrafos o medido con termistores. Sin embargo, se ha observado que el termistor, un excelente medidor de apneas, no es un buen sistema para detectar hipopneas14-17 cuando se utiliza de forma aislada (aunque combinado con la información obtenida de las bandas respiratorias tiene mayor sensibilidad). Por ello, en los últimos años se han introducido señales semicuantitativas para la medición del flujo ventilatorio mediante cánulas nasales conectadas a un transductor de presión y a un amplificador14,17. Además, estos sistemas ayudan a identificar los esfuerzos ventilatorios relacionados con "microdespertares" que forman parte del concepto del síndrome de resistencia aumentada de la vía respiratoria18. Sin embargo, las cánulas nasales también tienen sus limitaciones. Así, si el paciente abre la boca, el flujo se reduce considerablemente y pueden sobrestimarse las hipopneas. Otra dificultad adicional de las cánulas es la obstrucción nasal de algunos pacientes. Por ello, siempre es necesario estimar el flujo aéreo del paciente durante la vigilia y evaluar el comportamiento de la cánula para un paciente concreto. Por todo ello, el mejor sistema es el que combina el empleo de una cánula nasal con un termistor bucal.
El concepto de síndrome de resistencia aumentada de la vía aérea fue introducido por Guilleminault et al18 para describir a los sujetos sin apneas ni desaturaciones que presentaban despertares electroencefalográficos (microdespertares) repetidos como consecuencia de un aumento progresivo de la presión intrapleural medida mediante un balón esofágico. Con los modernos sistemas de detección de hipopneas (cánula nasal, bandas de esfuerzo mediante pletismografía, etc.) es controvertido considerar esta entidad independiente del SAHS19. De hecho, las últimas recomendaciones de la Academia Americana de la Medicina del Sueño incluyen estos eventos dentro del concepto genérico del SAHS6. La PSG deberá realizarse en horario nocturno o en el habitual de sueño del sujeto, con un registro no < 6,5 h8-12 y que incluya por lo menos 180 min de sueño.
Poligrafía respiratoria
Aunque el procedimiento diagnóstico recomendado para el SAHS es la PSG, su empleo exclusivo no ha estado exento de críticas. Por un lado, ya en 1992, Douglas et al20 estudiaron a 200 pacientes consecutivos con sospecha de SAHS mediante PSG y demostraron que la supresión de las variables neurofisiológicas no cambiaba sensiblemente el diagnóstico. Por otro lado, la PSG tampoco es capaz de dar respuesta a todas las preguntas en el universo de pacientes con trastornos del sueño21. De hecho, no es lo mismo estudiar a un paciente con alta sospecha clínica de SAHS, sin otros hallazgos, que a un paciente con síntomas de solapamiento con otros trastornos del sueño, comorbilidad asociada, etc. Por ello, es muy probable que la aproximación más juiciosa al diagnóstico del SAHS dependa de qué queremos medir y en qué tipo de paciente deseamos hacerlo. Además, la menor disponibilidad, los mayores costes y la relativa complejidad de la PSG, hace que este patrón de referencia no pueda llegar a toda la población afectada, lo que ha originado la búsqueda de alternativas más sencillas22-24.
En los estudios realizados en España se estima que cerca del 25% de la población general adulta en edades medias tiene un IAH anormal y que, como mínimo, un millón doscientas mil personas padecen un SAHS clínicamente relevante susceptible de tratamiento con presión positiva continua por vía nasal (CPAP)22. Por otra parte, el número de pacientes tratados con CPAP era en 1994 de, aproximadamente, 8.000 casos24 y había aumentado a unos 28.000 en 199723, con una cifra en agosto de 2003 de 109.000 equipos de CPAP22. A pesar de este espectacular incremento, apenas hemos alcanzado el 10% de los pacientes subsidiarios de tratamiento. Así, se han prescrito 269 CPAP/100.000 habitantes cuando lo deseable (tratar al menos al 50% de la población con SAHS severo) sería de 1.486 CPAP/100.000 habitantes22. Aunque se observa un progresivo incremento de los recursos en los últimos años, como se puede observar en la tabla III, donde se clasifican los laboratorios de sueño de acuerdo con su equipamiento22-24, éstos se muestran claramente insuficientes en todos los estudios llevados a cabo. Las consecuencias de esta escasez de medios técnicos y humanos para el diagnóstico y el tratamiento del SAHS ha motivado la aparición de prolongadas listas de espera. Por todo ello está justificado el empleo de sistemas alternativos o complementarios de la PSG que, aunque tengan una menor precisión diagnóstica, permitan establecer el abordaje de un mayor número de pacientes y, por tanto, aumenten el grado de salud de la población.
La poligrafía respiratoria (PR) consiste en el análisis de las variables respiratorias y cardíacas sin evaluar los parámetros neurofisiológicos y es un sistema aceptado como abordaje diagnóstico en SAHS25-29. La principal ventaja de la PR es que se trata de un método más simple y barato. Sin embargo, este ahorro es preciso cuantificarlo en cada centro, ya que dependerá del equipo empleado, su validación, el número y la cualificación del personal requerido, la implementación en el centro hospitalario o el domicilio del paciente y la selección de pacientes potencialmente candidatos a PR. En teoría, los pacientes más adecuados son los que tienen una baja probabilidad clínica de SAHS, ya que en su mayoría se podrá descartar la enfermedad, y aquellos otros con una alta probabilidad clínica, en quienes se podrá establecer el diagnóstico con suficiente grado de certeza. La PSG y la PR son técnicas complementarias y una unidad de sueño completa debe contar con ambos sistemas. Debe tenerse en cuenta que no todas las PR son comparables. El número de canales oscila entre 4 y más de 10. Algunas permiten la visualización en tiempo real y otras no. Además, no es lo mismo su empleo en una unidad de sueño que en el domicilio del paciente. Por ello, su validez diagnóstica no es comparable en todos los equipos.
La desventaja más importante de la PR es que no permite evaluar las variables neurofisiológicas. En consecuencia, no se conoce la calidad y la cantidad de sueño, por lo que el número de eventos no puede dividirse por el número de horas de sueño, sino por el tiempo de registro en cama, lo que tiende a infraestimar la severidad del SAHS. Sin embargo, es posible inferir el sueño con la ayuda de otros canales, como el de ronquido, la posición, las bandas de esfuerzo toracoabdominal y la actimetría.
A pesar de la enorme difusión y el empleo generalizado de los equipos de PR, la American Academy of Sleep Medicine sostiene que sólo es aceptable el uso vigilado de los equipos de PR para descartar o confirmar el diagnóstico de SAHS y siempre que sea realizado y analizado por personal médico y técnico cualificado y con experiencia en enfermedades del sueño. En el caso de que la prueba sea negativa en pacientes sintomáticos, deben ser remitidos para una PSG convencional6.
Estudios domiciliarios
Los modernos y portátiles sistemas de PSG y de PR permiten su empleo fuera del hospital. Estos sistemas pueden, por un lado, enviar señales por módem, redes locales e incluso por Internet y, por otro, almacenar los registros en tarjetas de memoria, para su posterior volcado e interpretación. Sin embargo, el empleo de la PSG no vigilada en el domicilio es escaso en nuestro medio, probablemente debido a que el coste en recursos humanos es elevado y no se puede intervenir en la prueba si algo falla, como ocurre en el laboratorio de sueño. Es posible que equipos de fácil instalación y sencillos en su manejo puedan ser una alternativa a la PSG realizada en el laboratorio en algunos casos. No obstante, el número de PR realizadas en el domicilio es lo que más está creciendo en los últimos años en nuestro país y se dispone de una aceptable experiencia en esta área. Así, en 1994 sólo había 16 centros que hacían estudios de sueño en el domicilio y en el 2003 eran ya 75 los centros que llevaban a cabo pruebas de sueño en el domicilio; en la práctica totalidad son estudios mediante PR22.
En todo caso, debe considerarse que la realización de estudios domiciliarios en modo no vigilado supone un incremento del número de pruebas perdidas por problemas técnicos u otras razones. En general, se estima que alrededor de un 11-15% de los estudios realizados en estas condiciones debe repetirse. Asimismo, el consumo de material fungible es mayor y el deterioro de los equipos empleados en el domicilio es más rápido que su utilización en el hospital. Por ello, debe evaluarse con cuidado la relación coste-beneficio en cada caso. La mayor ventaja de los estudios domiciliarios es el ahorro de la cama hospitalaria y el tiempo que el técnico dedica a supervisar el estudio. Esto implica que una unidad de sueño puede emplear sus propias camas y adicionalmente un número determinado de estudios domiciliarios en función de su disponibilidad en aparatos y técnicos de sueño para instalarlos. También es posible que un centro pueda realizar sólo estudios en el domicilio. En este caso, especialmente si no dispone de PSG, es conveniente que trabaje de forma coordinada con una unidad de referencia en la que se pueda apoyar si el diagnóstico fuera dudoso o controvertido.
Un problema relevante de las PR, tanto en el domicilio como en el laboratorio, es el relacionado con la validación del equipo25-28. En un metaanálisis encargado por la Agencia para la Salud Pública y la Investigación de Estados Unidos (AHCPR)26 se puso de manifiesto que las sensibilidades y las especificidades de los diferentes equipos oscilaban entre el 30-35 y el 100%, respectivamente. Esta variabilidad no permitió extraer conclusiones globales, por lo que los autores afirmaron que con los datos disponibles cada equipo debería ser validado para la tarea concreta para la que se pretenda utilizar. Consideramos que esta recomendación es deseable y casi obligada en todos los centros de referencia, pero muy difícil de implementar en las unidades de escasa dotación o que no disponen de la PSG, aunque este inconveniente puede solucionarse si estas unidades trabajan coordinadamente con algún centro de referencia. En esta línea, algunos autores han sugerido el empleo de una serie de algoritmos de trabajo que facilitan las decisiones en torno a qué tipo de prueba y dónde deberíamos realizarla para que sea más efectiva27. A pesar de estas limitaciones, en una reciente revisión de la bibliografía sobre el diagnóstico del SAHS con PR se ha encontrado que la PR es una buena alternativa a la PSG, sobre todo cuando se realiza en el hospital; se dipone de muchos menos datos a la hora de evaluar las PR llevadas a cabo en el domicilio de los pacientes28.
En el momento actual hay un número importante de equipos de PR en nuestro país, muchos de los cuales han sido validados29-38. Sin embargo, el mercado evoluciona muy rápidamente y salen a la venta equipos nuevos o versiones modificadas que no han sido validadas de manera adecuada. Por otra parte, la mayoría de las validaciones han sido hechas en el hospital y pocos estudios han evaluado los resultados en el domicilio de los pacientes33-35. Otro problema, escasamente mencionado, es que la validación de un equipo por personal experto, en las condiciones de un laboratorio de sueño, podría no ser extrapolable a los resultados obtenidos por un grupo menos experimentado. Asimismo, es importante señalar que una validación llevada a cabo en una población determinada podría tener distintos resultados si se aplica a una población diferente36,37. Incluso en un mismo centro pueden cambiar las características de una población con el tiempo. Por ejemplo, inicialmente, la tipología de SAHS puede ser muy típica (sujetos obesos, mayoritariamente varones, cuello corto, sintomatología florida, etc.) y con el paso del tiempo, al ser esta población cribada, la tipología del paciente que acude al laboratorio cambia. Si la validación del equipo se hizo en la primera etapa, los resultados podrían ser diferentes al aplicarlos en la segunda.
Otro aspecto que debe tenerse en cuenta es el método que se utilizará. Los equipos pueden ser instalados en el hospital por personal técnico y, así, el paciente se lo lleva puesto a su domicilio para devolverlo al día siguiente. En otros casos el paciente se lleva el equipo a su casa y él mismo se lo instala antes de dormir para devolverlo por la mañana, con lo que el riesgo de la señal sea defectuosa aumenta. Finalmente, otra forma consiste en que un técnico se desplace al domicilio del paciente e instale el equipo. En este último caso el procedimiento es mucho más costoso, aunque es posible que el número de problemas técnicos sea menor. Es muy probable que el primer sistema, donde es el paciente quien recoge y entrega el equipo, sea el más adecuado. Sin embargo, cada centro deberá valorar la mejor relación coste-efectividad en su propio entorno. Siempre que usemos un sistema PR, sea en el domicilio o en el hospital, es conveniente que el paciente rellene un cuestionario con respuestas tales como la hora de irse a la cama, la hora aproximada a la que cree que se durmió y la hora a la cual estima que se despertó y a que hora se levantó, así como una impresión subjetiva sobre la calidad del sueño. Esto nos ayudará a interpretar los resultados de las PR.
Uno de los problemas del uso de la PR domiciliaria en algunas comunidades es que la PR es realizada por las mismas casas comerciales que suministran la CPAP, independientemente del médico, que tiene poco control sobre la calidad de la prueba. En algunos casos, tras su realización, se lo entregan al especialista para que lo analice y en otros se lo dan ya interpretado. Esta situación no es recomendable por cuanto se puede dar el caso de que el médico prescriba una CPAP a un paciente cuyo estudio ha sido realizado y analizado por la misma compañía prestataria. Afirmamos que el control y supervisión de las unidades de sueño sobre la calidad de las pruebas debe ser total. Por ello, aunque la colaboración de la industria en la realización de pruebas es bienvenida, ésta debe llevarse a cabo bajo la supervisión del equipo médico encargado del paciente y nunca de manera independiente de éste.
Es obvia la infradotación de unidades de sueño con PSG en España y la escasez de personal bien formado, técnico y médico. Ésta debería ser la primera reivindicación para que el esquema propuesto de coordinación de laboratorios que sólo disponen de PR con unidades de referencia con PSG y PR pudiera ser, de facto, una realidad.
Son, pues, dos ámbitos distintos y, aunque la PSG y la PR son complementarias y alternativas, más PR no debe significar menos PSG, sino más bien al contrario. Conforme se van llevando a cabo más estudios de sueño a un mayor número de población, cada vez se observan con más frecuencia la aparición de PR no concluyentes que necesitan una PSG convencional por lo que, a su vez, la propia PSG actual se ha transformado en una prueba más compleja y de más difícil interpretación que cuando ésta era la única prueba realizada. Esto es debido a que el mayor conocimiento médico y social de la enfermedad lleva a consultar a más pacientes con síntomas dudosos, que quedan sin resolver, aunque con una PR "negativa" para las apneas. Sólo una buena historia clínica con la prueba complementaria necesaria en cada caso (PR o PSG) permitirá resolver el problema del paciente de manera concluyente.
Este Documento de Consenso hace las siguientes afirmaciones en relación con el diagnóstico del SAHS:
1. La PSG es la prueba de referencia para establecer el diagnóstico del SAHS. La PR es una alternativa aceptable para el diagnóstico de SAHS en pacientes con baja probabilidad clínica (descartar SAHS) y alta probabilidad clínica (confirmar SAHS). En los pacientes con probabilidad clínica media, sospecha de otros trastornos del sueño, insomnio, depresión-ansiedad o portadores de comorbilidad relevante, la prueba recomendable es la PSG.
2. Una prueba de sueño negativa (PR o PSG) en presencia de una clínica altamente sugestiva de SAHS es indicación de la realización de una PSG tan completa como sea necesario, incluidas las variables neurofisiológicas, respiratorias y cardíacas necesarias y la realización, si así se estima oportuno, de mediciones objetivas de la somnolencia, como el tiempo de latencia múltiple de sueño (TLMS).
3. Por el momento, y teniendo en cuenta la evidencia científica disponible, la utilización de la PR en el domicilio no ha sido suficientemente validada. Por ello, este Documento de Consenso recomienda su empleo vigilado hasta que se disponga de estudios de validación que permitan su uso generalizado. Sin embargo, todos los estudios llevados a cabo hasta ahora sugieren que sus resultados serán similares a los de la PR vigilada y que los estudios domiciliarios formarán parte fundamental del diagnóstico del SAHS. Hasta entonces, su empleo deberá ser individualizado por cada unidad de sueño.
4. Todas las unidades de sueño que no dispongan de PSG y usen la PR para el diagnóstico del SAHS (unidades respiratorias de trastornos del sueño [URTS]) deberán tener formación y entrenamiento en SAHS y trabajar en coordinación con unidades de referencia. Por otra parte, las unidades de referencia, con disposición de PSG y PR además de formación y experiencia en todos los trastornos del sueño, deberán dar apoyo y prioridad a las URTS para la solución de los casos remitidos.
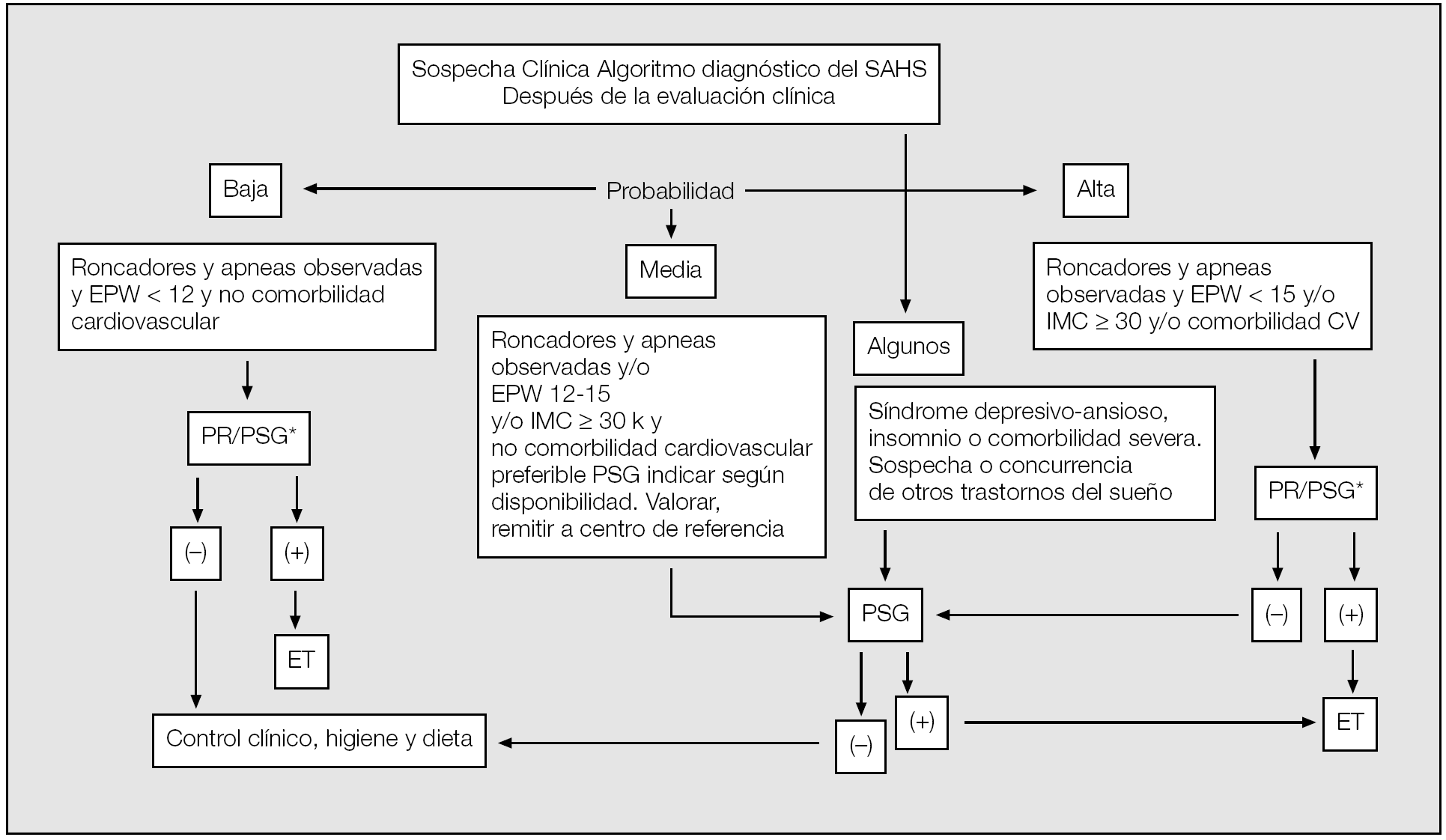
Algoritmo diagnóstico
La estrategia diagnóstica se presenta en la figura 1. La evaluación de un paciente con sospecha clínica de SAHS puede realizarse con una PR, pero también puede realizarse mediante un PSG convencional. Según el tipo de paciente, el grado de sospecha y la severidad de la enfermedad, el lugar de residencia, las características propias del centro y, sobre todo, la experiencia con las técnicas de registro ambulatorio puede realizarse también en el domicilio del paciente, teniendo en cuenta que en alrededor de un 11-15% de los casos deberá repetirse el estudio mediante una PSG convencional, por lo que es altamente recomendable poder realizar esta técnica en el centro o estar en contacto directo con un centro de referencia donde se pueda realizar. Algunos pacientes con depresión, insomnio, sospecha de enfermedades de solapamiento como enfermedad pulmonar obstructiva crónica (EPOC), insuficiencia cardíaca, otros trastornos del sueño o enfermedades neurológicas asociadas deberán realizar directamente una PSG, ya que los resultados de la PR pueden ser poco fiables o enmascararse por los otros procesos. Asimismo, en los pacientes con alta sospecha clínica y PR dudosa o no concluyente deberá indicarse una PSG. En buenas manos, un 50-75% de los casos, según el porcentaje de cada tipo de pacientes que se atienda en el centro (simples o complejos) puede manejarse desde el punto de vista diagnóstico con una PR32.
Fig. 1. Algoritmo diagnóstico de un paciente con excesiva somnolencia durna (ESD). PR: poligrafía respiratoria; PSG: polisomnografía convencional; EPW: escala clínica de somnolencia de Epworth; ET: evaluación terapéutica; IMC: índice de masa corporal.
La oximetría cutánea puede utilizarse para establecer prioridades en las listas de espera o incluso poner un tratamiento con CPAP de manera provisional en un paciente severo. Sin embargo, desaconsejamos su empleo como método único de diagnóstico7-11. De hecho, en la tabla I se observa que el número de centros que únicamente utiliza la oximetría cutánea para el diagnóstico ha descendido de forma importante, de manera que en 2003 era tan sólo del 5%22.
Perspectivas de futuro en el diagnóstico del síndrome de apneas-hipopneas del sueño
El futuro inmediato del diagnóstico del SAHS pasa por la búsqueda de sistemas extraordinariamente sencillos en su manejo y aplicación, que puedan emplearse en el domicilio y por personal no experto, aunque los equipos en su estructura interna sean de gran complejidad. Recientemente empiezan a estar disponibles en el mercado sistemas monocanal que identifican el evento directamente y no a través de la SaO2 transcutánea que, en el fondo, únicamente permite deducir la presencia de apneas o hipopneas según sus consecuencias sobre la SaO2. Estos equipos podrían cambiar nuestra aproximación diagnóstica, al llevar un transductor de presión unido a una cánula nasal38 o bien emplear termistores desechables39. Los costes por estudio son entre 30 y 60 e, respectivamente, lo que supone una reducción muy importante sobre los precios actuales de las pruebas de sueño40,41. Estos aparatos todavía no han sido adecuadamente validados y los pocos estudios llevados a cabo38,39 se han realizado en los laboratorios de sueño y se han comparado sus resultados con la PSG. Sin embargo, el destino natural de estos aparatos es el domicilio de los pacientes y es en ese contexto donde deberían ser validados.
Otro aspecto fundamental es que las futuras validaciones de equipos que se vayan a llevar a cabo no sólo deberán limitarse a los análisis de correspondencia entre el IAH encontrado con la PSG, la PR o cualquier otro sistema, sino también deberán validarse las decisiones terapéuticas que se tomen de acuerdo con los resultados de cada sistema. No podemos olvidar que hacemos pruebas de sueño para establecer diagnósticos que nos permitan tomar decisiones. En este sentido, no es tan importante coincidir con los diferentes sistemas en el IAH obtenido como que la decisión terapéutica final elegida sea similar en ambos grupos. Así, en ese futuro inmediato, la idea de disponer de un "sistema experto manejado por no expertos" será fundamental a la hora de abordar el proceso diagnóstico de los pacientes, no sólo por parte del personal especializado en los laboratorios de sueño, sino también por parte de los médicos de atención primaria (MAP), que deberán involucrarse tanto en el diagnóstico como en el tratamiento y el control de los pacientes con SAHS. Esto implicará la realización de un trabajo coordinado y multidireccional entre centros de referencia (laboratorios de sueño) y centros colaboradores (unidades de sueño sin PSG pero con sistemas de PR) y MAP que favorezca y agilice el diagnóstico y el tratamiento de los pacientes42.
Otro elemento importante es el empleo de técnicas que nos permitan conocer mejor la fisiopatología del SAHS. Éste es el caso de los sistemas que nos ayudan a identificar el "microdespertar" autonómico, que podría estar relacionado con algunas de las complicaciones cardiovasculares del SAHS y que se refleja en las variables cardiorrespiratorias, como la medición de la presión arterial latido a latido y el retraso en la onda de pulso, denominado pulse transit time o PTT43, que consiste en cuantificar el retardo de la onda de pulso desde su génesis la en aurícula izquierda hasta su llegada radial. Cuanto mayor sea la presión negativa intrapleural, la onda del pulso será más retardada. Aunque este sistema aún está en investigación, parece tener un futuro prometedor.
Finalmente, la introducción de la genética y la identificación de marcadores biológicos relacionados con el SAHS no sólo actuarán como factores de riesgo, sino que podrán ser empleados como herramientas diagnósticas.
Conclusiones
El abordaje diagnóstico del SAHS en España está infradotado en cuanto a recursos materiales y formación de los profesionales. Las nuevas técnicas diagnósticas más simplificadas y accesibles, como la PR, pueden ser una herramienta para ayudar a paliar estas carencias, si su desarrollo e implantación se hace en coordinación con unidades de sueño de referencia, que deberán estar en contacto con los profesionales que las realizan.
En condiciones adecuadas, la PR puede ser una alternativa a la PSG y puede realizarse vigilada o en el domicilio, lo que permitiría realizarla en más pacientes, aumentar el número de estudios en unidades consolidadas e implementar este sistema en los centros en los que todavía no se ha iniciado. No obstante, los equipos de PR empleados deberán ser adecuadamente validados, tanto en lo que respecta a su precisión diagnóstica como en lo referente a las decisiones que se toman con ellos.
De manera complementaria, es muy posible que en los próximos años se introduzcan sistemas monocanal para ser manejados tanto por personal altamente cualificado como por personal no experto, lo que facilitará el abordaje diagnóstico de esta entidad.
Sin embargo, no podemos dar la impresión de que la solución al problema del SAHS en España es aumentar el número de PR. Esto, junto con la cada vez mayor demanda asistencial de trastornos del sueño por parte de la población y lo inespecífico de la sintomatología del SAHS, puede llevar a un aumento de estudios no concluyentes, repetición de pruebas, diagnósticos incorrectos y ensayos terapéuticos con CPAP innecesarios, lo que ocasionaría un perjuicio económico y asistencial mayor que el beneficio buscado.
Así pues, en cualquiera de los planteamientos, las palabras clave son formación, experiencia y coordinación. Es imprescindible que los médicos que participan en el proceso diagnóstico hayan recibido formación y entrenamiento suficientes en relación con el sueño y trabajen de forma coordinada, de manera que puedan manejar los diferentes métodos diagnósticos e interpretar sus resultados de forma adecuada y eficiente, y que el aumento de oferta de PR se haga de forma proporcional a la capacidad de las unidades multidisciplinaria de sueño de referencia con suficiente oferta de camas y personal cualificado en medicina del sueño.
Finalmente, es imprescindible que los MAP se impliquen en todo el proceso porque su participación es insustituible. Así, por su responsabilidad en la medicina primaria, son los encargados de la formación de sus pacientes y de establecer la sospecha clínica del proceso. Por tanto, deberán contar con sistemas sencillos, como cuestionarios rápidos y pruebas simples, que les permitan descartar a los pacientes de baja probabilidad y remitir a las unidades de sueño, con la preferencia que sea necesaria, a los pacientes con sospecha de SAHS. Asimismo, deberán recibir formación sobre el control del tratamiento y, especialmente en la CPAP, sobre su manejo, cumplimiento y efectos secundarios.