Definición y concepto
El síndrome de apneas-hipopneas del sueño (SAHS) consiste en la aparición de episodios recurrentes de limitación del paso del aire durante el sueño como consecuencia de una alteración anatómico-funcional de la Vía aérea superior (VAS) que conduce a su colapso, provocando descensos de la saturación de oxihemoglobina (SaO2) y microdespertares que dan lugar a un sueño no reparador, somnolencia diurna excesiva, trastornos neuropsiquiátricos, respiratorios y cardíacos1. Las principales definiciones del SAHS se presentan en la tabla I.
El SAHS se ha llamado síndrome de hipersommia y respiración periódica (SHRP), maldición de Ondina, y síndrome de Pickwick asociándolo a la obesidad. Actualmente se denomina OSAS (obstructive sleep apnea syndrome) en la bibliografía anglosajona o SAOS (síndrome de apneas obstructivas del sueño) o, simplemente SAS (síndrome de apnea del sueño), que incluye todas las otras enfermedades. No obstante, este documento de consenso recomienda usar el concepto de síndrome de apneas-hipopneas del sueño y sus siglas "SAHS" debido a que: incluye una referencia específica a las hipopneas, las cuales se consideran de importancia creciente, tanto en adultos como en niños; evita el término "obstructiva", lo que permite incluir no sólo éstas, sino también las mixtas y las centrales (muchas de las cuales son realmente obstructivas en origen y por eso desaparecen con presión positiva continua por vía nasal [CPAP]) y, finalmente, estas siglas definen tanto la traducción española de "síndrome de apneas-hipopneas del sueño" como a la anglosajona de "sleep apnea-hipopnea y síndrome", lo que facilita su uso.
Guilleminault et al2 introdujeron en 1976 el término de síndrome de apnea del sueño para definir a los sujetos con apneas obstructivas y excesiva somnolencia durante el día. Una apnea se definió como el cese completo de la señal respiratoria de al menos 10 s de duración. Hay que decir que el criterio de los 10 s fue adoptado por consenso y basado en un grupo de sujetos normales. Sin embargo, tiene algunas limitaciones: no contempla la presencia o ausencia de desaturaciones asociadas y/o arousal electroencefalográficos (microdespertares), por lo que no evalúa el "daño" en términos de intercambio gaseoso o fragmentación del sueño. Por otra parte, es muy posible que mantener una pausa de 10 s no sea lo mismo a los 30 años que a los 80, e incluso podría ser diferente en varones y mujeres. Además, no tiene en cuenta la comorbilidad asociada, como las enfermedades cardíacas y/o respiratorias que reduzcan la reserva de oxígeno o aumenten su consumo, lo que podría condicionar que pausas < 10 s pudieran tener significación patológica. A pesar de estas potenciales limitaciones, el concepto de apnea se ha mantenido hasta la actualidad con la única salvedad que un cese total (línea plana) no suele observarse con los modernos equipos con señales de alta sensibilidad y, en general, se acepta que hay apnea cuando el cese de la señal respiratoria es > 90%.
Kurtz et al3 sugirieron por primera vez el concepto de hipopneas, que posteriormente fue establecido por Block et al4 como una reducción parcial de la señal respiratoria que cursaba con desaturación, y comprobaron que sus repercusiones clínicas eran similares a las de las apneas, por lo que acuñaron el término "síndrome de hipopneas durante el sueño"5. Sin embargo, el consenso en la definición de hipopnea es mucho menos claro que en las apneas y suscita más controversias. La Academia Americana de la Medicina del Sueño6 define una hipopnea como una reducción claramente discernible de la señal respiratoria que cursa con una disminución de la saturación de al menos un 3% y/o un despertar transitorio (arousal) en el electroencefalograma7. Sin embargo, no hay un criterio unánime en su definición y los descensos de la señal del flujo varían del 30 al 90% o cualquier reducción que el observador considere "significativa" o "discernible". Por otra parte, los descensos de la SaO2 oscilan entre el 2 y el 4% según distintos laboratorios. Incluso la definición de microdespertar no es homogénea en muchas unidades de sueño y, lo que es peor, hay una importante variabilidad tanto interobservador como intraobservador a la hora de identificarlos (tabla I).
Otro aspecto muy importante en la caracterización de las hipopneas es el modo en que medimos la ventilación. Así, el neumotacógrafo y la pletismografía corporal (que puede usarse con la cabeza fuera para dejar libre la cavidad oronasal) pueden considerarse los patrones de referencia. Sin embargo, el método más utilizado es el termistor, que registra diferencias de temperatura (aire caliente = espiración, aire frío = inspiración) y, por tanto, no es una medida cuantitativa sino cualitativa. Así, Berg et al8 encontraron una preocupante falta de sensibilidad de los diferentes termistores probados. En el mejor de los casos, mediante la combinación de la pletismografía inductiva y la sonda de presión nasal este autor obtuvo una sensibilidad de 0,86 con una especificidad similar. Otros autores también han encontrado resultados semejantes9. Por supuesto, la inclusión o no de otros parámetros (desaturación o microdespertar) modifica el número total de eventos respiratorios detectados, aunque las diferencias son menores si se usan sistemas fiables para medir la ventilación y umbrales bajos de hipopnea (descensos del 30%), tal como comprobaron Tsai et al10, que encontraron diferencias del 15-32% en el número de sujetos diagnosticados de SAHS dependiendo del punto de corte diagnóstico elegido. En nuestro país se han encontrado resultados similares al comparar el termistor con un neumotacógrafo y, mediante la utilización diferentes definiciones de hipopnea y desaturación, junto con la inclusión o no del microdespertar, se han observado importantes diferencias en el número de sujetos diagnosticados y, sobre todo, en la severidad de su afección11,12. El empleo de un neumotacógrafo clásico, las gafas o la sonda nasales, o los equipos sensibles para detectar la limitación del flujo aéreo, pueden ser elementos útiles para detectar síndromes de hipopneas no diagnosticados.
A pesar de estas limitaciones, este documento de consenso recomienda, como definición más aceptada de hipopnea, la objetivación de una reducción claramente discernible de la señal respiratoria > 30% y < 90%) que cursa con una disminución de la saturación ≥ 3% y/o un microdespertar en el electroencefalograma.
En la tabla II se presenta un resumen de las diferentes definiciones de los eventos respiratorios. Tanto las apneas como las hipopneas pueden ser: obstructivas cuando se acompañan de un aumento del esfuerzo toracoabdominal, centrales si este esfuerzo está ausente o mixtas cuando se produce una combinación de ambos; es frecuente que comiencen por un componente central y terminen con un componente obstructivo. El número de apneas más hipopneas dividido por las horas de sueño es el índice de apnea-hipopnea (IAH). Un IAH > 5-10 se considera anormal. Sin embargo, un IAH anormal no define un SAHS por sí mismo. Recientemente, la Academia Americana de la Medicina del Sueño6 ha definido el SAHS como la presencia de un índice de alteración respiratoria (IAR) anormal, considerado como la suma del IAH y los esfuerzos respiratorios asociados a los microdespertares (ERAM). Un IAR > 5 asociado con síntomas y signos clínicos relevantes se considera diagnóstico de SAHS (tabla I).
Cada una de estas definiciones tiene sus ventajas y sus limitaciones. Los conocimientos actuales sobre esta entidad obligan a referirse a las consecuencias metabólicas e inflamatorias de la enfermedad. Por otra parte, también parece razonable hacer alguna referencia a que el IAH varía con la edad y el sexo, así como definir los límites a partir de los cuales debe considerarse como anormal.
Este documento de consenso define el SAHS como un cuadro de somnolencia excesiva, trastornos cognitivo-conductuales, respiratorios, cardíacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía respiratoria superior durante el sueño. Estos episodios se miden con el IAR. Un IAR ≥ 5 asociado con síntomas relacionados con la enfermedad y no explicados por otras causas confirma el diagnóstico. El IAR se define por el número de apneas, hipopneas y los ERAM por las horas de sueño (tabla II).
Fisiopatología
La fisiopatología del SAHS es compleja y todavía no se conoce bien. El mejor conocimiento de ésta debería ayudarnos a optimar las decisiones sobre la estrategia terapéutica utilizada en cada paciente y a desarrollar nuevas líneas terapéuticas16,17.
La estabilidad en el calibre de la VAS depende de la acción de los músculos dilatadores orofaríngeos y abductores, que normalmente son activados de forma rítmica durante cada inspiración. La VAS es sometida a colapso cuando la fuerza producida por estos músculos, para un área de sección determinada, es sobrepasada por la presión negativa generada por la actividad inspiratoria del diafragma y los músculos intercostales16.
La presión tisular inductora del colapso es la denominada presión crítica de colapso (Pcrit). La VAS normal se caracteriza por una presión crítica negativa. Esta Pcrit es más baja en sujetos normales que en roncadores, y en éstos es más baja que en pacientes con SAHS. El aumento de la Pcrit puede deberse a anomalías anatómicas o a una disminución del tono de los músculos dilatadores18.
Los factores que favorecen el colapso incluyen el estrechamiento de la vía respiratoria superior (factor anatómico), una pérdida excesiva del tono muscular (factor muscular) y el defecto en los reflejos protectores (factor neurológico)19.
Factor anatómico
Los factores que reducen el calibre de la VAS comportan un aumento de la resistencia, con la generación de una presión negativa faríngea durante la inspiración que predispone al colapso. Los factores anatómicos, además, tienen repercusión sobre los otros dos (muscular y neurológico). La micrognatia, por ejemplo, lleva la base de la lengua hacia atrás y ello interfiere en la eficacia muscular del geniogloso. Los individuos obesos, además, suelen tener menores volúmenes pulmonares, especialmente menor capacidad residual funcional, hecho que influye de manera negativa en el tamaño de la vía respiratoria y su estrechamiento16. Asimismo, el depósito graso entre las fibras musculares reduce su capacidad contráctil.
Factor muscular
Los factores musculares desempeñan, asimismo, un papel relevante en la fisiopatología del SAHS. En estudios electromiográficos se ha demostrado una reducción o desaparición de la actividad de los músculos dilatadores durante el sueño, sobre todo en pacientes con SAHS. Por contra, la actividad del diafragma cambia muy poco durante el sueño, lo que provoca un desplazamiento del equilibrio hacia las fuerzas de cierre. Se ha demostrado claramente la presencia de una excesiva distensibilidad, lo que provoca que esta vía sea más colapsable o que precise menos presión negativa para hacerlo16. Los factores de la función muscular de la vía respiratoria superior incluyen una actividad dilatadora muscular anormal y una alteración de la relación contracción diafragma-músculos dilatadores18,20. Los defectos en la respuesta de esta musculatura o la descoordinación entre ella y el diafragma pueden ser causa de SAHS16.
En estudios recientes se ha llegado a la conclusión de que los músculos dilatadores en el SAHS son la diana de fenómenos tróficos adaptativos, inmunohistoquímicos y metabólicos en respuesta a la estimulación21,22. Aunque no hay evidencias de que el sueño afecte a la actividad neuromuscular en SAHS, la desaparición de la hiperactividad compensatoria en vigilia y la reducción de la eficacia de contracción muscular observada en algunos pacientes puede explicar la mayor inestabilidad de VAS característica del SAHS23.
Estos músculos parecen tener una composición histológica adaptada a las contracciones de corta duración, haciéndolos más vulnerables a la fatiga. En apneicos, estos músculos están solicitados continuamente y se ha sugerido que pueden presentar lesiones musculares por este sobresfuerzo24.
Estas alteraciones musculares son las que inducen la realización de intentos terapéuticos modernos mediante estimulación eléctrica del hipogloso o, sobre todo, directamente sobre los músculos linguales (geniogloso), antes durante la noche y últimamente durante el día a modo de entrenamiento muscular25,26.
Factor neurológico
Ya se ha señalado que la supresión de la actividad de los músculos faríngeos en el sueño es fundamental para que en el SAHS se produzca una reducción del calibre de la VAS que la hace más vulnerable al colapso en inspiración. Los factores anatómicos que provocan este estrechamiento predisponen a la apnea, al reducir la presión crítica que es necesaria para el colapso. De la misma manera, los cambios en la estabilidad del sistema de control respiratorio y el descenso del volumen pulmonar en el sueño también pueden desempeñar un papel. Con independencia del papel de estos factores es importante resaltar que, a pesar de que los rasgos de un individuo predispongan al SAHS, la VAS sigue abierta en la vigilia y se cierra sólo durante el sueño. Es decir, el SAHS es una alteración que depende de mecanismos del sueño, ya que sólo ocurre durante éste. Por extensión, incluso en individuos con una VAS estrechada, la enfermedad está causada en último extremo por el impacto de los mecanismos cerebrales del sueño en el proceso de control de los músculos faríngeos, el tono de los cuales es necesario y suficiente para mantener la VAS abierta en la vigilia20.
Muchos estudios indican el papel de los mecanismos reflejos de la VAS en el mantenimiento de la permeabilidad. El mantenimiento de la eficacia de la VAS dependerá de una correcta coordinación de la sincronización y de la intensidad de la musculatura inspiratoria y los músculos dilatadores de las vías respiratorias superior.
Manifestaciones clínicas
Los hallazgos clínicos más importantes se producen en dos ámbitos. Por un lado, las apneas y las hipopneas condicionan una hipoxia intermitente que puede ocasionar la aparición de problemas cardiovasculares, y por el otro, hay una distorsión en la arquitectura del sueño que conduce a hipersomnia diurna, así como a alteraciones cognitivas y psiquiátricas. En general se trata de pacientes obesos --aunque la enfermedad no es exclusiva de éstos-- roncadores con una excesiva somnolencia diurna (ESD) que tiene relevancia clínica. Los factores de riesgo más importantes son: el sexo, con una relación varón/mujer de 1-3/1 en las edades medias, aunque tiende a igualarse con la menopausia y en las edades avanzadas; la obesidad, que puede actuar como una variable de confusión, ya que se ha observado que está relacionada de manera independiente con la aparición de ESD en sujetos sin SAHS13; y finalmente, los factores agravantes, como el consumo de alcohol, el hábito tabáquico y dormir en decúbito supino.
Durante el sueño se repite muchas veces el mismo ciclo: sueño, apnea-hipopnea, cambios gasométricos, despertar transitorio y fin de la apnea-hipopnea. Los microdespertares repetidos causan la fragmentación del sueño, lo que da lugar a la mayoría de las manifestaciones neuropsiquiátricas, como la ESD, los trastornos de la conducta y la personalidad. Los síntomas más frecuentes son: ESD, ronquidos y pausas respiratorias repetidas durante el sueño, observados por el compañero de dormitorio (tabla III). En los casos más severos pueden aparecer lentitud intelectual o dificultad de concentración, cansancio matutino (especialmente en mujeres), cefalea y nicturia. No es infrecuente que estos pacientes hayan tenido accidentes de tráfico o "casi accidentes" debido a la somnolencia durante la conducción de vehículos, presenten hipertensión arterial o tengan antecedentes de cardiopatía coronaria. Con frecuencia presentan una disminución de la libido o impotencia, refieren despertares con sensación asfíctica y el compañero suele relatar con preocupación y de manera detallada los episodios de apneas-hipopneas durante la noche de las que ha sido testigo.
Excesiva somnolencia diurna
El síntoma diurno más importante es la ESD. Es difícil de medir, pero se acepta definirla como la tendencia a dormirse involuntariamente en situaciones inapropiadas. Por ello, la ESD fisiológica del embarazo o la posprandial no se consideran verdadera ESD. Hay muchas formas de medir la ESD, tanto de manera objetiva como subjetiva.
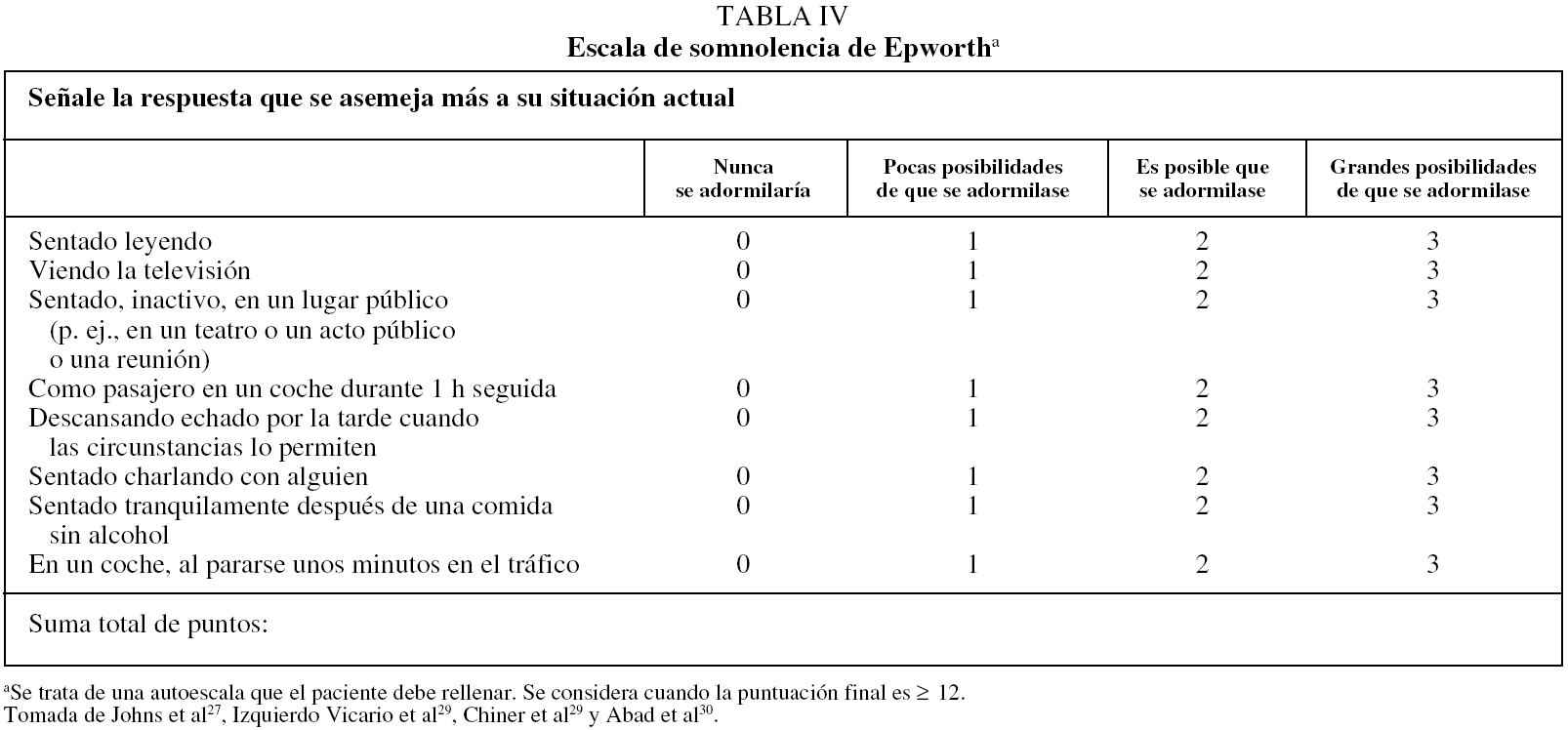
Mediciones subjetivas de la ESD. Una forma sencilla como primera aproximación sería utilizar la escala de Epworth. Se trata de una escala diseñada para ser realizada por el paciente27. Consta de 8 preguntas en las que se le exponen diferentes situaciones y el sujeto debe establecer qué posibilidades tendría de adormilarse. Se puntúa de 0 a 24 (tabla IV) y, aunque en la bibliografía anglosajona se considera anormal cuando es más de 10 puntos, los 2 estudios realizados en la población española28 sugieren que el límite superior de la normalidad podría estar alrededor de 12. Es una escala universalmente aceptada, traducida al castellano y validada en población española28,29. Su reproducibilidad es variable y algunas de sus preguntas pueden presentar variaciones socioculturales. Sin embargo, sirve de ayuda para la aproximación inicial al paciente y su seguimiento30. Dado que es el propio paciente quien la rellena mientras espera la consulta (aunque algunos pacientes pueden necesitar asistencia) y se hace en menos de 5 min, es muy útil disponer de ella cada vez que el paciente acude a consulta. Por otra parte, puede ser completada con una escala de gravedad de la ESD31 (tabla V).
Mediciones objetivas de la ESD
1. Test de latencia múltiple de sueño (TLMS). El TLMS mide el tiempo que tarda el individuo en quedarse dormido (latencia de sueño) cuando se encuentra en unas condiciones favorables y potencialmente inductoras de sueño. Se basa en la asunción de que un paciente con ESD se dormirá con mayor rapidez y que, por tanto, podemos cuantificar la ESD por la rapidez con que alguien cae dormido cuando le proporcionamos esa oportunidad. El TLMS continúa considerándose por muchos autores como el patrón de referencia de todos los métodos objetivos de medición de ESD6,15,32,33. La prueba tiene sus limitaciones y, más que valorar la somnolencia, evalúa la habilidad del sujeto para quedarse dormido en un entorno favorable. Esto implica que no nos informa sobre la capacidad del individuo para permanecer despierto. Para su realización ideal se debe haber realizado una polisomnografía convencional (PSG) nocturna la noche previa con objeto de asegurar un tiempo total de sueño suficiente y vigilar que el TLMS no esté artefactado por un sueño insuficiente; también nos permite aproximarnos a la posible etiología de la ESD. Por otra parte, se considera muy útil que, durante las 2 semanas previas a la realización de la prueba, los pacientes hayan rellenado un diario con sus hábitos de sueño y hayan registrado la hora a la que se acuestan y se levantan, tanto en el período nocturno como en las posibles siestas durante el día. Si se puede, es mejor retirar con antelación los fármacos que puedan variar la latencia de sueño o influir en el sueño REM. Sin embargo, no siempre es posible si el paciente los toma de forma crónica.
Tras la realización de la PSG comienza el TLMS bajo unas condiciones determinadas34. Debe llevarse a cabo en una habitación tranquila y oscura. La primera siesta se realiza de 1,5 a 2 h después de que el paciente haya finalizado el período nocturno. Posteriormente se realiza el resto, con un intervalo de 2 h entre sí. Se realizarán 4 siestas, que se completan con una quinta si el paciente hace una entrada en la fase REM en las cuatro primeras. Si, por el contrario, hace 2 o más fases REM no precisará la quinta siesta. Antes de cada siesta los pasos son los siguientes: a) no fumar los 30 min previos; b) no realizar una actividad física intensa los 15 min previos; c) acomodarse en la habitación 10 min antes del inicio; d) en los últimos 5 min, con el paciente acostado, conectaremos los electrodos y realizaremos la calibración, y e) finalmente, en los últimos 5 s se le pide que cierre los ojos e intente dormir, apagando la luz. El técnico de sueño a cargo del TLMS debe tener experiencia en la estadificación del sueño para decidir el momento de la finalización de cada prueba. Ésta debe terminar a los 20 min de registro si la persona no se ha dormido, o a los 15 min tras el inicio del sueño.
Deberá registrarse la latencia al inicio de sueño en cada una de las siestas. Definimos latencia de sueño como el tiempo transcurrido entre el momento en que se apaga la luz hasta la primera época de cualquier fase de sueño. La latencia de sueño se considerará igual a 20 min si el paciente no se duerme. La media de todas las latencias es la latencia media al inicio del sueño. Una latencia media < 5 min se considerará patológica y compatible con una ESD de grado severo. Las latencias > 10 min se pueden observar en controles sanos y se consideran normales. Los casos intermedios tienen un significado incierto. También deberá registrarse la latencia a la primera época de la fase REM, si ésta se produce. Se considera que ha habido un comienzo de REM (SOREM) cuando ésta es < 15 min. Si en las primeras 4 siestas se produce más de 1 SOREM o bien no se produce ninguno, terminaremos la prueba. Si se registra sólo 1 hay que realizar una quinta siesta para dar al sujeto la oportunidad de realizar el segundo SOREM. La presencia de 2 o más SOREM junto con una latencia media al inicio del sueño corta apoya fuertemente la sospecha clínica de narcolepsia. Sin embargo, deben tenerse en cuenta otras situaciones en las que se puede encontrar más de 1 SOREM como, por ejemplo, el SAHS o la retirada brusca de fármacos supresores de REM.
El TLMS es una técnica cara por el consumo en recursos humanos. Una forma de hacerlo más eficiente es realizar más de un TLMS simultáneo, si se dispone de las condiciones adecuadas.
El TLMS no debe ser indicado de manera sistemática en el estudio de la mayoría de los pacientes con sospecha de SAHS. Las indicaciones aceptadas para su realización son las siguientes15,35:
Claramente indicado: a) cuando la ESD interfiere con la realización de las actividades cotidianas y la clínica no sugiere un SAHS, y b) cuando hay sospecha de narcolepsia para demostrar períodos de sueño REM precoz.
Puede estar indicado, dependiendo de la justificación clínica: a) cuando la ESD interfiere con la realización de las actividades cotidianas y la clínica sugiere un SAHS pero se necesita una medida objetiva del grado de somnolencia, y b) en estudios de seguimiento, para evaluar la respuesta al tratamiento cuando se ha establecido previamente el diagnóstico de somnolencia moderada-severa.
No está indicado de forma sistemática: a) cuando la ESD se debe a una restricción voluntaria de sueño, y b) cuando la ESD no llega a interferir con la realización de las actividades cotidianas.
2. Test de mantenimiento de la vigilancia (TMV). Es una variante del TLMS que cuantifica la habilidad del sujeto para mantener la vigilia mediante la medición de su capacidad para mantenerse despierto en unas condiciones de baja estimulación36,37. Las variables neurofisiológicas que se registran son las mismas que en el TLMS y que en una PSG. También es necesario que el técnico de sueño tenga conocimientos y experiencia en registros de PSG.
Se realizan 4 pruebas con un intervalo de 2 h entre sí, y se instruye al sujeto para que permanezca cómodamente sentado en una cama situada en una habitación tranquila, oscura y con una temperatura agradable e intente permanecer despierto, pero sin realizar medidas extraordinarias para conseguirlo. Daremos por finalizada la prueba cuando el paciente se duerma o a los 20 (o 40) min del inicio si no se registra sueño. El TMV está menos estandarizado que el TLMS y, a pesar de que sería la prueba ideal, no ha conseguido sustituir al TLMS. En un reciente estudio multicéntrico se recomienda el uso del TMV con 4 pruebas de 20 min de duración y definiendo el inicio del sueño como la primera época de cualquier fase de sueño. Con esta metodología, se considera alterado cuando la latencia media al sueño es < 11 min.
Los estudios en los que se han comparado el TLMS y el TMV muestran que su correlación, aunque significativa, no es tan alta como cabría esperar: se encuentran pacientes con resultado anormal en el TLMS que, sin embargo, tienen resultados normales en el TMV, y viceversa. Por ello, se ha sugerido que estas pruebas, aunque similares, miden cosas diferentes y pueden ser complementarias. Parece que el TMV es más sensible para medir los cambios en la somnolencia tras la instauración de un tratamiento y puede ajustarse más a la realidad, al valorar el impacto de la ESD en situaciones en las que es fundamental mantenerse despierto, como conducir o trabajar.
3. Test OSLER (Oxford Sleep Resistance). Es una variante del TMV que mide la habilidad para mantener la vigilia en condiciones de baja estimulación, pero es más simple, ya que no se monitoriza ninguna variable neurofisiológica y, por tanto, puede realizarse por personal no experto.
Se acomoda al sujeto sentado en una habitación aislada y oscura, y se le pide que presione un botón en respuesta a un destello de luz (de 1 s de duración) que se enciende automáticamente cada 3 s. La latencia al sueño se calcula automáticamente y está definida como la falta de respuesta durante 21 s (7 destellos luminosos). El botón que presiona el paciente es rígido y no se deprime. Es decir, no aporta ninguna información al paciente de si se ha pulsado o no, con objeto de evitar un mecanismo de feedback. Es importante reseñar que en esta prueba no se mide el tiempo que el paciente tarda en apretar el botón sino únicamente si lo aprieta o no. Por tanto, no mide la velocidad de reacción sino la capacidad del sujeto para permanecer alerta.
Se realizan 4 pruebas a intervalos de 2 h que concluyen al inicio del sueño o, en el caso de que el sueño no se alcance, a los 40 min del inicio de la prueba. El test OSLER ha permitido diferenciar a pacientes con apnea del sueño de sujetos normales. Tiene la ventaja de que la latencia al sueño está definida automáticamente, por lo que no se precisa personal experimentado y es más fácil de administrar y estandarizar. Algunos lo consideran una alternativa clara al TLMS38.
4. Test de la vigilancia motriz (PVT). Mide el tiempo de reacción del sujeto en respuesta a un estímulo visual. Evalúa la capacidad para mantener la atención, la cual se encuentra influida por la ESD. Se le pide al sujeto que presione un botón tan rápido como pueda en respuesta a una luz que aparece a intervalos de entre 2 y 10 s. El período entre esos dos eventos (tiempo de reacción) es grabado en un ordenador, calculándose posteriormente diversos parámetros: el número de lapsos (tiempo reacción > 500 ms), tiempo de reacción medio, los tiempos de reacción más lentos y los tiempos más rápidos. El test tiene una duración de 10 min. Esta prueba, al contrario que el test OSLER, mide el tiempo de reacción. Aquí la velocidad de la respuesta es lo que cuenta. Los estudios realizados muestran que los sujetos a los que se les reduce el tiempo de sueño tienen un empeoramiento de todos estos parámetros, y hay varios modelos en el mercado39.
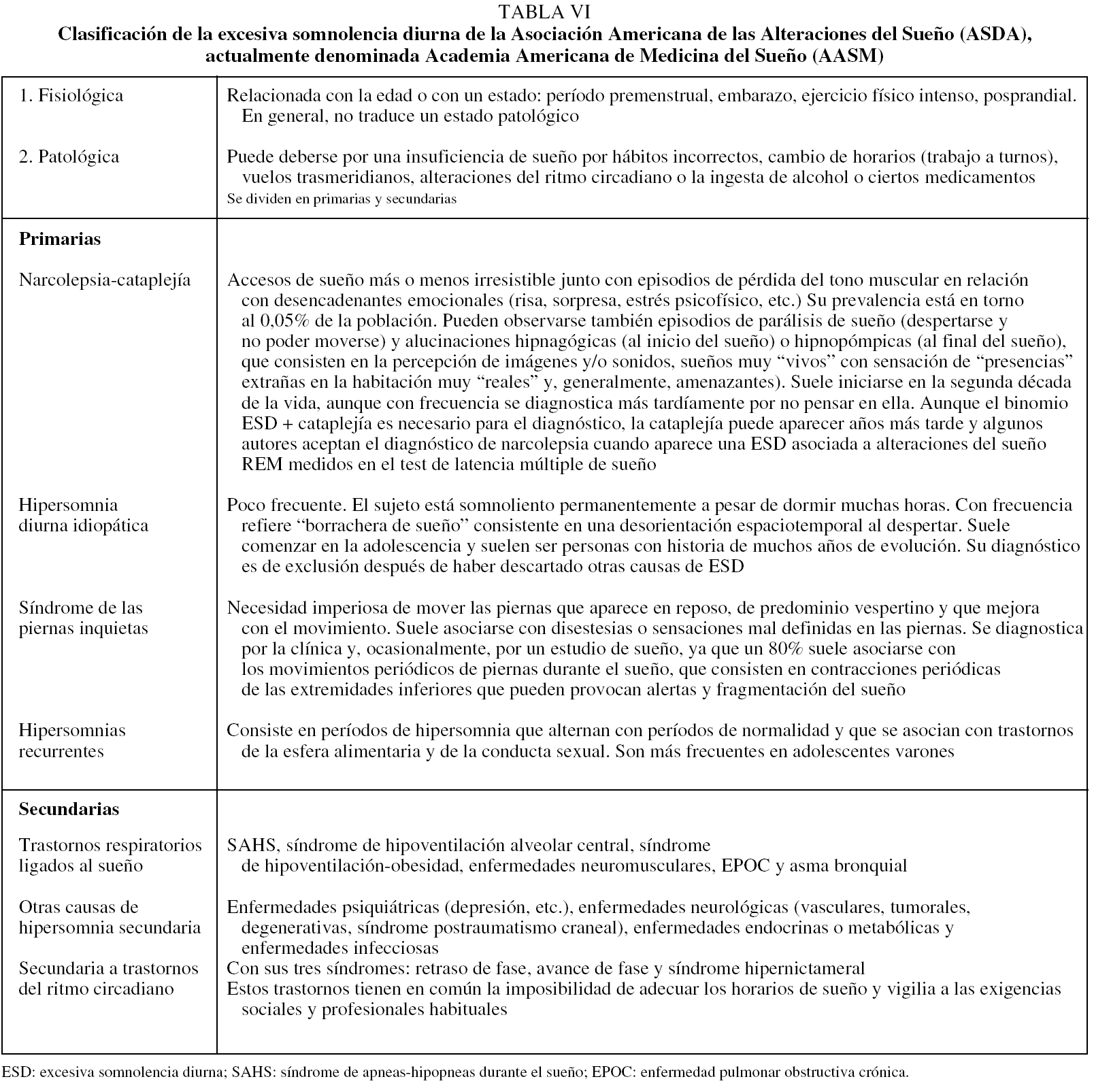
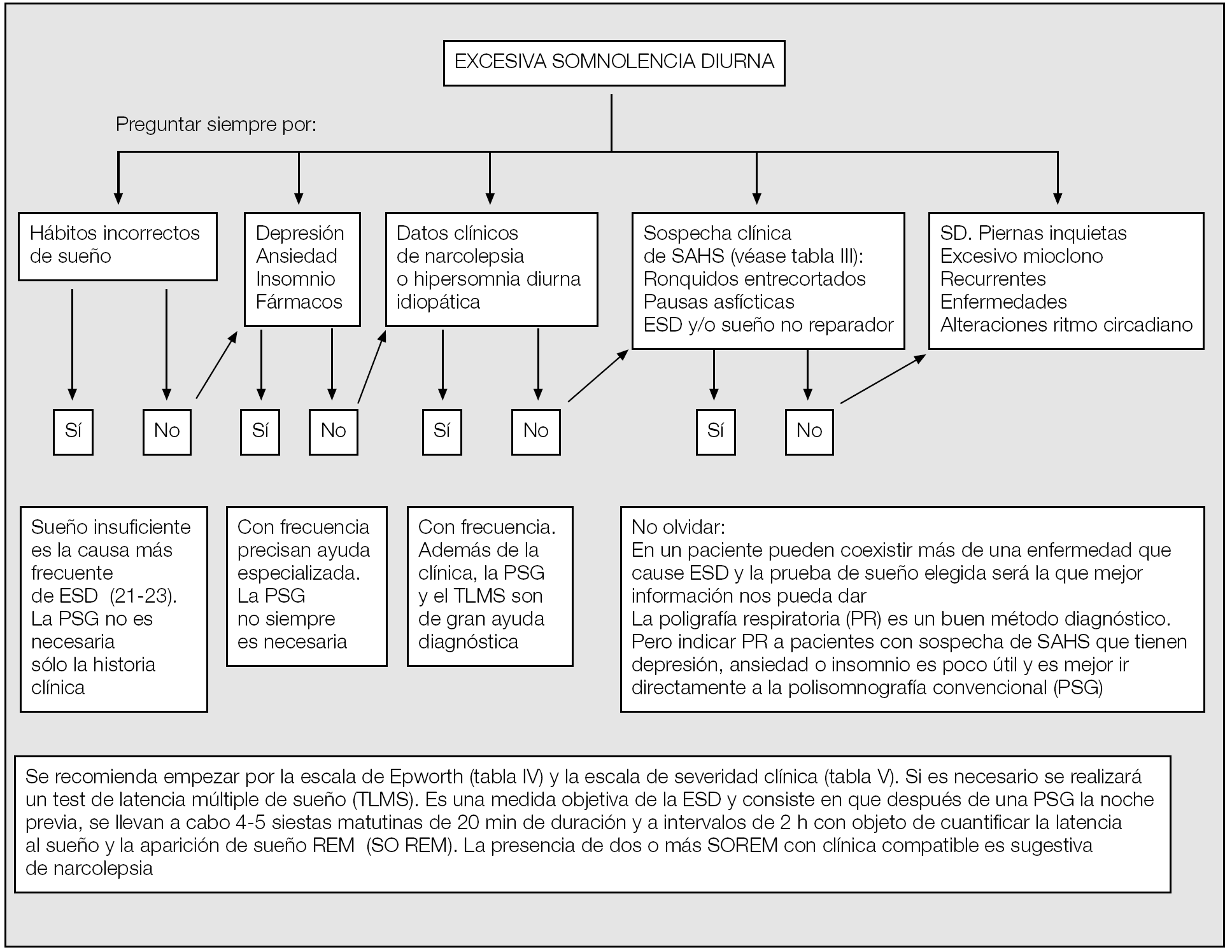
Debe tenerse en cuenta que la prevalencia de la ESD es muy elevada en la comunidad y puede ser secundaria a múltiples causas, como el sueño insuficiente, el trabajo a turnos, el empleo de sustancias o fármacos con efecto sedante, las enfermedades del sistema nervioso central, las alteraciones del ritmo circadiano o el sueño de mala calidad secundario a enfermedades médicas. Por otra parte, la ESD puede ser secundaria a trastornos primarios del sueño que, aunque menos frecuentes, es necesario conocer para hacer el diagnóstico diferencial, como es el caso de la narcolepsia, la hipersomnia diurna idiopática, las hipersomnias recurrentes y, más raramente, el síndrome de piernas inquietas. Incluso, no es infrecuente que haya un solapamiento y que la ESD sea la manifestación final de más de un problema. Por ello, deberemos descartar cuidadosamente otras causas de excesiva somnolencia antes de atribuirla a la presencia de apneas e hipopneas y considerar que el sujeto tiene un SAHS. En la tabla VI se presenta el diagnóstico diferencial de la ESD y en la figura 1 se muestra un algoritmo de actuación ante un paciente con ESD. Siempre deberemos tener en cuenta que el síndrome de sueño insuficiente es la causa más frecuente de ESD y que puede afectar a más del 20% de la población40-44.
Fig. 1. Algoritmo diagnóstico de un paciente con excesiva somnolencia durna (ESD).
Los síntomas nocturnos más importantes son los ronquidos y las pausas respiratorias repetidas durante el sueño, observados por el compañero de dormitorio y/o los que conviven con el paciente. El ronquido no es fácil de definir, aunque suele identificarse con facilidad. El ronquido más frecuentemente asociado al SAHS es el que se acompaña de ruidos asfícticos y sonidos entrecortados. Las pausas respiratorias se definen como las apneas o hipopneas observadas por el compañero, que suelen terminar con sonidos asfícticos e incluso con movimientos de todo el cuerpo como una respuesta del organismo en su intento por salir de la apnea-hipopnea. Paradójicamente, aunque se ha encontrado una asociación clara entre el IAH, los ronquidos y las apneas observadas, esta asociación no ha sido evidente entre el IAH y la ESD, lo que implica que hay otros factores intermedios que no se conocen bien43.
Por desgracia, no hay ningún síntoma específico del SAHS y los 3 síntomas guía, y especialmente la ESD, son muy frecuentes, tanto entre la población general como en pacientes con sospecha de SAHS40-44. Aunque se han propuesto varios modelos diagnósticos predictivos con la combinación de síntomas de SAHS y variables antropométricas45-48, no se ha obtenido una precisión diagnóstica suficiente para confirmar el SAHS, de manera que su uso sistemático no es recomendable. Sin embargo, la clínica es la primera aproximación al diagnóstico y la presencia de sintomatología relevante, uno de los pilares básicos para indicar tratamiento. Por tanto, una buena historia clínica, sola o combinada con modelos de predicción, será de gran ayuda para estimar el grado de sospecha diagnóstica que permita establecer el tipo de prueba de sueño que se realizará. Esto permitirá también dar prioridad a los pacientes en lista de espera con alta sospecha de enfermedad y no efectuar estudios en casos de baja probabilidad clínica.
Este documento de consenso considera que cuando una persona refiere ronquidos entrecortados, con pausas asfícticas, ESD o sensación de sueño no reparador no atribuible a otras causas, nos debe hacer sospechar un SAHS y es indicación de la realización de una prueba de sueño.
Sin embargo, también hay otras alteraciones que sugieren la presencia de un SAHS no diagnosticado. Así, en 1997, el Sexto informe del Comité Nacional Americano para la Prevención, Detección, Evaluación y Tratamiento de la Hipertensión Arterial (HTA) reconoció por primera vez la importancia de descartar el SAHS como un factor que contribuye a la HTA resistente49 y, más recientemente, en su Séptimo informe de 2003, este Comité ha incluido el SAHS como la primera en la lista de causas identificables de HTA50. Por tanto, el SAHS siempre debe considerarse en el diagnóstico diferencial de la HTA refractaria y la HTA de reciente diagnóstico, especialmente en los pacientes cuya presión arterial (PA) no se reduce en el período nocturno (no dippers)51.
Por otra parte, debemos recordar la relación entre la presencia de determinadas bradiarritmias nocturnas y el SAHS, especialmente de grado severo. En la actualidad, la coincidencia de ambas enfermedades no plantea ningún cambio clínico de actuación y se debe proceder ante cada una por separado. No obstante, debemos descartar la presencia de SAHS en sujetos de riesgo ( obesidad central, varones y de edades medias)51 que, al ser estudiados para valorar la indicación de estimulación cardíaca permanente, presenten bradiarritmias en los registros electrocardiográficos Holter, en especial si se presentan exclusivamente en horas de sueño o son asintomáticas52.
Asimismo, ante un paciente con un episodio cardiovascular o cerebrovascular agudo debe investigarse en la anamnesis la presencia de un SAHS y su posible papel como un factor agravante y/o desencadenante del episodio. De hecho, en la actualidad se puede establecer una relación entre el SAHS y determinados factores que contribuyen a alterar la función endotelial. Teniendo en cuenta que estamos ante una entidad a la que se puede aplicar un tratamiento correctivo eficaz, tiene un especial interés clínico descartar la presencia de esta enfermedad para contemplarla, dentro del tratamiento multidisciplinario preventivo de la enfermedad arteriosclerótica51-53.
El SAHS se ha relacionado con una mayor incidencia de enfermedad arteriosclerótica coronaria. La hipoxia y su principal consecuencia vascular, la hipertensión sistémica, aumentan, a través de un incremento en la disfunción endotelial, el riesgo de enfermedad coronaria en los SAHS graves. También se ha establecido una relación entre SAHS grave y miocardiopatía dilatada idiopática. Las alteraciones de oxigenación y sus consecuencias vasculares y sobre la poscarga pueden constituir un factor de riesgo definitivo en la aparición de afección miocárdica y en la progresión de la insuficiencia cardíaca congestiva. De hecho, la alteración de la estructura del sueño es claramente más frecuente en pacientes con miocardiopatía dilatada avanzada, y la congestión pulmonar y el bajo gasto cerebral podrían ser dos importantes condicionantes para presentar datos significativos de SAHS. De forma complementaria, el SAHS se ha asociado con arritmias rápidas auriculares en relación con un incremento en la presión telediastólica ventricular. En el SAHS podemos encontrar esta situación en pacientes con una presión auricular izquierda elevada por presentar, tanto como factor coadyuvante del SAHS o como efecto, un grado avanzado de miocardiopatía ventricular izquierda. La existencia de cor pulmonale subsiguiente a la hipertensión arterial pulmonar también se relacionará con la presencia de taquiarritmias auriculares. El tratamiento específico de esta enfermedad será fundamentalmente el control de la situación desencadenante. En cuanto a la incidencia de bradiarritmias, sobre todo nocturnas, en el SAHS es muy alta. Son en su mayoría arritmias neuromediadas a través de un intenso reflejo vagal cardioinhibidor que se han relacionado de forma directa con las desaturaciones nocturnas.
En resumen:
1. Deberemos considerar la relación directa entre HTA y SAHS en casos refractarios, con datos de sospecha diagnóstica de SAHS y que se comporten como no dipper. El tratamiento con CPAP puede ser útil en estos pacientes.
2. El SAHS debe considerarse como un factor de riesgo más que debe ser tratado en pacientes con enfermedad coronaria y sospecha clínica. Igualmente, debemos considerar la presencia clínica de enfermedad coronaria en pacientes con SAHS con mayor motivo que en la población general al evaluar los factores de riesgo coronario.
3. Los pacientes con miocardiopatía dilatada con criterios clínicos de sospecha de SAHS deben estudiarse mediante poligrafía nocturna ya que su enfermedad cardíaca puede responder positivamente al tratamiento de su SAHS.
4. La presencia de taquiarritmias en pacientes con SAHS debe obligarnos a investigar la existencia de otras enfermedades desencadenantes y dirigir el tratamiento hacia su control.
5. La presencia de bradiarritmias en los pacientes con SAHS no es una indicación de estimulación cardíaca permanente en la actualidad. Los pacientes con indicación de estimulación cardíaca que presenten un SAHS podrían beneficiarse de la estimulación nocturna a frecuencias superiores que su frecuencia media basal, en especial si registramos mayoritariamente apneas centrales.
Finalmente, aunque la obesidad, la HTA o el ronquido aislados no constituyen, en principio, una indicación para la realización de una prueba de sueño, especialmente si no se encuentran asociados a otros factores de riesgo, en estos pacientes siempre debe interrogarse sobre la presencia de síntomas "gatillo" (ronquidos entrecortados y/o pausas asfícticas y/o ESD y/o sueño no reparador), dado que en ellos la prevalencia de SAHS es mucho más elevada que entre la población general. En cuanto a la ESD, no debemos olvidar que la causa más frecuente es la insuficiencia de sueño52, que podría definirse cuando el número de horas de sueño durante la semana laboral es < 2 h que las horas de sueño durante el tiempo de ocio53.
Exploración del paciente con sospecha clínica de SAHS
Exploración de la vía respiratoria superior
La exploración otorrinolaringológica es importante en una correcta evaluación del paciente a pesar de que, muchas veces, al igual que sucede con la clínica, no se relacione su alteración anatómica con la gravedad del SAHS54. Mayer-Brix et al55 publicaron en 1989 un estudio interesante en el que 336 pacientes con clínica de SAHS fueron referidos al otorrinolaringólogo antes de practicarles la PSG. De ellos, 95 (30%) mostraron alteraciones de la región no sospechadas en un examen visual. Las más frecuentes fueron desviaciones septales, poliposis e hipertrofias adenoideas. Por tanto, estos autores recomiendan que se realice esta exploración antes de iniciar el tratamiento. Estas afirmaciones pueden ser especialmente relevantes en pacientes no obesos, en los que las alteraciones anatómicas destacan más como condicionantes de alteraciones respiratorias durante el sueño56.
La exploración anatómica de la VAS ayuda a comprender la fisiopatología y también a valorar otras opciones terapéuticas, además de la aplicación de la CPAP. Se conseguirá un estudio del caso individualizado y, por tanto, una planificación terapéutica mucho más correcta57. Esta exploración anatómica puede, además, prever posibles malas adaptaciones futuras a la utilización del CPAP. En algunos casos, los problemas de adaptación a la CPAP pueden reducir su cumplimiento, y bien pueden estar generados por alteraciones anatómicas, en especial nasales58.
El primer paso es el examen visual del paciente, en el que se valorarán el morfotipo (p. ej., obesidad, cuello corto) y la constitución facial, especialmente las discordancias maxilomandibulares, las malas mordidas y las alteraciones mandibulares.
En el gabinete otorrinolaringológico, la exploración instrumental debe seguir con una exploración nasal anatómica con rinoscopia anterior y endoscopia nasal que alcance explorar ambas fosas nasales y la rinofaringe. Debemos explorar especialmente la presencia de alteraciones septales y turbinales, y descartar la presencia de tumoraciones o poliposis. En la rinofaringe o el cavum evaluaremos la posible ocupación de esta zona por masas como, por ejemplo, una hipertrofia de las vegetaciones adenoideas. La exploración oral y orofaríngea debe buscar, además de las ya mencionadas alteraciones maxilomandibulares, el volumen lingual en relación con la cavidad, la posible presencia de hipertrofia amigdalar y, finalmente, el aumento de volumen de paladar blando, su posición en relación con la pared posterior o la presencia de membranas que incrementen su superficie.
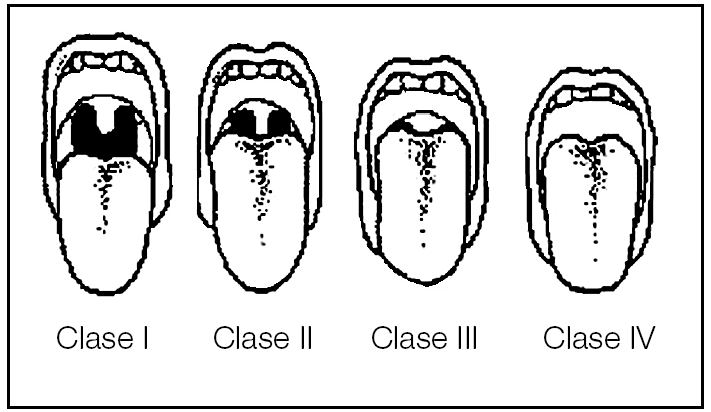
En esta fase pueden ser útiles dos exploraciones comunes. La primera es la laringoscopia indirecta con el clásico espejillo de laringe, que permite valorar la amplitud de visión del espacio retrolingual. La segunda exploración se realiza simplemente con el paciente en posición sentada y máxima apertura oral sin fonar. Evalúa en cuatro grados de la capacidad de visión que se tiene de la orofaringe y que utilizan los anestesistas para prever la dificultad de intubación (clasificación de Mallampati)59:
Clase I: pueden verse el paladar blando, las fauces, la úvula y los pilares amigdalares.
Clase II: pueden verse el paladar blando, las fauces y la úvula parcialmente. La úvula contacta con la base de la lengua.
Clase III: pueden verse el paladar blando y la base de la úvula.
Clase IV: puede verse únicamente paladar duro y el resto queda fuera de visión.
Finalmente es imprescindible la exploración endoscopica de la VAS mediante endoscopio flexible. Los estudios con endoscopia de la VAS han sido también muy utilizados para la evaluación de esta región en los pacientes con SAHS, con la finalidad de descubrir el lugar del colapso60,61. El problema siempre ha residido en el hecho de que es una exploración que se realiza en condiciones diferentes de aquellas en las que se desarrolla la enfermedad (en vigilia y con el paciente sentado). Se han intentado estudios endoscópicos durante el sueño, haciendo desconexiones bruscas de la CPAP y observando el comportamiento de la luz de la VAS, en un intento de que resultara útil para prever los resultados de una eventual cirugía. También se han desarrollado estudios de endoscopia durante el día y asociada con PSG con la utilización de sedantes. En este sentido, parecen más interesantes los estudios endoscópicos destinados a evaluar la forma faríngea antes y después de colocar una prótesis de avance maxilar60.
También se ha utilizado mucho la maniobra de Müller en un intento de simular el cierre faríngeo durante el sueño (esfuerzo inspiratorio contra la boca y la nariz cerradas) y observarlo mediante endoscopia60. Esta prueba no ha sido nunca validada. Además, esta maniobra no evalúa de forma objetiva la cantidad de esfuerzo inspiratorio que se realiza. Tampoco evalúa la actividad muscular durante la prueba. Este hecho es crucial, ya que se ha demostrado un aumento de la actividad electromiográfica de los músculos de la VAS en respuesta a la presión negativa que tiene tendencia a colapsarla. Este reflejo, además, puede estar claramente influido por el hecho de estar despierto. Por todo ello, esta prueba no parece demostrar, como algunos habían previsto, el éxito o no de determinadas intervenciones quirúrgicas.
De forma ideal, la exploración de la VAS hasta aquí descrita (rinoscopia anterior, orofaringoscopia, exploración de la cavidad oral, laringoscopia indirecta y endoscopia nasofaringolaríngea, examen visual de morfotipo y discrepancias maxilomandibulares) debería ser realizada por el especialista en otorrinolaringología antes de cualquier planteamiento terapéutico; sin embargo, esta aproximación es evidente que estará condicionada por los problemas de disponibilidad de cada centro.
Se han desarrollado muchos medios diagnósticos complementarios de la localización del factor anatómico y, entre ellos, tienen un papel destacado los radiológicos. No podemos olvidar su importante papel para estudiar los mecanismos, la patogenia y la biomecánica de la VAS en el SAHS. Estas exploraciones radiológicas pueden ser especialmente útiles antes de realizar tratamientos quirúrgicos, ya que podrían predecir sus posibilidades de éxito y planificar estrategias de seguimiento62. Por tanto, hoy por hoy no pueden considerarse exploraciones que ayuden al diagnóstico del SAHS ni a definir su gravedad y, por tanto, no podemos considerar que deban realizarse sistemáticamente en todos los casos con sospecha clínica de SAHS. Como bien señalaba Schwab57 en 2001, las indicaciones clínicas de imagen de VAS evolucionan según las necesidades en los pacientes tratados con cirugía o prótesis orales.
La cefalometría ha sido muy empleada en ortodoncia y hay múltiples índices de normalidad para todas las edades. Ha sido ampliamente utilizada para evaluar las estructuras óseas y las partes blandas en pacientes con enfermedades del sueño. Las anomalías más importantes incluyen el estrechamiento del espacio aéreo posterior, el paladar blando hipertrófico y el posicionamiento inferior del hioides, la retroposición mandibular y un ángulo nasion-sella-basion pequeño. También se ha sugerido que la lengua es demasiado grande respecto al contenedor esquelético. Aunque estos datos son interesantes, su valor predictivo en pacientes con SAHS es bajo. Incluso en pacientes que reciben uvulopalatoplastias, los datos obtenidos no son útiles para predecir el éxito o el fracaso de la cirugía60.
Estas deficiencias se compensan parcialmente por el hecho de que es barata, irradia poco y es reproducible. Quizá la cefalometría aporta menos resultado del esperado por que únicamente ofrece datos bidimensionales de un problema que es tridimensional y donde el principal problema se sitúa en un plano transversal que la cefalometría no puede evaluar60.
La tomografía computarizada (TC) permite una evaluación muy precisa de la VAS y ha sido validada para medir el área de sección faríngea. Las modernas tecnologías permiten realizar reconstrucciones tridimensionales, imágenes virtuales y estudios dinámicos. Se han hecho estudios dinámicos de faringe durante la respiración pausada en pacientes sanos y con SAHS, incluidos los efectos de la postura60.
Se han hecho estudios mediante cine-TC en sujetos normales y pacientes con SAHS y se ha observado que la VAS se expande durante la espiración y permanece estable en la inspiración. Además, la VAS tiene un diámetro menor en pacientes con SAHS y los cambios más importantes se observan los diámetros laterales. La VAS es más distensible en los enfermos con SAHS que en los sanos57.
A pesar de que los estudios dinámicos con TC han ayudado a entender la dinámica de la fisiopatología, se hace difícil imaginar su aplicación sistemática en todos los pacientes con sospecha de SAHS en la práctica diaria60.
La resonancia magnética (RNM) aporta, al igual que la TC, una imagen tridimensional de la VAS. Además, nos da una idea no sólo del contenido de tejido graso, sino también del contenido acuoso.
Se ha demostrado que los contenidos grasos están aumentados en pacientes con SAHS y que se localizan lateralmente. También se ha observado que el volumen de grasa alrededor de la faringe se correlaciona con la gravedad del SAHS (índice de apnea/hipopnea)60,62.
La forma de la faringe permite distinguir mejor que el área de sección a los pacientes con SAHS y a los roncadores de los sanos en vigilia: el área de sección en los pacientes sanos es elíptica con el eje mayor transversal, mientras que en los pacientes roncadores y con SAHS, la faringe adopta una forma circular o elíptica pero con el eje mayor sagital, incluso aunque el área de sección no difiera entre los 3 grupos. Ello es compatible con el depósito graso en las paredes laterales, que reducen el diámetro lateral compensado por un aumento en vigilia de la actividad de los músculos dilatadores en la dirección anteroposterior60.
También se ha demostrado que el efecto de la CPAP aumenta este diámetro lateral al reducir el grosor de las paredes laterales faríngeas, y que reduce el edema (contenido acuoso de las paredes faríngeas)60.
No podemos dejar de mencionar las exploraciones de la nariz, tanto de índole puramente funcional, como la rinomanometría, como de cariz más anatómico como la rinometría acústica. Este órgano es el inicio del sistema respiratorio, genera la mayoría de las resistencias de esta vía y es el causante de la generación de flujos y presiones fundamentales para el aparato respiratorio. Los estudios funcionales y anatómicos de la nariz deben ser muy tenidos en cuenta en la evaluación del SAOS.
Finalmente, hay otros métodos de exploración, muchos de ellos desarrollados por especialistas en la VAS y que todavía no han podido introducirse en la práctica diaria. Hoy por hoy, son claramente útiles para los estudios básicos del funcionamiento y la fisiopatología de la VAS en la roncopatía crónica y la apnea del sueño. Hablamos de la ecografía por reflexión acústica, la medición de las presiones diferenciales en la VAS y los estudios con manometría y electromiografía de esta región63.
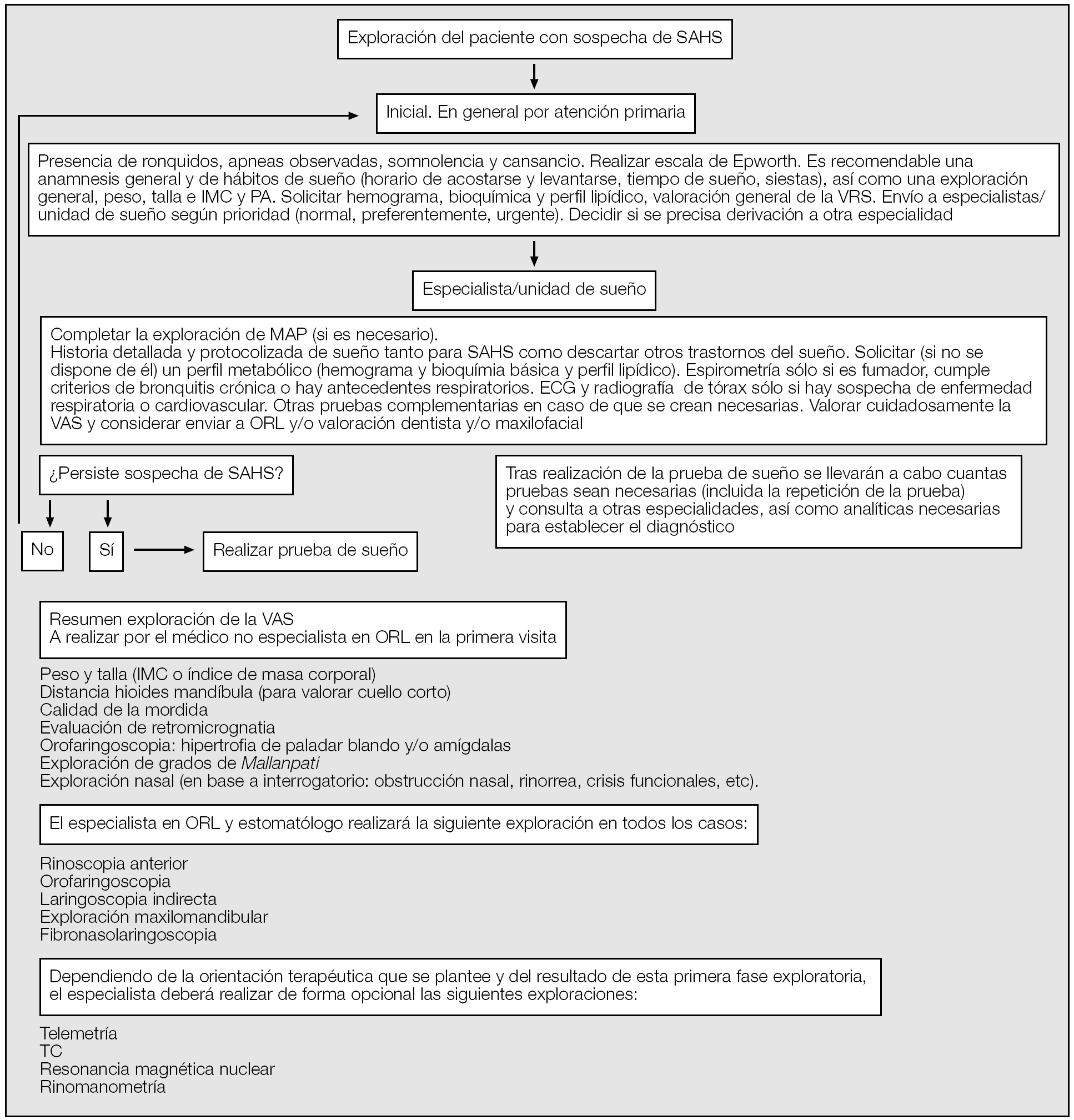
En la figura 2 se resume una algoritmo de la exploración de la VAS en los pacientes con sospecha clínica de SAHS.
Fig. 2. Algoritmo en la exploración del paciente con sospecha clínica de SAHS. IMC: índice de masa corporal; PA: presión arterial; VAS: vía respiratoria superior; SAHS: síndrome de apneas-hipopneas del sueño, ECG: electrocardiograma; TC: tomografía computarizada.
Esquema de exploración básica para el no especialista ORL
Peso y talla e índice de masa corporal (IMC)
El peso se realizará con la persona descalza y con la ropa puesta, pero quitándose la ropa pesada (abrigo, chaqueta, etc.). La talla se medirá en metros con dos decimales y con el sujeto sin calzado. El IMC se calcula dividiendo el peso en kg entre la talla en metros al cuadrado y se suele expresar con dos decimales redondeando al primer par. Por ejemplo, un sujeto que pesa 90 kg y mide 1,87 m tendrá un IMC de:
1,87 x 1,87 = 3,50
IMC = 90/3,50 = 25,71
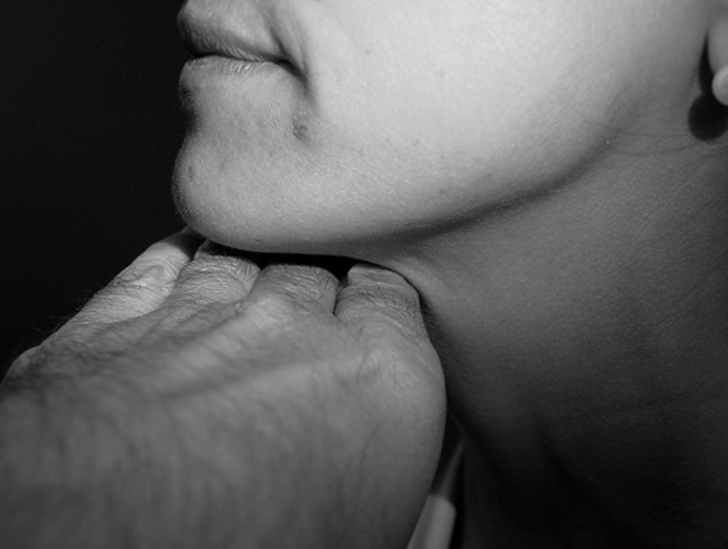
Distancia hioides-mandíbula (para valorar el cuello corto)
Una sencilla maniobra que permite observar si estamos en presencia de un cuello corto consiste en colocar los últimos 4 dedos de la mano del explorador (siempre que sea proporcional al paciente explorado) con la palma hacia abajo desde la zona de hiodes hasta mentón. Si estos 4 dedos sobresalen en relación con el mentón del paciente, de forma evidente podemos sospechar una distancia hioides-mentón corta y, por tanto, un cuello corto.
Calidad de la mordida
Boca cerrada en posición de mordida y separación de los labios que permita ver claramente la posición de ambas arcadas dentarias en contacto.
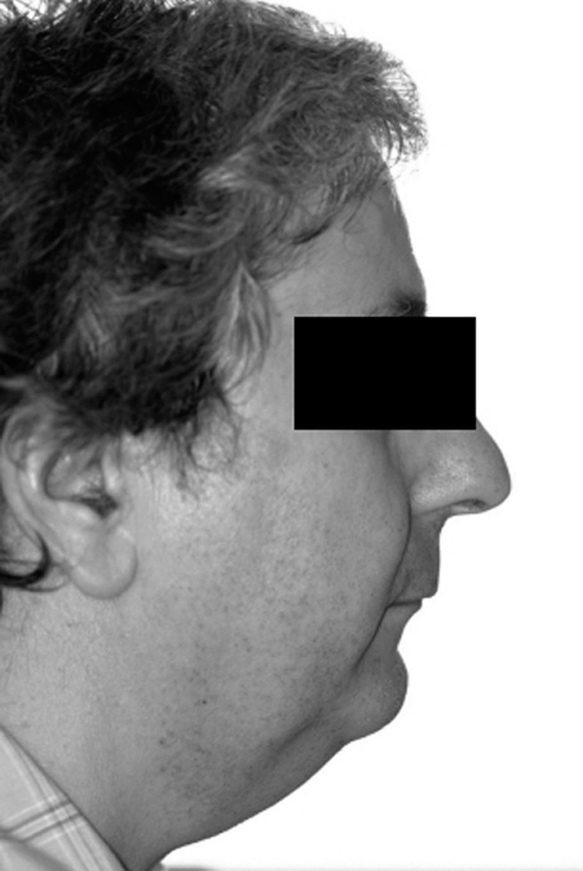
Evaluación de retrognatia-micrognatia
Se trata de una exploración aproximativa que deberá confirmarse ulteriormente por el especialista. La micrognatia se valora observando la facies del paciente y evaluando la arcada mandibular en relación al volumen facial.
Para valorar la retrognatia se coloca al paciente de perfil y se valora de forma aproximada la posición del mentón en relación con la línea vertical del maxilar.
Orofaringoscopia: hipertrofia de paladar blando y/o amígdalas
La exploración oral y orofaríngea debe buscar el volumen lingual en relación con la cavidad, la posible presencia de hipertrofia amigdalar y, finalmente, el aumento de volumen de paladar blando, su posición en relación con la pared posterior o la presencia de membranas que incrementen su superficie.
Para esta exploración se debe utilizar una luz directa sobre la región, mantener al paciente en la situación más basal posible con respiración pausada por boca, con la lengua dentro de la cavidad y realizando una presión suave con un depresor en la mitad anterior de la lengua.
Exploración de los grados de Mallanpati
Se realiza con el paciente en posición sentada, buena iluminación de la cavidad oral y máxima apertura oral con el paciente sin fonar.
Clase I: pueden verse el paladar blando, las fauces, la úvula y los pilares amigdalares.
Clase II: pueden verse el paladar blando, las fauces y úvula parcialmente. La úvula contacta con la base de la lengua.
Clase III: pueden verse el paladar blando y la base de la úvula.
Clase IV: puede verse únicamente el paladar duro y el resto queda fuera de visión.
Exploración nasal
La realización de la rinoscopia o endoscopia nasal requiere la valoración de un especialista, pero una aproximación útil se basa en el interrogatorio dirigido al paciente en relación con los síntomas de dificultad respiratoria (continua, intermitente, diurna o nocturna) y la presencia de otros síntomas, como la rinorrea, la presencia de crisis de estornudos, etc.
Exploraciones complementarias
El Grupo de Trabajo de este Documento de Consenso ha hecho una reflexión sobre la necesidad o no de solicitar pruebas complementarias y cuáles serían imprescindibles y bajo qué condiciones. Este tema no es fácil porque apenas hay bibliografía al respecto y muchas unidades de sueño piden pruebas complementarias basadas en su propia experiencia y el origen de la especialidad de la que proceden. Así, los neumólogos tienden a solicitar pruebas relacionadas con el aparato respiratorio, los ORL con su área, etc. Por ello, se ha realizado una encuesta a 10 unidades de sueño de nuestro país de reconocido prestigio formadas por especialistas interdisciplinarios para alcanzar un nivel de evidencia de consenso a la hora de pedir las pruebas complementarias. Los resultados han sido los siguientes:
Pruebas de función respiratoria (PFR). Se ha revisado un total de 2.794 pacientes consecutivos con PFR (espirometría) válidas, visitados por sospecha de SAHS, a los que se realizó una espirometría. Se comprobó que 2.066 (73,9%) fueron normales, 379 (13,6%) tuvieron una alteración leve, 187 (6,7%) moderada, 131 (4,7%) severa 31 (1,1%) muy severa. En otras palabras, la petición de esta exploración sistemática es normal en cerca de las tres cuartas partes de los pacientes.
Todos los centros consultados las piden en casos de sospecha de enfermedad respiratoria obstructiva, restrictiva o mixta, en pacientes con bronquitis crónica, fumadores de más de 40 años o ex fumadores de menos de 1 año. En cualquier paciente con tos, disnea o sibilancias, el National Lung Health Education Program la recomienda como parte de cualquier examen global de salud.
Al mismo tiempo, la mayoría de los centros recomienda realizar una SaO2 a todos, y si es < 93%, se pide una gasometría arterial. Sin embargo, algunos centros la piden de manera sistemática pero reconocen que aporta poco. La mayoría de los centros pide PFR en casos de obesidad mórbida y, a veces, gasometría arterial. Otros prefieren empezar por la SaO2.
Este Documento de Consenso recomienda la realización de una espirometría sistemática sólo en pacientes con sospecha de enfermedad respiratoria, tos crónica y disnea, así como en los que cumplan criterios de bronquitis crónica, fumadores de más de 40 años o ex fumadores de menos de 1 año y sujetos con obesidad mórbida (IMC > 40) y/o comorbilidad relevante.
Hormonas tiroideas. En una revisión realizada por miembros del grupo GES sobre un total de 2.267 pacientes consecutivos con hormonas tiroideas válidas, visitados por sospecha de SAHS, se comprobó que en 2.159 casos (95,2%) fueron normales, 95 casos (4,2%) tuvieron hipotiroidismo, la mayoría subclínico, y 13 pacientes (0,6%) tenían datos de hipertiroidismo.
En un estudio realizado por Castejón et al70 en 1.084 pacientes evaluables a los que se realizó una determinación de las hormonas tiroideas previa a la realización del estudio de sueño, un 2% tuvo hipotiroidismo subclínico (TSH elevada con T3 y T4 normales), un 2,6% tenía un hipotiroidismo previo ya conocido y tratado, y sólo un 0,2% tuvo hipotiroidismo clínico no conocido.
En otro estudio realizado por García-Samones et al71 en 206 pacientes diagnosticados de SAHS por PSG, únicamente 4 presentaron alguna alteración hormonal: 1 paciente con un bocio multinodular ya conocido (TSH = 0,18); 1 paciente con TSH baja (0,26) sin clínica en probable relación con el uso de sal yodada; 1 paciente con TSH discretamente elevada (5,09) sin clínica y no confirmada en análisis posteriores, y 1 paciente diagnosticado de bocio pretóxico y que posteriormente desarrolló un hipotiroidismo. Por tanto, tan sólo 1 paciente (0,49%) tuvo una alteración hormonal no conocida previamente con significación clínica en probable relación con la ingesta.
En resumen, todos los centros consultados están de acuerdo en solicitar hormonas tiroideas si hay sospecha de hipotiroidismo o hipertiroidismo, o en pacientes con tratamiento hormonal por enfermedad tiroidea que, sin embargo, no tiene un control reciente. Algunos centros sugieren que, si se va a pedir una analítica para detectar un síndrome metabólico y/o medir el perfil de riesgo cardiovascular, añadir una determinación de TSH no es costoso, ya que la enfermedad tiroidea no es fácil de diagnosticar salvo cuando es muy florida. Varios centros la pedirían en caso de obesidad mórbida. No obstante, en estos pacientes ya se suele haber realizado esta clase de analítica antes de que sean visitados en una unidad de sueño.
Este Documento de Consenso no recomienda pedir de manera sistemática la determinación de TSH y restringir su solicitud a pacientes con sospecha de enfermedad tiroidea o en tratamiento por esta enfermedad que no tengan un control reciente.
Electrocardiograma. Todos los centros consultados están de acuerdo en solicitarlo ante la sospecha de enfermedad cardíaca o HTA, y este Documento de Consenso recomienda, igualmente, pedirlo en esos casos.
Analítica. Todos los centros pedirían un perfil metabólico y de riesgo cardiovascular (glucemia y lípidos). El resto de determinaciones analíticas lo pedirían según la historia clínica, es decir, si hay sospecha de alguna enfermedad. También se solicitaría en pacientes con obesidad mórbida que no tengan una reciente, en los que se pediría una analítica más completa.
Este Documento de Consenso recomienda hacer de manera sistemática sólo un hemograma y una bioquímica básica que incluya el perfil lipídico.
Radiografía. Se pide sólo ante la sospecha de enfermedad cardíaca o respiratoria (tórax). No se piden de manera sistemática la cefalometría y el Waters, ni una radiografía lateral de cráneo en adultos. Este Documento mantiene la misma recomendación.
Ecocardiografía transtorácica. La Sociedad Española de Cardiología, dada la prevalencia de HTA, miocardiopatía dilatada, hipertensión pulmonar y enfemedad isquémica en el SAHS severo, estima aconsejable incluir un estudio ecocardiográfico en el evaluación clínical de este tipo de pacientes. Este Documento de Consenso suscribe esta recomendación.
Especialista ORL. Todos los centros reconocen hacer una exploración ORL básica que incluye la exploración de las fosas nasales y la orofaringe, así como el paladar. Si hay alteraciones relevantes o el paciente tiene una enfermedad ORL se le remite al especialista. Lo mismo se hace cuando el paciente tiene problemas para tolerar la CPAP debido a efectos secundarios otorrinolaringológicas. Ningún centro remite a un paciente a ORL antes de indicar la CPAP. También se remitirá a otorrinolaringólogo cuando el paciente desea recibir una alternativa quirúrgica a la CPAP o cuando la cirugía nasal es necesaria para que el paciente tolere la CPAP.
Este Documento de Consenso recomienda que en todo paciente con sospecha clínica de SAHS se realice una exploración básica de la VAS y del área ORL según se ha explicado. El paciente deberá ser remitido al especialista ORL y/o dentista y/o maxilofacial si se detectaran alteraciones específicas de esas áreas o el paciente deseara someterse a un tratamiento quirúrgico y/o un dispositivo de avance mandibular. Todo paciente con intolerancia a la CPAP deberá evaluarse por ORL. La evaluación por ORL previa a la prescripción de la CPAP se considera recomendable, aunque dependerá de la disponibilidad de cada centro.
Exploración del ronquido simple y del ronquido patológico
El ronquido es un ruido respiratorio que se presenta durante el sueño, por lo que puede ser tanto nocturno como diurno. Hay muchas definiciones del ronquido. Koskenvuo et al72 lo definen como "un sonido inspiratorio producido durante el sueño por la vibración de diferentes partes de las vías respiratorias superiores". Hans et al73 lo definen como "el sonido producido por la vibración del paladar blando contra la pared faríngea posterior".
La Asociación Americana de Alteraciones del Sueño lo define como una respiración grave de la VAS, sin apnea ni hipoventilación, causada por vibración de los tejidos faríngeos74. Lo clasifica en ronquido leve, moderado y grave, dependiendo fundamentalmente de la frecuencia, la influencia postural y la repercusión en las personas que conviven con el roncador. Powell et al75 lo definen como un sonido ronco de una frecuencia entre 400-2.000 Hz y una intensidad > 60 decibelios. El sonido está producido por la vibración de los tejidos flexibles en una VAS estrecha. Por tanto, hay que considerarlo como un signo de obstrucción parcial de la vía respiratoria y, en consecuencia, un signo precoz de un trastorno obstructivo de la respiración que con el tiempo puede conducir a un progresivo empeoramiento.
La fuente del ronquido es primariamente la región palatina y faríngea; sin embargo, también pueden crear un sonido semejante, pero en menor grado, las fosas nasales. El ronquido se produce debido a una presión negativa que produce colapso y apertura repetitiva de la vía respiratoria, haciendo vibrar las mucosas implicadas. Puede ser de origen nasal si hay pólipos, tumores pediculados o un tabique flácido (postoperado o traumático), de origen velar, que vibra con la pared posterior de la nasofaringe u orofaringe, o con el dorso de la lengua, lingual, que vibrará con la pared posterior de la orofaringe o hipofaringe sin la participación del velo, o laríngeo con la participación de la epiglotis y los repliegues ariepiglóticos en vibración con la pared posterior de la hipofaringe. Si el ruido se produce en la zona glótica o subglótica se conoce como estridor y ya no es propiamente un ronquido.
Powell et al75 clasificaron el ronquido de la siguiente manera:
Ronquido simple. Cuando además de no molestar a los acompañantes no está acompañada de evidencia objetiva de resistencias de la VAS.
Ronquido alto habitual o ronquido social. Cuando molesta al acompañante y/o a las personas que conviven en la casa, pero sin resistencias de la VAS. Este tipo de ronquido se suele considerar como simple.
Ronquido acompañado de SAHS.
Lugaresi et al76,77 distinguen el ronquido continuo del ronquido cíclico. El primero corresponde a un ruido inspiratorio de amplitud igual en cada ciclo. Se trata de un fenómeno frecuente que plantea pocos problemas a los acompañantes y no es peligroso para el paciente. Por el contrario, el ruido cíclico es un ruido de "vaivén", de intensidad variable, superior al continuo, que puede llegar a los 85 decibelios. Los intervalos silenciosos corresponden a las apneas. Estos autores proponen clasificar los ronquidos crónicos en 4 estados evolutivos:
Estadio 0. Ronquido severo aislado que sólo plantea problemas a los acompañantes.
Estadio 1. El ronquido ocupa largos períodos del sueño y aparece somnolencia diurna.
Estadio 2. El ronquido ocupa todo el sueño y, aparte de la somnolencia diurna, plantea problemas psicosociales importantes.
Estadio 3. El ronquido se asocia a un cuadro severo de SAHS evidente.
Es evidente que a la hora de valorar el ronquido se ha de tener en cuenta si éste es esporádico o habitual y si la postura condiciona su aparición.
El término roncopatía crónica fue introducido por Chouard et al78 y agrupa las entidades patológicas secundarias a un aumento anormal de las resistencias de las VAS ligado al sueño. El ronquido es el síntoma común y hay que considerarlo como el síntoma guía de una enfermedad única, que comporta diversos estadios de gravedad. En efecto, las formas más graves están siempre precedidas por presencia de un ronquido simple. El término roncopatía crónica admite que tanto el ronquido simple como el síndrome de las resistencias anormalmente elevadas de las VAS y el SAHS hay que considerarlos como parte integral de un mismo proceso mórbido evolutivo. A efectos de este Documento de Consenso, la roncopatía crónica es denominada ronquido patológico.
Aunque por desgracia no hay ningún elemento que de forma segura nos haga afirmar que un roncador simple va a evolucionar hacia un SAHS más o menos típico, es evidente que un roncador más joven que presente retrognatia, cuello corto e hipertrofia de velo del paladar posiblemente presente un SAHS, sobre todo si aumenta de peso.
Siguiendo a Dejean et al79, para valorar correctamente la gravedad de la roncopatía crónica es necesario distinguir:
En el momento de la consulta. El facultativo ha de apreciar el estado actual del paciente y valorar los 3 posibles estadios: roncador simple, roncador con anomalías y SAHS.
Los riesgos posibles a largo plazo por el roncador simple. En esta apreciación el ronquido de la roncopatía crónica debe considerarse como el signo de alarma de una enfermedad que en cualquier momento puede ser grave, por lo que el paciente debe ser informado de los posibles riesgos, sobre todo si aumenta de peso.
Es muy difícil distinguir, sólo con la anamnesis y la exploración física, entre roncadores simples y roncadores asociados a SAHS, y ésta únicamente se puede asegurar con la PSG64. Sin embargo, podemos hablar de ronquido simple o benigno cuando éste es aislado, sin asociaciones patológicas ni anomalías anatómicas (p. ej., obesidad, retrognatia) o semiológicas (p. ej., ESD) asociadas a una alta incidencia de SAHS. En el resto de los casos hablaremos de ronquido patológico asociado a trastornos respiratorios del sueño. Adaptando este concepto a la clasificación de Lugaresi, podríamos decir que el ronquido simple correspondería al estadio 0 y el patológico a los estadios 1 y 2. El estadio 3 de Lugaresi correspondería propiamente al que queda incluido en el SAHS.
A pesar de ello, y aunque no hay evidencias de que el ronquido simple se asocie a alguna enfermedad sistémica, hay fuertes sospechas de que pudiera ser así. Hay publicaciones que inducen a pensar que éste podría tener relación con alteraciones cardiovasculares debidas a anomalías en el desarrollo del proceso arteriosclerótico o metabólico65-67, otras señalan una relación con la HTA, tanto en el SAHS como en los roncadores simples68,69, y en algunos artículos también se hacen referencia a su posible relación con alteraciones del metabolismo glucosa-insulina80,81. Incluso se pueden encontrar publicaciones que indican alteraciones tan diversas como alteraciones auditivas en el propio roncador o en su compañero de cama82, cefalea crónica83 o retraso de crecimiento fetal de madres roncadoras84. Finalmente, es evidente su relación, como se detallará en capítulos posteriores, con la siniestralidad en accidentes de tráfico85.
En todo caso, el ronquido siempre es un signo de alarma que nos debe orientar a preguntar si el paciente tiene apneas observadas u otros síntomas o complicaciones que orienten a la sospecha clínica de SAHS.