Las infecciones pleurales presentan una elevada morbimortalidad, y su incidencia está aumentando en todos los países del mundo y en todos los grupos de edad. No todos los derrames infecciosos son paraneumónicos, y en esos casos, los organismos que se encuentran en el espacio pleural no son los mismos que se observan en las infecciones del parénquima pulmonar. La dificultad diagnóstica radica en saber si un derrame infeccioso evolucionará hacia un derrame complicado/empiema, ya que los métodos diagnósticos utilizados con este fin ofrecen pobres resultados.
Los pilares del tratamiento son establecer un diagnóstico precoz e instaurar, lo antes posible, una pauta antibiótica y un drenaje torácico. Este se llevará a cabo, preferiblemente con tubos de pequeño calibre, ante la presencia de determinadas características morfológicas, bacteriológicas y bioquímicas del líquido pleural. El análisis del líquido es el método más fiable para valorar su evolución, sobre todo la determinación del pH. En un subgrupo de pacientes los fibrinolíticos pueden contribuir a mejorar la recuperación, y su combinación con deoxirribonucleasa se relaciona con la obtención de mejores resultados. Si fracasa el tratamiento médico y es necesaria la cirugía, la rentabilidad de la cirugía toracoscópica videoasistida es, al menos, comparable a la decorticación por toracotomía, por lo que esta solamente se realizará si han fallado las técnicas anteriores.
Son necesarios más ensayos clínicos que analicen factores que puedan influir sobre los resultados obtenidos para conformar nuevas estrategias diagnósticas y terapéuticas basadas en la evidencia, que proporcionen un manejo más efectivo y estandarizado de esta enfermedad.
Pleural infections have high morbidity and mortality, and their incidence in all age groups is growing worldwide. Not all infectious effusions are parapneumonic and, in such cases, the organisms found in the pleural space are not the same as those observed in lung parenchyma infections. The diagnostic difficulty lies in knowing whether an infectious effusion will evolve into a complicated effusion/empyema, as the diagnostic methods used for this purpose provide poor results.
The mainstays of treatment are to establish an early diagnosis and to commence an antibiotic regimen and chest drain as soon as possible. This should preferably be carried out with fine tubes, due to certain morphological, bacteriological and biochemical characteristics of the pleural fluid. Fluid analysis, particularly pH, is the most reliable method for assessing evolution. In a subgroup of patients, fibrinolytics may help to improve recovery, and their combination with DNase has been found to obtain better results. If medical treatment fails and surgery is required, video-assisted thoracoscopic surgery (VATS) is, at least, comparable to decortication by thoracotomy, so should only undertaken if previous techniques have failed.
Further clinical trials are needed to analyze factors that could affect the results obtained, in order to define new evidence-based diagnostic and therapeutic strategies that provide more effective, standardized management of this disease.
Un derrame pleural (DP) paraneumónico (DPP) es aquel que se asocia a una neumonía bacteriana, un absceso pulmonar o a bronquiectasias infectadas1. También hablamos de infección pleural (IP) o de DP complicado (DPC) cuando no se observa enfermedad parenquimatosa acompañante. Aunque la mayoría de los DPP se resuelven únicamente con tratamiento antibiótico, un subgrupo de pacientes puede presentar complicaciones graves, como: DPP refractario al tratamiento antibiótico y al drenaje torácico (DT) con necesidad de drenaje quirúrgico (33%)2, fibrosis pleural (14%)3, estancia hospitalaria prolongada (media de 12-15días y >1mes en el 25% de los casos)2,4,5 y altas tasas de mortalidad (10-20%)2,4,6. Para evitar estas complicaciones es preciso llegar a un diagnóstico de certeza lo antes posible y establecer un estrecho control clínico.
EpidemiologíaEn Estados Unidos, del millón de hospitalizaciones anuales por neumonía, alrededor de 60.000 pacientes presentarán un empiema y otros 25.000 lo desarrollarán por otras razones7. A pesar de los avances disponibles, la incidencia de IP aumenta en todos los países5,8, independientemente de su grado de desarrollo, y en todos los grupos de edad9-11. En Estados Unidos, en el periodo 1996-2008 la tasa de hospitalización por empiema se duplicó (de 3,04 a 5,98/100.000 habitantes), aumentando en todos los grupos de edad12.
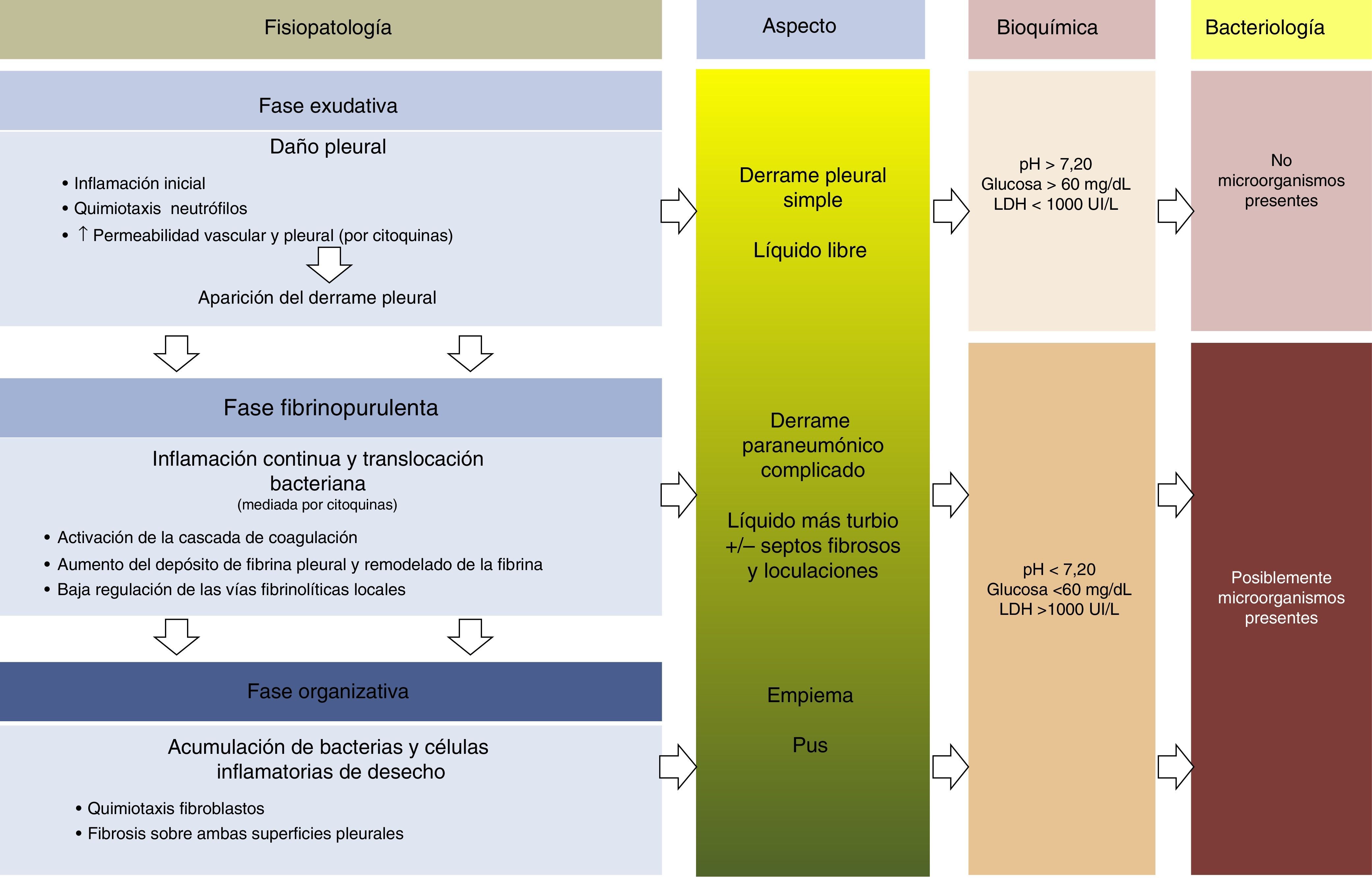
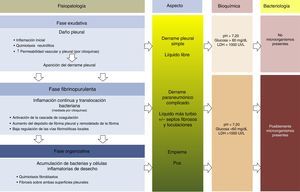
FisiopatologíaEn la evolución del DPP existen 3 fases. En la primera (exudativa), la formación del líquido pleural (LP) es una consecuencia de la inflamación localizada y de la activación del sistema inmune. Los neutrófilos activados pueden provocar una lesión endotelial que ocasionaría un aumento de la permeabilidad capilar con la consiguiente aparición del DP13,14. El daño pleural puede conducir al comienzo de la segunda fase (fibrinopurulenta), con la activación de los componentes proinflamatorios y profibróticos y el inicio de la cascada de la coagulación. Por tanto, la respuesta inflamatoria local se amplifica por la presencia de diversas citocinas, que estimulan la quimiotaxis de neutrófilos y fibroblastos14. Además, la permeabilidad de la membrana puede permitir el paso de las bacterias al espacio pleural. En las últimas etapas de esta fase es posible observar un LP con apariencia de empiema debido a la presencia de productos de degradación celular y restos bacterianos. Durante este periodo existe también una disminución de la fibrinólisis, con el consiguiente aumento de la formación de fibrina en el espacio pleural. Este proceso puede progresar a la última fase (organizativa), en la que se constituye una capa de fibrosis sobre ambas superficies pleurales debido al aumento de la infiltración fibroblástica, lo que puede provocar que el manejo de estos pacientes sea extremadamente difícil sin tener que recurrir a una intervención quirúrgica15,16 (fig. 1). El aspecto, análisis y cultivo del DP pueden variar en cada una de las fases evolutivas del DPP. Los cambios fisiopatológicos que tienen lugar en el espacio pleural hacen que, desde un punto de vista clínico, hablemos de DPP no complicado (DPPNC), que se resolverá con tratamiento antibiótico, de DPP complicado (DPPC), que necesitará un DT o cirugía para su resolución, y de empiema, es decir, la presencia de pus en el espacio pleural, que siempre debe drenarse.
Fisiopatología, aspecto, parámetros bioquímicos y microbiología del derrame pleural paraneumónico.
Modificada de Bhatnagar y Maskell16.
Diagnosticar un DPP no es complejo si la presentación es la clásica. La clínica es similar a la de las neumonías17. Una mala respuesta en el manejo de una neumonía puede indicar la presencia de un DPP o de un empiema como una complicación de la misma18. En ocasiones es difícil sospechar una IP, ya que la sintomatología no es la habitual y no hay evidencia de neumonía en la radiografía (Rx) de tórax19. Los hemocultivos solamente son positivos en el 12% de los casos, el cultivo del LP es negativo en más del 40% de las muestras2 y, en ocasiones, los gérmenes responsables son muy poco habituales y requieren de microbiología molecular para identificarlos20. Aunque los criterios para definir los DPPC están bien establecidos17, no hay datos clínicos ni radiológicos que identifiquen a los pacientes que desarrollarán un DPPC/empiema. Como estos son fácilmente identificables por su aspecto, la dificultad radica en detectar, lo antes posible, qué pacientes con un DPP no purulento pueden evolucionar hacia un DPPC. Para ello se han utilizado diversos métodos diagnósticos pero con pobres resultados hasta la actualidad.
Escalas de gravedad de las neumonías y scoresLas escalas de gravedad de las neumonías18,21 se han utilizado para predecir la mortalidad a los 30días del ingreso, pero no para valorar la posibilidad de desarrollar un DPPC/empiema. Chalmers et al.22 demuestran la incapacidad, tanto de estas escalas como de los scores genéricos de sepsis (APACHEII,, SEWS y SIRS), para predecir el desarrollo de un DPPC/empiema. Sin embargo, la regresión logística multivariable identifica que: albúmina <30g/l, Na<130mmol/l, plaquetas >400.000, proteína C reactiva (PCR)>100mg/l y antecedentes de abuso de alcohol y de drogas i.v. son factores independientes que se asocian al desarrollo de DPPC/empiema22.
Rahman et al.23 desarrollan una puntuación de riesgo clínico validado (RAPID) para identificar a pacientes con IP y alto riesgo de muerte para poder implantar la mejor estrategia de manejo. La puntuación incluye los niveles de urea, la edad, la purulencia o no del LP, la fuente de infección (comunidad u hospital) y factores dietéticos (albúmina). En base a ella se constituyen grupos de bajo, medio y alto riesgo. La odds ratio para mortalidad a los 3meses para los grupos de medio y alto riesgo, usando como referencia a los de bajo, es de 24,4 y 192,4, respectivamente, por lo que este sistema permite estratificar el riesgo de los pacientes con IP en el momento de su presentación.
Pruebas de imagenLa Rx, la ecografía torácica (ET) y la tomografía computarizada (TC) de tórax pueden proporcionar información sobre el tamaño, la extensión y la naturaleza del DP. Cantidades de LP>200-250cc suelen apreciarse en la Rx de tórax, y puede sospecharse un DPPC si la opacificación del espacio pleural es fija y no cambia con los efectos gravitacionales del LP.
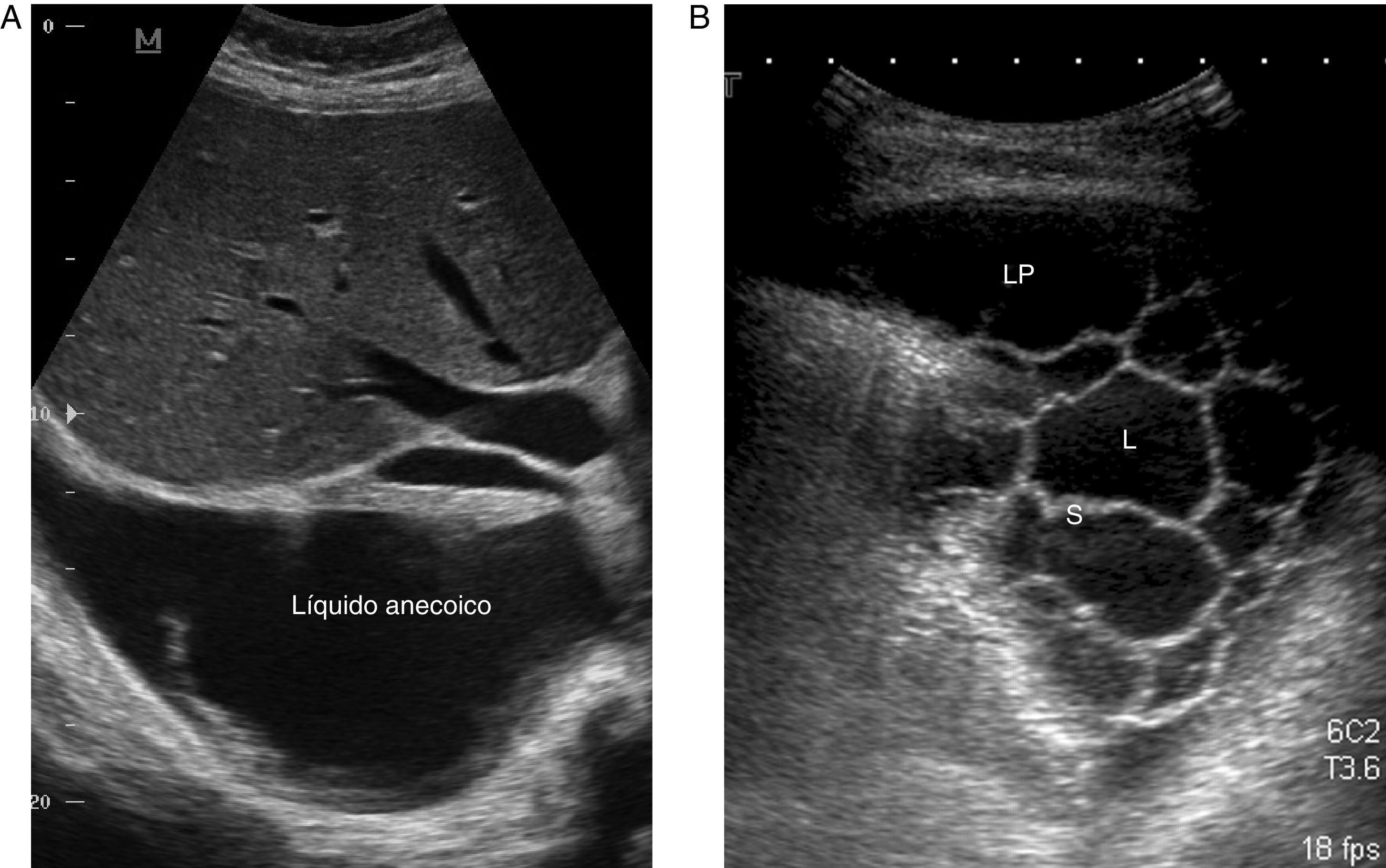
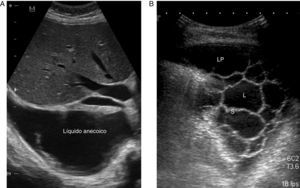
La ET es una técnica básica en el manejo del DP, especialmente del DPP, que los neumólogos deberían dominar. Es más sensible que la Rx para detectar un DP pequeño, establece la ecogenicidad del LP, localiza con precisión el líquido loculado, estima el volumen y la profundidad del DP, diferencia entre LP y consolidación subyacente o atelectasia, mejora el rendimiento de la toracocentesis y disminuye el riesgo de complicaciones en comparación con el uso conjunto de exploración física y Rx24. La presencia de septos en la ecografía sugiere un DPPC (fig. 2), y la hiperecogenicidad se asocia con pus en la cavidad pleural.
La TC es la técnica de imagen en la que mejor se visualiza la pleura. Ofrece la posibilidad de reconstruir imágenes, determinar loculaciones y observar si existen lesiones en el pulmón subyacente. Además, permite diferenciar entre un absceso pulmonar periférico y una IP loculada a través del signo «split pleura»25.
La ET, al estar libre de radiaciones y ser fácilmente accesible a la cabecera de la cama en los pacientes críticamente enfermos, debería ser la técnica de primera elección. Factores que puedan dificultar la calidad de la imagen, como la obesidad o el enfisema subcutáneo, y la sospecha de un DP maligno o de una infección pleural con otra patología asociada (rotura de esófago, fístula broncopleural, etc.) en que es necesario saber si hay otras anormalidades anatómicas, pueden hacer necesaria la realización de una TC.
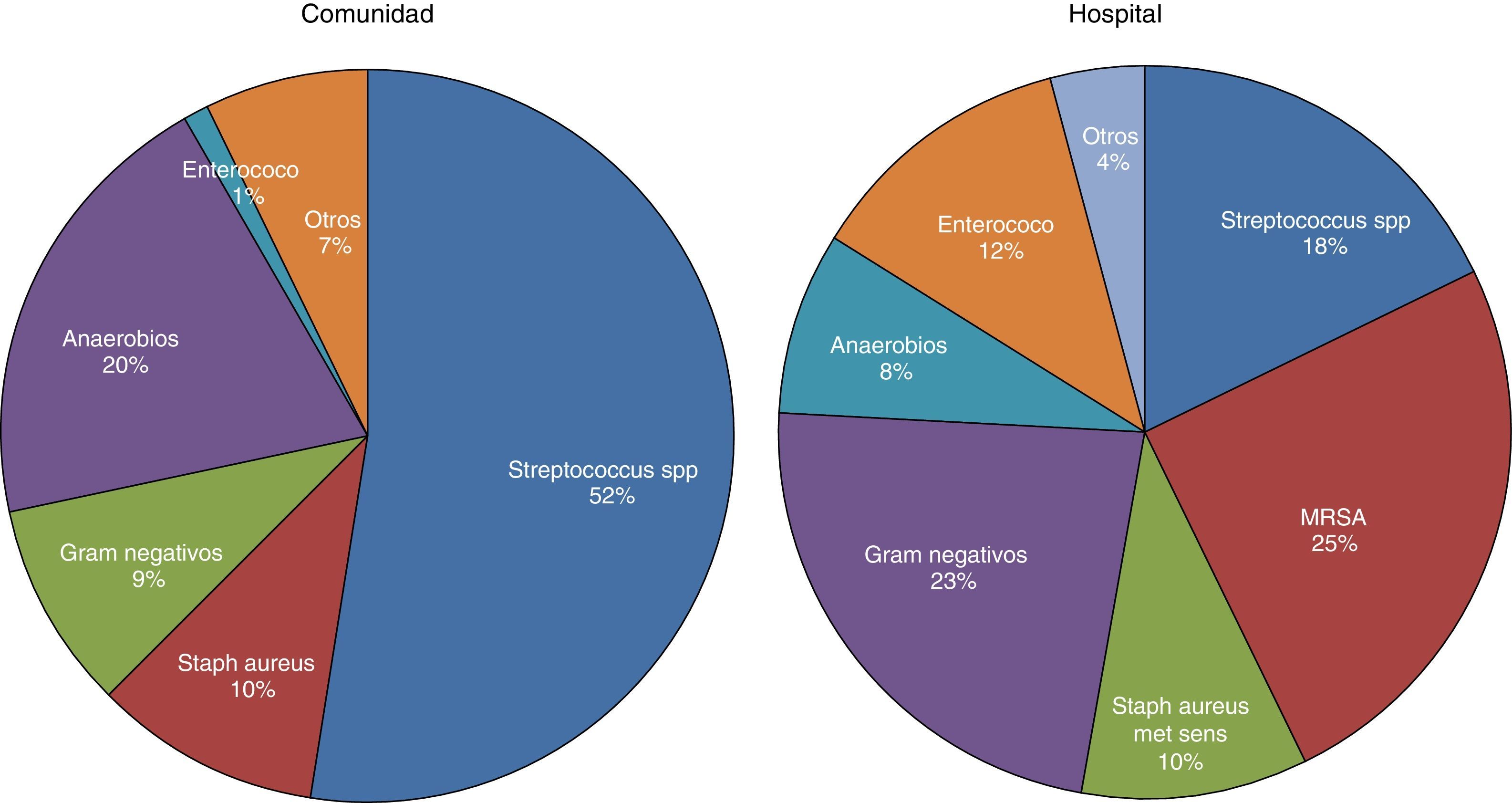
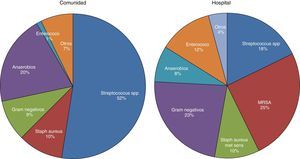
MicrobiologíaUn cultivo positivo del LP es diagnóstico de IP, pero esto solamente sucede en el 58% de los casos y aumenta al 74% si se utiliza microbiología molecular20. Se asume que la IP se produce como consecuencia de la migración de las bacterias que hay en el parénquima pulmonar, por lo que suelen denominarse DPPC, interpretando que la etiología bacteriana de todas las IP es la misma que la que causa la neumonía. Sin embargo, en una revisión de 14 estudios con un total de 1.383 pacientes con empiema, solamente el 70% se debieron a una neumonía y el resto lo fueron a otras causas26. Por tanto, la elección antibiótica para tratar la IP basada en esta suposición no es la más adecuada, ya que existen importantes diferencias bacteriológicas entre ambas20. Estas diferencias se deben, probablemente, a que el espacio pleural infectado tiene diferencias significativas en la acidez y en la oxigenación en comparación con el pulmón ventilado, por lo que se presta a la invasión por ciertos organismos más que por otros27. También existen diferencias, en lo que a tipos de microorganismos se refiere, entre las IP adquiridas en la comunidad y en el hospital20 (fig. 3).
Microbiología de la infección pleural adquirida en la comunidad y en el hospital20.
MRSA: Staphylococcus aureus resistente a la meticilina.
La vacuna neumocócica heptavalente puede estar jugando un papel relevante en la evolución de la microbiología de la IP. Se ha observado que los serotipos predominantes que la causan son los que no cubre la vacuna28, y esto parece correlacionarse con un aumento significativo en la incidencia de empiema29, lo cual sugiere un aumento de la virulencia de los nuevos gérmenes.
Análisis del líquido pleuralEl conjunto de sintomatología clínica, exploración física, analítica de sangre y Rx de tórax suele confirmar la existencia de una neumonía con un DPP. El análisis de las características del LP es el método más fiable para su diagnóstico y para tratar de evitar la evolución hacia un DPPC30. Por tanto, se recomienda hacer una toracocentesis a todos los pacientes con sospecha de un DP infeccioso si el grosor del líquido pleural en la Rx de tórax obtenida en decúbito lateral es >10mm19, si bien la posibilidad de que un DPP<2cm de profundidad en la TC evolucione hacia un DPPC es pequeña31.
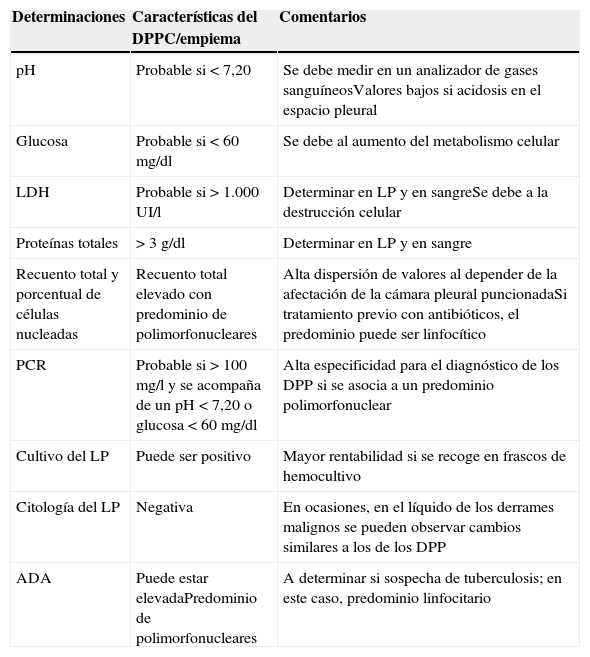
El análisis del LP puede variar en cada una de las fases evolutivas del DPP. Los test a realizar ante la sospecha de un DPP se indican en la tabla 1. Un DPPNC es un exudado de aspecto seroso de predominio polimorfonuclear, sin datos bioquímicos relevantes y cultivo negativo. En caso de haber recibido previamente antibióticos, el predominio de células nucleadas puede ser linfocítico32. Pero la verdadera utilidad de las determinaciones bioquímicas del LP es poder detectar, lo antes posible, los DPPC/empiemas. Mientras los empiemas siempre requieren drenaje, la decisión de drenar un DPP no purulento se basa en las características morfológicas del DP (>1/2hemitórax, loculaciones y engrosamiento de la pleura parietal), bacteriológicas (cultivo) y bioquímicas (pH<7,20)19,33. Una lactato deshidrogenasa (LDH) >1.000UI/l y una glucosa <60mg/dl no mejoran la rentabilidad diagnóstica y solamente se utilizarán si no se puede determinar el pH19. Factores como la entrada de aire en la jeringa en la que se obtiene la muestra, o restos de heparina o de anestésico local en la misma, pueden alterar los resultados del pH34. Además, las IP causadas por Proteusspp. pueden secretar enzimas que alcalinizan el LP35. Algunos pacientes con un pH pleural inicial >7,20 también pueden necesitar DT e incluso cirugía. Esto se debe a la heterogeneidad de las características bioquímicas en los DP tabicados, ya que el grado de afectación de la cámara puncionada puede dar lugar a índices de gravedad de la enfermedad, determinados por el pH, marcadamente distintos. Por tanto, aunque el pH pleural es altamente específico (91,8%)36 en predecir la necesidad de DT, es menos sensible a la hora de precisar la mortalidad o la eventual necesidad de intervención quirúrgica4,19. Aunque importantes sociedades científicas aceptan este parámetro para drenar un DP19,33, un análisis retrospectivo ha demostrado que este test no es altamente específico a la hora de establecer la necesidad de un DT en los DP no purulentos. Es decir, un grupo de pacientes con DPPNC son considerados como DPPC, lo que da lugar a la colocación de drenajes torácicos innecesarios37. El recuento total de células nucleadas y el porcentaje de polimorfonucleares suelen ser más elevados en los DPPC/empiemas38.
Determinaciones en líquido pleural ante la sospecha de un derrame pleural infeccioso
| Determinaciones | Características del DPPC/empiema | Comentarios |
|---|---|---|
| pH | Probable si <7,20 | Se debe medir en un analizador de gases sanguíneosValores bajos si acidosis en el espacio pleural |
| Glucosa | Probable si <60mg/dl | Se debe al aumento del metabolismo celular |
| LDH | Probable si >1.000 UI/l | Determinar en LP y en sangreSe debe a la destrucción celular |
| Proteínas totales | >3g/dl | Determinar en LP y en sangre |
| Recuento total y porcentual de células nucleadas | Recuento total elevado con predominio de polimorfonucleares | Alta dispersión de valores al depender de la afectación de la cámara pleural puncionadaSi tratamiento previo con antibióticos, el predominio puede ser linfocítico |
| PCR | Probable si >100mg/l y se acompaña de un pH<7,20 o glucosa <60mg/dl | Alta especificidad para el diagnóstico de los DPP si se asocia a un predominio polimorfonuclear |
| Cultivo del LP | Puede ser positivo | Mayor rentabilidad si se recoge en frascos de hemocultivo |
| Citología del LP | Negativa | En ocasiones, en el líquido de los derrames malignos se pueden observar cambios similares a los de los DPP |
| ADA | Puede estar elevadaPredominio de polimorfonucleares | A determinar si sospecha de tuberculosis; en este caso, predominio linfocitario |
ADA: adenosina desaminasa; DPP: derrame pleural paraneumónico; DPPC: derrame pleural paraneumónico complicado; LDH: lactato deshidrogenasa; LP: líquido pleural; PCR: proteína C reactiva.
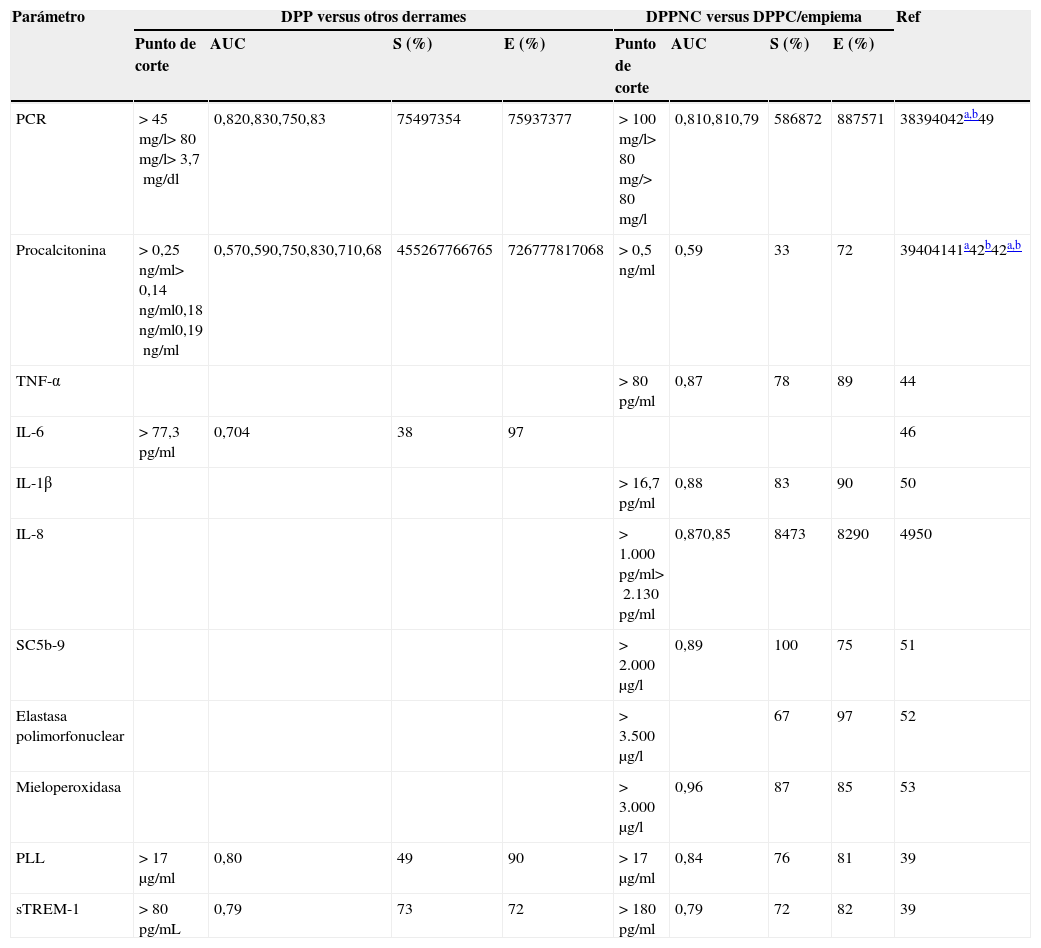
La PCR se ha utilizado para diferenciar tanto los DPP de los exudados no paraneumónicos38-41 como los DPPNC de los DPPC38,39 (tabla 2). Hay que destacar que su especificidad aumenta (96%38 y 92%40) si valores elevados de PCR se asocian a un predominio de polimorfonucleares en el LP, y que si una PCR>100mg/l se acompaña de un pH<7,20 o de una glucosa <60mg/dl, la especificidad para el diagnóstico del DPPC es del 97%38.
Rentabilidad de los biomarcadores alternativos en el líquido pleural para el diagnóstico de los derrames pleurales paraneumónicos
| Parámetro | DPP versus otros derrames | DPPNC versus DPPC/empiema | Ref | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Punto de corte | AUC | S (%) | E (%) | Punto de corte | AUC | S (%) | E (%) | ||
| PCR | >45mg/l>80mg/l>3,7mg/dl | 0,820,830,750,83 | 75497354 | 75937377 | >100mg/l>80mg/>80mg/l | 0,810,810,79 | 586872 | 887571 | 38394042a,b49 |
| Procalcitonina | >0,25ng/ml>0,14ng/ml0,18ng/ml0,19ng/ml | 0,570,590,750,830,710,68 | 455267766765 | 726777817068 | >0,5ng/ml | 0,59 | 33 | 72 | 39404141a42b42a,b |
| TNF-α | >80pg/ml | 0,87 | 78 | 89 | 44 | ||||
| IL-6 | >77,3pg/ml | 0,704 | 38 | 97 | 46 | ||||
| IL-1β | >16,7pg/ml | 0,88 | 83 | 90 | 50 | ||||
| IL-8 | >1.000pg/ml>2.130pg/ml | 0,870,85 | 8473 | 8290 | 4950 | ||||
| SC5b-9 | >2.000μg/l | 0,89 | 100 | 75 | 51 | ||||
| Elastasa polimorfonuclear | >3.500μg/l | 67 | 97 | 52 | |||||
| Mieloperoxidasa | >3.000μg/l | 0,96 | 87 | 85 | 53 | ||||
| PLL | >17μg/ml | 0,80 | 49 | 90 | >17μg/ml | 0,84 | 76 | 81 | 39 |
| sTREM-1 | >80pg/mL | 0,79 | 73 | 72 | >180pg/ml | 0,79 | 72 | 82 | 39 |
AUC: área bajo la curva; DPP: derrame pleural paraneumónico; DPPC: derrame pleural paraneumónico complicado; DPPNC: derrame pleural paraneumónico no complicado; E: especificidad; IL: interleucina; PCR: proteína C reactiva; PLP: proteínas ligadas a lipopolisacáridos; Ref: referencia; S: sensibilidad; SC5b-9: forma soluble de C5b-9; sTREM-1: activador del receptor soluble expresado en células mieloides; TNF-α: factor de necrosis tumoral alfa.
Aunque los valores de procalcitonina (PCT) se encuentran elevados en las infecciones bacterianas, existe controversia acerca de las ventajas de su determinación en el LP y de su capacidad para separar los DPPC de los DPPNC39-42. Sin embargo, un trabajo reciente confirma que la PCT es un biomarcador específico para infección, y que sus valores no se ven afectados por la inflamación no infecciosa43. Además, la PCT diferencia mejor que la PCR los DPP de los no infecciosos, si bien no predice la necesidad de intervención quirúrgica ni de muerte43.
La rentabilidad de otros parámetros —factor de necrosis tumoral-alfa (TNF-α), interleucina (IL)-6, IL-1β, IL-8, productos del complemento (forma soluble de C5b-9), enzimas derivadas de los neutrófilos (elastasa polimorfonuclear y mieloperoxidasa), proteína ligada a lipopolisacáridos (PLL) y activador del receptor soluble expresado en células mieloides (sTREM-1)—, se resume en la tabla 239,44-53. Existe escepticismo entre los investigadores sobre la posibilidad de que un único parámetro —sobre todo sin tener en cuenta datos clínicos, radiológicos o microbiológicos— sea capaz de diagnosticar, por sí mismo, una IP con suficiente seguridad como para cambiar la práctica clínica actual54.
TratamientoEl tratamiento se basa en controlar la infección con el antibiótico apropiado, drenar el DPPC/empiema, valorar el uso de fibrinolíticos y las opciones quirúrgicas que existen, llevar a cabo una buena nutrición y realizar una profilaxis antitrombótica55.
AntibióticosEl uso de antibióticos debería basarse en las recomendaciones microbiológicas locales y en los riesgos específicos de cada paciente e iniciarse de forma empírica y precoz ajustándolos al origen comunitario o nosocomial de la infección, al resultado de los cultivos y a la actividad del antibiótico en el LP56. En las IP comunitarias la asociación recomendada es amoxicilina-ácido clavulánico en monoterapia o una cefalosporina de tercera generación y clindamicina/metronidazol. Si hay alergia a las penicilinas, una opción sería la asociación de una quinolona y metronidazol/clindamicina. En las IP nosocomiales, en las que Staphylococcus aureus resistente a la meticilina es muy frecuente20, la pauta empírica debería cubrir este microorganismo y los anaerobios (por ejemplo, vancomicina/linezolid, penicilinas anti-Pseudomonas, carbapenem o cefalosporinas de tercera generación asociados a metronidazol). Los macrólidos no suelen utilizarse de forma rutinaria, ya que aunque las neumonías por Legionella o Mycoplasma pneumoniae pueden cursar con DP, suelen ser autolimitados y raramente causan empiema57. No se aconseja la utilización de aminoglucósidos, debido a su escasa penetración en el espacio pleural, ni hay evidencias que recomienden el uso intrapleural de antibióticos16.
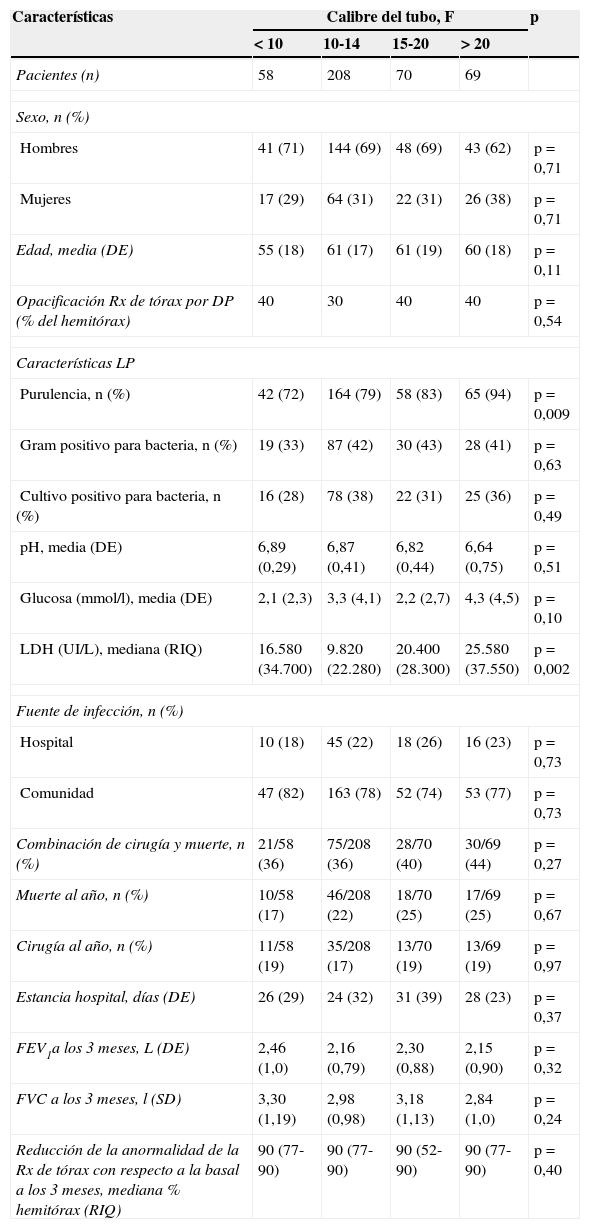
Drenaje torácicoAunque no hay consenso acerca del calibre del tubo de drenaje, las guías de la British Thoracic Society19 y otros estudios58 sugieren que los de pequeño calibre (10-14F) son los adecuados para la mayoría de los DPPC, debido a que son más fáciles de colocar, son menos traumáticos y dolorosos para el paciente, e igual de eficaces que los de mayor calibre (tabla 3). La inserción de un catéter torácico debería guiarse siempre por una prueba de imagen, generalmente una ET, y sus indicaciones serían la presencia de un LP turbio o purulento, tinción o cultivo positivo del LP, loculación o DP mayor de la mitad del hemitórax, pH<7,20, o engrosamiento de la pleura parietal.
Características de los pacientes según el tamaño del calibre del tubo torácico, y el efecto de este sobre los resultados clínicos primarios y secundarios
| Características | Calibre del tubo, F | p | |||
|---|---|---|---|---|---|
| < 10 | 10-14 | 15-20 | > 20 | ||
| Pacientes (n) | 58 | 208 | 70 | 69 | |
| Sexo, n (%) | |||||
| Hombres | 41 (71) | 144 (69) | 48 (69) | 43 (62) | p = 0,71 |
| Mujeres | 17 (29) | 64 (31) | 22 (31) | 26 (38) | p = 0,71 |
| Edad, media (DE) | 55 (18) | 61 (17) | 61 (19) | 60 (18) | p = 0,11 |
| Opacificación Rx de tórax por DP (% del hemitórax) | 40 | 30 | 40 | 40 | p = 0,54 |
| Características LP | |||||
| Purulencia, n (%) | 42 (72) | 164 (79) | 58 (83) | 65 (94) | p = 0,009 |
| Gram positivo para bacteria, n (%) | 19 (33) | 87 (42) | 30 (43) | 28 (41) | p = 0,63 |
| Cultivo positivo para bacteria, n (%) | 16 (28) | 78 (38) | 22 (31) | 25 (36) | p = 0,49 |
| pH, media (DE) | 6,89 (0,29) | 6,87 (0,41) | 6,82 (0,44) | 6,64 (0,75) | p = 0,51 |
| Glucosa (mmol/l), media (DE) | 2,1 (2,3) | 3,3 (4,1) | 2,2 (2,7) | 4,3 (4,5) | p = 0,10 |
| LDH (UI/L), mediana (RIQ) | 16.580 (34.700) | 9.820 (22.280) | 20.400 (28.300) | 25.580 (37.550) | p = 0,002 |
| Fuente de infección, n (%) | |||||
| Hospital | 10 (18) | 45 (22) | 18 (26) | 16 (23) | p = 0,73 |
| Comunidad | 47 (82) | 163 (78) | 52 (74) | 53 (77) | p = 0,73 |
| Combinación de cirugía y muerte, n (%) | 21/58 (36) | 75/208 (36) | 28/70 (40) | 30/69 (44) | p = 0,27 |
| Muerte al año, n (%) | 10/58 (17) | 46/208 (22) | 18/70 (25) | 17/69 (25) | p = 0,67 |
| Cirugía al año, n (%) | 11/58 (19) | 35/208 (17) | 13/70 (19) | 13/69 (19) | p = 0,97 |
| Estancia hospital, días (DE) | 26 (29) | 24 (32) | 31 (39) | 28 (23) | p = 0,37 |
| FEV1a los 3 meses, L (DE) | 2,46 (1,0) | 2,16 (0,79) | 2,30 (0,88) | 2,15 (0,90) | p = 0,32 |
| FVC a los 3 meses, l (SD) | 3,30 (1,19) | 2,98 (0,98) | 3,18 (1,13) | 2,84 (1,0) | p = 0,24 |
| Reducción de la anormalidad de la Rx de tórax con respecto a la basal a los 3 meses, mediana % hemitórax (RIQ) | 90 (77-90) | 90 (77-90) | 90 (52-90) | 90 (77-90) | p = 0,40 |
DE: desviación estándar; DP: derrame pleural; F: French; LP: líquido pleural; RIQ: rango intercuartil.
Modificado de Rahman et al.58.
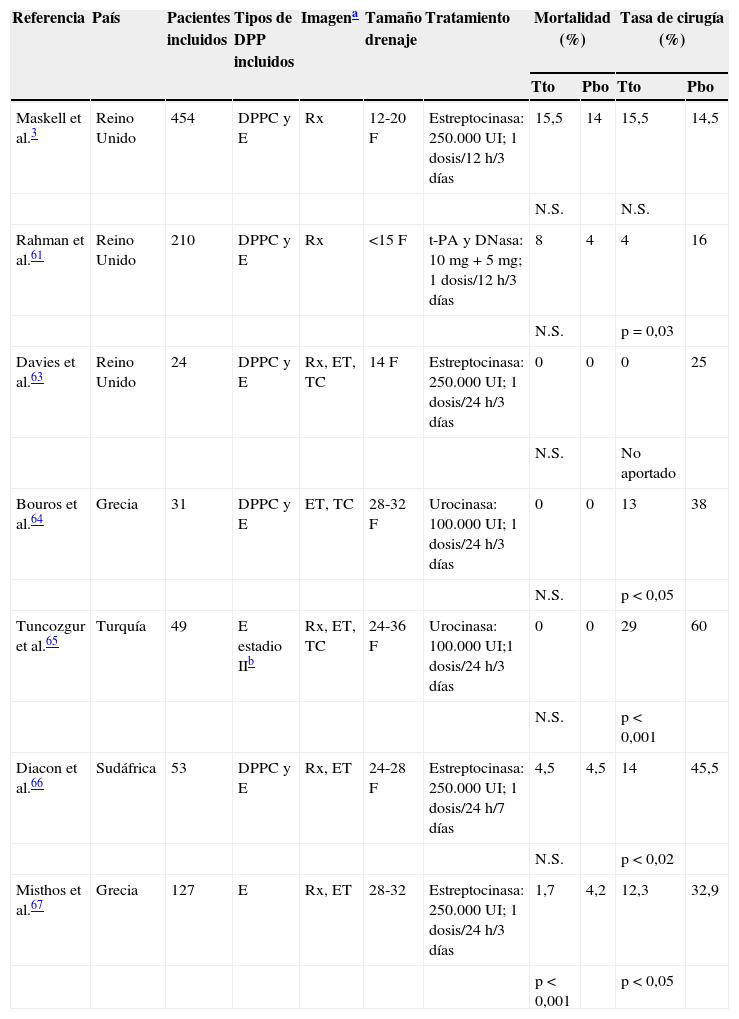
Las guías actuales no encuentran indicación para el uso rutinario de fibrinolíticos intrapleurales en los pacientes con IP19, y existe controversia acerca de su uso sistemático en el manejo de los DPPC59. Una revisión Cochrane confirmó que los fibrinolíticos intrapleurales aportan beneficio, tanto en la reducción de fallos del tratamiento como en la necesidad de recurrir a la cirugía en los DP loculados o empiemas, pero no influyen sobre la mortalidad60. Se observó que los pacientes que recibían alteplasa y deoxirribonucleasa (DNasa) presentaban mejoría significativa en la reducción de la opacificación pleural radiológica, en la tasa de cirugía a los 3meses y en la estancia hospitalaria media, que los que recibían placebo61. Un metaanálisis que incluye este estudio (y otros que utilizan estreptocinasa y urocinasa) demuestra heterogeneidad en los resultados, pero sugiere que el tratamiento con fibrinolíticos reduce las tasas de necesidad de cirugía, aunque no de la mortalidad (tabla 4)3,61-67. Las guías actuales recomiendan utilizar los fibrinolíticos de forma precoz cuando hay loculaciones en la cavidad pleural (resistentes al DT) y ante un empiema. No hay suficiente evidencia para recomendar un fármaco sobre el otro, ni acuerdo sobre la dosis a utilizar19,55, y se aconseja cerrar el tubo de DT durante unas horas tras su administración19,61.
Tratamiento fibrinolítico intrapleural. Características de los ensayos controlados con placebo
| Referencia | País | Pacientes incluidos | Tipos de DPP incluidos | Imagena | Tamaño drenaje | Tratamiento | Mortalidad (%) | Tasa de cirugía (%) | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Tto | Pbo | Tto | Pbo | |||||||
| Maskell et al.3 | Reino Unido | 454 | DPPC y E | Rx | 12-20 F | Estreptocinasa: 250.000 UI; 1 dosis/12h/3días | 15,5 | 14 | 15,5 | 14,5 |
| N.S. | N.S. | |||||||||
| Rahman et al.61 | Reino Unido | 210 | DPPC y E | Rx | <15 F | t-PA y DNasa: 10 mg+5mg; 1 dosis/12h/3 días | 8 | 4 | 4 | 16 |
| N.S. | p = 0,03 | |||||||||
| Davies et al.63 | Reino Unido | 24 | DPPC y E | Rx, ET, TC | 14 F | Estreptocinasa: 250.000 UI; 1 dosis/24h/3 días | 0 | 0 | 0 | 25 |
| N.S. | No aportado | |||||||||
| Bouros et al.64 | Grecia | 31 | DPPC y E | ET, TC | 28-32 F | Urocinasa: 100.000 UI; 1 dosis/24h/3 días | 0 | 0 | 13 | 38 |
| N.S. | p < 0,05 | |||||||||
| Tuncozgur et al.65 | Turquía | 49 | E estadio IIb | Rx, ET, TC | 24-36 F | Urocinasa: 100.000 UI;1 dosis/24h/3 días | 0 | 0 | 29 | 60 |
| N.S. | p < 0,001 | |||||||||
| Diacon et al.66 | Sudáfrica | 53 | DPPC y E | Rx, ET | 24-28 F | Estreptocinasa: 250.000 UI; 1 dosis/24h/7 días | 4,5 | 4,5 | 14 | 45,5 |
| N.S. | p < 0,02 | |||||||||
| Misthos et al.67 | Grecia | 127 | E | Rx, ET | 28-32 | Estreptocinasa: 250.000 UI; 1 dosis/24h/3 días | 1,7 | 4,2 | 12,3 | 32,9 |
| p < 0,001 | p < 0,05 | |||||||||
DPP: derrame pleural paraneumónico; DPPC: derrame pleural paraneumónico complicado; E: empiema; ET: ecografía torácica; F: French; N.S.: no significativo; Pbo: grupo placebo; Rx: radiografía; TC: tomografía computarizada; Tto: grupo tratamiento
La cirugía (drenaje por videotoracoscopia asistida [VATS]; toracotomía con decorticación pleural, u otro tipo de drenaje quirúrgico abierto) hay que valorarla cuando falla el tratamiento médico (antibióticos, DT y fibrinolíticos) tras un periodo de 5-7días16,19,55, o cuando ya se ha establecido el empiema organizado y existe una importante fibrosis pleural. El hallazgo precoz de un LP purulento o de loculaciones no es predictivo de la necesidad de cirugía2. La VATS permite, además del desbridamiento pleural, realizar decorticaciones en los empiemas avanzados o crónicos. En estos últimos los resultados no son tan favorables, ya que el mayor éxito se obtiene cuando se hace de forma precoz. No obstante, la tasa global de éxito de esta técnica sobrepasa el 85%68. Varios estudios han comparado el tratamiento conservador (antibióticos y DT con/sin fibrinolíticos) con la VATS como tratamiento de primera línea, tanto en niños como en adultos. El enfoque quirúrgico precoz no ha demostrado ventajas en la mortalidad ni en la morbilidad grave en ningún ensayo69. Además, la cirugía no está exenta de complicaciones, destacando las neuralgias intercostales poscirugía pleural. El papel de la decorticación por toracotomía en el empiema es cada vez menor, en relación directa con el aumento de la evidencia de que la VATS es al menos comparable, o incluso superior70, y suele reservarse para aquellos casos en los que fallan los procedimientos menos invasivos.
NutriciónUna pobre nutrición es un determinante adverso en el resultado de un empiema pleural que habitualmente no se tiene en cuenta. Las IP que se asocian a hipoalbuminemia tienen un peor resultado16,19,55, y debería proporcionarse un adecuado soporte nutricional, incluida la alimentación enteral complementaria, desde el momento del diagnóstico.
Profilaxis antitrombóticaTodos los pacientes ingresados por neumonía y/o IP deberían recibir profilaxis con heparinas de bajo peso molecular, si no están contraindicadas16,19,55.
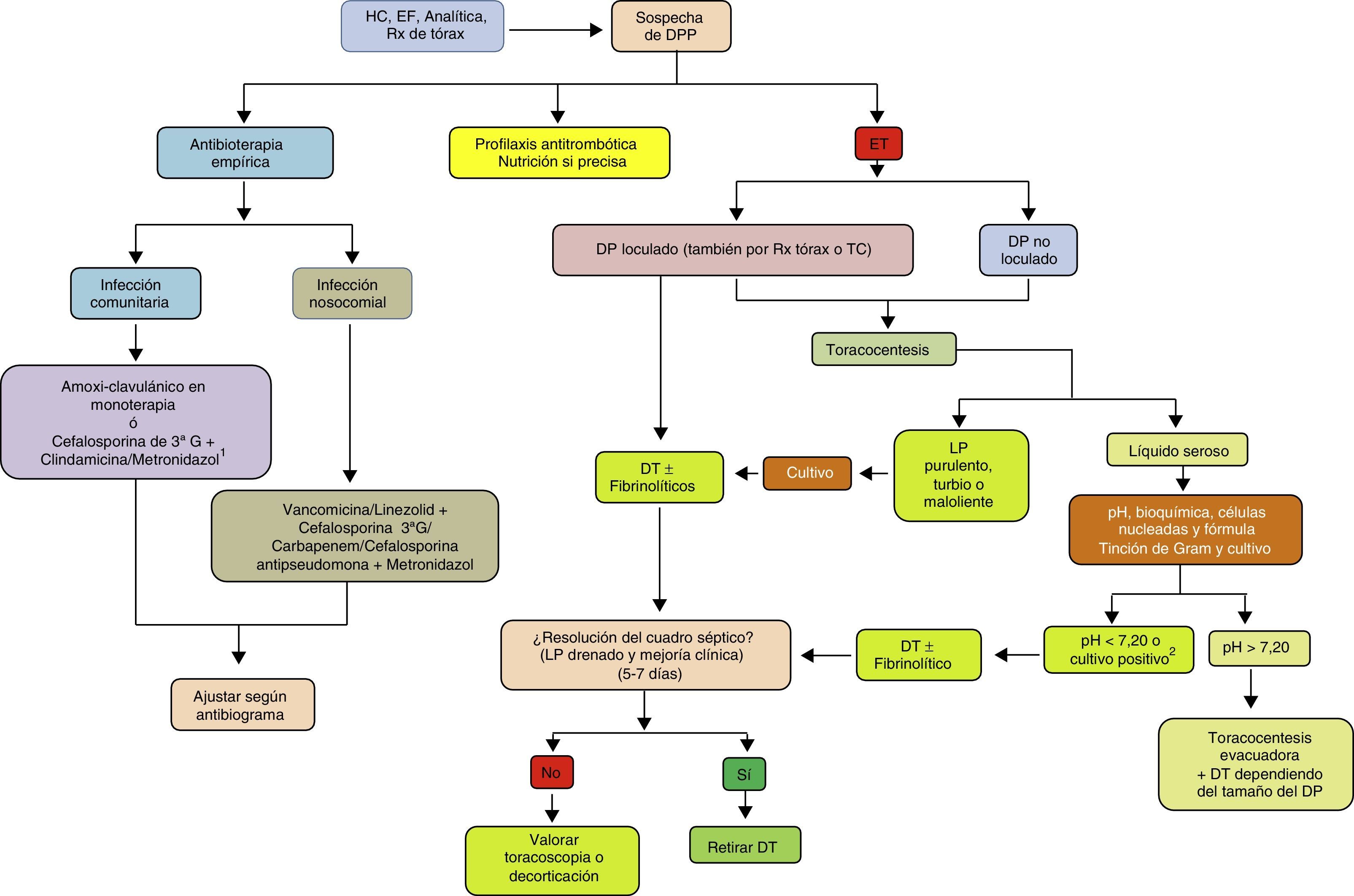
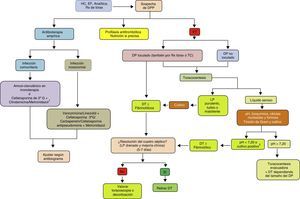
ConclusionesLa incidencia del DPP está aumentando en todo el mundo y en todos los grupos de edad. Aunque relacionado con la neumonía, existe poca correlación entre los organismos que se encuentran en el espacio pleural y los que se observan en las infecciones del parénquima pulmonar, lo que sugiere que la IP primaria es más frecuente de lo que se piensa. Los métodos diagnósticos actuales se enfocan en poder predecir si un DPP va a evolucionar hacia un DPPC/empiema. Su diagnóstico y la instauración precoz de medidas como la pauta antibiótica y el DT siguen siendo la base del tratamiento. En un grupo de pacientes, los fibrinolíticos contribuyen a una mejor recuperación, y su combinación con DNasa se relaciona con la obtención de mejores resultados. Si es necesaria la cirugía, cada vez hay más evidencia de que la rentabilidad de la VATS es igual, si no superior, a la decorticación por toracotomía, por lo que esta se reservaría para los casos en los que fallan los procedimientos menos invasivos (fig. 4). Se necesitan nuevos ensayos clínicos que conformen estrategias diagnósticas y terapéuticas basadas en la evidencia, que proporcionen un manejo más efectivo y estandarizado de esta enfermedad.
Algoritmo para el tratamiento del derrame pleural paraneumónico.
DP: derrame pleural; DPP: derrame pleural paraneumónico; DT: drenaje torácico; EF: exploración física; ET: ecografía torácica; G: generación; HC: historia clínica; LP: líquido pleural; Rx: radiografía; TC: tomografía computarizada.
1 Si alergia a la penicilina: quinolona+metronidazol.
2 Si no se puede determinar el pH, utilizar LDH>1.000UI/l o glucosa <60mg/dl.
Ferreiro L. Autora y redactora. Concepción y diseño. Aprobación final del manuscrito.
San José ME. Coautora. Redactora. Aprobación final del manuscrito.
Valdés L. Redactor y autor. Concepción y diseño. Aprobación final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.