Las micosis son enfermedades graves y potencialmente letales. Con el desarrollo de terapias inmunosupresoras y técnicas de soporte vital, la inmunosupresión en sus diferentes grados es cada vez más prevalente. El deterioro de la respuesta inmune es el factor de riesgo principal para el desarrollo de las micosis oportunistas. El diagnóstico y tratamiento precoces son factores cruciales para mejorar el pronóstico de estas enfermedades. Sin embargo, los aislamientos mediante cultivos o las técnicas de detección antigénicas no son capaces de distinguir entre colonización e infección invasiva, y las biopsias rara vez se pueden realizar por la situación clínica. Ello sitúa al médico en una situación de incertidumbre en la que debe reconocer precozmente los signos clínicos y radiológicos e interpretar los resultados microbiológicos en su contexto. El objetivo de esta revisión es aportar una visión general del perfil de paciente que sufre estas infecciones, el papel de su sistema inmune, y de forma más detallada, los principales avances diagnósticos más reconocidos y recomendados por la comunidad científica.
Mycoses are serious diseases with potentially fatal outcome. The introduction of immunosuppressive treatments and life support techniques has led to a growing prevalence of different degrees of immunosuppression. Compromised immune response is the primary risk factor for the development of opportunistic mycoses. Early diagnosis and treatment are crucial for improving prognosis. However, isolation in cultures or identification using antigen detection techniques cannot distinguish between colonization and invasive infection, and the clinical status of the patient often prevents biopsy sampling. Clinicians thus find themselves in an uncertain position, requiring them to quickly recognize clinical and radiological signs and interpret microbiological results in context. The aim of this review is to provide a general overview of the profile of patients susceptible to these infections, the role of the immune system and, in more detail, the major diagnostic developments that have gained most acceptance and recognition among the scientific community.
Los hongos son un amplio reino eucariota del que pocos miembros son capaces de producir enfermedad. La presente revisión centra el análisis en aquellos hongos que producen patología respiratoria en estados de inmunosupresión mediante invasión tisular. Por tanto, no son objeto de revisión los procesos secundarios a una respuesta inmune desadaptativa (aspergilosis broncopulmonar alérgica) o las micosis endémicas, menos frecuentes y menos dependientes del estado inmune.
Las micosis oportunistas son producidas por hongos ubicuos, que incluso forman parte de la flora comensal. El control de la invasión micótica se realiza mediante la integridad de piel y mucosas, la actividad de los neutrófilos, y la respuesta inmune celular mediada por linfocitos CD4 y macrófagos. No existe una respuesta común a todos los hongos, sino que presenta datos diferenciales; ello justificaría que el deterioro de linfocitos CD4 se relacione con hongos como Pneumocystis y Cryptococcus, mientras que la neutropenia favorece infecciones por Aspergillus u hongos mucorales.
Las formas de inmunodepresión asociadas a estas micosis están recogidas en la tabla 1. Merece la pena destacar que muchos de los factores de riesgo señalados llevan aparejado el uso de corticoterapia a dosis elevada, de manera crónica, lo que refuerza la necesidad de ajustar la inmunosupresión y plantear alternativas terapéuticas a estos fármacos.
Factores de riesgo para el desarrollo de micosis oportunistas
| • Disrupción de las barreras naturales: mucositis, vías venosas, heridas quirúrgicas, intubación |
| • Neutropenia prolongada |
| • Neoplasias hematológicas, asociadas o no a trasplante de precursores hematopoyéticos o enfermedad injerto contra huésped |
| • Neoplasias malignas sólidas diseminadas |
| • Trasplantes de órganos sólidos |
| • Infección por VIH, especialmente con recuento de linfocitos CD4 menor de 200 células/mm3 |
| • Neumopatías crónicas |
| • Conectivopatías |
| • Fármacos inmunosupresores: principalmente los corticoides. Otros inmunosupresores asociados son los fármacos anti-TNFα y el alemtuzumab |
Las manifestaciones clínicas de las micosis pulmonares no son específicas, y aunque en el contexto de una inmunosupresión conocida la sospecha es más sencilla, este enfoque no debe ser unidireccional: la presencia de un cuadro pulmonar difuso con evolución tórpida debe alertar sobre una posible infección fúngica y buscar una posible inmunosupresión subyacente. Una anamnesis y exploración detalladas pueden mostrar datos orientativos: afectación de senos paranasales sugerentes de Mucor, afectación cutánea en formas diseminadas que faciliten biopsias, etc.
Respecto al diagnóstico, la radiografía de tórax puede resultar incluso normal. La tomografía computarizada (TC) torácica es por ello de elección. Son características comunes la presencia de infiltrados bilaterales difusos con áreas de vidrio deslustrado y/o patrones multinodulares, si bien no son específicos1. Los cultivos microbiológicos o la detección de antígenos fúngicos pueden resultar positivos en el seno de una colonización, disminuyendo su valor diagnóstico. Las pruebas serológicas tienen escasa rentabilidad en pacientes con deterioro inmune. Clásicamente se señala la biopsia como la prueba inequívoca que muestra la proliferación fúngica invasiva, pero en muchos casos la situación clínica del paciente impide realizarla. Además, la extrema gravedad de estas infecciones obliga a instaurar un tratamiento empírico adecuado de forma precoz.
La European Organization of Research and Treatment of Cancer/Mycoses Study Group (EORTC/MSG) ha acuñado la terminología de micosis invasiva probada (anatomía patológica compatible o cultivo positivo en medio estéril), probable (evidencia microbiológica de menor grado, en paciente con factores de riesgo y cuadro clínico apropiado) y posible (pacientes con cuadro clínico y factores de riesgo, a pesar de ausencia de resultados microbiológicos)2. Todo ello traduce un esfuerzo en unificar criterios y ayudar al clínico en la gestión de la incertidumbre diagnóstica.
En lo referente al tratamiento es necesario resaltar que no depende exclusivamente del uso de antifúngicos, sino también de revertir o reducir el grado de inmunosupresión, en búsqueda de un equilibrio poco definido. Un estado de inmunosupresión irreversible escasamente responderá al tratamiento antifúngico, pero la recuperación inmunológica puede suponer un empeoramiento clínico secundario a la respuesta inflamatoria. Este hecho es bien conocido en sujetos con VIH, pero también está descrito en pacientes no VIH3.
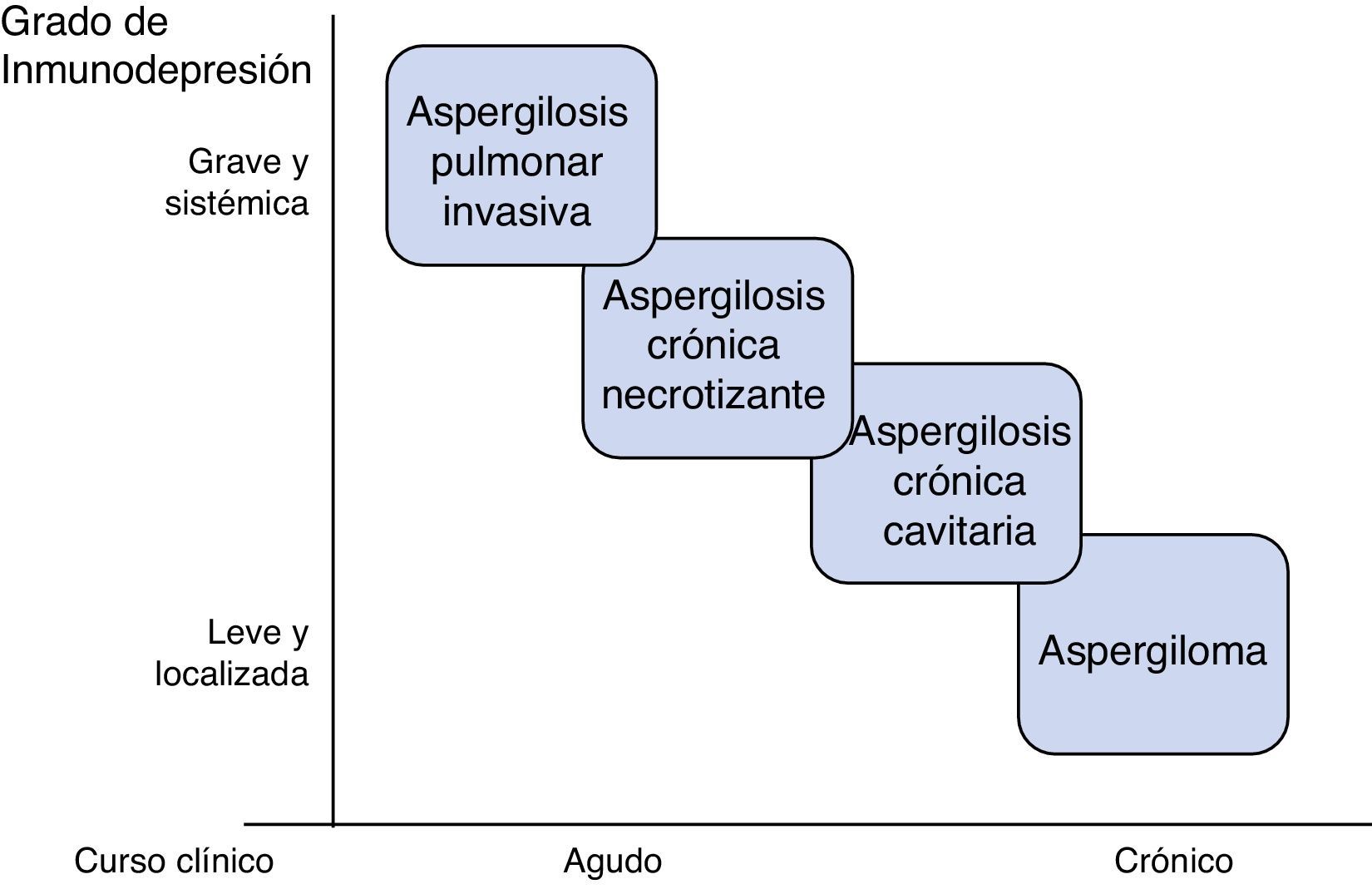
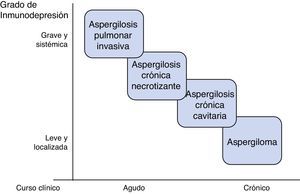
AspergilosisEs la principal micosis pulmonar en pacientes críticos4. Destacan las especies: fumigatus, flavus, niger y terreus. Se adquieren por inhalación de conidias, pero la actividad de los macrófagos alveolares y neutrófilos es capaz de erradicarlas en situación de competencia inmune. La patología se desarrolla por deterioro de esa línea defensiva, o, más raramente, inhalación excesiva de conidias como ocurre en derrumbamientos o grandes catástrofes5. Se describen diferentes formas clínicas pulmonares, entre las que cabe destacar: aspergilosis pulmonar invasiva (API), aspergilosis crónica y aspergiloma6. Las características del enfermo determinan el tipo y la gravedad de la aspergilosis (fig. 1); estados de inmunosupresión grave y generalizada como la neutropenia prolongada, se asocian con cuadros invasivos agudos, mientras que estados de inmunosupresión moderados y localizados, como la presencia de cavernas, favorecen formas como el aspergiloma.
Aspergilosis pulmonar invasivaEs la forma más grave con una mortalidad cercana al 50%. Se produce por proliferación masiva de Aspergillus, con invasión tisular y elevado tropismo vascular que favorece fenómenos de isquemia y diseminación.
Suponen factores de riesgo mayores: la neutropenia prolongada en el seno de neoplasias hematológicas, el trasplante de precursores hematopoyéticos (TPH) y el trasplante de órganos sólidos, especialmente pulmonar y cardiaco. Otros factores considerados intermedios son: ingreso en unidad de cuidados intensivos, enfermedad pulmonar obstructiva crónica (EPOC) en tratamiento con corticoides inhalados o sistémicos, quimioterapia y radioterapia, sida, etc.5,7. A pesar del diferente peso de los factores de riesgo, por su elevada prevalencia, la mayor parte de los cuadros de API en pacientes críticos se asocian principalmente a EPOC y al uso prolongado de corticoides4.
Cursa con fiebre, tos, expectoración, hemoptisis, disnea y dolor pleurítico. Puede asociar afectación traqueobronquial, especialmente en trasplante pulmonar8. En caso de diseminación puede afectar a la piel, el sistema nervioso central (SNC), el hígado y los riñones5.
El TC muestra áreas en vidrio deslustrado con múltiples nódulos y lesiones cavitadas. Las lesiones nodulares pueden presentar hemorragia perinodular dando el aspecto típico del signo del halo. Posteriormente, en su evolución se produce necrosis periférica y cavitación con el signo del menisco aéreo, o necrosis y atenuación central con el signo del halo inverso. Estos signos radiológicos, clásicamente relacionados con API, pueden ser imitados por otras micosis e incluso otras infecciones no fúngicas. Además muchos pacientes no los desarrollan, especialmente aquellos con corticoterapia y sin neutropenia9,10.
Los cultivos de esputo o lavado bronquioalveolar (LBA) presentan ciertas limitaciones: baja sensibilidad (hasta el 50% de las API muestran cultivos negativos) y especificidad subóptima por no diferenciar la infección de una posible colonización. Sin ir más lejos se estima que en trasplantados de pulmón el 30-60% de los cultivos positivos son secundarios a colonización. Los hemocultivos carecen de rentabilidad por ser negativos incluso en formas diseminadas4,11.
Con la finalidad de mejorar la sensibilidad y de reducir el tiempo de espera de los cultivos, se han propuestos diversas técnicas diagnósticas. El galactomanano es un componente de la pared celular de Aspergillus. Su determinación en suero tiene una sensibilidad del 71% y una especificidad del 89% en pacientes oncohematológicos12. Su rendimiento es menor en trasplantados o con EPOC13,14. La determinación de galactomanano en LBA incrementa la sensibilidad y especificidad frente a la determinación en sangre, tanto en pacientes oncohematológicos como en otros grupos15. Sin embargo, se han detectado falsos positivos relacionados con el uso de betalactámicos, colonización por Bifidobacterium y presencia de histoplasmosis, blastomicosis o penicilinosis16,17.
Otro antígeno de la pared de Aspergillus es el 1,3-β-D-glucano, y su determinación en suero arroja resultados similares a los del galactomanano. Sin embargo, es menos específico por formar parte de la estructura de la mayoría de hongos, entre ellos Candida y Pneumocystis y por tanto resultar positivo en otras micosis invasivas17. Finalmente se ha propuesto el uso de técnicas de reacción en cadena de la polimerasa (PCR) en LBA con una sensibilidad y especificidad de 91 y 92% respectivamente18. La biopsia supone la prueba definitiva, pero muchas veces es impracticable por la situación de inestabilidad clínica del enfermo.
El retraso terapéutico está asociado a mayor mortalidad19. Por tanto, ante una sospecha fundamentada se debe iniciar el tratamiento. El antifúngico de elección es el voriconazol mientras que la anfotericina B liposomal es una alternativa. Son de segunda línea el posaconazol, la caspofungina o la micafungina. La duración del tratamiento es de un mínimo de 12 semanas, y debe ser individualizada en función de la resolución de las lesiones o la estabilización prolongada de las mismas. Puede ser útil la monitorización de los niveles del galactomanano en sangre. La cirugía se reserva para desbridamiento de zonas necróticas superficiales e invasión de pericardio o grandes vasos por contigüidad. Los estimulantes de granulocitos se emplean en casos de neutropenia pero no existe evidencia de reducción de mortalidad7,10,20,21.
AspergilomaBola fúngica compuesta por hifas, fibrina, moco y detritus celulares, desarrollada en el interior de una cavidad pulmonar preexistente secundaria a tuberculosis, neoplasia, etc. Clínicamente tiene un curso asintomático o con síntomas locales a modo de tos y/o hemoptisis, ocasionalmente grave. En la TC se objetiva la lesión, que suele ser aislada y con escasos cambios evolutivos. Los cultivos de muestras respiratorias y los anticuerpos frente al Aspergillus (precipitinas) suelen ser positivos. Respecto al tratamiento, en formas asintomáticas se recomienda vigilancia en tanto que en formas sintomáticas el tratamiento de elección es la resección quirúrgica. Los antifúngicos orales o intralesionales no han demostrado eficacia a largo plazo, y su uso queda restringido a casos sintomáticos no susceptibles de cirugía5,10,22,23.
Aspergilosis pulmonar crónicaLa aspergilosis pulmonar crónica constituye un amplio espectro clínico secundario a la infección subaguda o crónica por Aspergillus. Se produce por crecimiento fúngico local de predominio en lóbulos superiores; la diseminación es excepcional. El principal factor de riesgo es la presencia de una neumopatía crónica que genere algún grado de inmunosupresión local: tuberculosis, infección por otras micobacterias, asma y EPOC con corticoterapia, neoplasia pulmonar y bullas. Se ha asociado con polimorfismos en lectinas de unión a manosa, déficit de surfactante y deficiencia de producción de interferón22,23.
La clasificación más aceptada subdivide la aspergilosis pulmonar crónica en 3 formas: cavitaria, necrosante o necrotizante, y fibrosante24. Las características del paciente y la eficacia de su sistema inmune determinan el subtipo clínico.
- A.
Aspergilosis crónica cavitaria: consiste en un cuadro progresivo caracterizado por el desarrollo de múltiples nódulos pulmonares cavitados. El curso clínico es crónico, de meses de duración, y en él destacan síntomas generales como pérdida de peso, malestar general, sudoración nocturna, febrícula o fiebre. Los síntomas respiratorios son escasos e inespecíficos: tos crónica productiva, posible hemoptisis y disnea. En la TC se objetiva la afectación multinodular, con progresión a cavidades de pared gruesa, sobre las que pueden formarse aspergilomas23,25.
- B.
Aspergilosis crónica necrosante: algunos autores la consideran una forma subaguda de API. Ocurre en pacientes con mayor grado de inmunosupresión, y se caracteriza por una progresión clínica más rápida y agresiva que la cavitaria, con mayor grado de invasión y destrucción tisulares. En su presentación, además de los síntomas generales, hay mayor frecuencia de fiebre y la clínica respiratoria es más florida. La TC revela afectación parcheada con áreas de necrosis; las cavidades suelen presentar pared más fina y es posible objetivar el signo del menisco aéreo propio de la API23,25.
- C.
Aspergilosis crónica fibrosante: evolución tardía de la forma cavitaria o, más raramente, de la necrosante. En ella se evidencia una fibrosis progresiva en pruebas de imagen, con repercusión en las pruebas funcionales respiratorias.
La sospecha diagnóstica se basa en los hallazgos clínico-radiológicos. En la analítica destaca la elevación de reactantes inflamatorios, y las precipitinas son positivas en la mayoría de los casos. Puede detectarse IgE frente a Aspergillus sin datos de aspergilosis broncopulmonar alérgica. La positividad del cultivo de esputo es cercana al 40-50%, rentabilidad que se incrementa con PCR o detección de galactomamano en muestras respiratorias. Aunque con menos frecuencia que en la API, el galactomanano puede estar elevado en sangre, especialmente en las formas necrotizantes.
En el contexto clínico-radiológico adecuado, la presencia de precipitinas o cultivos positivos es muy sugerente de esta entidad clínica. Sin embargo, algunos pacientes tienen resultados microbiológicos negativos; además existen procesos intercurrentes o imitadores (infección por micobacterias especialmente), por lo que muchas veces se hace necesaria la realización de broncoscopia para la obtención de muestras de mayor rentabilidad. El diagnóstico definitivo lo aporta la biopsia, con las hifas, necrosis local y/o reacción granulomatosa. No suele haber angioinvasión, y de existir es más frecuente en las formas necrotizantes22,23,25.
El tratamiento de las formas crónicas de aspergilosis se realiza mediante azoles orales (itraconazol o voriconazol) de manera prolongada, incluso indefinida por alto riesgo de recurrencia. Son alternativas el posaconazol, o anfotericina B en casos graves. Así mismo se recomienda optimizar la inmunidad en caso de ser posible. Hay casos aislados en la literatura de mejoría con inferferón23,25. Para la monitorización terapéutica se recomienda vigilancia clínico-radiológica y del título de precipitinas10,21. A pesar del tratamiento, el control de la infección a medio o largo plazo muchas veces es subóptimo.
La profilaxis primaria de la aspergilosis es motivo de debate. Las principales indicaciones están recogidas en la tabla 226–28. En pacientes oncohematológicos con neutropenia que previsiblemente durará menos de 7 días, o tumores sólidos con quimioterapia convencional se desaconseja su uso. El fármaco más recomendado en las distintas guías es el posaconazol, por ser el más estudiado en ensayos clínicos y tener la ventaja de ser activo frente a hongos mucorales. El voriconazol es una alternativa razonable.
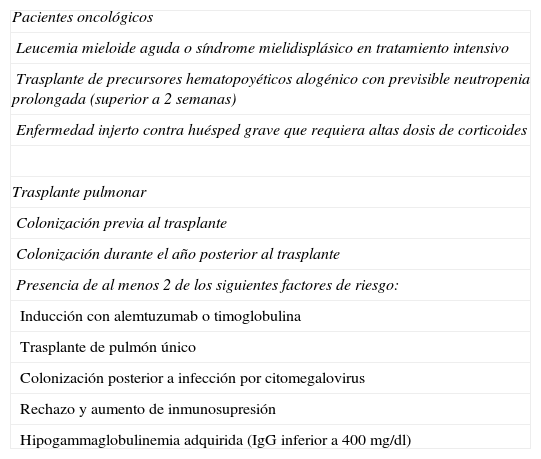
Principales indicaciones de profilaxis primaria para la aspergilosis
| Pacientes oncológicos |
| Leucemia mieloide aguda o síndrome mielidisplásico en tratamiento intensivo |
| Trasplante de precursores hematopoyéticos alogénico con previsible neutropenia prolongada (superior a 2 semanas) |
| Enfermedad injerto contra huésped grave que requiera altas dosis de corticoides |
| Trasplante pulmonar |
| Colonización previa al trasplante |
| Colonización durante el año posterior al trasplante |
| Presencia de al menos 2 de los siguientes factores de riesgo: |
| Inducción con alemtuzumab o timoglobulina |
| Trasplante de pulmón único |
| Colonización posterior a infección por citomegalovirus |
| Rechazo y aumento de inmunosupresión |
| Hipogammaglobulinemia adquirida (IgG inferior a 400mg/dl) |
Respecto a la profilaxis en pacientes sometidos a trasplante pulmonar, existe bajo grado de evidencia de las diferentes recomendaciones por ausencia de estudios adecuados29,30. En la práctica habitual existe una tendencia a la profilaxis antifúngica universal31. La pauta adecuada de profilaxis tampoco está bien definida, pero se suele emplear alguno de los azoles activos frente a Aspergillus (itraconazol, voriconazol o posaconazol) y/o anfotericina B inhalada.
MucormicosisEnfermedad producida por hongos del orden de los mucorales. Los géneros más implicados son: Rhizopus, Mucor y Rhizomucor.
Se adquiere por inhalación o a través de soluciones de continuidad en piel y mucosas. Producen rápida invasión vascular, trombosis y necrosis secundaria32. La mucormicosis presenta factores de riesgo similares a la aspergilosis, pero además destacan otros como la diabetes mellitus con mal control metabólico, la sobrecarga férrica y el uso de desferroxamina. Existe controversia sobre si el uso de profilaxis con voriconazol podría favorecer la mucormicosis32–35; la razón de esta relación no ha sido aclarada pero se postula que podría ser secundaria a un desplazamiento de Aspergillus con selección positiva para mucorales, la mayoría resistentes a voriconazol. Paradójicamente es poco habitual en VIH salvo en casos asociados a uso de drogas parenterales y corticoterapia32.
Las localizaciones más frecuentes son los senos paranasales, los pulmones y la piel. La forma rinoorbitaria destaca en diabéticos, en tanto que las formas pulmonares predominan en pacientes hematológicos. La afectación pulmonar se comporta como una neumopatía intersticial micronodular muy grave y rápidamente invasiva. Tiene una mortalidad cercana al 70-75%32,36. Cursa con disnea, tos, dolor torácico y hemoptisis, ocasionalmente masiva. Además presenta alta capacidad para producir cavitación e invasión progresiva que puede afectar al pericardio, la pleura, el mediastino y la pared torácica. Al igual que Aspergillus, también puede producir afectación endobronquial y obstrucción de vía aérea20. Los hallazgos radiológicos son muy variados: infiltrados, nódulos, cavitaciones, atelectasias, derrame pleural y linfadenopatías mediastínicas. Como Aspergillus produce el signo del halo y, más característicamente, el signo del halo inverso32,37.
Como puede apreciarse la presentación es similar a la API; algunos datos orientativos de mucormicosis son: mayor afectación rinosinusal, palatina o facial, o presencia de inflamación del tejido subcutáneo torácico38. Respecto a los hallazgos radiológicos la presencia de más de 10 nódulos y el derrame pleural son factores más asociados a mucormicosis que a API39. Así mismo, el galactomanano y el 1,3-β-D-glucano son negativos en esta micosis. El antecedente de uso de voriconazol o la ausencia de respuesta a este apoyan la sospecha. Ninguno de estos hallazgos es específico pero orientan a la espera de resultados microbiológicos.
El diagnóstico lo aportan los cultivos respiratorios o biopsias. Dado que su presencia en muestras respiratorias es poco habitual, su aislamiento en un contexto clínico adecuado se considera diagnóstico. Los hemocultivos son negativos incluso en formas invasivas37,38.
El tratamiento también debe ser precoz40,41 mediante reversión de los factores de riesgo, desbridamiendo quirúrgico de zonas accesibles y antifúngicos32. Solo la anfotericina B y el posaconazol tienen eficacia conocida. La anfotericina B es el tratamiento de primera línea empleándose el posaconazol en casos de deterioro de la función renal y en la secuenciación oral para el tratamiento de mantenimiento. La duración tampoco está establecida y se recomienda individualizar en función de la respuesta clínica y la remisión de las lesiones20,21,38,42,43. La cirugía juega un papel fundamental en las formas locales. La efectividad de los estimulantes de granulocitos en pacientes neutropénicos tampoco ha sido definida en esta micosis42,44.
CriptococosisLas especies patógenas más importantes son Cryptococcus neoformans (C. neoformans) y la emergente, Cryptococcus Gatti (C. gatti). Son ubicuos, se aíslan en suelos, especialmente en aquellos transitados por aves y murciélagos45. Si bien C. neoformans tiene una distribución universal, C. gatti es más frecuente en áreas subtropicales, con un incremento en los últimos años en algunas zonas del Pacífico Norte46.
La capacidad invasiva de Cryptococcus se debe a la expresión de una cápsula polisacárida, con propiedades antifagocíticas. La vía respiratoria es la puerta de entrada para producir su cuadro clínico paradigmático: meningitis y meningoencefalitis. Sin embargo, su tránsito pulmonar puede ser bloqueado por una reacción inmune celular y desarrollo de granulomas, o en caso de inmunodepresión, producir invasión47–49.
El principal factor de riesgo es la infección por VIH, especialmente con niveles de linfocitos CD4 por debajo de 100 células/mm3, dominando el cuadro clínico la afectación del SNC50. En otros estados de inmunosupresión, como las enfermedades pulmonares crónicas, pacientes con corticoterapia prolongada o receptores de trasplante de órgano sólido, se produce un cuadro de predominio respiratorio21,51. En el caso de C. gatti se produce afectación pulmonar incluso en inmunocompetentes46.
La criptococosis pulmonar se caracteriza por un cuadro febril de disnea, tos seca, sudoración nocturna y deterioro respiratorio progresivo, ocasionalmente fulminante47,52,53. Las formas pulmonares graves presentan riesgo de diseminación al SNC y otras localizaciones, especialmente a la piel54.
El patrón radiológico más habitual es de afectación nodular múltiple. Las formas reticulonodulares son más propias de los cuadros invasivos. También es posible la afectación como consolidación lobar o segmentaria. Pueden aparecer adenopatías torácicas. El derrame pleural o la cavitación son excepcionales55.
Su presencia como colonizador no suele ser habitual, por lo que su aislamiento en cultivo de esputo o LBA en el contexto clínico es suficiente para el diagnóstico. La determinación de antígeno de Cryptococcus en plasma es muy útil, pero puede ser negativa en las formas pulmonares limitadas53,56. La detección de antígeno en esputo o LBA muestra resultados inconsistentes47. El estudio del líquido cefalorraquídeo (LCR) se realiza mediante tinción de tinta china, detección de antígeno y/o cultivo. La punción lumbar no se recomienda de rutina en todas las formas pulmonares, sino en presencia de síntomas neurológicos, inmunodepresión grave, datos de diseminación, o presencia de títulos altos de antígeno en suero57.
El tratamiento de las formas pulmonares ha sido poco estudiado y las principales recomendaciones se basan en la experiencia terapéutica de la afectación del SNC en pacientes con infección por VIH. Para cuadros respiratorios leves o moderados se recomienda fluconazol durante 6-12 meses20,21,47,58. En cuadros graves o con afectación del SNC se recomienda al menos 2 semanas de terapia combinada con anfotericina B y flucitosina21,58,59. Tras ese tratamiento se procede a secuenciar con fluconazol durante 6-12 meses. La duración del tratamiento se debe individualizar en función de los factores de riesgo y de si ha revertido el estado de inmunosupresión; por ejemplo en sujetos con VIH debe mantenerse hasta controlar la replicación viral y obtener una cifra de linfocitos CD4 por encima de 100 células/mm3 de forma estable. Además se debe retrasar al menos 4-8 semanas el inicio de la terapia antirretroviral para evitar el síndrome de reconstitución inmune, subrayándose una vez más el difícil equilibrio inmunológico que se requiere en el manejo de las micosis oportunistas56,60.
NeumocistosisPneumocystis jirovecii es un hongo atípico de adquisición por vía aérea incluso desde la infancia61. El principal factor de riesgo para el desarrollo de esta micosis es la presencia de infección por VIH especialmente con niveles de CD4 por debajo de 200 células/mm3. Sin embargo, también se produce en otros estados de inmunosupresión celular comunes a otras micosis62,63. Cabe destacar que los corticoides han sido los inmunosupresores más implicados, especialmente con las modificaciones en su dosis, tanto incrementos, como descensos desde dosis previamente elevadas64,65.
El cuadro clínico en pacientes con infección por VIH es subagudo, con fiebre, tos seca y disnea progresiva, así como síndrome constitucional y pérdida de peso. Sin embargo, en inmunodeprimidos VIH negativos, la clínica suele ser más aguda, de pronóstico más grave y con mayores tasas de fracaso respiratorio agudo, necesidad de soporte ventilatorio y mortalidad64,66–69. Algunos autores han relacionado este exceso de mortalidad en pacientes no VIH con un estado de inmunodepresión más grave, y con el retraso diagnóstico-terapéutico al existir menor grado de sospecha67.
La radiografía puede mostrar infiltrados intersticiales bilaterales difusos. La TC define mejor las áreas bilaterales de vidrio deslustrado, y posibles neomatoceles y neumotórax por destrucción parenquimatosa local. Rara vez se aprecian infiltrados lobares, nódulos, cavitaciones o derrame pleural. La normalidad de la TC debe hacer dudar del diagnóstico70.
Los niveles de 1,3-β-D-glucano también se elevan en sangre en esta micosis, por lo que muchos autores han planteado que su determinación en paciente de alto riesgo y con cuadro clínico compatible puede ser suficiente para el diagnóstico. Sin embargo, dada la asociación de neumocistosis con otros procesos intercurrentes, se recomienda procurar un diagnóstico más específico71,72. Puesto que no puede cultivarse, se recurre a la visualización mediante técnicas de inmunofluorescencia, de alta rentabilidad. Se puede emplear el esputo inducido, con una sensibilidad variable entre 55-90%, o LBA con sensibilidad cercana al 90-100%. La biopsia rara vez es necesaria. El valor de la PCR está por definir73.
Ante la sospecha clínica debe iniciarse tratamiento y no diferirlo por la obtención de muestras respiratorias; son necesarias varias semanas de terapia para lograr su erradicación de las secreciones respiratorias74,75.
Sobre el tratamiento, en pacientes con VIH es de elección el cotrimoxazol durante 21 días. Como alternativas se pueden emplear pentamidina, dapsona, actovacuona o la combinación de clindamicina y primaquina en función de la gravedad. En formas graves se recomienda asociar corticoides76. Además se debe retrasar la terapia antirretroviral al menos 2 semanas68,76,77.
El tratamiento de los pacientes no VIH está menos estudiado y se extienden la mayoría de las recomendaciones en cuanto a los antimicrobianos. La corticoterapia es más controvertida en estos pacientes. Algunos estudios pequeños no han demostrado clara eficacia en términos de mortalidad, por lo que en pacientes que tomaban corticoides previamente se recomienda mantenerlos, e iniciarlos en aquellos casos de inflamación pulmonar grave21,78,79. La profilaxis secundaria se realiza preferentemente con cotrimoxazol hasta la recuperación inmunológica. La profilaxis primaria se realiza también con cotrimoxazol. Son alternativas la actovacuona, la dapsona o la pentamidina aerosolizada. Sus principales indicaciones se enumeran en la tabla 31,27,80,81.
Principales indicaciones de profilaxis primaria contra Pneumocystis jirovecii
| • VIH con recuento de linfocitos CD4 menor de 200 células/mm3 |
| • Tratamiento con prednisona en dosis superiores a 20mg diarios durante más de un mes y presencia de otra causa de inmunosupresión |
| • Tratamiento con alemtuzumab |
| • Leucemia linfoide aguda |
| • Pacientes oncohematológicos con régimen intensivo que incluya análogos de purinas |
| • Receptor de trasplante de precursores hematopoyéticos |
| • Receptor de trasplante de órgano sólido |
| • Enfermedad reumatológica que requiera terapia inmunosupresora de inducción (por ejemplo corticoides y ciclofosfamida) |
Los autores declaran no tener ningún conflicto de intereses.