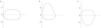En este artículo revisamos primero por pruebas (espirometría, prueba de reversibilidad, flujo espiratorio pico, volúmenes pulmonares, presiones respiratorias máximas, transferencia de monóxido de carbono, gasometría arterial, prueba de marcha de 6min y desaturación con ejercicio y ergoespirometría), y luego por patologías más frecuentes (disnea no aclarada, tos crónica, asma, EPOC, enfermedades neuromusculares, enfermedades intersticiales, enfermedades vasculares pulmonares, valoración preoperatoria y valoración de la discapacidad), la utilidad de las pruebas funcionales respiratorias más habituales desde la perspectiva de la toma de decisiones, de la interpretación clínica o de aspectos que el clínico debe tener en cuenta a la hora de utilizarlas. En consecuencia, no se incide en aspectos de calidad, de la técnica ni de los equipos, salvo referencia a los costos, porque pensamos que es un elemento importante en la toma de decisiones. El documento está ampliamente fundamentado con referencias a la literatura.
In this article, we review the utility of the most common lung function tests (spirometry, reversibility test, peak expiratory flow, lung volumes, maximal respiratory pressure, carbon monoxide transference, arterial blood gas, 6-minute walk test and desaturation with exercise and ergospirometry) related to the most frequent pathologies (dyspnea of undetermined origin, chronic cough, asthma, COPD, neuromuscular diseases, interstitial diseases, pulmonary vascular diseases, pre-operative evaluation and disability evaluation). Our analysis has been developed from the perspective of decision-making, clinical interpretation or aspects that the physician should take into account with their use. Consequently, the paper does not deal with aspects of quality, technique or equipment, with the exception of when regarding costs as we believe that this is an important element in the decision-making process. The document is extensively supported by references from the literature.
El estudio de la función pulmonar es clave en la evaluación diagnóstica y el seguimiento de los pacientes con enfermedades respiratorias. Además tiene otras aplicaciones clínicas muy importantes, como son la evaluación del riesgo quirúrgico, la discapacidad y el pronóstico1. La información que proporcionan es objetiva, precisa, reproducible y fiable.
Son numerosas las pruebas funcionales respiratorias (PFR), y cada una tiene sus indicaciones. Las que podemos denominar como PFR básicas son la espirometría basal y curva flujo volumen, la prueba broncodilatadora y la gasometría arterial. Otras pruebas importantes en la práctica clínica son la prueba de transferencia de monóxido de carbono (DLco), la determinación de los volúmenes pulmonares, las pruebas de provocación bronquial, las pruebas de ejercicio y la determinación de las presiones musculares máximas. En esta revisión presentaremos sus aspectos más relevantes.
Para la realización de todas estas pruebas necesitamos distintos equipos que deben cumplir los requisitos técnicos que se establecen en las normativas vigentes1,2. Igualmente es imprescindible comprobar la calibración de los aparatos previa a su uso, así como seguir las normas de control de la infección e higiene establecidas2. El personal que realiza las pruebas debe estar familiarizado con los equipos y tener la experiencia suficiente en su realización para obtener resultados de calidad. El paciente debe seguir las instrucciones previas de preparación y se le debe explicar cómo realizar correctamente la prueba2.
Pruebas funcionales respiratoriasEspirometría y curva flujo volumenLa espirometría forzada incluye la medición del volumen espiratorio forzado en un segundo (FEV1) y la capacidad vital forzada (FVC), y es la prueba de función pulmonar más accesible y útil. Se necesitan 10 a 15min y un equipo de entre 2.000 y 6.000euros, y prácticamente no conlleva riesgos. Cuesta unos 40euros. Si nuestro espirómetro es capaz de recoger datos más de 30s, también se puede medir la capacidad vital lenta (SVC o VCin). La SVC aumenta la sensibilidad de la espirometría para detectar obstrucción1–3, pero a expensas de una duración mayor de la prueba. Otros parámetros son los flujos mesoespiratorios (MEF25-75%) y los flujos máximos instantáneos al 75%, al 50% o al 25% de la FVC (MEF75%, 50%, 25%). Estos parámetros se consideran indicadores del estado de la vía aérea pequeña y es cierto que se ha observado una correlación estadística en grupos de sujetos, pero son muy poco sensibles por su variabilidad, y los puntos de corte (percentil 5%) se aproximan al 50%4 en sujetos >50 años5.
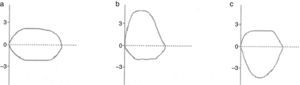
La morfología de la curva flujo volumen es muy útil para detectar la concavidad característica del enlentecimiento de la espiración a volúmenes bajos en los obstructivos6 y la convexidad en los restrictivos6 (fig. 1); además, tiene una forma distintiva en la obstrucción de la vía aérea superior, como se muestra en la figura 2. Hay que notar, sin embargo que la sensibilidad es baja en estenosis traqueales de más 1cm de diámetro7.
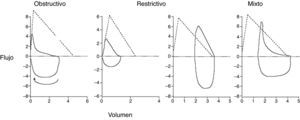
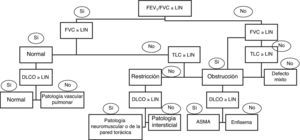
La correcta interpretación de la espirometría requiere su integración con los datos clínicos del paciente, pero en general podemos hablar de patrones funcionales respiratorios: obstructivo, restrictivo y mixto (fig. 3). El parámetro más importante para la identificación de una obstrucción es una relación FEV1/VC <70%2,6. Este punto de corte puede llevar a un número no despreciable de falsos positivos en varones de más de 40años y en mujeres de más de 50años, así como al sobrediagnóstico de obstrucción en personas mayores, asintomáticas y no fumadoras6,8, por lo que se ha recomendado usar el límite inferior del intervalo de confianza (LIN)=Valor medio predicho–(Error estándar de los residuales×1.645)2,6, pero la tradición y el hecho de que este percentil no esté disponible en la mayoría de los equipos hace que se emplee poco.
La espirometría también permite la valoración de la gravedad de la alteración ventilatoria2,6, y para ello se han definido categorías como marco conceptual más sencillo en función del FEV1 post-broncodilatadores para los defectos obstructivos, y según la capacidad vital (VC), o la capacidad pulmonar total (TLC), para los defectos restrictivos2,6. Los puntos de corte de las distintas normativas se muestran en la tabla 1; estos puntos de corte guardan alguna relación con la capacidad de llevar a cabo actividades de la vida diaria, morbilidad y mortalidad en la EPOC9–13, pero son menos relevantes en el asma, donde la hiperreactividad, la variabilidad de la función (y de la clínica) y la respuesta al tratamiento son factores más relevantes que el FEV1 puntual14, y tampoco son relevantes en la obstrucción de las vías aéreas superiores6.
Graduación de la gravedad según distintas normativas
| Alteración obstructiva | Alteración restrictiva | ||
| FEV1 | VC | ||
| ATS/ERS | |||
| Leve | > 70% | Leve | > 70% |
| Moderada | 60-69% | Moderada | 60-69% |
| Moderada grave | 50-59% | Moderada grave | 50-59% |
| Grave | 35-49% | Grave | 35-49% |
| Muy grave | < 35% | Muy grave | < 35% |
| SEPAR | |||
| Leve | > 65% | Leve | > 65% |
| Moderada | 50-64% | Moderada | 50-64% |
| Grave | 35-49% | Grave | 35-49% |
| Muy grave | < 35% | Muy grave | < 35% |
| Clasificación (GOLD) de gravedad de la EPOC | |||
| Estadio I leve | ≥ 80% | ||
| Estadio II moderado | 50-80% | ||
| Estadio III severo | 30-50% | ||
| Estadio IV muy severo | < 30% | ||
ATS: American Thoracic Society; EPOC: enfermedad pulmonar obstructiva crónica; ERS: European Respiratory Society; FEV1: volumen espiratorio forzado en un segundo; GOLD: Global Initiative for Chronic Obstructive Lung Disease; SEPAR: Sociedad Española de Neumología y Cirugía Torácica; VC: capacidad vital.
Aunque en la mayoría de los trastornos restrictivos el empeoramiento clínico se acompaña de una pérdida de la VC, la VC puede estar solo moderadamente disminuida en enfermedades pulmonares intersticiales difusas (EPID) con una marcada pérdida de la capacidad de difusión y alteraciones gasométricas graves6,15–17, y se puede producir insuficiencia respiratoria grave en pacientes con enfermedades neuromusculares rápidamente progresivas que tenían poco antes un VC normal o levemente disminuida6.
Otro aspecto del FEV1 y la VC es que son indicadores generales de salud relacionados con la expectativa de vida incluso en pacientes no fumadores18 (fig. 4).
Relación difusión-volumen alveolar. DLco: transferencia pulmonar de monóxido de carbono por respiración única. VA: volumen alveolar. De Frans et al.52.
La espirometría es muy útil para seguir la evolución y monitorizar los cambios funcionales con el tiempo. En la tabla 2 se describen los puntos de corte para considerar significativo un cambio de acuerdo con lo publicado en la literatura6.
Cambios significativos en las variables espirométricas y de transferencia de monóxido de carbono
| FVC | FEV1 | MEF25-75% | DLco | |
| Diaria | ||||
| Normales | ≥ 5% | ≥ 5% | ≥ 13% | ≥ 7% |
| Pacientes EPOC | ≥ 11% | ≥ 13% | ≥ 23% | |
| Semanal | ||||
| Normales | ≥ 11% | ≥ 12% | ≥ 21% | ≥ 2a |
| Pacientes EPOC | ≥ 20% | ≥ 20% | ≥ 30% | ≥ 1,3 |
| Anual | ≥ 15% | ≥ 15% | ≥ 10% | |
FVC: capacidad vital forzada; FEV1: volumen espiratorio forzado en un segundo; MEF25-75%: flujo mesoespiratorio al 25-75%; DLco: transferencia de monóxido de carbono por respiración única.
aEn mmol·min−1·kPa−1; para transformarlas en las unidades más frecuentemente usadas en Estados Unidos (mL·min−1·mmHg−1), multiplicar por ∼3 (3,013). Tomado de Pellegrino et al.6.
La prueba de reversibilidad cuesta unos 40euros adicionales a la espirometría (80euros en total), está indicada en todos los asmáticos en el momento del diagnóstico19 y, si siguen teniendo obstrucción, en las espirometrías de seguimiento. Como en muchos laboratorios se retira la medicación de forma rutinaria, debemos advertir al paciente y al laboratorio que no la retire si nuestro objetivo es verificar la respuesta al tratamiento (ensayo terapéutico individual).
La propia definición de la EPOC señala que esta enfermedad se caracteriza por «la limitación del flujo aéreo que no es reversible»20 y porque «no hay cambios marcados en la función en un periodo de varios meses»21, es decir, se debe cumplir la condición de que si hubiese reversibilidad, esta no sea total, y para ello se requiere medir el FEV1/VC <70% tras broncodilatadores. De hecho, en estudios epidemiológicos se ha visto que la prevalencia de EPOC disminuye entre el 10 y el 40% usando el FEV1/VC post-broncodilatadores, aunque se desconoce el impacto socioeconómico de dicha diferencia21.
La respuesta positiva a los broncodilatadores no permite diferenciar entre EPOC y asma20,21, aunque las mejorías de más de 400ml tras broncodilatadores o glucocorticoides sugieren la segunda posibilidad21 o, por lo menos, un fenotipo mixto22.
Un concepto que ha cambiado en los últimos años, a raíz de los grandes ensayos clínicos, es que la presencia o ausencia de broncodilatación, salvo que sea muy acusada (es decir, >400ml), no parece predecir con suficiente exactitud ni el alivio sintomático, ni los cambios en la capacidad de ejercicio, ni la respuesta a largo plazo ni a corticoesteroides ni a broncodilatadores23,24 y, por tanto, la prueba de broncodilatadores no tiene valor como guía de tratamiento.
En cuanto al pronóstico, hay abundante evidencia que identifica al FEV1 como un factor de riesgo en la EPOC9–13, y en este caso, como para el diagnóstico, el parámetro óptimo es el FEV1 tras broncodilatadores. Se ha encontrado que la reversibilidad se asocia a una disminución acelerada de la FEV1, pero no todos los estudios encuentran esta asociación25.
El porcentaje de pacientes con EPOC que responden a broncodilatadores es variable. En el estudio UPLIFT26, en el que se administró bromuro de ipratropio y salbutamol y se repetía las espirometría 30min después, el 52% de los pacientes respondieron a broncodilatadores, pero estas cifras eran del 64, del 48 y del 18% según que los pacientes estuviesen en los estadios GOLD II, III o IV. Se ha visto que hasta el 35% de los pacientes con la primera prueba de broncodilatadores negativa la pueden tener positiva en las posteriores. Sin embargo, con dos pruebas se detectan la mayoría de pacientes (el 88%) que ocasionalmente pueden responder al broncodilatador, y por tanto no estaría justificado su uso rutinario en pacientes con EPOC que ya tienen una o a lo sumo dos pruebas de broncodilatación anteriores26.
Se puede usar cualquier fármaco, pero por cuestiones de eficiencia casi siempre se usa un β2-agonista inhalado de acción rápida (el más usado es el salbutamol a dosis de 400μg o 4«pufs» separados 30s y con una correcta maniobra de inhalación), ya que su efecto comienza 5min tras la inhalación y alcanza un máximo tras 20min. Si se usa ipratropio, se recomienda una dosis de 160μg (8puffs) y hacer la espirometría «post» a los 45min. Otra forma de evaluar la reversibilidad es administrar un tratamiento de prueba (ensayo terapéutico individual) y evaluar al paciente a los 30días, advirtiendo al laboratorio y al paciente de que no se ha de retirar la medicación prescrita antes de realizar la prueba de evaluación de efectividad.
Flujo máximo espiratorioEl flujo máximo espiratorio (PEF) es el flujo máximo que una persona puede exhalar durante un breve esfuerzo espiratorio máximo después de una inspiración completa. En los pacientes con asma el PEF se correlaciona con el FEV1, pero no debe usarse como su sustituto. El flujo máximo espiratorio es una medición fácil de hacer con un equipo que cuesta 30euros, pero su popularidad no es grande. Tiene las siguientes utilidades:
DiagnósticoVariaciones superiores al 20% son diagnósticas de asma en el contexto adecuado27. El PEF permite además observar la variabilidad en relación con ciertas exposiciones, como mejoría en vacaciones o empeoramiento al exponerse a ciertos ambientes, que si tiene implicaciones económicas o legales debe comprobarse fehacientemente.
Monitorización de la enfermedadPara ello deberemos establecer el valor inicial realizando mediciones 15 días en condiciones de estabilidad clínica y máximo tratamiento28 y utilizar esta referencia para establecer planes de acción28; sin embargo, no es fácil mantener la adhesión a largo plazo29, y ello limita su uso.
Pruebas de provocación inespecíficaExisten distintas pruebas de provocación inespecífica (ATP, manitol, hiperventilación isocápnica, ejercicio, colorantes alimenticios) útiles en contextos específicos. Estas pruebas llevan tiempo y su coste es de unos 200euros.
La prueba puede estar indicada cuando el diagnóstico de asma está en cuestión (síntomas atípicos, espirometría normal), cuando un paciente es sospechoso de padecer asma ocupacional o asma inducida por irritantes, y cuando se requiere una prueba que descarte el asma en buceadores, deportistas, personal militar u otros individuos en los que el broncoespasmo supondría un peligro inaceptable para ellos o para otras personas, o es requerido por las normas para usar medicación antiasmática30 y no esté contraindicada. En los casos en que el asma se desencadene por el ejercicio, el asma de esfuerzo tenga implicaciones profesionales o ante la persistencia de síntomas con el ejercicio en un asmático correctamente tratado, pueden estar indicadas las pruebas de provocación al ejercicio o hiperventilación isocápnica30.
Aunque las pruebas de provocación bronquial inespecíficas permiten valorar la gravedad del asma y monitorizar su tratamiento, no se usan para estos fines en la clínica30.
Interpretación de la prueba negativaDescarta en general el asma, salvo en ciertos casos de asma alérgica o asma inducida por irritantes en los que la prueba se ha realizado tiempo después de la exposición y de los síntomas30,31.
Interpretación de la prueba positivaAproximadamente del 1 al 7% de la población general asintomática tienen hiperreactividad bronquial (hasta el 26% si se incluyen los fumadores o atópicos)32, aunque hay quien piensa que estos pacientes son asmáticos leves que no perciben sus síntomas30,33; por tanto, el diagnóstico no se debe basar una prueba de hiperreactividad positiva, y se debe confirmar que los síntomas del paciente desaparecen con el tratamiento.
Determinación de los volúmenes estáticos y resistencias pulmonaresEs la determinación de los volúmenes y capacidades pulmonares que no podemos medir en una espirometría, como son el volumen residual (VR), la capacidad residual funcional (FRC) y la capacidad pulmonar total (TLC). Su coste es de unos 150euros. Los métodos más usados son el método de dilución de helio y lavado de nitrógeno (FRC), que suelen poderse medir con el mismo equipo que la difusión de monóxido de carbono, y la pletismografía corporal (FRCpleth), que requiere una cabina que cuesta unos 36.000euros. La pletismografía da resultados algo mayores que los otros dos métodos, pero es el método más rápido, preciso y reproducible6. Nunca se debe utilizar la TLC medida durante la determinación de la DLco como medida de la TLC real, pues la infraestima, tanto más cuanto mayor sea la obstrucción6,34.
Del estudio de los volúmenes pulmonares podemos encontrarnos dos patrones patológicos: restricción, definida por una TLC inferior al 80% del valor de referencia, e hiperinsuflación, definida por una FRC% o una relación VR/TLC superior al 120%. No hay datos que documenten el uso de categorías de VR o la FRC en la obstrucción al flujo aéreo o TLC en la restricción pulmonar para clasificar la gravedad, como se hace en la espirometría.
Son excepcionales los casos de TLC baja con VC normal3,6,35–37, por lo que estas mediciones son en general poco útiles en sujetos con VC normal. No se ha demostrado su utilidad en el diagnóstico diferencial entre enfisema y bronquitis crónica, o entre EPOC y asma36,38, y existe en general una correlación entre la reducción del FEV1 y el aumento del VR36,38, aunque en hasta en el 15% la concordancia no es buena36,38, por lo que podría ayudar a interpretar algunos casos de disnea no justificada en pacientes obstructivos al detectar hiperinsuflación no esperada. En pacientes con EPOC con o sin VC normal estas medidas son útiles en la selección de pacientes para reducción de volumen, exigiéndose más de 100% de TLC y 135% de FRC39.
La medición de volúmenes puede ser útil en el estudio de sujetos con VC baja. En casos de patrón mixto, solo aproximadamente el 10% tiene la TLC baja (la gran mayoría de ellos tiene un FEV1/VC >60% y un FEV1 >40%)3,36, por lo que esta sería la población diana para medir volúmenes pulmonares.
En las enfermedades restrictivas la TLC tiene un valor pronóstico16, pero casi siempre se usa la VC, más fácil de medir. En los casos de espirometrías restrictivas «típicas», es decir, cuando la VC está reducida, el FEV1/VC está aumentado (85-90%) y la curva flujo-volumen tiene el patrón convexo característico (fig. 1)6, y si el cuadro clínico es compatible, probablemente no es necesario confirmar la restricción con una medida de la TLC. Si la reducción de la VC en la espirometría no va acompañada de un FEV1/VC normal o solo ligeramente aumentado, frecuentemente se debe a que la inspiración o la espiración no han sido máximas y en hasta el 50% de estos pacientes la repetición de la espirometría demuestra que el sujeto es normal3,6,40. En estos casos también estaría indicada la medición de volúmenes si la VC sigue baja tras repetir la espirometría.
La resistencia al flujo aéreo se puede medir en un pletismógrafo, pero raramente se usa en la clínica por su variabilidad y porque incluso el parámetro más sensible, la resistencia específica, en general refleja más la obstrucción de las grandes vías aéreas que de las zonas más periféricas6,34,41. Puede ser útil en los pacientes que son incapaces de realizar correctamente una espirometría, ya que requiere menos colaboración.
Presiones respiratorias máximasLa presión inspiratoria máxima (PIM) es la presión máxima que el paciente puede producir cuando trata de inhalar a través de una boquilla bloqueada después de una espiración máxima (desde VR). La presión PIM se puede medir en la nariz insertando una oliva conectada y esnifando con la otra fosa nasal abierta; este procedimiento se denomina «SPIN» y tiene las mismas indicaciones que la PIM. Su ventaja es que permite medir presiones en pacientes con enfermedades neuromusculares que no pueden cerrar bien la boca, ya que esnifar es una maniobra natural más fácil de entender por el paciente, que a veces la hace mejor. Habitualmente se miden las dos (PIM y SPIN), y se considera más representativa la mejor, que es la que luego se usa en el seguimiento. La presión espiratoria máxima (PEM) es la presión máxima ejercida sobre una boquilla bloqueada, medida durante la espiración forzada tras una inhalación completa (desde TLC), con los carrillos inflados. Es fácil de medir con un simple manómetro de presión conectado a una boquilla que cuesta entre 1.500 y 2.000euros. El coste de la prueba es de unos 60euros, más otros 80euros adicionales si se combina con espirometría sentado y tumbado. La PIM y la PEM son medidas de la capacidad para generar fuerza de los músculos inspiratorios y espiratorios, y por tanto se pueden ver afectadas por la configuración de tórax, particularmente del diafragma, sin que haya alteraciones propiamente musculares, como ocurre en el EPOC hiperisuflado. Las PIM (SPIN) y PEM promedio para los hombres adultos son –100cmH2O (–98hPa) y 170cmH2O (167hPa), respectivamente, mientras que los valores correspondientes para las mujeres adultas son aproximadamente –70cmH2O (–69hPa) y 110cmH2O (108hPa), respectivamente42,43. El límite inferior del rango normal es de alrededor de dos tercios de estos valores6.
Está indicada siempre que exista una disminución inexplicable de la capacidad vital o se sospeche clínicamente debilidad de los músculos respiratorios. La monitorización de la PIM (SPIN) y de la PEM es útil, junto a la VC, en el seguimiento de la evolución de los pacientes con trastornos neuromusculares (tabla 3), aunque solo permiten constatar la situación en el momento de la medición y su valor pronóstico es limitado, ya que algunas de ellas evolucionan a brotes y la función muscular pueden empeorar en cualquier momento de forma impredecible.
Procesos en los que puede ser útil medir las presiones respiratorias
| Procesos | Ejemplos |
| Enfermedades del SNC | Enfermedades de las motoneuronas (ELA) |
| Poliomielitis | |
| Lesiones de la médula cervical | |
| Neuropatías | Guillain-Barré |
| Parálisis diafragmática bilateral | |
| Neuropatía de las enfermedades críticas | |
| Trastornos de la placa neuromuscular | Miastenia gravis |
| Botulismo | |
| Enfermedad muscular | Polimiositis |
| Distrofias (Duchenne, Steinert, etc.) | |
| Miopatías, en especial la miopatía por déficit de maltasa ácida (Pompe) y las miopatías mitocondriales |
ELA: esclerosis lateral amiotrófica; SNC: sistema nervioso central.
La capacidad de difusión del monóxido de carbono por respiración única (DLCO), también llamada transferencia de monóxido de carbono (TLco), es útil en la evaluación de la enfermedad, tanto restrictiva y obstructiva44. Se requiere un equipo que cuesta de 18.000 a 24.000euros. El coste de una prueba es de unos 100euros. La DLco debe darse siempre corregida para la hemoglobina, lo que en la mayoría de los equipos aparece como DLcoc, y si se puede, para la carboxihemoglobina.
Una disminución de la DLcoc con una espirometría normal sugiere trastornos vasculares pulmonares6, pero también se puede dar en EPID o enfisema incipientes6.Una DLco disminuida en presencia de restricción sugiere EPID15,16, aunque algunas veces se ve restricción en las enfermedades vasculares pulmonares45.
Una DLco disminuida en presencia de obstrucción sugiere enfisema46 y también ante otras enfermedades mucho más raras como la histiocitosis X, la linfangioleiomiomatosis y la esclerosis tuberosa con afectación pulmonar47,48.
En la insuficiencia cardiaca por insuficiencia ventricular izquierda se puede observar una DLco baja que guarda relación directa con la gravedad y que es un potente factor pronóstico de la enfermedad15.
Una DLco alta se puede ver en el asma49, en la obesidad50 y en la hemorragia intrapulmonar51.La DLco se puede usar también para categorizar la gravedad de las enfermedades6.
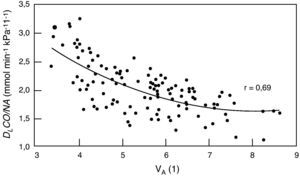
La relación DLco/VA, también conocida como constante de difusión Kco, permitiría diferenciar en teoría los procesos que reducen el volumen alveolar (VA) que limitan la expansión normal del tórax (que se comportan como pérdida de VA) o que, como en la EPOC, el VA efectivo está reducido en la medida en que los gases usados para medir DLco no se diluyen completamente por todo el espacio alveolar (se reduce en proporción al VA mal comunicado) de otras enfermedades que reducen la DLco porque afectan de forma difusa a la superficie de intercambio bien por el engrosamiento de los alvéolos como por la pérdida de capilarización. Sin embargo, la comparación con el valor teórico obtenido en sujetos con VA normal puede llevar a errores cuando el VA es bajo52 ya que la TLco/VA no varía linealmente con el VA (fig. 1)53 y por ello hay un gran debate sobre su utilidad clínica6,54,55. Nuestra experiencia es que conociendo el cuadro clínico del paciente, la DLco/VA suele aportar poca información (tabla 4).
Gasometría arterialEn pacientes ambulatorios estables la gasometría arteria basal (sin suplemento de oxígeno), o GAB, puede ser un complemento útil para las pruebas de función pulmonar en pacientes concretos. Su coste es de unos 30euros. Sirve para confirmar la hipoventilación cuando se sospecha en base de la historia clínica (p.ej., enfermedad neuromuscular o EPOC avanzada). La GAB también sirve para confirmar la hipoxemia crónica y proporcionar una evaluación más detallada de su gravedad. Es una prueba dolorosa. Su uso no debe ser rutinario, y solo está indicada en los pacientes que tienen una SatO2 baja por pulsioximetría.
Medición del óxido nítrico exhaladoEn los últimos años se ha despertado mucho interés en la determinación de la fracción de óxido nítrico en el aire exhalado (FENO), que se ha convertido en una prueba rutinaria después de la aparición de normas para su estandarización56. Su coste por prueba es de unos 50euros. Es un método cuantitativo, simple, no invasivo y seguro para medir la inflamación de las vías aéreas, y proporciona una herramienta complementaria a otras PFR para evaluar las enfermedades bronquiales como el asma.
Aunque su papel todavía no está exento de controversia debido a que la evidencia en la que se basan las recomendaciones no está basada en ensayos clínicos, la medición del FENO puede servir para57:
- •
La detección de la inflamación eosinofílica de las vías respiratorias (FENO >35-50ppb)19,57, que en presencia de clínica compatible o de obstrucción al flujo aéreo (FEV1/VC) <70% permite establecer un diagnóstico de presunción de asma (o al menos de presunción de respuesta al tratamiento con corticoides inhalados de forma similar al asma) que obligatoriamente deberá ser confirmado mediante la demostración de reversibilidad aguda o un «ensayo terapéutico individual» con corticoesteroides inhalados u orales (véase Prueba de reversibilidad) que mejore la función o al menos mejore los síntomas19.
- •
La determinación de la probabilidad de respuesta con corticoesteroides en pacientes con síntomas respiratorios crónicos. La recomendación es:
- –
Usar un punto de corte de ≤25ppb para considerar a un sujeto como poco probable respondedor.
- –
Usar un punto de corte de más de 50ppb para considerarlo como probable respondedor.
- –
En los niveles intermedios (>25 y ≤50ppb), valorar en función de la clínica.
- –
- •
Monitorizar la inflamación de las vías respiratorias para determinar las dosis de corticoesteroides. Se recomienda establecer primero si el paciente sigue expuesto a los alérgenos sospechosos de ser causantes de la inflamación de la vía aérea. La recomendación, basada en la opinión de expertos, es considerar significativos incrementos (falta de respuesta) o descensos (respuesta) del FENO mayores del 20% para valores superiores a 50ppb o mayores de 10ppb para valores inferiores a 50ppb de una visita a la siguiente.
- •
Detectar la falta de cumplimiento del tratamiento con corticoesteroides.
La distancia caminada en 6min (PM6) es un buen índice de la función física58–61, y tiene además valor pronóstico en muchas enfermedades respiratorias crónicas58,62–64. Su coste es de unos 50euros. Por lo general las personas sanas pueden caminar de 400 a 700m, dependiendo de la edad, de la estatura y del sexo59,61.
La desaturación durante el ejercicio, generalmente medida en una prueba de marcha, es un índice con valor pronóstico en las enfermedades vasculares pulmonares, en las enfermedades intersticiales y en la EPOC65. Una caída en la SpO2 de más del 4% (que termina por debajo del 93%) sugiere desaturación importante y se usa para valorar la necesidad y titular el uso de oxígeno en pacientes con enfermedades pulmonares crónicas65–67.
ErgoespirometríaLas aplicaciones de las pruebas de ejercicio cardiopulmonar en neumología son múltiples (tabla 5). La maquinaria cuesta unos 24.000euros, más 9.000euros del cicloergómetro. El coste por prueba es de 150euros. Está fuera del propósito de este artículo una revisión detallada tales pruebas, y se recomienda al lector interesado lecturas más avanzadas66–75. El consumo máximo de oxígeno tiene un valor pronóstico en las enfermedades respiratorias65,68,70−75.
Indicaciones de la prueba de esfuerzo en neumología
| Valoración de la tolerancia al ejercicio y de los factores limitantes del mismo |
| Objetivación de la limitación de la capacidad de esfuerzo |
| Análisis de los factores limitantes de la capacidad de esfuerzo |
| Distinción entre disnea de origen respiratorio o cardiaco |
| Estudio de la disnea no explicable por las pruebas en reposo |
| Valoración funcional y pronóstica y detección de alteraciones que se producen o empeoran acusadamente con el ejercicio en enfermedades pulmonares crónicas |
| Valoración de la discapacidad en enfermedades respiratorias |
| Prescripción de ejercicio en rehabilitación |
| Diagnóstico de broncoespasmo inducido por esfuerzo |
| Valoración de los efectos de intervenciones terapéuticas |
| Valoración preoperatoria en la cirugía resectiva pulmonar |
Las PFR son útiles para evaluar todas las formas de enfermedad pulmonar y como cribado de la presencia de la enfermedad en personas con factores de riesgo como el tabaquismo. Otras indicaciones para las pruebas de función pulmonar son:
- •
La evaluación de síntomas tales como tos crónica persistente, sibilancias, disnea y tos en condiciones de reposo o con el ejercicio.
- •
La evaluación objetiva del tratamiento broncodilatador.
- •
La evaluación de los efectos de la exposición a agentes nocivos para el pulmón (polvo o productos químicos).
- •
La evaluación del riesgo de los pacientes antes de la cirugía torácica y la prevención en cualquier cirugía en pacientes en los que se sospeche enfermedad pulmonar tratable no conocida.
- •
La evaluación objetiva de la disfunción o discapacidad.
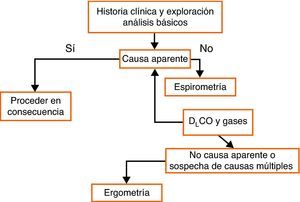
Muchas enfermedades pulmonares comienzan de forma lenta e insidiosa y, finalmente, se manifiestan con síntomas no específicos, como la disnea de esfuerzo. Las PFR son una parte esencial de la rutina diagnóstica en estos pacientes. La espirometría debe ser la primera prueba y ordenar nuevas pruebas en función de sus resultados. Si la causa de la disnea de esfuerzo sigue sin aclarar después de las pruebas de broncodilatación, DLco y volúmenes pulmonares, puede ser útil una ergoespirometría (fig. 5).
Tos crónicaEs un síntoma muy frecuente, y puede suponer hasta el 40% de las consultas externas de neumología76. Cuando por la historia clínica y la radiografía de tórax se sospeche asma o EPOC será necesaria una espirometría y prueba de broncodilatadores. Antes de pedir una prueba de hiperreactividad hay que verificar que el paciente tiene tos persistente (>8 semanas), que no toma medicación (inhibidores de la enzima convertidora de la angiotensina) o tiene otras causas de tos (radiografía normal), y que no tiene una probabilidad clínica muy alta de asma, reflujo gastroesofágico o rinitis, en cuyo caso es preferible un ensayo terapéutico individual previo76,77.
AsmaLa espirometría antes y después de un broncodilatador está indicada en el estudio inicial de pacientes con sospecha de asma y en su seguimiento. La demostración de broncodilatación con un cuadro clínico compatible es muy sugestiva de asma19. También está indicada ante síntomas atípicos de asma como opresión en el pecho o tos con el ejercicio o la exposición al aire frío, polvo, humos o carcajadas, que sugiere hiperreactividad bronquial. En estos casos la espirometría hecha en momentos en que el paciente esté asintomático incluso tras broncodilatadores puede ser normal y no mejorar tras broncodilatadores, por lo que en una segunda visita se debe llevar a cabo una prueba de hiperreactividad19. Alternativamente hay que medir la FENO y, si está elevada (>35-50ppb), realizar un ensayo de tratamiento19,57 o medir la variabilidad del PEF durante 15días19. La curva flujo volumen puede ser útil en la detección de «disfunción de las cuerdas vocales» en pacientes con asma atípica o de difícil control.
EPOCEl FEV1/VC <70% tras broncodilatadores (o varias semanas de tratamiento)20,21 es criterio diagnóstico de EPOC en pacientes con antecedentes de exposición al tabaco, al humo de leña o a nubes de polvo industriales y clínica de bronquitis crónica20,21. La prueba de broncodilatadores no permite diferenciar la EPOC del asma, a no ser que la clínica lo sugiera y la respuesta sea muy notable (lo que se ha definido arbitrariamente como >400ml21); además, existe un fenotipo de la EPOC, llamado mixto, que presenta características de ambas enfermedades22. Tampoco ayuda a decidir el tratamiento23,24, salvo que sea muy importante y se acompañe de otros criterios sugestivos de fenotipo mixto22. La medición de volúmenes pulmonares no suele ser útil en general, pero puede estar indicada en pacientes con patrón mixto36 y en los casos en los que se plantee reducción de volumen39. La DLco puede ser útil para diferenciar el enfisema de la bronquitis crónica; estos dos fenotipos no tienen tratamiento diferente, pero hay evidencia de que su evolución puede ser distinta, con una pérdida acelerada de FEV1 en los enfisematosos78. Anecdóticamente, la DLco puede tener cierto valor diferencial entre EPOC y asma, ya que en este último proceso nunca está disminuida y frecuentemente está elevada49. La gasometría arterial en condiciones estables es dolorosa y solo es necesaria cuando sospechamos insuficiencia respiratoria hipercápnica o cuando la saturación por pulsioximetría es menor del 92%. Las pruebas de esfuerzo tienen un valor pronóstico72,74,79, y la distancia caminada en la PM6 se ha integrado en el índice multifactorial BODE64 que estratifica el riesgo mejor que el FEV121. Sin embargo, se carece de información sobre el coste-efectividad, y aunque la determinación del índice BODE ofrece información pronóstica adicional, es el sentir general que dicha información no es suficiente para justificar el tiempo y el coste de la realización rutinaria de la PM6 en todos los pacientes21. Una variante de la PM6 se usa para titular el oxígeno cuando se prescribe oxigenoterapia ambulatoria65–67.
La espirometría es esencial en el seguimiento de los pacientes con EPOC para monitorizar la eficacia de tratamiento (tabla 2) y la progresión de la enfermedad78,80. No parece tener sentido hacer más de una al año sin otros motivos que el seguimiento78,80. Debemos esperar descensos del FEV1 de entre 30 y 40ml/año. Descensos superiores puede estar relacionados con el fenotipo enfisema, con la persistencia en fumar, con el mal control de las exacerbaciones o con insuficiente tratamiento23,81,82. Estos cambios están por debajo de la variabilidad de la prueba, así que para interpretarlos hay que disponer de espirometría de calidad y realizarla en las mismas condiciones (mismo laboratorio, mismo ambiente farmacológico, paciente estable) y varios puntos (dos o tres años), a no ser que el descenso (o mejoría) supere la variabilidad de la prueba (tabla 2). En los pacientes con FEV1 <1l la espirometría puede ser poco sensible a los cambios por la variabilidad de la prueba (12% o 190ml). En estos pacientes, otras determinaciones como las mediciones de síntomas, la calidad de vida, la desaturación en ejercicio o la tolerancia al esfuerzo pueden ser más sensibles a las intervenciones y al progreso de la enfermedad que el propio FEV165,83.
Enfermedades neuromuscularesDesde el advenimiento de la ventilación mecánica no invasiva un número cada vez mayor de pacientes con insuficiencia respiratoria grave se mantienen con esta terapia, y la demanda de las pruebas destinadas a medir la fuerza muscular ha aumentado. Desde el punto de vista clínico práctico la VC es una prueba de cribado útil y su disminución en más del 25% en decúbito (normal, <5%) comparado con la posición erecta es indicativo de enfermedad neuromuscular. La habilidad de toser eficazmente suele perderse cuando la VC es menor de 30ml/kg, y una VC <30% se considera que predice la inminencia de insuficiencia respiratoria en enfermedades neuromusculares crónicas, pero se debe acompañar de otras mediciones como la PaCO2 y, a veces, la capnografía nocturna. Las presiones respiratorias son más sensibles que la VC y estarían indicadas en el diagnóstico y el seguimiento como complemento, sobre todo en los casos en que la disminución de la capacidad vital con el decúbito no es clara.
Enfermedad pulmonar intersticial difusaLas pruebas funcionales se deben poner en el contexto clínico radiológico. La espirometría es útil en la detección de restricción (VC), pero rara vez ayuda a establecer la causa84. La DLco es útil como cribado de afectación pulmonar intersticial cuando se van a practicar intervenciones (trasplante de médula ósea, quimioterapia) que pueden causar EPID y para diferenciar las enfermedades intrínsecas del pulmón de otras causas de restricción, y también tiene un valor pronóstico15,16,84. La desaturación en ejercicio también tiene valor pronóstico en estos pacientes65,84, y la PM6 puede utilizarse para titular el oxígeno ambulatorio cuando llegue el caso65,66. Todas estas pruebas tienen un papel en el seguimiento del paciente cada 6 o 12 meses, o cuando se presuma un cambio en la evolución de la enfermedad.
Enfermedad pulmonar vascularLa espirometría está indicada en la evaluación inicial de las enfermedades vasculares pulmonares para el diagnóstico diferencial con otros procesos85. A veces se observa una disminución de la VC6. La DLco puede jugar un papel de cribado en la detección de hipertensión pulmonar, por ejemplo en enfermedades reumáticas6,86, y en la valoración de su pronóstico44,85, aunque se utilizan más otros índices derivados de la ecocardiografía y de las pruebas de esfuerzo85. Aunque la PM6 es la más popular, la ergoespirometría puede tener ventajas al dar más información fisiológica y realizarse en general en un medio más seguro, como es el laboratorio65. Las pruebas de esfuerzo son útiles en el seguimiento de estos pacientes y en la monitorización de la eficacia del tratamiento65,85.
Valoración preoperatoriaLas pruebas funcionales solo están indicadas cuando se sospecha enfermedad respiratoria no conocida o reagudizada, susceptible de mejorar con el tratamiento y así reducir el riesgo, ya que nunca se debe contraindicar una cirugía necesaria en base a la función pulmonar87. Excepciones a esta regla son la cirugía de aorta abdominal88 y la cirugía de resección pulmonar. En esta última la combinación de la espirometría, la DLCO y la ergoespirometría permiten la mejor estratificación del riesgo71,88.
Valoración de discapacidadLa legislación española (Real Decreto 1971/1999, de 23 de diciembre, de procedimiento para el reconocimiento, declaración y calificación del grado de discapacidad) establece que la valoración de la discapacidad se debe efectuar basándose en criterios espirométricos, DLco o consumo máximo de oxígeno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.