Este documento sobre EPOC de la Asociación Latinoamericana de Tórax (ALAT) 2019 analiza las nuevas evidencias de medicación inhalada utilizando la metodología de preguntas clínicas en formato PICO. Surgen de este análisis los siguientes puntos claves: 1) no hay evidencia que compare el uso de broncodilatadores de acción corta vs. larga en pacientes con EPOC leve; en aquellos con EPOC moderada-grave existe mayor beneficio de los broncodilatadores de acción larga, 2) beneficios similares de la monoterapia con antimuscarínicos de acción prolongada (LAMA) y la terapia combinada β2-agonistas de acción larga/corticosteroides inhalados (LABA/CIS), asociada esta última a mayor riesgo de neumonía, 3) mayores beneficios del LABA/LAMA en función pulmonar y riesgo de exacerbación vs. LABA/CIS (esta última con mayor riesgo de neumonía) y 4) mayores beneficios de la terapia LAMA/LABA/CIS comparada con LABA/LAMA sobre el riesgo de exacerbaciones moderadas-severas. En relación al rol de los eosinófilos para guiar el uso de los CIS: debe considerarse su retiro cuando la indicación inicial fue errada o sin respuesta, en pacientes con efectos secundarios como neumonía, y en aquellos con bajo riesgo de exacerbación con recuento de eosinófilos en sangre <300cél/μl. Incorporando estas evidencias según la gravedad de la obstrucción, síntomas y riesgo de exacerbaciones se genera un algoritmo para el uso de medicación inhalada en la EPOC.
This document on COPD from the Latin American Chest Association (ALAT-2019) uses PICO methodology to analyze new evidence on inhaled medication and answer clinical questions. The following key points emerged from this analysis: 1) evidence is lacking on the comparison of short-acting vs. long-acting bronchodilators in patients with mild COPD; patients with moderate-to-severe COPD obtain greater benefit from long-acting bronchodilators; 2) the benefits of monotherapy with long-acting antimuscarinic agents (LAMA) and combined therapy with long-acting β2-agonists and inhaled corticosteroids (LABA/ICS) are similar, although the latter is associated with a greater risk of pneumonia; 3) LABA/LAMA offer greater benefits in terms of lung function and risk of exacerbation than LABA/ICS (the latter involve an increased risk of pneumonia), 4) LAMA/LABA/ICS have greater therapeutic benefits than LABA/LAMA on the risk of moderate-severe exacerbations. With regard to the role of eosinophils in guiding the use of ICS, ICS withdrawal must be considered when the initial indication was wrong or no response is elicited, in patients with side effects such as pneumonia, and in patients with a low risk of exacerbation and an eosinophil blood count of <300 cells/μl. All this evidence, categorized according to the severity of the obstruction, symptoms, and risk of exacerbations, has been used to generate an algorithm for the use of inhaled medication in COPD.
La enfermedad pulmonar obstructiva crónica (EPOC) con distintas formas de presentación clínica requiere un tratamiento individualizado (medicina precisa). Estudios recientes aportan evidencias sobre beneficios de diferentes combinaciones de fármacos que pueden influir en las pautas terapéuticas1–5.
La Asociación Latinoamericana de Tórax (ALAT) presentó en el 2014 un documento sobre la EPOC utilizando la metodología de preguntas clínicas en formato PICO6. Con el objetivo de actualizar el contenido sobre medicamentos inhalados se analiza en este documento la nueva evidencia utilizando la misma metodología. La razón por la cual se centra en medicamentos inhalados es porque estos son la base del tratamiento farmacológico de la EPOC, el área de mayores cambios y controversias, independientemente de la disponibilidad de los estudios clínicos controlados. Este documento va dirigido a médicos clínicos, en particular a especialistas del área respiratoria y a otros profesionales sanitarios implicados en la atención y el manejo de los pacientes con EPOC.
MetodologíaEn el desarrollo del documento participaron médicos especialistas convocados por el departamento de EPOC de ALAT. El grupo de trabajo realizó 3 discusiones presenciales y por teleconferencia sobre las controversias de medicamentos inhalados en EPOC. Se formularon nuevas preguntas clínicas sobre áreas de controversia en medicación inhalada y se incorporó esta evidencia en una propuesta para el uso de esta terapia. Se seleccionaron 5 preguntas clínicas por consenso que se analizan en este documento.
Una explicación más extensa sobre la metodología que incluye: formulación de preguntas clínicas en formato PICO, estrategia de búsqueda, criterios de elegibilidad, análisis crítico y formulación de recomendaciones se presenta en el material suplementario de este documento y en una publicación previa6. Las tablas 1 y 2 muestran las estrategias de búsqueda (Trip Database y términos MeSH), número y tipo de trabajos seleccionados.
Estrategia de búsqueda (palabras claves del Trip Database y términos MeSH)
| Pregunta clínica | Pregunta PICO | Estrategia de búsqueda con términos MeSH |
|---|---|---|
| ¿Los broncodilatadores de larga acción (LABA o LAMA) son más efectivos que los broncodilatadores de acción corta (SABA o SAMA) en los pacientes con EPOC leve? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=LABA o LAMAC=SABA o SAMAO=Ø | a) (((((“pulmonary disease, chronic obstructive”[MeSH Terms] OR copd OR chronic obstructive pulmonary disease OR coad OR chronic obstructive airway disease OR chronic obstructive lung disease OR airflow obstruction, chronic OR airflow obstructions, chronic OR chronic airflow obstructions OR chronic airflow obstruction))))) AND (“Albuterol”[MeSH] OR salbutamol OR 2-t-Butylamino-1- AND (4-hydroxy-3-hydroxy-3-hydroxymethyl) AND phenylethanol OR ventolin OR sultanov OR albuterol sulfate OR prove it)b) (((((“pulmonary disease, chronic obstructive”[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction))))) AND (“Ipratropium”[MeSH] OR atrovent OR ALovent) |
| ¿La asociación LABA más CI proporciona mayores beneficios que la monoterapia con LAMA o la broncodilatación dual con LABA más LAMA? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=LABA+ICsC=LAMA o LAMA+LABAO=Ø | ((((((“pulmonary disease, chronic obstructive”[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction))))) AND “Bronchodilator Agents”[MeSH]) AND Inhale* corticosteroids* |
| ¿La asociación LABA más LAMA más CI (terapia triple) proporciona mayores beneficios comparada con monoterapia con LAMA, la terapia combinada (LABA/CI) o la doble terapia broncodilatadora (LABA/LAMA) en pacientes con EPOC? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=LABA+LAMA+ICsC=LAMA o LABA+ICs o LAMA+LABAO=Ø | (((((“pulmonary disease, chronic obstructive”[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction))))) AND Triple Therapy |
| ¿Cuáles son los pacientes con EPOC que se benefician del uso de CI (reducción de exacerbaciones)? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=inhaled corticosteroidsC=ØO=exacerbation* OR mortality | ((((((“pulmonary disease, chronic obstructive”[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction)))) AND Inhale* corticosteroid*) |
| ¿En cuáles pacientes es seguro retirar los CI? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=((withdrawal of ICS) OR (withdrawal of corticoid*))C=ØO=Ø | ((((“pulmonary disease, chronic obstructive”[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction)))) AND Withdra* AND Inhale* AND corticosteroid* |
CI: corticoide inhalado; ECA: ensayos clínicos controlados; EPOC: enfermedad pulmonar obstructiva crónica; LABA: β2-agonistas de acción prolongada; LAMA: Antimuscarínicos de acción prolongada; SABA: short-acting β-agonist; SAMA: short-acting muscarinic antagonist.
Número y tipo de trabajos seleccionados para responder las preguntas clínicas
| Pregunta clínica | Total de referencias seleccionadas | Total de referencias recogidas del Trip Database | Total de referencias recogidas del MeSH | Total de referencias seleccionadas para responder la pregunta | Tipo de estudio seleccionados |
|---|---|---|---|---|---|
| ¿Los broncodilatadores de larga acción (LABA o LAMA) son más efectivos que los broncodilatadores de acción corta (SABA o SAMA) en los pacientes con EPOC leve? | 485 | 20 | 465 | 2 | 2 Revisiones sistemáticas12,13 |
| ¿La asociación LABA más CI proporciona mayores beneficios que la monoterapia con LAMA o la broncodilatación dual con LABA más LAMA? | 238 | 8 | 230 | 5 | 5 Revisiones sistemáticas23–27 |
| ¿La asociación LABA más LAMA más CI (terapia triple) proporciona mayores beneficios comparada con monoterapia con LAMA, la terapia combinada (LABA/CI) o la doble terapia broncodilatadora (LABA/LAMA) en pacientes con EPOC? | 193 | 12 | 181 | 7 | 2 Revisiones sistemáticas30,315 ECA3,4,32–34 |
| ¿Cuáles son los pacientes con EPOC que se benefician del uso de CI (reducción de exacerbaciones)? | 338 | 92 | 246 | 5 | 3 Revisiones sistemáticas26,36,372 ECA3,38 |
| ¿En cuales pacientes es seguro retirar los CI? | 588 | 341 | 247 | 3 | 1 Metaanálisis452 ECA46,47 |
CI: corticoide inhalado; ECA: ensayos clínicos controlados; EPOC: enfermedad pulmonar obstructiva crónica; LABA: β2-agonistas de acción prolongada; LAMA: Antimuscarínicos de acción prolongada; SABA: short-acting β-agonist; SAMA: short-acting muscarinic antagonist.
Con cierre a septiembre de 2018 se consideraron publicaciones en español, portugués e inglés utilizando «ACCP grading system», se clasificó la recomendación en fuerte o débil, de acuerdo al balance entre riesgo, beneficio, carga y, en ocasiones, coste. La calidad de la evidencia fue clasificada en alta, moderada o baja según diseño del estudio, consistencia de resultados y claridad de la evidencia para responder la pregunta.
Monoterapia broncodilatadoraPregunta: ¿Los broncodilatadores de acción larga (LABA o LAMA) son más efectivos que los de acción corta (SABA o SAMA) en pacientes con enfermedad pulmonar obstructiva crónica leve?JustificaciónAlrededor del 70% de los pacientes con EPOC tienen obstrucción del flujo de aire entre leve-moderada (FEV1≥50%), con pocos síntomas respiratorios7–10. Existe limitada información sobre la medicación inhalada en etapas iniciales o enfermedad leve. Solo 2 ensayos clínicos controlados (ECA) en pacientes con obstrucción leve-moderada, evaluaron los beneficios del tratamiento con broncodilatadores (BD) de acción larga vs. placebo: uno con tiotropio11 y otro con la combinación β2-agonistas de acción larga más corticoides inhalados (LABA/CIS)12. El tiotropio mostró mejoría en el volumen espiratorio forzado en el primer segundo (FEV1), calidad de vida, frecuencia de exacerbaciones y caída de la función pulmonar11. En EPOC leve usualmente se recomienda el uso de cualquier BD por lo que sería importante analizar si se justifica usar un BD de acción larga en lugar de acción corta en estos pacientes.
Selección de búsquedaSe capturaron 485 referencias (MeSH: 465; Trip Database: 20), seleccionando 2 revisiones sistemáticas para responder la pregunta13,14.
Resumen de la evidenciaEn términos de eficacia, una revisión sistemática que compara tiotropio vs. ipratropio (SAMA) en pacientes con obstrucción moderada-grave, muestra mayor beneficio del tiotropio en la función pulmonar (incremento FEV1: 109ml; IC 95%: 80-137ml), calidad de vida (diferencia SGQT: −3,3; IC 95%: 0,97-5,63), menores hospitalizaciones (OR: 0,34; IC 95%: 0,15-0,76) y exacerbaciones (OR: 0,71; IC 95%: 0,52-0,95)13. Otra revisión sistemática que comparó ipratropio y LABA14 en pacientes con obstrucción moderada-grave, mostró mayores beneficios del salmeterol sobre el (FEV1: 60ml; IC 95%: 110-0ml) y el flujo pico matutino (−10,96lit/min; IC 95%: −16,09 a −5,83), sin diferencia en calidad de vida, exacerbaciones, medicación de rescate, capacidad de ejercicio o síntomas. El uso de formoterol comparado con ipratropio parece mostrar mejoría en el flujo pico matutino sin diferencia en el FEV1, calidad de vida, disnea o capacidad de ejercicio.
En términos de seguridad, el estudio que compara ipratropio vs. tiotropio mostró menos eventos adversos serios (OR: 0,50; IC 95%: 0,34-0,73) y eventos de la enfermedad con el tiotropio (OR: 0,59; IC 95%: 0,41-0,85), sin diferencias en mortalidad13. No se encontraron estudios comparativos de monoterapia con BD de acción larga vs. β2-agonistas de acción corta (SABA), ni estudios comparativos entre BD de acción corta vs. larga en pacientes con obstrucción leve.
Conclusiones y recomendacionesNo hay evidencia disponible que compare el uso de BD de acción corta y larga en pacientes con EPOC y obstrucción leve. Los estudios comparativos capturados en la búsqueda y selección de la evidencia son en pacientes con obstrucción moderada-grave. Estos muestran que, en términos de eficacia, tiotropio y LABA comparados con ipratropio tienen mayores beneficios en función pulmonar. Tiotropio, además, mostró mayores beneficios sobre disnea, exacerbaciones y calidad de vida con mejor perfil de seguridad.
A partir de estos hallazgos solamente se puede recomendar el uso de LABA o tiotropio sobre ipratropio en EPOC con obstrucción moderada-grave en términos de disnea, calidad de vida y función pulmonar, y de tiotropio sobre ipratropio en términos de mejoría de exacerbaciones y hospitalizaciones.
Terapias combinadas (LABA/CIS, LABA/LAMA y LABA/LAMA/CIS)Pregunta: ¿La asociación LABA más CIS proporciona mayores beneficios que la monoterapia con LAMA o la doble terapia broncodilatadora con LABA más LAMA?JustificaciónLa monoterapia con LAMA produce beneficios sobre la disnea, calidad de vida, frecuencia de exacerbaciones y hospitalizaciones15–18. También se reporta reducción de exacerbaciones, mejoría en la calidad de vida y función pulmonar con LABA/CIS19 y la terapia LABA/LAMA18,20–29. Surge la pregunta sobre si existen diferencias entre estos tratamientos.
Selección de búsquedaSe capturaron 238 referencias (MeSH: 230; Trip Database: 8), seleccionando 4 revisiones sistemáticas para contestar la pregunta30,32–34.
Resumen de la evidenciaEn términos de eficacia, una revisión sistemática que compara fluticasona/salmeterol vs. tiotropio en pacientes con obstrucción moderada-grave, muestra resultados similares en la frecuencia de exacerbaciones, ingresos hospitalarios por exacerbaciones y calidad de vida30. Sin embargo, el número de abandonos en un estudio incluido fue alto con desequilibrio entre ambos grupos, sin seguimiento de los pacientes luego del abandono, lo que limita parcialmente la aplicabilidad de sus resultados31.
Otra revisión sistemática en pacientes con obstrucción moderada-grave mostró mejoría modesta (sin relevancia clínica) del LABA/CIS (fluticasona/salmeterol) comparada con tiotropio en el FEV1 pre-BD (cambio 60ml), medicación de rescate y calidad de vida (St. George's Respiratory Questionnaire-SGRQ –2,07 unidades)32.
Una revisión sistemática compara la efectividad de LABA/LAMA con LABA/CIS (fluticasona/salmeterol) en pacientes con EPOC en su mayoría moderada-grave33. La terapia LABA/LAMA mostró mayores beneficios en función pulmonar (FEV1 valle [MD 80ml]) y riesgo de exacerbaciones (OR: 0,82). No hubo diferencia en calidad de vida (puntaje total del SGRQ); sin embargo, se observó que con LABA/LAMA, se alcanzó con mayor frecuencia la diferencia clínica mínima de 4 puntos comparado con fluticasona/salmeterol (OR: 1,25)33.
Otra revisión sistemática y metaanálisis en pacientes con EPOC moderada-muy grave, mostró mayores beneficios de LABA/LAMA en la función pulmonar (FEV1 valle [MD 80ml]), riesgo de exacerbaciones moderadas-graves (RR: 0,82) y medicación de rescate (−0,18puff/día) comparada con LABA/CIS (fluticasona/salmeterol)34. No hubo diferencia en calidad de vida ni gravedad de la disnea entre las terapias.
En seguridad, las revisiones sistemáticas muestran aumento del riesgo de neumonía y efectos adversos serios con fluticasona/salmeterol vs. tiotropio o LABA/LAMA33.
Conclusiones y recomendacionesEn términos de eficacia en pacientes con EPOC moderada-grave, tiotropio y fluticasona/salmeterol son similares. LABA/LAMA tiene mayores beneficios sobre función pulmonar y riesgo de exacerbaciones comparada con fluticasona/salmeterol. En seguridad, existe evidencia de mayor riesgo de neumonía con fluticasona/salmeterol vs. tiotropio y LABA/LAMA.
Evidencia ALTA para el uso de tiotropio o LABA/CIS (fluticasona/salmeterol) en términos de disnea, función pulmonar, calidad de vida, frecuencia de exacerbaciones y hospitalizaciones en pacientes con EPOC moderada-grave.
Recomendación FUERTE para preferir tiotropio sobre fluticasona/salmeterol, por riesgo aumentado de neumonía.
Evidencia ALTA y recomendación FUERTE para uso de LABA/LAMA sobre LABA/ICS (fluticasona/salmeterol), para mejorar función pulmonar y frecuencia de exacerbaciones, con menor riesgo de neumonías en pacientes con EPOC moderada-muy grave.
Pregunta: ¿La asociación LABA más LAMA más CIS (terapia triple) proporciona mayores beneficios comparada con monoterapia con LAMA, la terapia combinada (LABA/CIS) o la doble terapia broncodilatadora (LABA/LAMA) en pacientes con EPOC?JustificaciónLa asociación LABA/LAMA/CIS puede disminuir el riesgo de exacerbaciones, hospitalizaciones y costos de salud, en pacientes con EPOC con obstrucción moderada-muy grave35,36. Persiste la controversia sobre la eficacia y seguridad de la triple terapia en dosis fija o combinando diferentes dispositivos (LABA/CIS+tiotropio o LABA/CIS+glicopirronio), comparado con LAMA, LAMA/CIS o LABA/LAMA.
Selección de búsquedaSe capturaron 193 referencias (MeSH: 181; Trip Database: 12), seleccionando 2 revisiones sistemáticas37,38 y 5 ECA3,4,39–41 para responder la pregunta.
Resumen de la evidenciaUna revisión sistemática, mostró mayores beneficios con la triple terapia (LABA/CIS+tiotropio) en las admisiones hospitalarias por todas las causas (reducción de riesgo: 39%; OR: 0,61; IC 95%: 0,40-0,92), calidad de vida (diferencia SGRQ: −3,46; IC 95%: −5,05 a −1,87) y función pulmonar (FEV1 pre-dosis: 60ml; IC 95%: 40-80ml de 3-6 meses) comparado con tiotropio en pacientes con EPOC moderada-muy grave; sin diferencias en mortalidad o frecuencia de exacerbaciones37. Similares resultados fueron reportados por otra revisión sistemática y metaanálisis38. Tres ECA en pacientes con FEV1<50% e historia de exacerbaciones, evaluaron la efectividad y seguridad de la dosis fija (dipropionato de beclometasona+fumarato de formoterol+glicopirronio [BDP/FF/GLY]) comparada con tiotropio39; con BDP/FF41 y con indacaterol+glicopirronio4. La terapia BDP/FF/GLY comparado con tiotropio, mostró mayores beneficios en la frecuencia de exacerbaciones moderadas-graves (RR: 0,80; IC 95%: 0,69-0,92), función pulmonar (FEV1 pre-dosis diferencia: 61ml; IC 95%: 37-86ml), calidad de vida (respondedores SGRQ: 1,33; IC 95%: 1,10-1,59) y reducción de medicación de rescate39. Comparada con BDP/FF mostró mayores beneficios en función pulmonar a 26 semanas (FEV1 pre-dosis diferencia: 81ml; IC 95%: 52-109ml), reducción del 23% de exacerbaciones moderadas-graves (RR: 0,77; IC 95%: 0,65-0,92), calidad de vida (respondedores) a las 52 semanas (SGRQ, OR: 1,33; IC 95%: 1,06-1,66), sin diferencias en la gravedad de la disnea41. La terapia BDP/FF/GLY comparado con indacaterol/glicopirronio mostró mayores beneficios en la frecuencia de exacerbaciones moderadas-graves (RR: 0,85; IC 95%: 0,72-0,99); no hubo diferencias en función pulmonar ni calidad de vida4.
Dos ECA compararon la terapia fija furoato de fluticasona/umeclidinium/vilanterol (FFL/UMEC/VI) con (budesonida/formoterol [BUD/FF])40, FFL/VIy UMEC/VI3 en pacientes sintomáticos con obstrucción moderada-muy grave e historia de exacerbaciones. La triple terapia comparada con BUD/FF mostró mayores beneficios sobre la función pulmonar (FEV1 valle: diferencia 171ml; IC 95%: 148-194, a favor de FFL/UMEC/VI), calidad de vida (diferencia SGRQ: −2,2; IC 95%: −3,5 a −1, a favor de FFL/UMEC/VI) y la frecuencia de exacerbaciones moderadas-graves (reducción 35%; IC 95%: 14-51%). Un subanálisis40, muestra similares beneficios con FFL/UMEC/VIsobre BUD/FF en pacientes sintomáticos independientemente de la gravedad de la EPOC o el tratamiento previo. Uno de los estudios3 mostró mayores beneficios con FFL/UMEC/VI sobre la frecuencia de exacerbaciones moderadas-graves, comparada con FFL/VI (RR: 0,85; IC 95%: 0,80-0,90%, diferencia 15%) y UMEC/VI (RR: 0,75; IC 95%: 0,70-0,81, diferencia 25%) independiente del recuento de eosinófilos en sangre; aunque hubo una reducción mayor del riesgo en pacientes con eosinófilos >150cél/μl. También mostró mayores beneficios en la función pulmonar (FFL/UMEC/VI vs. FFL/VI, FEV1-valle diferencia: 97ml; IC 95%: 85-109ml y FFL/UMEC/VIvs. UMEC/VI, FEV1-valle diferencia: 54ml; IC 95%: 39-69ml) y calidad de vida (SGRQ, FFL/UMEC/VI vs. FFL/VIdiferencia −1,8; IC 95%: −2,4 a −1,1 y FFL/UMEC/VI vs. UMEC/VI −1,8; IC 95%: −2,6 a −1,0). En seguridad, la triple terapia en diferentes dispositivos no mostró diferencias con tiotropio en aparición de efectos adversos37,38. Con BDP/FF/GLY, se reportó incidencia de neumonía en un pequeño grupo de pacientes (BDP/FF/GLY 2% vs. tiotropio 1%)40. No hubo diferencias en incidencia de neumonía entre BDP/FF/GLY comparada con BDP/FF41 o indacaterol/glicopirronio4; sin embargo, el riesgo de neumonía con diagnóstico médico con FFL/UMEC/VI fue mayor comparada con UMEC/VI (HR: 1,52; IC 95%: 1,22-1,92)3.
Conclusiones y recomendacionesEn pacientes con EPOC sintomáticos con obstrucción grave-muy grave e historia de exacerbaciones, en términos de eficacia, la triple terapia muestra mayores beneficios sobre función pulmonar, calidad de vida y riesgo de exacerbaciones vs. tiotropio y LABA/CIS. La triple terapia comparada con LABA/LAMA muestra mayores beneficios sobre el riesgo de exacerbaciones moderadas-graves. La combinación FFL/UMEC/VI comparada con FFL/VI y UMEC/VI muestra mayores beneficios sobre la frecuencia de exacerbaciones moderadas-graves, independiente del recuento de eosinófilos en sangre; aunque este es mayor en pacientes con recuento >150cél/μl. El riesgo de neumonía es mayor en las terapias con CIS.
Evidencia ALTA y recomendación FUERTE para uso de triple terapia en pacientes con EPOC sintomáticos con obstrucción grave-muy grave y riesgo de exacerbaciones, para mejorar función pulmonar, calidad de vida y disminuir riesgo de exacerbaciones.
Pregunta: ¿Cuáles son los pacientes con EPOC que se benefician del uso de CIS en la reducción de exacerbaciones?JustificaciónEl uso de CIS solo o asociado a LABA ha mostrado beneficios en pacientes con EPOC como reducción de exacerbaciones y mejoría del deterioro del estado de la salud42,43.
Estos desenlaces deben ser analizados según el balance riesgo/beneficio, en particular el riesgo de neumonías descrito con los CIS.
Surge la necesidad de definir el subgrupo de pacientes con EPOC que más se beneficia del CIS, enfocado en la reducción del riesgo de exacerbación.
Selección de búsquedaSe capturaron 338 referencias (MeSH: 246; Trip Database: 92) seleccionando 3 revisiones sistemáticas33,44,45 y 2 ECA3,46 para responder la pregunta.
Resumen de la evidenciaUna revisión sistemática que compara la eficacia de cualquier dosis o tipo de CIS con placebo en pacientes con EPOC moderada-grave mostró que los CIS redujeron la tasa de exacerbaciones (−0,26 exacerbaciones paciente/año, IC 95%: −0,37 a −0,14)44. Otra revisión sistemática que comparó la eficacia de LABA/CIS (principalmente fluticasona/salmeterol) con monoterapia de CIS en pacientes con EPOC leve-grave mostró reducción en la frecuencia de exacerbación con LABA/CIS (RR: 0,91; IC 95%: 0,85-0,97)45. Dos ECA de fluticasona/salmeterol incluidos en esta revisión mostraron que las exacerbaciones que requerían esteroides orales se redujeron con fluticasona/salmeterol y otro no encontró diferencia en la tasa de hospitalizaciones45. Una revisión sistemática que comparó la efectividad de LABA/LAMA con LABA/CIS (fluticasona/salmeterol) en pacientes con EPOC en su mayoría moderada-grave mostró mayores beneficios de LABA/LAMA sobre el riesgo de exacerbaciones (OR: 0,82; IC 95%: 0,70-0,96). Los estudios incluidos en el análisis eran heterogéneos con período de observación menor de un año y la mayoría incluyeron pacientes con EPOC moderada-grave, sin exacerbaciones recientes33.
Un ECA que comparó FFL/UMEC/VI con FFL/VI y UMEC/VI3 en pacientes con obstrucción moderada-muy grave e historia de exacerbaciones mostró mayores beneficios de FFL/UMEC/VI sobre frecuencia de exacerbaciones moderadas-graves, comparado con FFL/VI (RR: 0,85; IC 95%: 0,80-0,90%; diferencia 15%) y UMEC/VI (RR: 0,75; IC 95%: 0,70-0,81; diferencia 25%) independiente del recuento de eosinófilos en sangre, aunque hubo una mayor reducción en los pacientes con recuento >150cél/μl.
Otro ECA evaluó el efecto de intensificar la terapia LABA/CIS (budesonida/formoterol) en pacientes moderados-muy severos, al inicio de infección del tracto respiratorio superior sobre la incidencia de exacerbación46. La incidencia de exacerbaciones fue similar entre el grupo de budesonida/formoterol intensificada y placebo (14,6 vs. 16,2%; HR: 0,77; IC 95%: 0,46-1,33), sin embargo, el riesgo de exacerbaciones graves se redujo el 72% (HR: 0,28; IC 95%: 0,11-0,74) con la terapia intensificada. En el subgrupo de pacientes con enfermedad más grave se observó reducción significativa del riesgo de cualquier exacerbación.
En términos de seguridad, las evidencias indican que las terapias que incluyen CIS se asocia con mayor frecuencia de efectos adversos serios particularmente aumento del riesgo de neumonía3,33,44.
Conclusiones y recomendacionesEn términos de eficacia el uso de CIS a largo plazo muestra beneficio sobre el riesgo de exacerbaciones en pacientes con EPOC moderada-grave el cual es mayor en aquellos con recuento elevado de eosinófilos en sangre. Este beneficio debe confrontarse con el incremento del riesgo de neumonías.
Evidencia Moderada y Recomendación Fuerte para uso de CIS en pacientes con EPOC moderada-grave con historia de exacerbación y recuento elevado de eosinófilos en sangre en términos de disminución del riesgo de exacerbaciones.
Pregunta: ¿En cuáles pacientes es seguro retirar los CI?JustificaciónEl sobreuso de CIS en EPOC es una práctica común47–49 a pesar de estar su uso usualmente reservado para pacientes con alto riesgo de exacerbaciones (un tercio de la población total)50,51. El uso a largo plazo de CIS se asocia con aumento del riesgo de eventos adversos, particularmente el de neumonía42,52. Es necesario identificar aquellos pacientes con baja probabilidad de beneficio de CIS en quienes sea seguro retirarlos.
Selección de búsquedaSe capturaron 588 referencias (MeSH: 247; Trip Database: 341) seleccionando un metaanálisis53 y 2 ECA54,55 para responder la pregunta.
Resumen de la evidenciaUn metaanálisis que incluye ECA y estudios observacionales de vida real en pacientes con obstrucción moderada-muy grave, no mostró aumento del riesgo general de exacerbaciones con el retiro del CIS (OR: 1,03; IC 95%: 0,95-1,12; p>0,05), pero se incrementó el de exacerbación moderadas-graves (2,4 y 33,6%, respectivamente), y acortó el tiempo hasta la primera exacerbación (p<0,05) en los pacientes que suspendieron el CIS. El retiro del CIS también se asoció con empeoramiento de la función pulmonar (FEV1: −30ml) y calidad de vida (+1,24 unidades SGRQ), sin alcanzar la diferencia clínica mínima importante53.
Un ECA evaluó la eficacia y seguridad del retiro abrupto del CIS de la triple terapia a largo plazo en pacientes con EPOC, no exacerbadores frecuentes con FEV1 entre 40-80%54. Los pacientes fueron aleatorizados, a continuar con fluticasona/salmeterol+tiotropio o recibir indacaterol/glicopirronio. No se observó diferencias en la frecuencia de exacerbaciones moderadas-graves (0,52 vs. 0,48) (RR: 1,08; IC 95%: 0,83-1,40) ni del tiempo hasta la primera exacerbación moderada-grave entre los grupos (HR: 1,11; IC 95%: 0,85-1,46)54. El retiro del CIS se asoció con discreta reducción del FEV1 valle: −26ml (IC 95%: −53 a 1ml)54. Los pacientes con recuento de eosinófilos en sangre ≥300cél/μl presentaron mayor deterioro de la función pulmonar e incremento del riesgo de exacerbación (RR: 1,86; IC 95%: 1,06-3,29). Los eventos adversos fueron similares entre los grupos54. Otro ECA evaluó los cambios en la inflamación de las vías respiratorias después de retirar la fluticasona en pacientes con EPOC moderada-grave que recibían esta medicación a largo plazo55. La interrupción de la fluticasona indujo aumento de los linfocitos T bronquiales, mastocitos, y varios tipos de células en esputo (recaída en la producción de células inflamatorias), que se acompañó de mayor deterioro de la función pulmonar55. Los resultados sugieren que la inflamación de las vías respiratorias se suprime durante el tratamiento con fluticasona, pero los efectos antinflamatorios no se mantienen después de su retiro55
Conclusiones y recomendacionesEn EPOC con bajo riesgo de exacerbación, obstrucción moderada-grave y recuento de eosinófilos en sangre <300cél/μl se puede retirar abruptamente el CIS sin incrementar el riesgo de exacerbación ni afectar a la función pulmonar. En pacientes con alto riesgo de exacerbaciones y obstrucción moderada-grave, no se deben retirar CIS por incremento del riesgo de exacerbación y deterioro de la función pulmonar.
Evidencia Moderada y Recomendación Fuerte para retiro del CIS en EPOC con bajo riesgo de exacerbaciones, obstrucción moderada-grave y recuento de eosinófilos <300cél/μl en sangre.
Incorporación de nuevas evidenciasEl tratamiento de la EPOC debe ser individualizado, de acuerdo a la gravedad de la enfermedad y a la disponibilidad de medicamentos. Debe abarcar medidas generales y de prevención (educación, cesación de tabaco, vacunación y actividad física, entre otras), tratamiento farmacológico y no farmacológico.
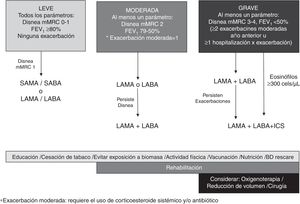
Incorporando las evidencias analizadas, se propone un esquema con medicación inhalada progresivo según la gravedad de la EPOC (disnea, obstrucción y exacerbaciones) que puede modificarse según respuesta clínica (fig. 1).
En pacientes con enfermedad leve (todos los criterios: disnea mMRC 1, FEV1≥80% post-BD) se recomienda monoterapia broncodilatadora.
En un documento previo se analizó la eficacia y la seguridad de la monoterapia LAMA vs. LABA6. La evidencia muestra que en términos de eficacia el tiotropio y los LABA tienen beneficios similares sobre la disnea, la función pulmonar y la calidad de vida, pero el tiotropio es más efectivo para reducir la frecuencia de exacerbaciones. Sobre la base de la evidencia analizada en pacientes con enfermedad moderada (con al menos un parámetro de gravedad: disnea mMRC-2, FVE1 79-50%, una exacerbación sin hospitalización en el último año) se recomienda iniciar monoterapia broncodilatadora (LAMA o LABA), de preferencia frente a LABA/ICS por riesgo aumentado de neumonía asociado a CIS. Según respuesta, se puede escalar a LAMA/LABA. En aquellos pacientes con rasgos de asma o diagnostico medico previo de asma antes de los 40 años (superposición asma-EPOC) está indicada la combinación LABA/CIS56.
En pacientes con enfermedad grave (al menos un parámetro de gravedad: mMRC 3-4, FVE1<50%, ≥2 exacerbaciones en el último año o ≥1 hospitalización por exacerbación) se recomienda iniciar tratamiento con LAMA/LABA salvo en aquellos con recuento de eosinófilos en sangre ≥300cél/μl en quienes se recomienda LABA/LAMA/CIS por los beneficios de la triple terapia sobre el riesgo de exacerbaciones y deterioro en la función pulmonar54. Esta indicado escalar a LABA/LAMA/CIS en pacientes que iniciaron LAMA/LABA y persisten con exacerbaciones independientemente del recuento de eosinófilos3. Debe considerarse retirar los CIS cuando la indicación inicial fue errada, o sin respuesta, en pacientes con efectos secundarios, como neumonía y en aquellos con bajo riesgo de exacerbación con recuento de eosinófilos <300cél/μl54. El uso profiláctico de azitromicina o roflumilast puede ser útil como terapia adicional para disminuir el número de exacerbaciones en pacientes graves57,58.
ConclusionesEl documento ALAT 2019 genera un diagrama de tratamiento con medicación inhalada en la EPOC incorporando la evidencia analizada mediante la metodología de preguntas clínicas en formato PICO y según gravedad de la obstrucción, síntomas y riesgo de exacerbaciones.
FinanciaciónEl presente trabajo ha sido financiado por AstraZeneca, Boehringer Ingelheim, y GlaxoSmithKline. Los patrocinadores no han influido ni han tenido participación en ninguna etapa de la elaboración de la guía. Ninguno de los autores ha recibido remuneración por su participación en la elaboración de esta actualización.
Conflicto de interesesAgustín Acuña y Efraín Sánchez declaran haber recibido honorarios profesionales por el desarrollo e implementación de aspectos metodológicos a través de ITSalud/Medsolid Todos los demás autores han declarado no tener ningún conflicto de intereses real o percibido.