El objetivo del estudio ha sido analizar la relación de la exposición prenatal y posnatal al tabaco con la aparición de síntomas respiratorios y alérgicos en los primeros 4 años de vida.
Pacientes y métodosEstudio de cohortes prospectivo y multicéntrico que incluye a sujetos del estudio AMICS (Asthma Multicentric Infant Cohort Study) en Ashford (Reino Unido), Barcelona y Menorca (España). Se incluyó a 1.611 niños que fueron seguidos desde el embarazo hasta el cuarto año de vida mediante cuestionarios anuales para obtener información sobre tabaquismo de los padres y síntomas respiratorios y alérgicos de los niños. En la cohorte de Barcelona (n=487) se procedió al análisis de un biomarcador de exposición al tabaco (cotinina) en distintas matrices.
ResultadosLa exposición prenatal exclusiva al tabaco se relaciona con mayor riesgo de hospitalización por infección respiratoria, especialmente en el segundo año de vida, mientras que la exposición posnatal se asocia con la aparición de sibilancias tardías y aumenta la probabilidad del diagnóstico de asma a los 4 años. Los niños expuestos pre y posnatalmente presentan más sibilancias y roncus persistentes, tos nocturna, episodios de resfriados al año y diagnósticos de asma. El riesgo de presentar sibilancias es mayor cuanto más altos son los valores de cotinina. No existe asociación entre exposición al tabaco y síntomas atópicos.
ConclusionesLa exposición pasiva al humo del tabaco durante el embarazo y la infancia tiene efectos clínicos respiratorios bien diferenciados en niños, por lo que la interrupción del hábito tabáquico en mujeres en edad fértil tiene que ser una prioridad en medicina preventiva.
To analyse the relationship between prenatal and postnatal tobacco exposure and the development of respiratory and allergy symptoms during the first 4 years of life.
Patients and methodsProspective and multicentred cohort study that included the subjects belonging to AMICS (Asthma Multicentred Infant Cohort Study) located in Ashford (England), Barcelona and Minorca (Spain). We recruited 1611 children, followed from the pregnancy to the 4th year of life, whose parents annually answered a questionnaire on their tobacco consumption and their children's respiratory and allergy health. In the Barcelona cohort (n=487) a tobacco exposure biomarker (cotinine) was analysed on several matrices.
ResultsPrenatal tobacco exposure is associated with a greater risk of hospitalisation due to respiratory infection, particularly in the second year of life, whereas postnatal tobacco exposure is associated more strongly with the presence of late wheezing presence and increases in the chance of being diagnosed with asthma at 4 years of age. The children prenatally and postnatally exposed had more persistent wheezing, persistent rhoncus, early cough, a higher number of upper respiratory infections per year and a greater number were diagnosed with asthma. The higher the levels of cotinine measured, the higher was the risk for wheezing. No relationship was seen between tobacco exposure and atopic symptoms.
ConclusionsPassive smoke exposure during pregnancy and childhood has very distinct clinical respiratory effects in children. Therefore, smoking cessation of childbearing age women must be a priority of preventive medicine.
Las enfermedades respiratorias infantiles son extremadamente frecuentes y representan un alto porcentaje de morbilidad, visitas médicas e ingresos hospitalarios, así como un elevado coste económico para la sanidad pública1. Las causas más frecuentes de las enfermedades respiratorias de las vías bajas son las infecciones y el asma. El asma constituye un importante problema de salud pública mundial, ya que es la afección crónica pediátrica más frecuente, con una prevalencia alta, que está en aumento en las regiones industrializadas2. El rápido incremento del asma infantil hace pensar que la exposición ambiental tiene un papel importante en la etiología de esta enfermedad3 y, dentro de los factores ambientales, la exposición al humo del tabaco parece ser crucial en su génesis4.
En las últimas 2 décadas se han llevado a cabo diferentes estudios para perfilar la asociación entre la exposición al humo del tabaco y el asma. Existe una evidencia concluyente de la relación entre la exposición al humo del tabaco y la presentación de síntomas respiratorios, especialmente las sibilancias4. Hoy día se está haciendo hincapié en la identificación de los períodos más críticos de exposición al humo del tabaco, comparando principalmente la exposición intraútero y la posnatal. En este sentido hay todavía pocos estudios que comparen los efectos de la exposición pre y posnatal al humo del tabaco, y los pocos que hay aportan resultados contradictorios5–8. El proyecto AMICS (Asthma Multicentric Infant Cohort Study), en el que se combinan esfuerzos de centros de Ashford, Barcelona y Menorca, ofrece un excelente marco para investigar los períodos de mayor susceptibilidad a la exposición al tabaco y relacionarlos con la sintomatología respiratoria que desencadena.
Pacientes y métodosSe crearon 3 cohortes, entre 1994 y 1998, en otras tantas localizaciones de Europa: Ashford (Reino Unido), Barcelona y Menorca. Se realizó un seguimiento de todos los niños incluidos en el estudio desde el embarazo hasta el cuarto año de vida mediante cuestionarios anuales para obtener información sobre el consumo de tabaco de los padres antes, durante y después del embarazo, y sobre los síntomas respiratorios y alérgicos que presentaban los niños. Al nacer y al cuarto año de vida se tomaron las medidas antropométricas a los niños.
Pediatras asistenciales que seguían los criterios estandarizados en la práctica clínica habitual establecieron los diversos diagnósticos a partir del cuestionario y de la revisión de la historia clínica. Se ha empleado la definición operativa y utilizada por los pediatras del III Consenso Internacional de Pediatría9, que define el asma como la existencia de “sibilancias recurrentes y/o tos persistente en una situación en que el asma es probable y se han descartado otras enfermedades menos frecuentes”. Esta definición es más adecuada para lactantes y preescolares. También se ha utilizado el término de sibilancias para definir diferentes fenotipos clínicos de esta enfermedad: sibilancias precoces transitorias, sibilancias de inicio tardío y sibilancias persistentes10.
A partir de la marca de cigarrillos consumida por las madres y los adultos en el entorno del niño se calcularon el consumo diario de nicotina, o nicotine daily intake (NDI), de la madre y la exposición total diaria a la nicotina (daily exposure to nicotine, DEN) del niño (sumando los NDI de la madre y los adultos en su entorno), del siguiente modo: NDI=número de cigarrillos fumados al día × mg de nicotina que contiene cada cigarrillo; DEN=suma de los NDI de cada fumador × h diarias pasadas con el fumador/24.
Las concentraciones de inmunoglobulina E (IgE) total se midieron en sangre de cordón al nacer y en sangre venosa del niño al cuarto año mediante fluoroinmunoanálisis (Pharmacia CAP System). Con esta misma técnica también se analizó en el plasma de los niños, al cuarto año, las IgE específicas frente a antígenos de ácaros del polvo y pelo de gato. Las variables IgE total e IgE específica se trataron como una distribución logarítmica continua.
En la cohorte de Barcelona se midió la cotinina en sangre de cordón, en orina materna y en orina fetal en el nacimiento, y también en orina del niño en el cuarto año, mediante radioinmunoanálisis11.
Análisis estadísticoSe utilizaron los tests de la χ2 y ANOVA para los análisis bivariantes, mientras que para los análisis multivariantes se empleó la regresión lineal o logística aplicables en cada momento según los tipos de variable. Todos los análisis estadísticos se efectuaron con Stata versión 8.
ResultadosEn la cohorte de Ashford se incluyó a 634 madres y 642 niños; en la de Barcelona, a 480 madres y 487 niños, y en la de Menorca, a 475 madres y 482 niños.
Características del consumo materno de tabacoLos porcentajes por grupos según el consumo de tabaco materno fueron: nunca un 41,8%, siempre (prenatal y posnatal) un 26,8%, sólo antes y durante el embarazo (prenatal) un 3,3%, sólo antes del embarazo (preconcepcional) un 10,9%, sólo antes y después del embarazo (preconcepcional y posnatal) un 12,2% y sólo después del embarazo (posnatal) un 5,2%.
En la cohorte de Barcelona es donde hay más fumadoras persistentes, mientras que en Menorca es donde hay más no fumadoras. Se observa un mayor consumo de tabaco en las clases sociales más bajas. Las fumadoras persistentes son mujeres más jóvenes que las no fumadoras. La prevalencia de atopia en las fumadoras persistentes es menor que en las no fumadoras. No hay diferencias significativas en la prevalencia de asma entre fumadoras y no fumadoras. Las mujeres fumadoras persistentes presentan un NDI de 20mg/día, el doble que las fumadoras ocasionales antes del embarazo. Globalmente, cuando se produce el embarazo, la proporción de gestantes que dejan de fumar es de un 40,1%. El 30,1% de gestantes fuma durante el embarazo. De las mujeres que continúan fumando durante la gestación, el consumo diario disminuye en promedio un 70% en proporción al consumo previo. Después del parto vuelve a aumentar el consumo de tabaco al 80% del consumo inicial. La prevalencia del tabaquismo materno a lo largo de los 4 primeros años de maternidad oscila entre el 30 y el 40%.
Síntomas respiratoriosExposición prenatal. El grupo de niños expuestos al tabaco sólo en época prenatal presenta una incidencia de hospitalizaciones por infección respiratoria mayor que los hijos de madres no fumadoras, tanto en el primer año de vida (odds ratio [OR]=2,96; intervalo de confianza [IC] del 95%, 1,1–7,7) como en el segundo (OR=4,95; IC del 95%, 1,36–17,91).
Exposición posnatal. En el análisis multivariante, se observa una asociación entre la exposición posnatal exclusiva y la aparición de sibilancias tardías (OR=2,48; IC del 95%, 1,08–5,7); esta asociación se potencia cuando la madre es atópica (OR=5,18; IC del 95%, 1,23–21,81) (tabla 1). La exposición sólo en la época posnatal también aumenta la probabilidad de ser diagnosticado de asma a los 4 años (OR=1,69; IC del 95%, 1,01–2,82), asociación que también se potencia cuando existe el antecedente de atopia materna (OR=3,19; IC del 95%, 1,11–9,19).
Asociación entre consumo de tabaco materno y patrones de sibilancias
| Grupos | Sibilantes precoces | Sibilantes persistentes | Sibilantes tardíos |
| 1 | 1,46 (0,98–2,18) | 2,18¿ (1,49–3,20) | 1,41 (0,80–2,48) |
| 2 | 0,72 (0,25–2,02) | 1,16 (0,45–2,96) | 1,07 (0,76–2,22) |
| 3 | 0,85 (0,53–1,36) | 0,79 (0,47–1,31) | 1,15 (0,58–2,31) |
| 4 | 0,80 (0,50–1,28) | 1,14 (0,71–1,81) | 1,42 (0,96–2,68) |
| 5 | 1,08 (0,56–2,08) | 0,96 (0,47–2,08) | 2,48¿ (1,08–5,71) |
Los valores expresan la odds ratio (intervalo de confianza del 95%). Análisis ajustado por lugar, sexo, lactancia materna, asma materna, tabaquismo paterno, peso al nacer, número de hermanos, número de personas en casa. La edad materna y la clase social no modifican el modelo.Grupos de consumo de tabaco materno según declaración por cuestionario: 1: siempre; 2: sólo prenatal; 3: sólo preconcepcional; 4: sólo preconcepcional y posnatal; 5: sólo posnatal.
Exposición persistente. El grupo de niños cuyas madres fumaron en los períodos prenatal y posnatal presenta más sibilancias persistentes (OR=2,18; IC del 95%, 1,49–3,2), roncus persistentes (OR=1,70; IC del 95%, 1,11–2,61) y tos nocturna temprana (OR=1,90; IC del 95%, 1,02–3,5). Este grupo, durante sus 2 primeros años de vida, tiene una probabilidad más alta de presentar más de 5 (OR=1,65; IC del 95%, 1,21–2,25) y más de 12 (OR=1,92; IC del 95%, 1,25–2,96) episodios de resfriado común al año que los no expuestos. Los niños expuestos pre y posnatalmente al tabaco tienen un mayor riesgo de ser diagnosticados de asma el segundo año de vida (OR=2,47; IC del 95%, 1,29–4,72), el tercero (OR=2,51; IC del 95%, 1,43–4,37) y el cuarto (OR=1,84; IC del 95%, 1,13–3,01) que los niños no expuestos. No se encontraron diferencias significativas entre expuestos y no expuestos al tabaco respecto al número de otitis.
Síntomas atópicos e inmunoglobulina ELos hijos de madres atópicas expuestos al humo del tabaco en el período posnatal tienen un riesgo 3,7 (IC del 95%, 1,22–11,24) veces mayor de presentar rinoconjuntivitis alérgica en el segundo año de vida, y 2,61 (IC del 95%, 1,01–6,88) veces mayor en el cuarto, que los niños de madres atópicas no fumadoras. No se infiere ninguna asociación entre exposición al tabaco y presencia de rinoconjuntivitis sin la existencia del antecedente de atopia materna. Tampoco se encontraron asociaciones entre la exposición al tabaco y el eccema o el prurito cutáneos.
La regresión logística muestra que los valores de IgE total en sangre de cordón y en sangre venosa el cuarto año de vida no están influidos por la exposición al humo del tabaco. Asimismo, el análisis entre los patrones de consumo de tabaco materno y la IgE específica a los ácaros del polvo y al epitelio de gato en el cuarto año no mostró ningún tipo de asociación.
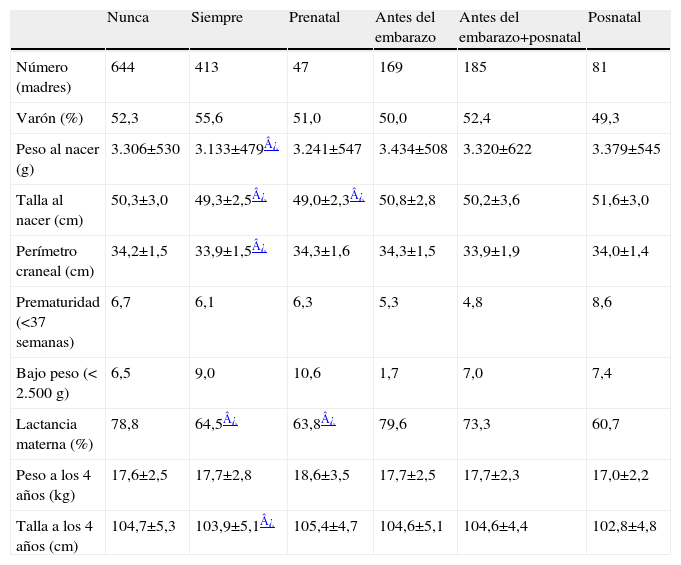
Parámetros antropométricosEl análisis multivariante muestra que, en los hijos de las madres fumadoras persistentes, los 3 parámetros antropométricos principales (peso, talla y perímetro craneal) y la relación cerebro-cuerpo están disminuidos de forma significativa en el nacimiento respecto a los hijos de las madres que nunca han fumado. Los hijos del grupo de consumo sólo prenatal presentaron tallas menores que los hijos de no fumadoras. Los hijos cuyas madres no fumaron durante el embarazo no presentaron déficit en ningún parámetro de crecimiento al nacer respecto el grupo que nunca había fumado. Al cuarto año no se observan diferencias en el peso y la talla (ajustada por el peso al nacer) de los niños comparando los distintos grupos de consumo materno de tabaco (tabla 2).
Parámetros antropométricos del recién nacido y a los 4 años de edad según tabaquismo materno
| Nunca | Siempre | Prenatal | Antes del embarazo | Antes del embarazo+posnatal | Posnatal | |
| Número (madres) | 644 | 413 | 47 | 169 | 185 | 81 |
| Varón (%) | 52,3 | 55,6 | 51,0 | 50,0 | 52,4 | 49,3 |
| Peso al nacer (g) | 3.306±530 | 3.133±479¿ | 3.241±547 | 3.434±508 | 3.320±622 | 3.379±545 |
| Talla al nacer (cm) | 50,3±3,0 | 49,3±2,5¿ | 49,0±2,3¿ | 50,8±2,8 | 50,2±3,6 | 51,6±3,0 |
| Perímetro craneal (cm) | 34,2±1,5 | 33,9±1,5¿ | 34,3±1,6 | 34,3±1,5 | 33,9±1,9 | 34,0±1,4 |
| Prematuridad (<37 semanas) | 6,7 | 6,1 | 6,3 | 5,3 | 4,8 | 8,6 |
| Bajo peso (< 2.500g) | 6,5 | 9,0 | 10,6 | 1,7 | 7,0 | 7,4 |
| Lactancia materna (%) | 78,8 | 64,5¿ | 63,8¿ | 79,6 | 73,3 | 60,7 |
| Peso a los 4 años (kg) | 17,6±2,5 | 17,7±2,8 | 18,6±3,5 | 17,7±2,5 | 17,7±2,3 | 17,0±2,2 |
| Talla a los 4 años (cm) | 104,7±5,3 | 103,9±5,1¿ | 105,4±4,7 | 104,6±5,1 | 104,6±4,4 | 102,8±4,8 |
Valores expresados en porcentaje o media±desviación estándar.
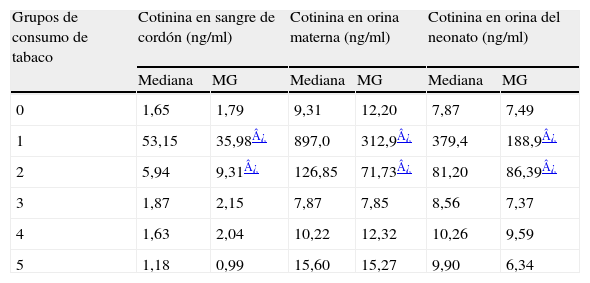
En el nacimiento. La media geométrica de la cotinina en sangre de cordón aumenta proporcionalmente con el grado de exposición a la nicotina (DEN) y con el aumento del NDI por cuestionario. Por su parte, la medición de cotinina tanto en orina materna como fetal sólo es significativamente distinta entre fumadoras y no fumadoras, pero no hay diferencias significativas entre expuestas y no expuestas al humo del tabaco. Asimismo, las concentraciones de cotinina medida en las 3 matrices usadas al nacimiento (sangre de cordón, orina de la madre, orina del recién nacido) muestran medias geométricas muy bajas en las madres no fumadoras, mientras que las madres fumadoras persistentes y las que fumaron sólo antes y durante el embarazo presentaron valores significativamente más altos. Las madres que no fumaron durante la gestación presentan medias indiferenciables respecto al grupo de referencia en las muestras recogidas al nacimiento (tabla 3).
Validación con biomarcadores de los grupos de consumo de tabaco materno según autodeclaración
| Grupos de consumo de tabaco | Cotinina en sangre de cordón (ng/ml) | Cotinina en orina materna (ng/ml) | Cotinina en orina del neonato (ng/ml) | |||
| Mediana | MG | Mediana | MG | Mediana | MG | |
| 0 | 1,65 | 1,79 | 9,31 | 12,20 | 7,87 | 7,49 |
| 1 | 53,15 | 35,98¿ | 897,0 | 312,9¿ | 379,4 | 188,9¿ |
| 2 | 5,94 | 9,31¿ | 126,85 | 71,73¿ | 81,20 | 86,39¿ |
| 3 | 1,87 | 2,15 | 7,87 | 7,85 | 8,56 | 7,37 |
| 4 | 1,63 | 2,04 | 10,22 | 12,32 | 10,26 | 9,59 |
| 5 | 1,18 | 0,99 | 15,60 | 15,27 | 9,90 | 6,34 |
MG: media geométrica ajustada por edad materna, sexo del niño y consumo de tabaco paterno.Grupos de consumo de tabaco materno según declaración por cuestionario: 0: nunca, 1: siempre; 2: sólo prenatal; 3: sólo preconcepcional; 4: sólo preconcepcional y posnatal; 5: sólo posnatal.
Al cuarto año. La media geométrica de la cotinina en orina del niño al cuarto año aumenta proporcionalmente con el grado de exposición a la nicotina procedente de la madre, el grado de exposición a la nicotina procedente del padre y el grado de exposición a la nicotina procedente de ambos progenitores. Los valores medios de cotinina en orina son aproximadamente 3 veces más altos cuando la exposición procede de la madre, con los mismos valores de DEN.
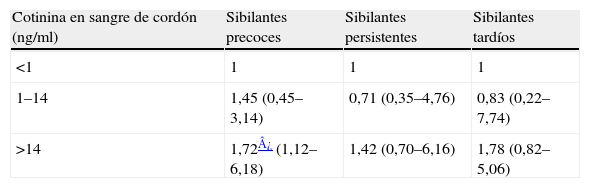
Correlación entre biomarcadores y sibilancias. Los niños con una exposición alta al humo del tabaco en época prenatal (cotinina en sangre de cordón > 14ng/ml)12 presentan un mayor riesgo de desarrollar sibilantes tempranos (OR=1,72; IC del 95%, 1,12–6,18) con relación a los no expuestos al tabaco (tabla 4A). Los valores altos de cotinina en orina del niño en el cuarto año de vida (> 50ng/ml)12 también se relacionan con un mayor riesgo de presentar sibilantes ese mismo año (OR=3,02; IC del 95%, 1,71–4,27) (tabla 4B).
Asociación entre los valores de cotinina en sangre de cordón y patrones de sibilancias
| Cotinina en sangre de cordón (ng/ml) | Sibilantes precoces | Sibilantes persistentes | Sibilantes tardíos |
| <1 | 1 | 1 | 1 |
| 1–14 | 1,45 (0,45–3,14) | 0,71 (0,35–4,76) | 0,83 (0,22–7,74) |
| >14 | 1,72¿ (1,12–6,18) | 1,42 (0,70–6,16) | 1,78 (0,82–5,06) |
Los valores expresan odds ratios (intervalo de confianza del 95%). Análisis ajustado por sexo, asma materna, número de hermanos y número de personas en casa. La edad materna y la clase social no modifican el modelo.
Asociación entre los valores de cotinina en orina del niño a los 4 años y patrones de sibilancias
| Cotinina en orina (ng/ml) | Sibilantes al 4.° año |
| <1 | 1 |
| 10–50 | 0,88 (0,56–4,18) |
| >50 | 3,02¿(1,71–4,27) |
Los valores expresan odds ratios (intervalo de confianza del 95%). Análisis ajustado por sexo, asma materna, número de hermanos y número de personas en casa. La edad materna y la clase social no modifican el modelo.
Los datos obtenidos en nuestro estudio indican que el tabaquismo durante el embarazo aumenta la prevalencia de hospitalizaciones por infección respiratoria de las vías bajas especialmente en los primeros 2 años de vida, y este efecto es independiente de la exposición posnatal al tabaco, de acuerdo con otros autores8.
Otros estudios concluyen que la exposición posnatal influye decisivamente en la presentación de infecciones respiratorias y que el tabaquismo durante el embarazo sólo representa un riesgo añadido para desarrollar este tipo de infecciones13,14.
Este aumento encontrado en la frecuencia de infecciones de etiología probablemente vírica en los niños expuestos al tabaco en el período prenatal puede explicarse por una capacidad disminuida para la neutralización de los virus en el grupo de expuestos al humo del tabaco15. También se ha visto que el tabaquismo durante el embarazo puede afectar al desarrollo y la maduración del sistema inmunitario pulmonar16. El desarrollo fetal representa un momento crítico de vulnerabilidad pulmonar, por lo que fumar durante el embarazo se asocia con una función pulmonar disminuida en el período neonatal17. Asimismo se ha postulado que la influencia de la exposición prenatal al tabaco sobre la función respiratoria sería indirecta, a través de un efecto negativo sobre los parámetros antropométricos, que condicionaría una disminución del tamaño de las vías aéreas18. Todas estas alteraciones pulmonares en el recién nacido facilitarían la aparición de infecciones respiratorias en los primeros años de vida.
Sibilancias y asmaNuestro estudio no ha encontrado asociación entre exposición prenatal al tabaco y presencia de sibilancias, y tampoco aumentó significativamente la prevalencia de niños diagnosticados de asma. En cambio, el consumo de tabaco exclusivamente en época posnatal sí se asoció con la aparición de sibilancias tardías y diagnóstico de asma al cuarto año. Cunningham et al19, en un extenso estudio transversal, también observan que existe asociación entre exposición posnatal y sibilantes. Esto indicaría que la exposición pasiva del niño durante su primera infancia afecta principalmente a la hiperreactividad bronquial más que a la inflamación. Contrariamente a nuestros datos, Gililand et al7 concluyen que la exposición in útero se asocia con una prevalencia aumentada de asma diagnosticada, historia de sibilantes y sibilantes persistentes, mientras que la exposición posnatal se relaciona con sibilantes tanto intermitentes como persistentes, pero no con el diagnóstico de asma. Por otro lado, el estudio Avon6 observa que tanto la exposición prenatal como la posnatal, de forma independiente, aumentan el riesgo de presentar sibilantes, y de forma similar Jaakkola et al8 encuentran que asma y sibilantes se asocian con la exposición prenatal, aunque también con la exposición posnatal precoz.
Nuestro estudio también ha detectado que la exposición ambiental al tabaco aumenta la frecuencia de diagnóstico médico de asma y sibilancias, especialmente cuando existe el antecedente de atopia de la madre. En este sentido, los niños con antecedente de atopia tendrían más susceptibilidad al humo del tabaco, y su hiperrectividad bronquial se manifestaría antes, como apuntan algunos autores20.
Según nuestros resultados, la exposición permanente al tabaco desde la gestación hasta la primera infancia se asocia con un aumento de la prevalencia de sibilantes persistentes, roncus persistentes, tos nocturna, episodios de resfriado común al año y un mayor riesgo de ser diagnosticado de asma. Estas observaciones son coincidentes con la mayoría de los estudios publicados21. Entre los mecanismos por los que la exposición pre y posnatal al tabaco puede inducir asma se han propuesto un efecto irritante con una respuesta inflamatoria de las mucosas y la posterior aparición de tos y roncus; aumento de la hiperreactividad bronquial con aparición de sibilancias, y alteraciones de la función pulmonar y aumento de la sensibilidad a alérgenos21.
Nuestro estudio no ha detectado ninguna asociación entre el número de otitis y la exposición al tabaco materno, aunque hay estudios que concluyen que la exposición al tabaco durante la infancia es un elemento que favorece el desarrollo de infecciones óticas22.
Una posible limitación del estudio sería la existencia de sesgos relacionados con la variabilidad de la práctica médica y las definiciones de los distintos cuadros clínicos. No obstante, los diversos diagnósticos se establecieron siguiendo los criterios estandarizados a partir del cuestionario y de la revisión de la historia clínica, y se contrastaron de forma individual. Además, se han seguido los mismos criterios diagnósticos que en el resto de publicaciones relacionadas con el proyecto AMICS23.
Síntomas atópicosAlgunas publicaciones describen una asociación positiva de la rinitis, rinoconjuntivitis o fenómenos alérgicos en general con el tabaquismo de los padres8. Nuestros datos, por el contrario, mostraron que la exposición al humo del tabaco no se relaciona con la mayoría de síntomas alérgicos, si no existe el antecedente de atopia materna. A favor de nuestros resultados está el estudio de Strachan et24, que afirman que el hábito tabáquico de los padres antes o inmediatamente después del nacimiento no incrementa la sensibilización atópica en los niños. Esto podría deberse a que son síntomas independientes del efecto irritante y lesivo del tabaco. Unos autores noruegos25 han observado una asociación negativa entre la exposición prenatal al tabaco y la prevalencia de atopia en los niños, y señalan que la evitación selectiva del tabaco en mujeres con historia de atopia podría explicar que sus hijos, con elevado componente genético, no estén expuestos a él.
Inmunoglobulina ESegún algunos autores, la exposición al tabaco podría aumentar el valor de IgE total en la infancia, mediante un mecanismo indirecto, como favorecedor del riesgo de infecciones intercurrentes26. En cambio, la IgE específica estaría influida solamente por la exposición al alérgeno específico, y el tabaco no tendría ninguna participación. En nuestro estudio la exposición pasiva al tabaco no modificó los valores de IgE total e IgE específica, ni en el nacimiento ni en el cuarto año, al igual que han observado otros autores27.
Parámetros antropométricosEl efecto adverso que el tabaquismo materno durante el embarazo tiene sobre el peso al nacer del recién nacido se conoce desde 195728. Se postula que este efecto se debe a que el tabaco produce una reducción transitoria del flujo de sangre en el útero, con la consecuente reducción de aporte de oxígeno del útero a la placenta29; por otro lado, el monóxido de carbono del tabaco induce la formación de carboxihemoglobina30. Todo ello conduce a una disminución de la oxigenación de los tejidos fetales y, en consecuencia, a un desarrollo fetal desacelerado. Hemos observado que todos los parámetros antropométricos al nacer están disminuidos en los hijos de madres fumadoras persistentes, grupo que se caracteriza por un consumo elevado de nicotina. En la exposición prenatal aislada, los hijos presentan una talla significativamente menor que los no expuestos, pero no hemos llegado a detectar diferencias en el peso; esto se debe a que el NDI medio de este grupo es mucho más moderado. Esto indica que se trata de una respuesta antropométrica dependiente de la dosis de tabaco consumida por la embarazada, como ya han señalado algunos autores31.
A pesar del deficiente medro inducido por el tabaco en la etapa gestacional, no hemos observado diferencias significativas en el peso y la talla al cuarto año entre los niños expuestos y no expuestos al tabaco, lo que denota que estos niños presentan una correcta recuperación ponderal. Según nuestros resultados, no hay evidencia de que la exposición pre y posnatal al humo del tabaco condicione alteraciones permanentes del crecimiento, como ya han apuntado otros autores32.
BiomarcadoresPara descartar que en los cuestionarios hubiera un sesgo debido a una infraestimación o subdeclaración de la exposición infantil al tabaco, se decidió incluir una medición objetiva con biomarcadores en la cohorte de Barcelona. Se eligió la cotinina, el mayor metabolito de la nicotina, porque en la actualidad se considera el biomarcador de elección por tener una vida media más larga que la nicotina y una alta especificidad33. Aunque algunos autores opinan que la información sobre el consumo de tabaco obtenida mediante cuestionario puede estar infraestimada, sobre todo por baja sensibilidad34, otros encuentran una coincidencia razonable entre los biomarcadores y la información recabada en las encuestas35. Estudios publicados por nuestro grupo han demostrado que el cuestionario permite discriminar entre fumadoras activas y no fumadoras, pero no es lo bastante sensible para distinguir entre no fumadoras expuestas al tabaco y no fumadoras no expuestas36,37. En nuestro estudio hemos observado una correlación aceptable entre la cotinina medida al nacer y la estratificación por grupos según el cuestionario. Además, nuestro grupo ha objetivado que la cotinina en sangre de cordón permite diferenciar el consumo materno activo de tabaco de la exposición pasiva; incluso permite diferenciar entre distintos grados de exposición diaria a nicotina y entre distintos grados de NDI según declaración36. También hemos observado que la cotinina en orina al cuarto año de vida del niño distingue entre distintos grados de exposición a partir de la madre, entre distintos grados de exposición a partir del padre y entre distintos grados de exposición a partir de ambos progenitores, lo que indica que la cotinina en orina es un valor altamente sensible. A pesar de que hay acuerdo en que el hábito tabáquico materno afecta a los hijos en mayor grado que el tabaquismo paterno, sólo nuestro grupo ha cuantificado esta relación recientemente35. Esto indica que la influencia del hábito tabáquico materno es mucho más perjudicial para sus hijos, principalmente porque las madres tienen un contacto más estrecho con ellos.
ConclusionesLa exposición al humo del tabaco tiene efectos nocivos para la salud del niño, especialmente para el aparato respiratorio. La exposición prenatal exclusiva aumenta la aparición de infecciones respiratorias de vías bajas en los primeros años de vida, mientras que la exposición posnatal al tabaco actúa como un inductor de sibilancias tardías y asma. En este momento, es fundamental limitar los efectos dañinos del tabaco debidos a una exposición en la etapa prenatal o posnatal. La interrupción del hábito tabáquico en mujeres en edad fértil tiene que ser una prioridad de la medicina preventiva.