La apnea obstructiva del sueño (AOS) se ha vinculado de forma creciente con las enfermedades cardiovasculares. Los procesos inflamatorios asociados a la AOS pueden contribuir a esta morbilidad. Algunos estudios han señalado que las concentraciones séricas de proteína C reactiva de alta sensibilidad (PCR-as) y de interleucina-6 (IL-6) están aumentadas en estos pacientes. El objetivo principal del estudio has sido investigar la repercusión a corto y largo plazo del tratamiento de presión positiva automática en la vía aérea (APAP) sobre las concentraciones séricas de PCR-as e IL-6 en pacientes con AOS clasificada entre moderada y grave. Como objetivo secundario, nos propusimos evaluar las concentraciones basales de PCR-as e IL-6 en los pacientes con AOS y su posible relación con la gravedad de dicho síndrome, independientemente de los factores de confusión, y comparar las concentraciones de PCR-as en los afectados de AOS con los de una población de control procedente de la comunidad.
Pacientes y métodosSe trata de un estudio prospectivo que ha incluido a 98 pacientes varones con AOS de moderada a grave, confirmada mediante un estudio domiciliario del sueño. Las neoplasias malignas y las enfermedades inflamatorias crónicas fueron criterios de exclusión. Se evaluaron las concentraciones séricas de PCR-as y de IL-6 antes de la APAP, a los 9 días y a los 6 meses del tratamiento. Los controles de la comunidad (n=103), que se seleccionaron mediante llamadas telefónicas aleatorias, se emparejaron por edad e índice de masa corporal (IMC) con el grupo de pacientes con objeto de comparar las concentraciones de PCR-as al inicio del estudio.
ResultadosLa población estudiada presentaba una media (± desviación estándar) de edad de 55,3±10,7 años, un IMC medio de 33,2±5,0kg/m2, un índice medio de apneas-hipopneas de 51,7±21,3/h y un índice de desaturación de 86,3±5,3/h. El cumplimiento del tratamiento con APAP fue bueno, con un uso de un 91,27±20,45% de los días y de 5,76±1,59h/noche.
Al inicio del estudio, los valores séricos medios de PCR-as e IL-6 fueron de 0,52±0,53 y 17,7±22,5μg/l, respectivamente. Los de PCR-as se correlacionaban de forma significativa con el índice de apneas-hipopneas, el índice de desaturación y la saturación de oxígeno mínima durante la noche, y los de IL-6 estaban correlacionados de forma significativa y negativa con la saturación de oxígeno mínima durante la noche. Al ajustar por los factores de confusión encontrados en el estudio, todas estas relaciones perdieron significación.
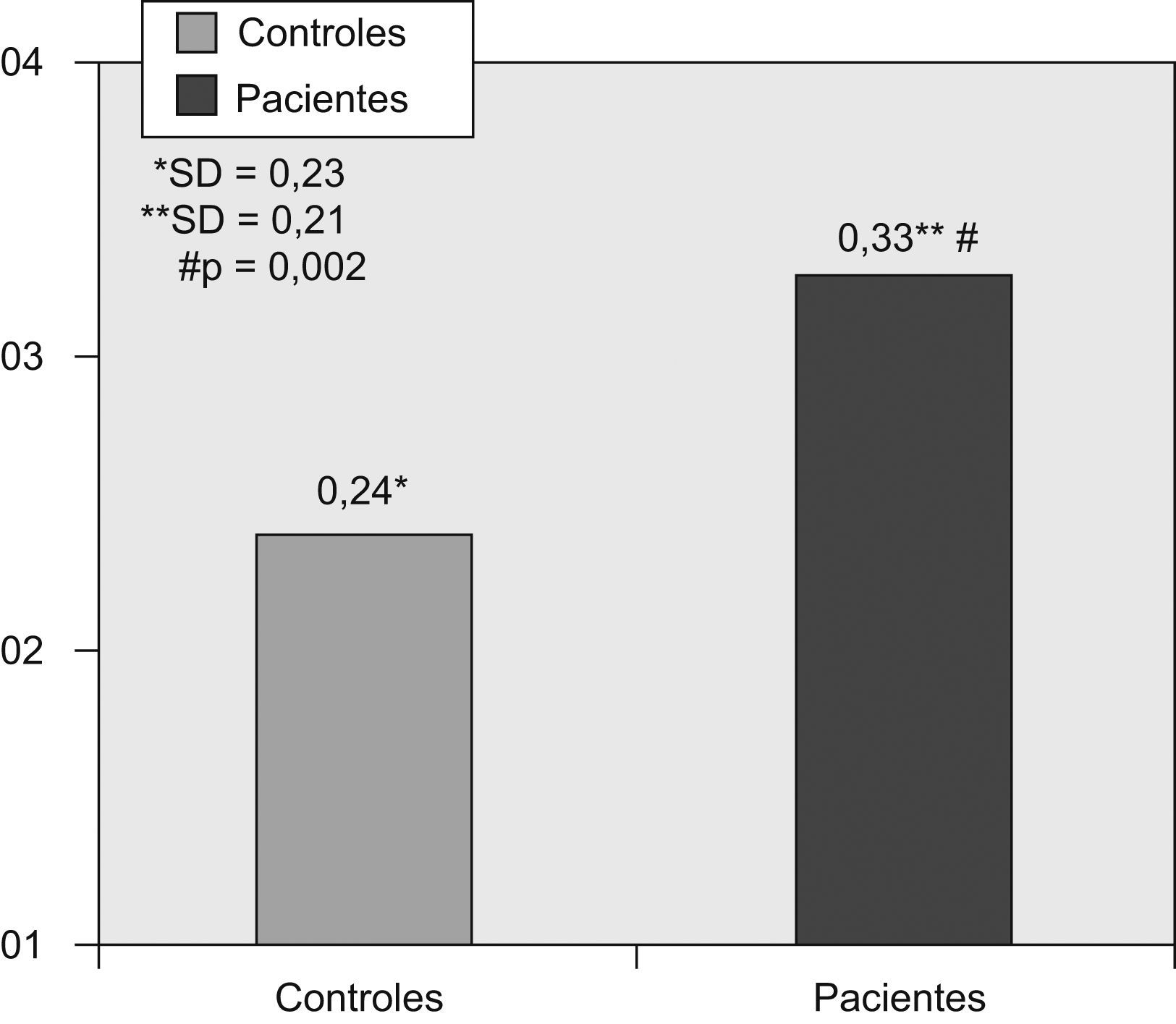
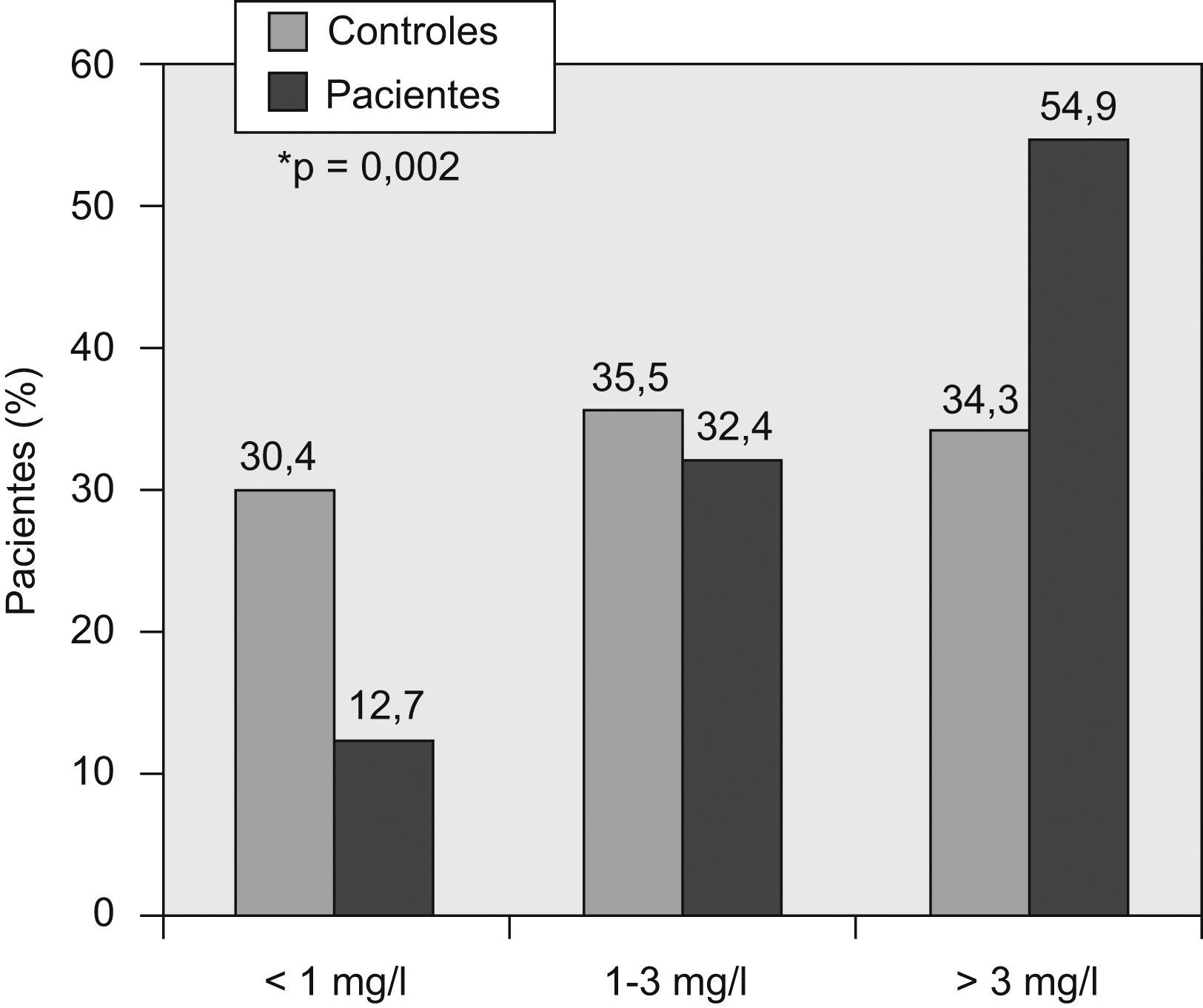
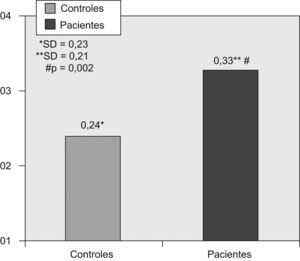
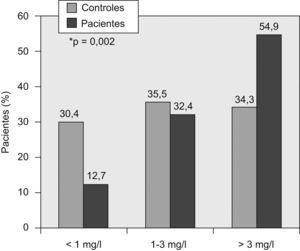
La PCR-as se encontraba significativamente elevada en los pacientes respecto a los controles (p=0,002). Al considerar las categorías de estratificación del riesgo cardiovascular mediante la PCR-as, en el grupo de pacientes era significativamente mayor el número de personas con riesgo elevado de episodios cardiovasculares en comparación con el grupo control (p=0,002).
Tras el ajuste por IMC e hipertensión arterial, el grupo de pacientes presentaba un riesgo moderado casi 2 veces superior y un riesgo importante más de 2 veces superior de desarrollar episodios cardiovasculares en comparación con el grupo de control.
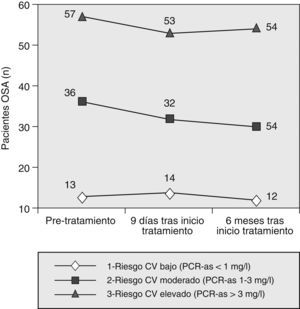
No encontramos diferencias significativas entre las concentraciones de PCR-as e IL-6 antes del tratamiento y en los 2 períodos posteriores, es decir, a los 9 días y a los 6 meses (PCR: p=0,720 y p=0,387; IL-6: p=0,266 y p=0,238, respectivamente).
ConclusionesLa AOS está asociada con un proceso inflamatorio de bajo grado. Las concentraciones séricas de PCR-as se encuentran elevadas en los pacientes con AOS al compararlas con las de un grupo de control procedente de la comunidad, independientemente de la edad y del IMC. Además, el grupo de pacientes presentaba un riesgo significativamente mayor de desarrollar episodios cardiovasculares que el de control. No se observó una disminución significativa de las concentraciones de los mediadores inflamatorios (PCR-as e IL-6) tras el tratamiento de APAP a corto ni a largo plazo.
Obstructive sleep apnoea (OSA) has been increasingly linked to cardiovascular disease. Inflammatory processes associated with OSA may contribute to this morbidity. Some studies have reported serum levels of high sensitivity C-reactive protein (hs-CRP) and interleukin-6 (IL-6) to be increased in these patients. Primary objective: investigate the impact of short and long-term autoadjusting positive airway pressure (APAP) therapy on IL-6 and hs-CRP serum levels in patients with moderate to severe obstructive sleep apnoea. Secundary Objective: evaluate the basal hs-CRP and IL-6 levels in OSA patients and its possible relation to OSA severity, independently of confounders and compare the hs-CRP levels in OSA patients with those in community controls.
Patients and methodsThis is a prospective study including 98 male patients with moderate to severe OSA confirmed by domiciliary sleep study. Malignancy and chronic inflammatory diseases were exclusion criteria. hs-CRP and IL-6 serum levels were evaluated before APAP, 9 days and 6 months after therapy. Community controls (n=103) were selected using random digit dialling, and matched by age and body mass index (BMI) for comparison of hs-CRP levels at baseline.
ResultsThe studied population had a mean age of 55.3±10.7 years, mean BMI 33.2±5.0kg/m2, mean apnoea-hypopnoea index 51.7±21.3/h and mean desaturation index 86.3±5.3/h. The APAP compliance was good: 91.27%±20.45 days usage and 5.76±1.59h/night of usage.
Mean basal hs-CRP and IL-6 serum values were 0.52±0.53μg/l and 17.7±22.5μg/l, respectively. CRP levels at baseline correlated significantly with apnoea-hypopnoea index, desaturation index and minimum nocturnal oxygen saturation. IL-6 levels at baseline correlated significantly and negatively with minimum nocturnal oxygen saturation. When adjusting for confounding factors found in this study, all these relations lost significance.
CRP is significantly increased in patients when compared to controls (p=0.002) and when considering hs-CRP cardiovascular risk stratified categories, cases had significantly more patients at high risk of cardiovascular events than controls (p=0.002).
After adjustment for BMI and arterial hypertension, cases had an almost twofold moderate risk of cardiovascular events and more than a twofold severe risk of cardiovascular events when compared to controls.
We found no significant difference between hs-CRP and IL-6 concentrations pre-treatment and in two moments post-treatment (9 days and 6 months) (CRP: p=0.720 and p=0.387, respectively; IL-6: p=0.266 and p=0.238, respectively).
ConclusionsOSA is associated with a low-grade inflammatory process; hs-CRP serum levels are elevated in OSA patients when comparing to community controls, independently of age and BMI and the former have a significantly higher risk of cardiovascular events when compared to the latter. There was no significant decrease of both inflamatory mediators (hs-CRP, IL-6) after short and long-term APAP therapy.
La apnea obstructiva del sueño (AOS) es un trastorno común con una prevalencia que oscila entre el 2 y el 4% en los adultos de mediana edad1. Se ha vinculado de forma creciente con las enfermedades cardiovasculares2–4. En su aparición participan mecanismos tales como el aumento de la actividad simpática5 y la disfunción endotelial. Los procesos inflamatorios6 asociados con la AOS también pueden actuar potencialmente como mediadores de la morbimortalidad cardiovascular en estos pacientes.
Varios estudios han demostrado que las concentraciones séricas de interleucina-6 (IL-6)7–9 y de proteína C reactiva (PCR)9–11 están elevadas en los pacientes con AOS, mientras que otros estudios no han podido corroborarlo12,13.
La IL-6 es una citocina circulante que secretan diferentes células, incluidas los macrófagos y los linfocitos activados14. La inflamación es el estímulo principal de la producción de IL-6, pero existen otros, como el humo del tabaco14 y la adiposidad15. Por otra parte, la síntesis hepática de la PCR está en gran medida regulada por la citocina proinflamatoria IL-616,17, que se cree representa el principal regulador de la respuesta hepática en la fase aguda16,17. A diferencia de las citocinas, la PCR constituye un importante marcador sérico de inflamación, que es muy estable a lo largo de las 24h18 y que puede reflejar el grado de respuesta inflamatoria.
Los estudios epidemiológicos revelan que una concentración elevada de PCR en varones y mujeres aparentemente sanos es una sólida variable predictiva de riesgo cardiovascular19,20, y algunos autores han demostrado que la PCR es un factor de riesgo cardiovascular independiente21,22. La PCR puede desempeñar una función directa en el inicio y la progresión de la aterosclerosis23. Sus propiedades proinflamatorias y aterógenas se han encontrado en las células endoteliales24, en las del músculo liso vascular25 y en los monocitos-macrófagos26; además, las concentraciones de PCR se asocian con el estrés oxidativo27.
Por otro lado, la hipoxemia da lugar a un aumento de la IL-6 y la PCR28 en los seres humanos sanos. El sueño fragmentado o la privación del mismo6 inducen asimismo un aumento de las citocinas que puede subyacer en las respuestas inflamatorias que conducen a la morbilidad cardiovascular29.
La presión positiva continua de la vía aérea (CPAP) es el tratamiento principal de la AOS30,31. Las pruebas acumuladas apoyan que también reduce las enfermedades cardiovasculares32,33 y los factores de riesgo cardiovascular34. Desde hace poco se utilizan como tratamiento alternativo a la CPAP tradicional los dispositivos de presión positiva automática de la vía aérea (APAP), que pueden mejorar los síntomas35, al tiempo que aumentan a largo plazo el cumplimiento del tratamiento36 sin los elevados costes que suponen los ajustes de dosis de la CPAP37. Sin embargo, al contrario de lo que ocurre con la CPAP, el efecto del tratamiento con APAP en la respuesta cardiovascular y metabólica de los pacientes con AOS es poco conocido38.
El presente estudio se ha realizado principalmente para evaluar la repercusión del tratamiento con APAP a corto y largo plazo en las concentraciones séricas de IL-6 y PCR de los pacientes con AOS de moderada a grave, y en segundo lugar, para evaluar las concentraciones basales de PCR de alta sensibilidad (PCR-as) e IL-6 en los pacientes con AOS y su posible relación con la gravedad de la AOS, independientemente de los factores de confusión. Por último, se compararon las concentraciones de PCR-as de los pacientes afectados de AOS con las de sujetos controles procedentes de la comunidad.
Pacientes y métodosDiseño del estudio y sujetosSe diseñó un estudio prospectivo y controlado, en el que se recogieron los datos de la PCR-as antes del tratamiento.
Se incluyó a 102 pacientes varones que fueron derivados a nuestro Departamento de Neumología y Trastornos Respiratorios del Sueño por sospecha de trastornos del sueño debidos a problemas respiratorios. Los criterios de inclusión se establecieron con anterioridad —AOS moderada/grave con criterios para el tratamiento activo mediante soporte ventilatorio nocturno (índice de apneas-hipopneas >20/h), pruebas de función pulmonar normales (relación volumen espiratorio forzado en el primer segundo/capacidad vital forzada >70; volumen espiratorio forzado en el primer segundo y capacidad vital forzada >80% del previsto) y sexo masculino—, al igual que los criterios de exclusión, que fueron los siguientes: enfermedades neoplásicas, enfermedades inflamatorias crónicas sistémicas, enfermedades infecciosas activas y corticoterapia sistémica de larga duración.
El índice de masa corporal (IMC) se calculó por la fórmula peso/altura2.
Los pacientes recibieron tratamiento con APAP mediante un dispositivo REM STAR™ Auto (Respironics Inc., Murrysville, PA, EE.UU.) con una presión mínima y máxima predeterminada de 4 y 15 cmH2O, respectivamente.
Todos los pacientes, excepto 4, participaron en el estudio hasta el final (n=98). Los que no lograron concluir el protocolo adujeron como razón del abandono la intolerancia nocturna a la APAP.
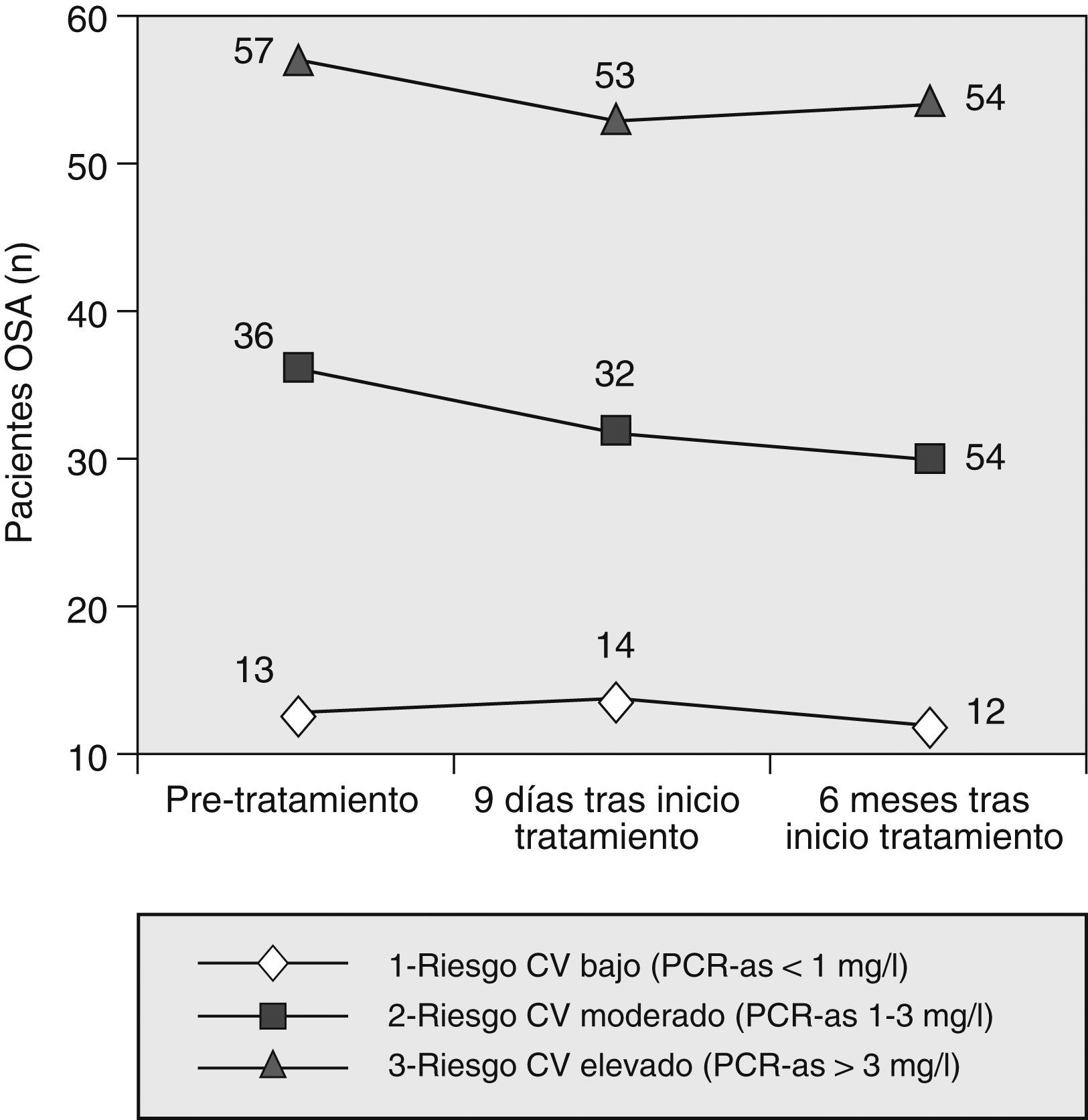
Las categorías de riesgo cardiovascular según la PCR-as se establecieron con anterioridad: riesgo cardiovascular bajo para PCR-as menor que 1mg/l; riesgo cardiovascular moderado para una PCR-as entre 1 y 3mg/l, y riesgo alto para PCR-as superior a 3mg/l.
Se recogió una muestra representativa de la población adulta de Oporto a partir de una encuesta realizada en un curso sobre salud y nutrición, y se utilizó como fuente de los controles. Ya se ha efectuado en otro lugar una descripción detallada de los procedimientos de selección y de las características generales de los sujetos39. A modo de resumen, diremos que los sujetos se seleccionaron mediante llamadas telefónicas aleatorias. La vivienda se utilizó como marco de muestra, mediante un sencillo muestreo aleatorio para seleccionar a una persona apta de entre los residentes permanentes de cada vivienda, y se la invitó a visitar nuestro departamento con el fin de realizar una entrevista y obtener una muestra de sangre.
Se evaluó a 250 controles de la comunidad con edades comprendidas entre los 18 y los 93 años, lo que supuso un porcentaje de participación del 70%. Se excluyó a los sujetos cuya edad superaba los 64 años y que obtuvieron menos de 24 puntos en el miniexamen del estado mental40. Seleccionamos a 103 de estos controles de la comunidad, que se emparejaron por sexo, edad e IMC con nuestro grupo de pacientes para realizar una comparación de los valores de PCR al inicio del estudio.
El Comité de Ética local aprobó el estudio, que se realizó en conformidad con las directrices de la Declaración de Helsinki y su revisión actual; todos los participantes dieron su consentimiento informado por escrito.
Procedimientos de estudioEstudio del sueño. Se realizó un estudio del sueño durante una noche mediante un dispositivo de registro de 5 canales (Alpha Screen, Vyasis) validado con anterioridad41). Este dispositivo produce un registro informatizado de las variaciones en el flujo de aire oronasal (medido mediante cánula nasal), la posición corporal, la actimetría de muñeca, la frecuencia del pulso y la saturación arterial de oxígeno (medida mediante pulsioxímetro de dedo). El dispositivo estima el tiempo total de sueño mediante el registro de actimetría de muñeca, eliminando los períodos con actividad alta. Calcula automáticamente el número de apneas e hipopneas por hora de tiempo de sueño estimado (índice de perturbación respiratoria automática) y también proporciona información sobre las desaturaciones mayores del 4% por hora de sueño estimado, así como los porcentajes acumulativos del tiempo de sueño con una saturación de oxígeno por debajo del 90%. En todos los casos, los operadores realizaron análisis manuales de los registros mediante el recuento de los episodios de apnea (episodios de=20% del flujo de aire previo y 10s de duración como mínimo) e hipopnea (episodios que mostraban entre el 20 y el 50% de flujo de aire previo y un mínimo de 10s de duración, junto con un descenso del 4% de la saturación de oxígeno), y la división del número total de dichos episodios por el tiempo de sueño en horas, para así obtener el índice de perturbación respiratoria manual de acuerdo con los criterios establecidos42.
Análisis sanguíneo. Se recogieron muestras de sangre venosa en ayunas entre las 8 y 10h de la mañana en 3 períodos diferentes: antes del tratamiento, 9 días después y al cabo de 6 meses.
Las muestras de sangre se enviaron de inmediato al laboratorio para la estimación de la glucosa, los lípidos y la PCR-as, y se centrifugó una muestra de sangre coagulada a 4.000g durante 20min para la obtención de suero, que se almacenó a −26°C en tubos de microcentrífuga hasta que se realizó el análisis de la IL-6. Las concentraciones séricas de IL-6 se midieron por duplicado con un equipo de análisis inmunorradiométrico de alta sensibilidad (IL-6–ELISA, KAP1261, Biosource® Europe SA, Nivelles, Bélgica). La sensibilidad de este análisis fue de 0,5ng/ml, la especificidad del 100% y el coeficiente de variación interanálisis del 4,6%.
Análisis estadísticoLos datos se analizaron con el programa informático SPSS versión 14.0 y se expresaron como valores medios, con sus respectivas desviaciones estándar, para las variables de distribución normal, o como mediana con sus correspondientes centiles 25 y 75 para las variables cuya distribución no era normal. Las variables categóricas se expresaron como número y proporciones Las proporciones se compararon mediante la prueba de la χ2 o la prueba exacta de Fisher cuando resultó adecuado.
Se calcularon los coeficientes de correlación de Spearman para estimar la asociación entre las concentraciones séricas de PCR e IL-6 y las características de los participantes al inicio del estudio. Para la comparación de los valores medianos en los 3 períodos estudiados se utilizó la prueba no paramétrica de Wilcoxon para muestras emparejadas.
En la comparación de pacientes y controles, ambos grupos se emparejaron de acuerdo con la edad y el IMC. Se utilizó la regresión logística incondicional para calcular las odds ratios y sus respectivos intervalos de confianza del 95%. Puesto que el IMC continuó siendo mayor en los pacientes que en los controles (un 33,4 frente a un 29,7%; p<0,001), el modelo final se ajustó para el IMC y también para la hipertensión arterial.
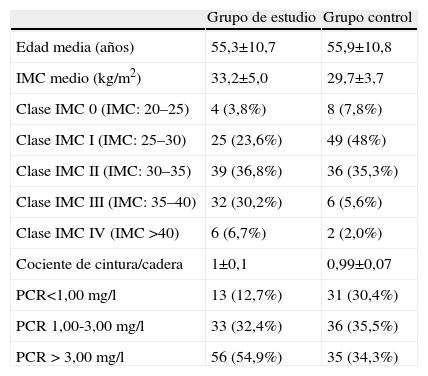
ResultadosEn la tabla 1 se describen las características de la población estudiada (n=98) y del grupo control (n=103), así como su distribución según las categorías de obesidad de Bray43.
Características del grupo de estudio y del grupo control
| Grupo de estudio | Grupo control | |
| Edad media (años) | 55,3±10,7 | 55,9±10,8 |
| IMC medio (kg/m2) | 33,2±5,0 | 29,7±3,7 |
| Clase IMC 0 (IMC: 20–25) | 4 (3,8%) | 8 (7,8%) |
| Clase IMC I (IMC: 25–30) | 25 (23,6%) | 49 (48%) |
| Clase IMC II (IMC: 30–35) | 39 (36,8%) | 36 (35,3%) |
| Clase IMC III (IMC: 35–40) | 32 (30,2%) | 6 (5,6%) |
| Clase IMC IV (IMC >40) | 6 (6,7%) | 2 (2,0%) |
| Cociente de cintura/cadera | 1±0,1 | 0,99±0,07 |
| PCR<1,00mg/l | 13 (12,7%) | 31 (30,4%) |
| PCR 1,00-3,00mg/l | 33 (32,4%) | 36 (35,5%) |
| PCR > 3,00mg/l | 56 (54,9%) | 35 (34,3%) |
Valores expresados como media±desviación estándar o número (porcentaje). IMC: índice de masa corporal; PCR: proteína C reactiva.
Las características de sueño del grupo de estudio se recogen en la tabla 2.
Durante los 6 meses del estudio, el cumplimiento del tratamiento con APAP fue bueno (tabla 3). La presión media durante el 90% de la noche disminuyó de forma significativa a lo largo del estudio (media basal: 10,8 cmH2O; media final: 10,1; p<0,001) y el índice de apneas-hipopneas residual reflejó la eficacia del tratamiento, ya que su valor medio (± desviación estándar) fue de 2,7±1,7/h.
Durante el estudio los pacientes no perdieron peso de forma significativa (peso medio inicial: 94,4kg; peso medio final: 94,1kg; p=0,545) ni experimentaron cambios en la distribución de grasa (p=0,151).
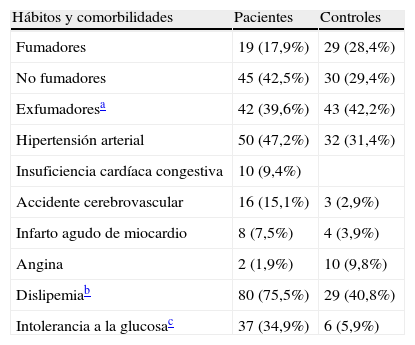
Hábitos y comorbilidadesLos datos se muestran en la tabla 4.
Hábitos y comorbilidades
| Hábitos y comorbilidades | Pacientes | Controles |
| Fumadores | 19 (17,9%) | 29 (28,4%) |
| No fumadores | 45 (42,5%) | 30 (29,4%) |
| Exfumadoresa | 42 (39,6%) | 43 (42,2%) |
| Hipertensión arterial | 50 (47,2%) | 32 (31,4%) |
| Insuficiencia cardíaca congestiva | 10 (9,4%) | |
| Accidente cerebrovascular | 16 (15,1%) | 3 (2,9%) |
| Infarto agudo de miocardio | 8 (7,5%) | 4 (3,9%) |
| Angina | 2 (1,9%) | 10 (9,8%) |
| Dislipemiab | 80 (75,5%) | 29 (40,8%) |
| Intolerancia a la glucosac | 37 (34,9%) | 6 (5,9%) |
El diagnóstico de hipertensión arterial se realizó de acuerdo con las directrices europeas y del séptimo informe del Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure44, según los resultados de un registro ambulatorio de la presión arterial durante 24h. Al inicio del estudio, en el grupo estudiado las medias de presión arterial, presión arterial sistólica y diastólica fueron, respectivamente, de 101,95; 134,98, y 83,17mmHg.
La intolerancia a la glucosa se definió según los criterios de la American Diabetes Association45, y el diagnóstico de síndrome metabólico se basó en los criterios clínicos de la Organización Mundial de la Salud46.
Un 53,3% (n=54) de los pacientes y un 45,1% (n=32) de los controles utilizaban medicación antihipertensiva. Un 15,8% (n=16) de los pacientes y un 7% (n=5) de los controles tomaban medicación para la diabetes. Seguían tratamiento con estatinas a un 37,6% (n=38) de los pacientes y un 40,8% (n=29) de los controles.
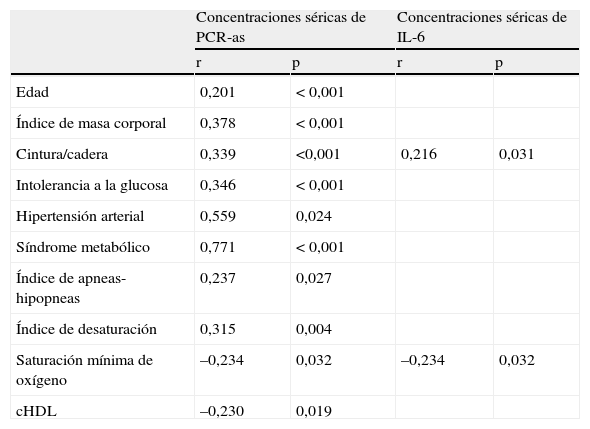
Asociaciones al inicio del estudioEn un análisis univariante, las concentraciones de PCR-as al inicio del estudio estaban correlacionadas de forma significativa con el índice de apneas-hipopneas, el índice de desaturación y la saturación mínima de oxígeno (tabla 5). Tras el ajuste por la edad, el IMC, el cociente cintura/cadera, el colesterol unido a lipoproteínas de alta densidad, la intolerancia a la glucosa, la hipertensión arterial y el síndrome metabólico, desaparecieron todas las asociaciones significativas entre la PCR-as y los índices de gravedad de la AOS.
Correlaciones de la proteína C reactiva de alta sensibilidad (PCR-as) y la interleucina-6 (IL-6) al inicio del estudio
| Concentraciones séricas de PCR-as | Concentraciones séricas de IL-6 | |||
| r | p | r | p | |
| Edad | 0,201 | < 0,001 | ||
| Índice de masa corporal | 0,378 | < 0,001 | ||
| Cintura/cadera | 0,339 | <0,001 | 0,216 | 0,031 |
| Intolerancia a la glucosa | 0,346 | < 0,001 | ||
| Hipertensión arterial | 0,559 | 0,024 | ||
| Síndrome metabólico | 0,771 | < 0,001 | ||
| Índice de apneas-hipopneas | 0,237 | 0,027 | ||
| Índice de desaturación | 0,315 | 0,004 | ||
| Saturación mínima de oxígeno | –0,234 | 0,032 | –0,234 | 0,032 |
| cHDL | –0,230 | 0,019 | ||
cHDL: colesterol unido a lipoproteínas de alta densidad.
En un análisis univariante, las concentraciones de IL-6 al inicio del estudio se correlacionaban de forma significativa y negativa con la saturación mínima de oxígeno (tabla 5), pero en el análisis multifactorial, que tenía en cuenta los factores de confusión encontrados en este estudio para la IL-6 (cociente de cintura/cadera), la relación perdió su significación estadística.
No se halló ninguna relación entre la PCR-as al inicio del estudio y el tabaquismo, y tampoco con comorbilidades tales como la insuficiencia cardíaca congestiva, los accidentes cerebrovasculares, el infarto agudo de miocardio, la angina de pecho y la somnolencia medida por la escala de Epworth.
Tampoco se encontró ninguna relación entre la IL-6 al inicio del estudio y la edad, el IMC, las concentraciones de colesterol, el tabaquismo y ciertas comorbilidades como la intolerancia a la glucosa, el síndrome metabólico, la hipertensión arterial, el infarto agudo de miocardio, los accidentes cardiovasculares, la insuficiencia cardíaca congestiva, la angina de pecho y la somnolencia medida por la escala de Epworth.
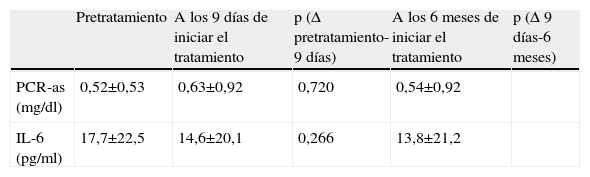
Efecto de la presión positiva automática en la vía aérea sobre la proteína C reactiva y la interleucina-6Los datos se muestran en la tabla 6.
Concentraciones séricas medias de proteína C reactiva de alta sensibilidad (PCR-as) e interleucina-6 (IL-6) antes y después del tratamiento con presión positiva automática de la vía aérea
| Pretratamiento | A los 9 días de iniciar el tratamiento | p (Δ pretratamiento-9 días) | A los 6 meses de iniciar el tratamiento | p (Δ 9 días-6 meses) | |
| PCR-as (mg/dl) | 0,52±0,53 | 0,63±0,92 | 0,720 | 0,54±0,92 | |
| IL-6 (pg/ml) | 17,7±22,5 | 14,6±20,1 | 0,266 | 13,8±21,2 |
Valores expresados como media±desviación estándar.
No encontramos diferencias significativas entre la PCR-as antes del tratamiento y la obtenida en los 2 períodos posteriores, esto es, a los 9 días y a los 6 meses (p=0,720 y p=0,387, respectivamente). Lo mismo ocurrió con las concentraciones séricas de IL-6 (p=0,266, p=0,238).
Al examinar la PCR-as según las categorías de riesgo cardiovascular establecidas (fig. 1), tampoco se observaron cambios en las proporciones de dichas categorías al comparar los resultados obtenidos antes del tratamiento con los de los 2 períodos posteriores (p=0,623 y p=0,872, respectivamente).
En los pacientes que recibían estatinas, la diferencia entre la PCR-as antes del tratamiento y a los 6 meses de iniciar la APAP no fue significativa (p=0,872).
En los pacientes sin problemas de somnolencia, el efecto de la APAP sobre la PCR-as y la IL-6 no fue diferente del observado en los pacientes con somnolencia (p=0,511 y p=0,620, respectivamente).
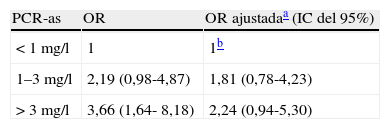
Comparación de los valores de proteína C reactiva al inicio del estudio entre pacientes y controles de la comunidadLa PCR-as estaba significativamente aumentada en los pacientes respecto a los controles (fig. 2). Según las categorías de estratificación del riesgo cardiovascular basadas en los valores de PCR-as, el grupo de pacientes presentaba un número significativamente mayor de personas con riesgo elevado de episodios cardiovasculares que los controles (fig. 3).
Tras el ajuste por el IMC y la hipertensión arterial, no se halló ninguna relación significativa entre el riesgo de acontecimientos cardiovasculares y la AOS (tabla 7).
Riesgo cardiovascular entre los pacientes con apnea obstructiva del sueño, según las categorías basadas en los valores de proteína C reactiva de alta sensibilidad (PCR-as), comparados con controles de la comunidad
| PCR-as | OR | OR ajustadaa (IC del 95%) |
| < 1mg/l | 1 | 1b |
| 1–3mg/l | 2,19 (0,98-4,87) | 1,81 (0,78-4,23) |
| > 3mg/l | 3,66 (1,64- 8,18) | 2,24 (0,94-5,30) |
IC: intervalo de confianza; OR: odds ratio.
El objetivo principal de nuestro estudio fue evaluar el efecto a corto y largo plazo del tratamiento con APAP sobre el estado proinflamatorio de los pacientes con AOS.
Se han establecido asociaciones estrechas y sistemáticas entre las concentraciones de PCR-as y las enfermedades cardiovasculares en varios estudios con grupos de población diferentes47. La PCR se está convirtiendo en un marcador biológico importante para la determinación del riesgo cardiovascular, incluso después del ajuste por los factores de riesgo tradicionales que normalmente se utilizan en los programas de evaluación del riesgo cardiovascular22. La relación entre la PCR y las enfermedades cardiovasculares se vio reforzada por el hallazgo de que las estatinas reducen sus valores plasmáticos y la incidencia de episodios cardiovasculares48.
En estudios prospectivos a gran escala21, las concentraciones basales de PCR-as son un predictor independiente de acontecimientos cardiovasculares futuros. Por consiguiente, las concentraciones de PCR-as constituyen a la vez un factor de riesgo y un agente patógeno activo49,50 en la aterosclerosis.
Varios estudios9 han observado una reducción de las concentraciones de PCR tras utilizar CPAP en pacientes con AOS, si bien algunos49 se realizaron sin grupo de control. Sin embargo, otros16,51,52 no encontraron que la utilización a largo plazo de CPAP tuviera un efecto significativo sobre dichas concentraciones. Ninguno de estos estudios ha evaluado el uso de estatinas en la población analizada.
De acuerdo con la información disponible respecto a la IL-6 en las enfermedades humanas, su concentración sérica parece ser un buen indicador de la activación de la cascada inflamatoria y una variable predictiva de una posterior disfunción del órgano53. Las concentraciones elevadas de IL-6 predicen la mortalidad cardiovascular total durante un seguimiento de 5 años, independientemente de los factores de riesgo tradicionales y de forma más potente, si bien con valor aditivo, que la PCR15.
La apnea del sueño se ha asociado a la elevación de los valores plasmáticos de IL-66,7 y PCR-as10,11, con independencia de la obesidad. A diferencia de lo recogido en la bibliografía existente, no hallamos ninguna relación entre la gravedad de la AOS y las concentraciones de IL-6 y PCR-as después del análisis multifactorial. Sin embargo, no puede excluirse que haya diferencias en las concentraciones de citocina entre la AOS moderada-grave y la AOS leve, ya que esta última no se incluyó en la presente investigación. Puede conjeturarse que, más allá de ciertos valores de gravedad en la AOS, no puede establecerse una correlación lineal, lo que invita a pensar que otros mecanismos, además de la hipoxia, podrían influir en el aumento de las citocinas proinflamatorias.
Además, a diferencia de los pacientes de otros estudios10 que han relacionado las concentraciones de PCR-as con la gravedad de la AOS, los nuestros eran de mayor edad y, dado que obtuvimos una correlación significativa entre la PCR-as y la edad, podría conjeturarse que los pacientes de mayor edad presentan valores superiores de PCR-as, lo que haría que su relación con la gravedad de la AOS fuera más débil.
Tampoco observamos la relación entre la somnolencia y las concentraciones de IL-6 que han notificado otros estudios6,54.
Por lo que sabemos, sólo hay un estudio que ha evaluado el efecto de la APAP sobre la PCR-as39 y no se ha publicado ninguno sobre la IL-6. Por lo tanto, nuestro estudio podría aportar ciertas pruebas adicionales acerca de la eficacia de la APAP a la hora de reducir el riesgo cardiovascular en los pacientes con AOS, ya que este tratamiento alternativo a la CPAP tradicional es capaz de mejorar los síntomas35 y el cumplimiento de los pacientes36.
En nuestro estudio, el tratamiento con APAP a corto y largo plazo no logró reducir las concentraciones séricas de PCR-as e IL-6. Si bien es cierto que no puede excluirse que la variación nocturna de la presión de la APAP sea la causa de que no se observase un descenso de las concentraciones séricas de PCR-as e IL-6, también es verdad que muchos estudios no han identificado una reducción de la PCR-as51 y la IL-655 tras el uso de CPAP, sobre todo cuando se analizaron importantes factores de confusión como la obesidad.
La APAP no indujo en los pacientes tratados con estatinas un patrón de respuesta de la PCR-as diferente de la de aquellos que no tomaban dicha medicación, dato que difiere de comunicaciones previas56,57.
Dado que la población estudiada no perdió peso durante el período de estudio, podemos conjeturar que la principal variable predictiva de las concentraciones de PCR-as e IL-6 no es la AOS, como sostienen algún artículo reciente57, sino la obesidad.
Por otro lado, nuestro estudio confirma que la AOS se asocia a valores elevados de PCR-as, un marcador de enfermedad cardiovascular e inflamación, como ya han demostrado otros estudios10. Los valores elevados de PCR-as en estos pacientes no pueden explicarse por otras circunstancias demográficas o patológicas, porque emparejamos y ajustamos pacientes y controles de acuerdo con las variables que desempeñaban un papel en estas relaciones. Asimismo podemos afirmar que, según los resultados, los pacientes con AOS tienen, respecto a los controles, el doble de riesgo de presentar un riesgo moderado de episodios cardiovasculares y un riesgo superior al doble de presentar un riesgo importante de episodios cardiovasculares.
El hecho de que nuestro estudio no tenga un diseño controlado y aleatorizado constituye una posible limitación. Sin embargo, tal estudio es difícil de llevar a cabo, puesto que no sería ético dejar sin tratamiento a pacientes con AOS confirmada.
En conclusión, en nuestro estudio la AOS se asocia a un proceso inflamatorio de grado bajo. Las concentraciones séricas de PCR-as están elevadas en los pacientes con AOS comparados con controles de la comunidad, con independencia de la edad y del IMC. Los pacientes con AOS tienen un riesgo significativamente mayor de presentar acontecimientos cardiovasculares que los controles, según las categorías basadas en la PCR-as. Por último, el tratamiento con APAP no logró reducir los valores de PCR-as e IL-6 ni a corto ni a largo plazo.
Los autores quisieran dar las gracias a Emília Araújo, Paula Martins y Edgar Mateus, de enfermería, por su colaboración en la recogida de muestras de sangre, y al Dr. Conceição Gonçalves por los análisis de laboratorio realizados, así como a todos los técnicos del sueño que examinaron manualmente todos los estudios de sueño.