El propósito del estudio ha sido analizar la relación entre la intensidad de la inflamación de las vías aéreas respiratorias, expresada por marcadores de estrés oxidativo, y la gravedad de la enfermedad en pacientes con bronquiectasias no asociadas a fibrosis quística.
Pacientes y métodosSe ha estudiado a 25 pacientes con bronquiectasias estables (15 mujeres y 10 varones). Como determinantes de gravedad se recogieron las siguientes variables: grado de disnea, número de exacerbaciones/ingresos en el último año, volumen diario medio de esputo, color del esputo (escala gradual de color), colonización bacteriana, exploración de la función respiratoria, calidad de vida (cuestionario St. George) y extensión radiológica de las lesiones (escala de Bhalla). La inflamación se analizó mediante la medición del óxido nítrico, pH y concentración de nitritos, nitratos e isoprostano en el condensado de aire exhalado. Asimismo se determinaron los valores de proteína C reactiva y velocidad de sedimentación globular en sangre periférica.
ResultadosNo hubo relaciones significativas entre los marcadores en condensado de aire exhalado y la afectación clínica, radiológica, funcional o de calidad de vida de los pacientes. Sólo la colonización bacteriana (16 casos) se relacionó con valores más altos de nitratos en aire exhalado (media±desviación estándar: 18±4 frente a 7±2μM; r2=0,6) y un mayor número de exacerbaciones (3,1±1,9 frente a 1,7±1,9; r2=0,3).
ConclusionesEn nuestra muestra, el estudio de marcadores de inflamación en aire exhalado sólo se relaciona con algunos parámetros de gravedad en pacientes con bronquiectasias colonizadas.
The aim of the study was to analyse the relationship between the intensity of the respiratory tract inflammation, expressed by oxidative stress markers, and the severity of the disease in patients with bronchiectasis unassociated with cystic fibrosis.
Patients and methodsThe study included 25 patients with stable bronchiectasis (15 females and 10 males). As determining factors of severity, the following parameters were collected: degree of dyspnoea, number of exacerbations/admissions in the last year, mean daily sputum volume, sputum colour (graduated colour scale), bacterial colonisation, respiratory function tests, quality of life (St. George questionnaire) and radiological extension of the lesions (Bhalla scale). Inflammation was analysed using the measurement of nitric oxide, pH and concentration of nitrites, nitrates and isoprostane in the exhaled air condensate. The C reactive protein and erythrocyte sedimentation rate were also determined in peripheral blood.
ResultsThere were no significant relationships between the markers in the exhaled air condensate and the clinical, radiological and functional involvement or the quality of life of the patients. Only bacterial colonisation (16 cases) was associated with higher values of nitrates in exhaled air (mean±standard deviation: 18±4 compared to 7±2μM; r2=0.6) and a higher number of exacerbations (3.1±1.9 compared to 1.7±1.9; r2=0.3).
ConclusionsIn our study, the measurement of inflammation markers in exhaled air is only associated with some parameters of severity in patients with bacterial bronchiectasis.
Las bronquiectasias, término con el que se denomina a las alteraciones estructurales que cursan con dilatación irreversible de las vías aéreas respiratorias, son el resultado final de múltiples enfermedades que comparten un proceso patológico común caracterizado por inflamación y remodelación de la pared bronquial1.
Las causas que conducen al desarrollo de las bronquiectasias son muy diversas y abarcan un amplio espectro que incluye, fundamentalmente, las enfermedades infecciosas —sobre todo en el período de desarrollo pulmonar—, anomalías genéticas en las estructuras ciliares y regulación de la secreción mucosa, disminución en los mecanismos de defensa naturales o específicos y agresión autoinmunitaria de la mucosa2,3. La gravedad e intensidad con que se manifiestan los síntomas asociados a las bronquiectasias (tos, volumen de moco expectorado o disnea) son muy variables. Su expresión clínica depende no sólo del período de desarrollo pulmonar en que se producen o de la extensión de las vías aéreas que se ven afectadas, sino también de la respuesta inflamatoria o infecciosa que el huésped es capaz de generar4,5.
Tradicionalmente se ha considerado que el mecanismo patogénico común se inicia por diversas agresiones que comprometen el sistema mucociliar y el transporte de moco6. Este hecho facilita el contacto de las bacterias con el epitelio bronquial y la aparición de una respuesta inflamatoria local. Esta respuesta inflamatoria, fundamentalmente neutrofílica, puede en ocasiones ser inadecuada o exagerada y desencadenar el daño bronquial irreversible. El balance entre la carga bacteriana y la respuesta inflamatoria, bien sea local o sistémica, es clave a la hora de entender la evolución de este proceso7.
Diversos estudios han mostrado un aumento de moléculas y citocinas proinflamatorias en las concentraciones séricas y en secreciones respiratorias de pacientes con bronquiectasias con respecto a grupos sanos8–10. Sin embargo, no siempre se ha demostrado una correlación significativa entre estos mediadores y la evolución clínica o funcional. La mayoría de los estudios publicados se han realizado en pacientes con fibrosis quística (FQ), una enfermedad donde las bronquiectasias son más extensas y la carga bacteriana, muy alta.
La relación de los marcadores inflamatorios con el curso clínico y la extensión de la enfermedad varía sobremanera en función de los criterios de valoración de la enfermedad y de los marcadores analizados. Algunos estudios han encontrado una relación positiva con la extensión radiológica11, mientras que la mayoría los relacionan con las variables clínicas o funcionales12,13. La discrepancia en los resultados se debe probablemente a la dificultad de definir la gravedad en una enfermedad cuyos mecanismos fisiopatológicos aún no conocemos bien. En la valoración de la gravedad se han propuesto múltiples parámetros clínicos, radiológicos, funcionales y evolutivos14,15. La correlación entre la afectación funcional y los hallazgos de la tomografía computarizada de alta resolución12 es elevada, y por ello la mayoría de los estudios los consideran elementos imprescindibles para valorar la gravedad; sin embargo, otros factores como la calidad de vida, la presencia de colonización o el número de agudizaciones influyen también de forma clara en el pronóstico de la enfermedad.
En este sentido, y ante la dificultad de encontrar una característica específica que defina la gravedad de las bronquiectasias, la mayoría de los estudios analiza estos criterios de forma variable teniendo en cuenta las limitaciones que ello entraña.
En el presente estudio nos hemos planteado como objetivo analizar la relación entre la intensidad de la inflamación de las vías aéreas respiratorias, expresada por marcadores de estrés oxidativo, y la gravedad de la enfermedad, definida por un conjunto de variables clínicas, funcionales y radiológicas, en pacientes con bronquiectasias no asociadas a FQ.
Pacientes y métodosSujetos del estudioEstudiamos a un grupo de pacientes adultos (>18 años) que acudieron de forma consecutiva a las Consultas Externas de Neumología de los 2 centros que participaron en el estudio, y a quienes se había diagnosticado previamente bronquiectasias difusas mediante tomografía computarizada.
Se excluyó a los pacientes con bronquiectasias secundarias a procesos quirúrgicos pulmonares, enfisema, aspergilosis broncopulmonar alérgica o enfermedades pulmonares intersticiales difusas. A todos los pacientes incluidos se les había realizado previamente a su inclusión un test del sudor con el fin de excluir bronquiectasias secundarias a FQ. Se consideró positivo para FQ si la concentración de cloruros (mmol/l) era superior a 70 y negativo si era menor de 45; en los valores intermedios se descartaba mediante pruebas genéticas.
Para ser incluidos en el estudio los pacientes debían estar clínicamente estables desde al menos las 2 semanas anteriores —es decir, sin cambios en la medicación y los síntomas, sin consultas a urgencias ni hospitalizaciones— y no haber recibido antibióticos durante ese período de tiempo.
Diseño del estudioDe todos los pacientes se recogieron datos correspondientes a sus características antropométricas (sexo, edad, peso y talla), hábito tabáquico, comorbilidades y clases de fármacos prescritos.
La gravedad de la enfermedad por bronquiectasias se evaluó mediante los siguientes parámetros: a) afectación de la función pulmonar; b) extensión anatómica de las bronquiectasias; c) volumen y características de la expectoración; d) consumo de recursos sanitarios, y e) impacto en la capacidad de esfuerzo y calidad de vida relacionada con la salud.
La afectación de la función pulmonar se estimó mediante los resultados de una espirometría forzada y la medición de volúmenes pulmonares por el método de dilución de helio practicada el mismo día de la primera visita; se recogieron las siguientes variables: volumen espiratorio forzado en el primer segundo (FEV1) en porcentaje del valor teórico, capacidad vital forzada (FVC) en porcentaje del valor teórico, FEV1/FVC y FEV1 tras la administración de broncodilatador, y capacidad pulmonar total en porcentaje del valor teórico.
La extensión anatómica de las bronquiectasias en la tomografía computarizada se midió mediante la escala modificada de Bhalla16, que considera para cada lóbulo pulmonar las siguientes características: extensión de las bronquiectasias, grosor de la pared, magnitud de la dilatación, presencia o no de tapones y presencia de atenuación. La extensión se gradúa en 0 (sin bronquiectasias), 1 (un segmento o menos de un segmento afectado), 2 (más de un segmento afectado) y 3 (bronquiectasias quísticas en todo el lóbulo); la magnitud de la dilatación bronquial en 0 (sin dilatación), 1 (<2 veces el diámetro de la arteria adyacente) y 2 (>2 veces el diámetro de la arteria adyacente), y el grosor de la pared bronquial en 0 (sin aumento del grosor), 1 (<0,5 veces el grosor de la arteria adyacente), 2 (entre 0,5 y 1 veces el grosor de la arteria adyacente) y 3 (>1 vez el grosor de la arteria adyacente). La puntuación máxima era de 72 puntos. Todas las puntuaciones se obtuvieron por acuerdo entre 2 de los investigadores (M.P.C. y A.D.D.).
Con el fin de analizar las características del esputo, se suministraron a todos los pacientes 3 contenedores estériles para que recogieron todo el esputo producido en 3 días consecutivos; se obtuvo la media aritmética de los 3 días, expresada en mililitros/día. Las características del color del esputo se analizaron mediante una escala de intensidad de color del moco (0-15) desarrollada en nuestro Laboratorio, que abarca el color transparente (0), el blanco (1), intensidades progresivas de amarillo (2-7), verde (8-10) y marrón (10-15). La intensidad del color se determinó tras el acuerdo por comparación visual de 2 investigadores (M.P.C. y A.D.D.).
Una vez recogidas las características del esputo, se remitió la muestra para su análisis microbiológico, que consistió en una tinción de Gram y cultivo microbiológico para microorganismos habituales, bacterias y hongos. El esputo se consideró colonizado si las muestras analizadas eran válidas (<10 células epiteliales y >25 leucocitos por campo) y presentaban más de 103 unidades formadoras de colonias. La infección en estos pacientes se descartó de forma clínica por la ausencia de cambios recientes en la expectoración o en los síntomas clínicos.
La morbilidad producida por las bronquiectasias en términos de consumo de recursos sanitarios se determinó por el número de exacerbaciones que habían requerido antibioterapia en el último año y el número de ingresos hospitalarios.
El impacto en la capacidad funcional se analizó cuantificando la disnea según la escala modificada del Medical Research Council y a través del estudio de la calidad de vida. Para ello, el paciente rellenó la versión española del Cuestionario Respiratorio de Calidad de Vida de Saint George (autoadministrado), que consta de 50 preguntas repartidas en 3 escalas: escala de síntomas (8 ítems), escala de actividad (16 ítems) y escala de impacto (26 ítems). La puntuación total va de 0 a 100, y las puntuaciones altas indican una peor calidad de vida relacionada con la salud.
La determinación de marcadores inflamatorios de las vías aéreas respiratorias se realizó en muestras procedentes de condensado de aire exhalado en la primera visita, antes de efectuar la exploración funcional.
Para la obtención del condensado de aire exhalado se siguieron las recomendaciones de la European Respiratory Society referentes a la estandarización del método y la preparación del paciente17. Para su medición se utilizó el dispositivo Eco-Screen (Jaegger, Hoechberg, Alemania). La muestra obtenida se recogió en tubos de polipropileno. Una vez obtenida la muestra, y con el fin de medir el pH del aire exhalado, se procedió a separar una parte alícuota de al menos 2ml que se sometió a desaireación durante 10min con un gas inerte libre de anhídrido carbónico (helio), a un flujo de 2l/min. Se consideraron válidas las muestras si los valores de anhídrido carbónico eran inferiores a 5mmHg. El pH se determinó de forma inmediata mediante electrodo de pH (Radiometer, Copenhague, Dinamarca).
La muestra no utilizada se congeló a −70°C en partes alícuotas de 200μl para la posterior determinación del resto de marcadores. La concentración de nitritos y nitratos en el condensado de aire exhalado se obtuvo mediante colorimetría tras reacción de Griess (Cayman Chemical) y los resultados se expresaron en micromoles. La concentración de 8-isoprostano se obtuvo por enzimoinmunoanálisis (Cayman Chemical) y se expresó en picogramos/mililitros.
Asimismo se procedió en todos los pacientes a la determinación de la fracción espirada de óxido nítrico (NO) en aire exhalado (FENO) mediante analizador de quimioluminiscencia (modelo Logan Research 2000), según el método de Kharitonov, expresándose los resultados en partes por billón (ppb).
Como reactantes de fase aguda en sangre se determinaron la proteína C reactiva y la velocidad de sedimentación globular.
Análisis estadísticoSe efectuó en primer lugar un análisis descriptivo de la muestra para todas las variables recogidas. Los valores se expresaron como media y desviación estándar o como porcentaje. Las diferencias entre pacientes colonizados y no colonizados se establecieron mediante la prueba de la U de Mann-Whitney o el test de la χ2 según el tipo de variable. Se comprobó asimismo que ambos grupos eran similares en edad, sexo y fármacos utilizados. Con el fin de analizar la relación entre los marcadores de inflamación y la intensidad de la enfermedad, se estableció una matriz de correlaciones de Spearman y se analizaron las correlaciones tanto en el grupo total como después de ajustar por la presencia de colonización. Se consideraron estadísticamente significativas las diferencias con un valor de p<0,05. Los análisis se realizaron con el programa informático SPSS versión 10.6 (SPSS para Windows, Chicago, EE.UU., 1999).
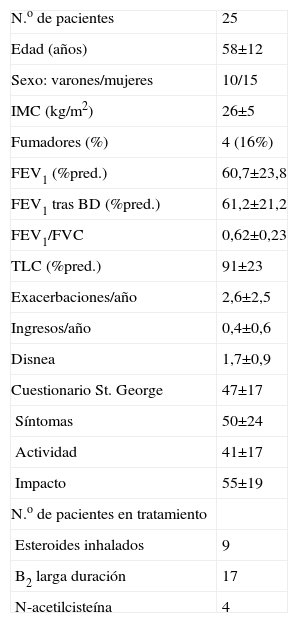
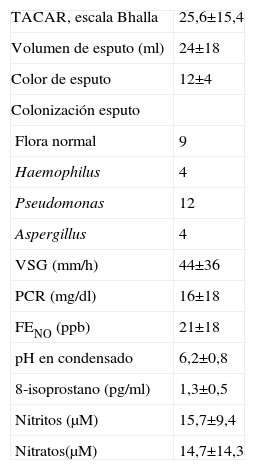
ResultadosSe incluyó a 25 pacientes (15 mujeres y 10 varones) con una edad media de 58 años. Sus características, tanto en lo que se refiere a su situación funcional como a la gravedad de las bronquiectasias, se muestran en las tablas 1 y 2. El 64% estaban colonizados, siendo los microorganismos más frecuentemente aislados Pseudomonas aeruginosa y Haemophilus influenzae. En 4 pacientes había una colonización asociada con Aspergillus fumigatus.
Características antropométricas y funcionales de los pacientes con bronquiectasias
| N.o de pacientes | 25 |
| Edad (años) | 58±12 |
| Sexo: varones/mujeres | 10/15 |
| IMC (kg/m2) | 26±5 |
| Fumadores (%) | 4 (16%) |
| FEV1 (%pred.) | 60,7±23,8 |
| FEV1 tras BD (%pred.) | 61,2±21,2 |
| FEV1/FVC | 0,62±0,23 |
| TLC (%pred.) | 91±23 |
| Exacerbaciones/año | 2,6±2,5 |
| Ingresos/año | 0,4±0,6 |
| Disnea | 1,7±0,9 |
| Cuestionario St. George | 47±17 |
| Síntomas | 50±24 |
| Actividad | 41±17 |
| Impacto | 55±19 |
| N.o de pacientes en tratamiento | |
| Esteroides inhalados | 9 |
| B2 larga duración | 17 |
| N-acetilcisteína | 4 |
Los datos se expresan como media±desviación estándar o número (porcentaje) de paciente.
BD: broncodilatador; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa coporal; TLC: capacidad pulmonar total.
Gravedad de las bronquiectasias y marcadores de inflamación en condensado de aire exhalado y sangre
| TACAR, escala Bhalla | 25,6±15,4 |
| Volumen de esputo (ml) | 24±18 |
| Color de esputo | 12±4 |
| Colonización esputo | |
| Flora normal | 9 |
| Haemophilus | 4 |
| Pseudomonas | 12 |
| Aspergillus | 4 |
| VSG (mm/h) | 44±36 |
| PCR (mg/dl) | 16±18 |
| FENO (ppb) | 21±18 |
| pH en condensado | 6,2±0,8 |
| 8-isoprostano (pg/ml) | 1,3±0,5 |
| Nitritos (μM) | 15,7±9,4 |
| Nitratos(μM) | 14,7±14,3 |
Los datos se expresan como media±desviación estándar. FENO: fracción espirada de óxido nítrico en aire exhalado; PCR: proteína C reactiva; TACAR: tomografía computarizada de alta resolución; VSG: velocidad de sedimentación globular.
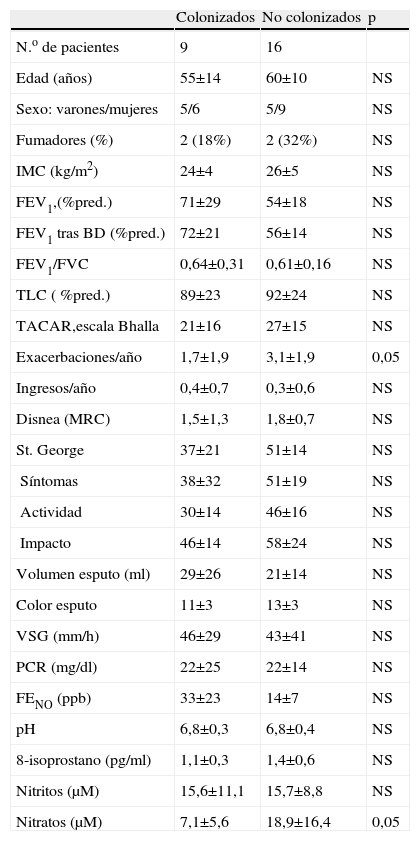
El análisis diferencial entre pacientes con bronquiectasias mostraba un número significativamente mayor de exacerbaciones en el último año en el grupo de bronquiectasias colonizadas (tabla 3). No encontramos entre ambos grupos diferencias en cuanto a la medicación utilizada que hubiesen modificado los resultados. En lo que se refiere a los parámetros inflamatorios, se observó un aumento de las concentraciones de nitratos en el condensado de aire exhalado de los pacientes con bronquiectasias colonizadas (media±desviación estándar: 18,9±16,4 frente a 7,1±5,6μM).
Diferencias en la gravedad de la enfermedad y marcadores inflamatorios entre pacientes con colonización y sin ella
| Colonizados | No colonizados | p | |
| N.o de pacientes | 9 | 16 | |
| Edad (años) | 55±14 | 60±10 | NS |
| Sexo: varones/mujeres | 5/6 | 5/9 | NS |
| Fumadores (%) | 2 (18%) | 2 (32%) | NS |
| IMC (kg/m2) | 24±4 | 26±5 | NS |
| FEV1,(%pred.) | 71±29 | 54±18 | NS |
| FEV1 tras BD (%pred.) | 72±21 | 56±14 | NS |
| FEV1/FVC | 0,64±0,31 | 0,61±0,16 | NS |
| TLC ( %pred.) | 89±23 | 92±24 | NS |
| TACAR,escala Bhalla | 21±16 | 27±15 | NS |
| Exacerbaciones/año | 1,7±1,9 | 3,1±1,9 | 0,05 |
| Ingresos/año | 0,4±0,7 | 0,3±0,6 | NS |
| Disnea (MRC) | 1,5±1,3 | 1,8±0,7 | NS |
| St. George | 37±21 | 51±14 | NS |
| Síntomas | 38±32 | 51±19 | NS |
| Actividad | 30±14 | 46±16 | NS |
| Impacto | 46±14 | 58±24 | NS |
| Volumen esputo (ml) | 29±26 | 21±14 | NS |
| Color esputo | 11±3 | 13±3 | NS |
| VSG (mm/h) | 46±29 | 43±41 | NS |
| PCR (mg/dl) | 22±25 | 22±14 | NS |
| FENO (ppb) | 33±23 | 14±7 | NS |
| pH | 6,8±0,3 | 6,8±0,4 | NS |
| 8-isoprostano (pg/ml) | 1,1±0,3 | 1,4±0,6 | NS |
| Nitritos (μM) | 15,6±11,1 | 15,7±8,8 | NS |
| Nitratos (μM) | 7,1±5,6 | 18,9±16,4 | 0,05 |
Los datos se expresan como media±desviación estándar o número (porcentaje) de pacientes.
BD: broncodilatador; FENO: fracción espirada de óxido nítrico en aire exhalado; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa coporal; MRC: escala del Medical Research Council; NS: no significativo; PCR: proteína C reactiva; TACAR: tomografía computarizada de alta resolución; TLC: capacidad pulmonar total; VSG: velocidad de sedimentación globular.
Al analizar globalmente en todos los pacientes la relación entre los marcadores inflamatorios en las vías aéreas y la intensidad de la enfermedad, no encontramos ninguna asociación estadísticamente significativa ni en lo que se refiere a los valores dependientes del individuo (capacidad funcional, calidad de vida, disnea) ni a la propia extensión y gravedad de las bronquiectasias.
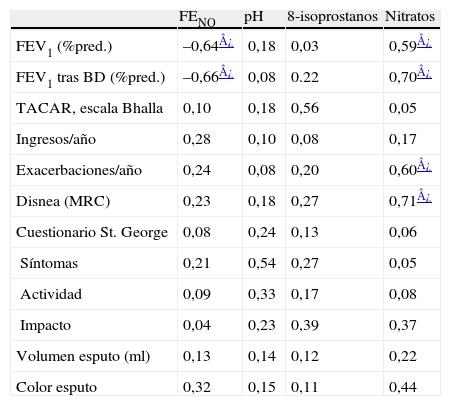
Tras ajustar por la presencia de colonización se observó una correlación significativa inversa entre los valores de FEV1 y la presencia de valores altos de FENO, y había una correlación significativa positiva de los nitratos con el FEV1, el número de exacerbaciones y la intensidad de la disnea (tabla 4).
Coeficientes de correlación entre parámetros de inflamación en la vía aérea y criterios de gravedad de las bronquiectasias en pacientes colonizados
| FENO | pH | 8-isoprostanos | Nitratos | |
| FEV1 (%pred.) | –0,64¿ | 0,18 | 0,03 | 0,59¿ |
| FEV1 tras BD (%pred.) | –0,66¿ | 0,08 | 0.22 | 0,70¿ |
| TACAR, escala Bhalla | 0,10 | 0,18 | 0,56 | 0,05 |
| Ingresos/año | 0,28 | 0,10 | 0,08 | 0,17 |
| Exacerbaciones/año | 0,24 | 0,08 | 0,20 | 0,60¿ |
| Disnea (MRC) | 0,23 | 0,18 | 0,27 | 0,71¿ |
| Cuestionario St. George | 0,08 | 0,24 | 0,13 | 0,06 |
| Síntomas | 0,21 | 0,54 | 0,27 | 0,05 |
| Actividad | 0,09 | 0,33 | 0,17 | 0,08 |
| Impacto | 0,04 | 0,23 | 0,39 | 0,37 |
| Volumen esputo (ml) | 0,13 | 0,14 | 0,12 | 0,22 |
| Color esputo | 0,32 | 0,15 | 0,11 | 0,44 |
BD: broncodilatador; FEV1: volumen espiratorio forzado en el primer segundo; MRC: escala del Medical Research Council; TACAR: tomografía computarizada de alta resolución.
Además de los parámetros estudiados, observamos una correlación estadísticamente significativa entre los parámetros de calidad de vida y la afectación de la función respiratoria, con independencia de la presencia o no de colonización. De este modo, el resultado del cuestionario de Saint George, tanto en lo que se refiere a la puntuación total como a la de las 3 subescalas, se asocia con una función respiratoria menor y un número mayor de agudizaciones. La intensidad del color del esputo se asocia a un número mayor de exacerbaciones. Los ingresos y las exacerbaciones se asocian fundamentalmente a una función respiratoria y una calidad de vida peores.
DiscusiónLos resultados del presente estudio muestran que, en las bronquiectasias no asociadas a FQ, la relación entre la gravedad de la enfermedad y algunos marcadores de estrés oxidativo viene condicionada por la presencia de colonización de la vía aérea.
Esta relación se expresa de forma diferente en los pacientes con respecto a los marcadores inflamatorios empleados: mientras que la FENO guarda una relación inversa con el grado de obstrucción, la concentración de nitratos es un marcador final del estrés oxidativo y se relaciona no sólo con la afectación funcional, sino también con una mayor tasa de recaídas.
La inflamación mucosa de las vías aéreas respiratorias en los pacientes con bronquiectasias se caracteriza habitualmente por un predominio celular de neutrófilos. La presencia exagerada de neutrófilos —y, por tanto, la actividad de sus enzimas, como la mieloperoxidasa— es el origen de una mayor acidificación de las vías aéreas como consecuencia de la liberación del anión superóxido. Entre los mecanismos de estrés oxidativo que se ponen en marcha tras la producción del anión súperóxido se incluye la producción exagerada de peróxido de hidrógeno y los compuestos derivados de la peroxidación lipídica, como es el caso del 8-isoprostano. La oxidación de productos derivados del NO da lugar a un aumento en su metabolismo y a la formación de productos más estables como los nitritos y nitratos.
La acidificación de las secreciones respiratorias constituye una de las primeras manifestaciones del incremento del estrés oxidativo. En los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) o bronquiectasias, se observa una disminución del pH en el condensado de aire exhalado cuando se los compara con individuos sanos o con otras afecciones de las vías aéreas como el asma18. En los trabajos que han observado esto, la disminución del pH en los pacientes con bronquiectasias guarda una relación significativa con la presencia de peróxido de hidrógeno y el grado de obstrucción al flujo aéreo; sin embargo, no se ha podido demostrar una correlación significativa entre la acidificación y los valores de 8-isoprostano o la concentración de nitritros/nitratos en el exhalado de las vías aéreas. La disminución de los valores de pH en el condensado de aire exhalado era significativamente mayor en el grupo de pacientes colonizados por P. aeruginosa. En nuestro estudio, no encontramos diferencias en el pH entre los pacientes con bronquiectasias que presentaban colonización y los que no, y tampoco observamos ninguna relación con los parámetros de gravedad de la enfermedad. Es posible que la exclusión de afectados de FQ y la estabilidad de nuestros pacientes contribuyan a estos hallazgos. Por otro lado, la determinación del pH en el condensado de aire exhalado es un valor muy variable en la mayoría de los estudios11,18,19.
El NO es un mediador biológico formado como consecuencia de la acción de la enzima NO sintetasa, que se encuentra en la mayoría de las células de las vías aéreas, ya sean constitutivas o inflamatorias. La utilidad de su medición en pacientes con bronquiectasias aún no está bien establecida. Los trabajos del grupo de Kharitonov11 demostraron que, al igual que ocurría en otras enfermedades inflamatorias crónicas de las vías aéreas como la EPOC o el asma, los valores de FENO estaban aumentados en pacientes con bronquiectasias; sin embargo, otros estudios20–23 han mostrado que en pacientes con bronquiectasias secundarias a FQ o discinesia ciliar la concentración de NO en aire exhalado no estaba aumentada ni siquiera durante las exacerbaciones infecciosas. De hecho, se ha propuesto que unos valores normales de FENO pueden servir para diferenciar y diagnosticar estas afecciones de otras enfermedades inflamatorias crónicas de las vías aéreas. En el estudio de Ho et al20, las concentraciones de FENO en pacientes con bronquiectasias no eran diferentes de las recogidas en personas sanas.
El NO se forma en las células epiteliales e inflamatorias de la mucosa bronquial y tiene que difundirse a través de las secreciones mucosas hasta alcanzar la luz de la vía aérea. La presencia de abundantes secreciones viscosas en las vías aéreas, como ocurre en las bronquiectasias, dificulta su difusión intraluminal al tiempo que facilita su reacción con otras especies reactivas para formar nitritos/nitratos. Según esta hipótesis, cuanto mayor es la producción de moco, menor es la concentración de NO en el condensado de aire exhalado y mayor es la de nitratos. En el presente trabajo, observamos que los valores de NO se correlacionaban de forma inversa con la obstrucción al flujo aéreo, de forma que cuanto menos obstruido estaba el paciente, mayor era la cantidad de NO. Este hecho podría sustentar de forma indirecta la hipótesis antes planteada si suponemos que en los pacientes con bronquiectasias la obstrucción guarda relación con la presencia de secreciones abundantes; sin embargo, no pudimos encontrar una relación con el volumen de esputo recogido.
El análisis compartimental de FENO, diferenciando la fracción alveolar y la bronquial, ha permitido también demostrar diferencias entre las causas de las bronquiectasias. Así, en pacientes con bronquiectasias asociadas a discinesia ciliar primaria, la disminución se produce fundamentalmente a expensas del componente bronquial, como cabría esperar según la hipótesis de la dificultad en la difusión, mientras que en pacientes con otro tipo de bronquiectasias el componente bronquial es similar o superior al de los controles sanos23. Por lo que se refiere al componente alveolar, no hay diferencias entre los controles sanos y los pacientes con bronquiectasias o con discinesia ciliar.
La baja producción de NO disminuye su actividad bactericida y facilita la aparición de exacerbaciones. En nuestro trabajo, no encontramos diferencias entre las exacerbaciones y la concentración de NO, pero sí observamos una relación con la concentración de nitratos y el número de exacerbaciones en el grupo de pacientes colonizados.
La concentración de nitritos/nitratos en las secreciones de las vías aéreas de pacientes con bronquiectasias guarda relación con la mayor capacidad de reacción del NO. A mayor cantidad de secreciones, o durante la infección, se observa una mayor producción de nitratos. En las bronquiectasias asociadas a FQ se ha observado que los valores son significativamente mayores durante la exacerbación, pero no en pacientes en situación estable o en los controles sanos24. En el estudio de Ho et al25, los valores de nitritos en el concentrado de aire exhalado también estaban aumentados en pacientes con FQ cuando se comparaban con el grupo de personas sanas.
En referencia al resto de marcadores estudiados, sabemos que las infecciones bacterianas contribuyen al estrés oxidativo al facilitar el reclutamiento y la activación de los macrófagos facilitando la liberación peróxido de hidrógeno y de 8-isoprostano. En pacientes con enfermedades inflamatorias de las vías aéreas como la EPOC26 se ha observado un aumento de los valores de 8-isoprostano en el condensado del aire exhalado, pero no se pudo demostrar ninguna relación con el grado de obstrucción o la intensidad de la inflamación neutrofílica. En pacientes con bronquiectasias crónicas colonizados por P. aeruginosa la concentración de peróxido de hidrógeno se encontraba aumentada y se relacionaba con la extensión y gravedad de la enfermedad27. En nuestro trabajo no hemos encontrado diferencias en los valores de 8-isoprostano entre los pacientes colonizados y los que no lo estaban, y tampoco relación alguna con los parámetros de gravedad de las bronquiectasias. En alguno de los estudios anteriores28 la relación no se modificaba por el tratamiento antibiótico o antiinflamatorio, lo que indicaba una inflamación mayor que probablemente no se da en nuestra muestra, lo que explica las diferencias con respecto a los hallazgos de dicho estudio.
Las alteraciones en el estrés oxidativo en pacientes con bronquiectasias se han demostrado no sólo en las vías aéreas, sino también en la forma en que reaccionan sus células inflamatorias sanguíneas frente a la infección. En un estudio realizado por King et al29 en 103 adultos con bronquiectasias idiopáticas, se observó que la liberación de productos reactivos de oxígeno en neutrófilos estimulados con Staphylococcus aureus era menor en pacientes con bronquiectasias. Según dichos autores, hay disminución intrínseca similar a la que ocurriría en la enfermedad granulomatosa crónica, lo que justificaría la predisposición a las infecciones y la aparición de bronquiectasias.
En el análisis de los pacientes incluidos en nuestra muestra es posible también que los tratamientos empleados hayan modificado los resultados. En este sentido, no encontramos diferencias en el porcentaje de pacientes que utilizaban corticoides inhalados entre ambos grupos. Dado el bajo número de pacientes que tomaban N-acetilcisteína, era difícil ajustar los resultados por esta variable. La relación que pudiese tener en estos pacientes, a la dosis de 600mg diarios, no se ha analizado en nuestros resultados.
Se descartó la realización de otros análisis ajustados en función de variables como la extensión radiológica o el grado de obstrucción al flujo aéreo debido a la ausencia de diferencias entre los grupos de pacientes y al pequeño tamaño muestral.
En resumen, las alteraciones en la respuesta inflamatoria que acompañan a las bronquiectasias son muy variables en función de la presencia o no de colonización bacteriana y de la respuesta al estrés oxidativo. En nuestro estudio no hemos podido encontrar diferencias en la respuesta oxidativa entre pacientes con bronquiectasias colonizadas y no colonizadas, salvo las diferencias producidas por la menor difusión del NO y la capacidad de generar nitratos. La utilidad de los marcadores de inflamación estudiados se ve disminuida por la ausencia de relación con el resto de marcadores de gravedad de la enfermedad, y debe limitarse a las características de los pacientes incluidos en nuestro estudio, sin que, por tanto, sea extrapolable a otros grupos como pacientes con FQ o bronquiectasias más leves.
FinanciaciónEstudio subvencionado con la Beca Sociedad Valenciana de Neumología 2005 y CYCYT_SAF05-669.