La utrasonografía endoscópica y la endobronquial son métodos complementarios. Combinadas, permiten una estadificación mediastínica casi completa del cáncer de pulmón sin cirugía. Son más potentes cuando se utilizan simultáneamente, ya que cada una de ellas tiene puntos fuertes y puntos débiles. Es de esperar que con la utilización de ambas se reduzca el uso de la mediastinoscopia (un proceso más caro e invasivo). Se ha demostrado que el empleo de ambas técnicas conduce a la realización de menos toracotomías, lo que beneficia no sólo a los pacientes, sino también a la sociedad, ya que se ahorran costes. En el artículo se realiza también una reflexión sobre los avances más recientes en este ámbito, se examinan los debates actuales al respecto y se presenta una perspectiva para el futuro.
Endoscopic and endobronchial ultrasound are complementary techniques. When combined, they allow for nearly complete mediastinal staging in lung cancer. Each technique has inherent strengths and weaknesses, but when used simultaneously they become far more powerful, to the extent that mediastinoscopy —a more expensive and invasive procedure— is expected to decline in use as the application of endoscopic and endobronchial ultrasound becomes more widespread. The incorporation of these ultrasound techniques has been shown to lead to fewer thoracotomies, benefiting patients and also society, given that costs are thereby reduced. We reflect on recent developments in the field, discuss current debates, and propose a view of what the future holds in store.
Aunque la incidencia del cáncer de pulmón ajustada por edad se ha reducido en los países donde los esfuerzos por lograr la deshabituación del tabaco han dado fruto1, la enfermedad ha adquirido proporciones epidémicas en todo el mundo. En Asia la carga del cáncer de pulmón aumentará rápidamente2 y esta enfermedad se sumará a los demás retos de salud pública que ya deben afrontar algunas naciones en dicho continente. La mortalidad por cáncer de pulmón entre las mujeres está aumentando en España3 y en muchos países de América Latina4. La mayoría (hasta el 80%) de los casos nuevos serán cáncer de pulmón no microcítico (CPNM). Las estrategias de tratamiento basado en la evidencia clínica contra el cáncer de pulmón requieren una estadificación exacta, y existe un abanico de elección bastante abrumador entre diversos métodos de estadificación no invasiva, mínimamente invasiva e invasiva. Durante la última década la punción aspirativa con aguja fina (PAAF) guiada por ultrasonografía endoscópica (USE) de los ganglios linfáticos mediastínicos se ha establecido como un complemento valioso para el diagnóstico y la estadificación de esta enfermedad, y las numerosas publicaciones así lo evidencian. Aún más importante es el hecho de que la USE-PAAF combinada con la recientemente desarrollada PAAF guiada por ultrasonografía endobronquial (USEB) puede permitir una estadificación mediastínica completa y mínimamente invasiva a un coste inicial inferior, tanto para los pacientes como para la sociedad, al de cualquiera de los métodos tradicionalmente empleados. Además, la combinación de ambos métodos puede evitar toracotomías inútiles, lo que conduce a ahorros adicionales y a una disminución de la morbilidad relacionada con el tratamiento.
En esta revisión se describen los avances recientes en este campo, se destacan los debates actuales sobre el tema y se presentan perspectivas para el futuro.
Diagnóstico inicial del cáncer de pulmónSi a partir, por ejemplo, de una tomografía computarizada (TAC) y del cuadro clínico se sospecha la existencia de un cáncer de pulmón microcítico, el diagnóstico debe obtenerse mediante el método más sencillo disponible. Una vez establecido el diagnóstico, la distinción entre una neoplasia limitada o extendida se realiza por medios radiográficos5. Por otra parte, en los pacientes en que se sospecha la presencia de un CPNM, el diagnóstico y la estadificación deben realizarse, si es posible, de forma simultánea, y la elección del método de diagnóstico dependerá del supuesto estadio que presenta la enfermedad. Por ejemplo, si hay derrame pleural, debe obtenerse un aspirado para realizar una citología. Esto no significa necesariamente que sea preciso programar una toracocentesis por separado, ya que la aspiración del líquido pleural puede realizarse durante la USE-PAAF de ganglios linfáticos mediastínicos que estén agrandados. A la mayoría de los pacientes en que se sospecha un cáncer de pulmón se les realiza en primer lugar una broncoscopia, que en la mayor parte de los casos se efectuará sin intentar practicar una punción transbronquial a ciegas (con aguja de Wang). Ésta puede ser una elección racional, pero a menudo no es el abordaje óptimo si la meta es obtener la mayor información posible con el menor número de pruebas y procedimientos. Aun cuando el objetivo sea sólo obtener información diagnóstica (en contraposición a información combinada de diagnóstico y estadificación), la broncoscopia da falsos negativos en hasta el 30% de los casos, incluso si se realizan cepillados, lavados y biopsias transbronquiales6. Varios estudios han examinado la eficacia de la USE-PAAF a la hora de obtener un diagnóstico inicial de cáncer de pulmón después de que se realizase un procedimiento broncoscópico sin fines diagnósticos. Por ejemplo, en una serie de 35 pacientes a los que se efectuó una broncoscopia no diagnóstica, Fritscher-Ravens et al7 lograron diagnosticar correctamente a todos menos uno con la USE-PAAF. En otro estudio prospectivo más reciente llevado a cabo con 20 pacientes en Singapur se evaluó la eficacia de la USE-PAAF realizada en la misma sesión e inmediatamente después de una broncoscopia que no revelaba resultados claros8, y el rendimiento fue del 90%. No es sorprendente que otros autores comenzasen a estudiar la USE-PAAF como método de diagnóstico inicial en el cáncer de pulmón9,10. Sin embargo, la pregunta no es si debería realizarse una broncoscopia o una USE-PAAF, sino cuándo debe elegirse una en lugar de la otra como técnica de diagnóstico inicial; o, con vistas al futuro, ¿se está evolucionando hacia el uso de la endoscopia de tórax en una sola sesión con USE-PAAF o broncoscopia convencional y USEB-PAAF según las necesidades? Antes de examinar los métodos de estadificación actuales y futuros, echemos una mirada atrás.
Una perspectiva históricaEn 1897, en Alemania, Gustav Killian describió por primera vez la forma práctica de realizar una broncoscopia11. En EE.UU., la “broncoesofagología” se estableció firmemente gracias a Chevalier Jackson, de Filadelfia, quien dominó dicha disciplina hasta bien entrados los años cuarenta del siglo xx12. Era habitual que la misma persona utilizase el broncoesofagoscopio rígido para examinar ambas estructuras, ya que las destrezas necesarias para manejar el instrumento no eran muy distintas para el esófago y el árbol traqueobronquial. De hecho, las perforaciones causadas por el instrumento eran siempre mortales y pocas personas fuera del ámbito de la broncoesofagología tenían interés en participar en dichas exploraciones. Con posterioridad los cirujanos torácicos practicaban casi en exclusiva las esofagoscopias o broncoscopias rígidas. En los años cincuenta el campo era muy activo, y en el Encuentro Argentino de Broncoesofagología celebrado en 1949 Schieppati13 describió la toma de muestras de ganglios linfáticos mediastínicos con un broncoscopio rígido a través de la carina de la tráquea. La broncoesofagología quedó relegada con la aparición de los endoscopios flexibles, ya que los internistas de gastroenterología, neumología y cardiología los adoptaron y adaptaron a sus propias disciplinas. La punción transbronquial aspirativa (PTBA) a ciegas con tipos de agujas apropiadas para los endoscopios flexibles, como la aguja de Wang14, se extendió a mediados de los años ochenta del siglo pasado, pero sigue estando infrautilizada. Sólo el 12% de los broncoscopistas estadounidenses la utilizan de forma sistemática y un 29% de forma ocasional15,16. Entre las razones que se barajan para explicar este bajo uso cabría mencionar el grado de experiencia de quienes han de realizarla, un rendimiento bajo y la inquietud ante la posibilidad de puncionar los grandes vasos. En un estudio el mejor factor predictivo para obtener una muestra diagnóstica con PTBA fue un tamaño de ganglio linfático superior a 2cm17. Se produjo un importante avance tras la comunicación de biopsias transesofágicas en los ganglios linfáticos mediastínicos guiadas en tiempo real por ultrasonidos con ecoendoscopios provistos de transducor lineal curvo, técnica que Wiersema et al18,19 describieron por primera vez. Los instrumentos se han hecho cada vez más pequeños, hasta el punto de permitir su inserción en el árbol traqueobronquial para realizar biopsias transbronquiales en tiempo real guiadas por ultrasonografía20. Se prevé que estos avances conduzcan a un importante cambio en la estadificación del cáncer de pulmón.
Estadificación del cáncer de pulmón mediante toma de muestras (estadificación invasiva)Una vez descartada la existencia de metástasis a distancia, es fundamental conocer el estado del mediastino. La sensibilidad y la especificidad combinadas de la TAC para identificar metástasis en ganglios linfáticos mediastínicos son del 51 y el 85%, respectivamente. Para la tomografía por emisión de positrones (PET), las cifras son del 74% (intervalo de confianza [IC] del 95%, 69–79%) y del 85% (IC del 95%, 82–88%), respectivamente21. Aun con las técnicas integradas de imagen más recientes, como la PET-TAC, la presencia de enfermedad N2 oculta en pacientes con captación mediastínica negativa continúa siendo un problema, cuya incidencia se ha cifrado en un 16% en un amplio estudio reciente22. En numerosas situaciones clínicas será necesario confirmar los resultados sobre el estado de los ganglios mediastínicos mediante toma de muestras, y así lo recomiendan las directrices de 2007 del American College of Chest Physicians (ACCP)23.
En general este tipo de estadificación se califica de invasiva, aunque el término puede resultar engañoso, ya que la USEB-PAAF y la USE-PAAF son mínimamente invasivas, con escasas complicaciones. En este sentido, se puede dividir conceptualmente la estadificación del cáncer de pulmón en 2 etapas: la de obtención de imágenes y la de toma de muestras. La recogida de muestras de los ganglios linfáticos mediastínicos puede hacerse con mediastinoscopia, USE-PAAF, PTBA, USEB-PAAF, PAAF transtorácica, toracoscopia videoasistida, el procedimiento Chamberlain y mediastinoscopia cervical extendida. Desafortunadamente, resulta difícil comparar la utilidad de estas pruebas en diferentes situaciones clínicas, ya que los estudios disponibles se definen sobre todo por las pruebas concretas que se realizaron a los pacientes, más que por criterios radiográficos o clínicos que puedan utilizarse de forma prospectiva para seleccionar a los pacientes en quienes se efectuará un abordaje concreto. Detterbeck et al23 proponen que las pruebas de estadificación se elijan según 4 grupos radiográficos: el grupo A presenta infiltración tumoral mediastínica patente y no precisa estadificación invasiva; el grupo B muestra ganglios linfáticos mediastínicos discretamente agrandados en la TAC, que pueden ser o no neoplásicos; el grupo C se compone de pacientes con tumores en estadio clínico II (ganglios linfáticos N1) o en estadio central I, y es el grupo en que la enfermedad mediastínica oculta es motivo de mayor preocupación, y el grupo D comprende a pacientes con tumores en estadio I periféricos.
Un metaanálisis reciente sobre el uso de la USE-PAAF en la estadificación del CPNM ha arrojado luz sobre el rendimiento de esta técnica en las diferentes poblaciones de pacientes, aunque no se ajustan exactamente a los grupos radiográficos que acabamos de mencionar24. El primer grupo, que consta de 8 estudios, comprendía a pacientes que en la TAC mostraban ganglios linfáticos mediastínicos agrandados y diferenciados7,25–31. En esta situación, la sensibilidad combinada era del 90% (IC del 95%, 84–94%) y la especificidad del 97% (IC del 95%, 95–98%). En 4 estudios con pacientes sin ganglios linfáticos mediastínicos agrandados en la TAC27,32–34, la sensibilidad combinada fue del 58% (IC del 95%, 39–75%). Se incluyó a un total de 1.201 pacientes en el análisis de 18 estudios elegibles sin solapamiento, de los que 16 eran prospectivos. Sólo 10 pacientes presentaron complicaciones menores (0,8%), la mayoría de las cuales fueron comunicadas por un único centro, y no se registró ninguna complicación grave. El empleo de la USE en pacientes sin ganglios linfáticos mediastínicos agrandados parece decepcionante, ya que la sensibilidad fue del 58%. No obstante, si se realiza la USE en este contexto como primera prueba de estadificación y resulta positiva, esto ayudará a evitar procedimientos de estadificación más invasivos o la cirugía. En el futuro es probable que la utilización combinada de la USE y la USEB mejore estos resultados.
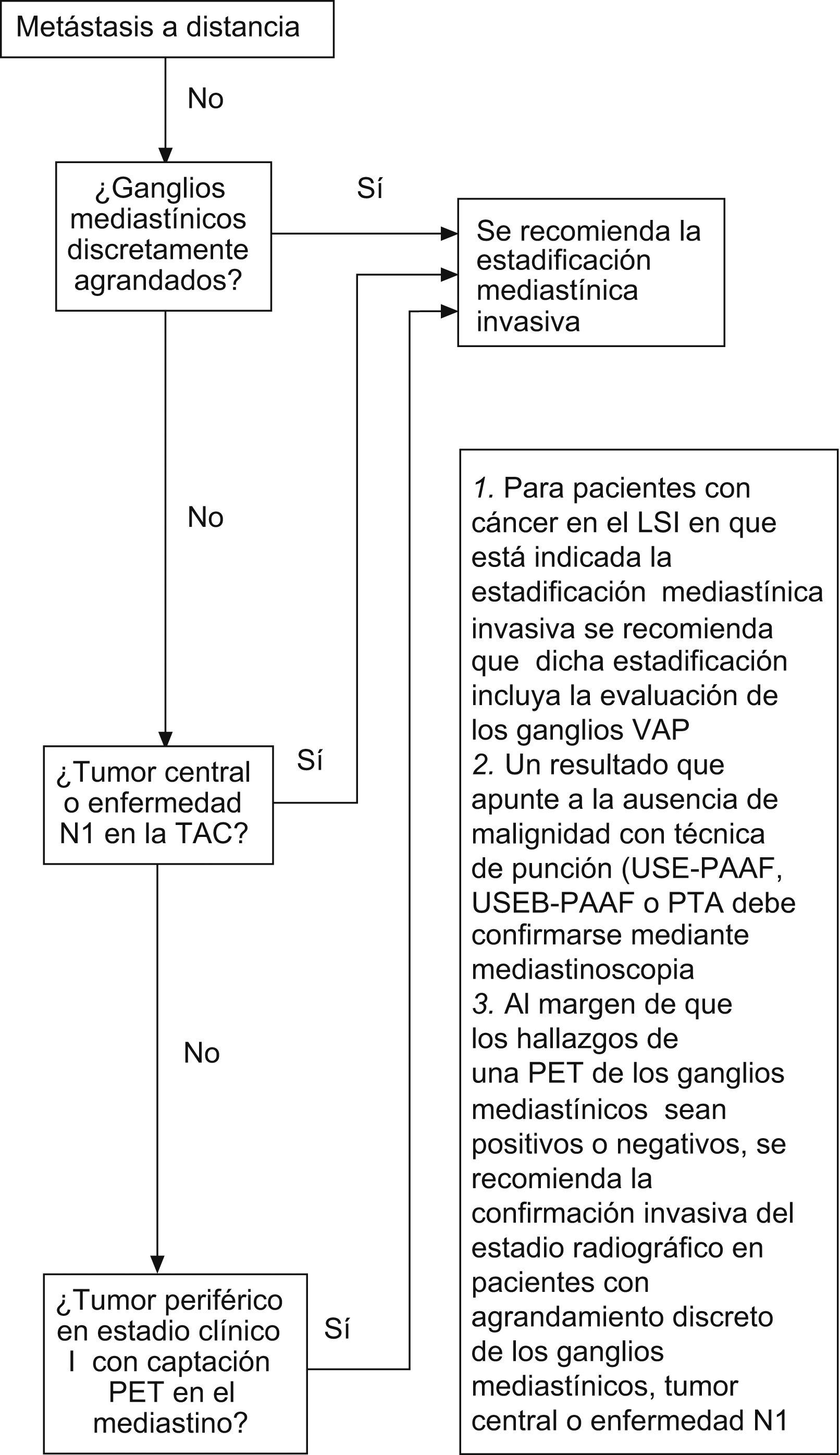
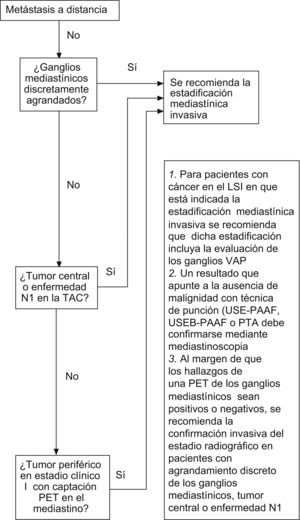
Para los pacientes con tumores de localización central o enfermedad N1, las directrices del ACCP recomiendan la estadificación invasiva (esto se aplica a pacientes con o sin agrandamiento de los ganglios linfáticos mediastínicos en la TAC, con independencia de los hallazgos obtenidos con la PET). Además, en el caso de los pacientes con ganglios linfáticos mediastínicos discretamente agrandados se recomienda la confirmación invasiva del estadio radiográfico (independientemente de los resultados de la PET). En tumores periféricos que aparecen clínicamente como estadio I y que no muestran captación mediastínica en la PET, no es necesario efectuar una estadificación mediastínica invasiva. Por otro lado, en el caso de un tumor periférico que (antes de efectuar la PET) parece estar clínicamente en estadio I, pero que en la PET muestra captación en el mediastino, debería someterse a una estadificación mediastínica invasiva para su confirmación. Si se utilizan técnicas de punción aspirativa (USE-PAAF, PTBA, USEB-PAAF o PAAF transtorácica), todo resultado que apunte a la ausencia de malignidad debe confirmarse mediante mediastinoscopia23 (fig. 1).
Diagrama de flujo donde se resumen las recomendaciones de estadificación mediastínica invasiva del American College of Chest Physicians (ACCP)1. CPNM: cáncer de pulmón no microcítico; LSI: lóbulo superior izquierdo; PAAF: punción aspirativa con aguja fina; PTA: punción transtorácica aspirativa; PTBA: punción aspirativa transbronquial; PET: tomografía por emisión de positrones; TAC: tomografía computarizada; USE: ultrasonografía endoscópica; USEB: ultrasonografía endobronquial; VAP: ventana aortopulmonar.
Durante años se ha aceptado que la mediastinoscopia era la técnica de referencia para la estadificación mediastínica en el CPNM. Permite acceder a ganglios derechos e izquierdos altos y a los ganglios paratraqueales bajos (estaciones 2R, 2L, 4R y 4L), a los ganglios pretraqueales (estaciones 1 y 3) y a los ganglios subcarinales anteriores (estación 7). Sin embargo, no es posible acceder a los ganglios mediastínicos inferiores (estación 8 y 9), a los ganglios de la ventana aortopulmonar (estación 5) ni a los mediastínicos anteriores (estación 6). La sensibilidad media de la mediastinoscopia en los estudios publicados es aproximadamente del 80%, y la tasa media de falsos negativos ronda el 10%23. En torno a la mitad de los falsos negativos se deben a ganglios que no eran accesibles con la mediastinoscopia. En la tasa de falsos negativos también influye la diligencia con que se disequen los ganglios. En condiciones ideales, deben examinarse de forma sistemática 5 estaciones ganglionares (2R, 4R, 7, 4L y 2L). Sin embargo, en un estudio retrospectivo holandés que incluía a 387 pacientes a quienes se efectuó una mediastinoscopia en 3 hospitales universitarios y un hospital no universitario, sólo en un 40% de los casos35 se tomaron muestras de forma sistemática. Igualmente se ha expresado cierta preocupación por el rendimiento de la mediastinoscopia según la experiencia del cirujano: los cirujanos torácicos reconocen que la eficacia de la técnica varía sobremanera según la formación y experiencia36. Las mismas inquietudes se pueden plantear una vez que la utilización de la USE y sobre todo de la USEB se extienda y otros profesionales, además de los expertos entusiastas, comiencen a realizarlas. En un estudio con 60 pacientes a quienes se efectuaron tanto una mediastinoscopia como una USE-PAAF (en algunos casos por indicación y en otros por selección aleatoria), la segunda fue superior a la primera en el examen de las regiones paratraqueales y subcarinales tomadas en conjunto37. Esto no resulta sorprendente en el caso de las estaciones subcarinales, pero es interesante destacar que la sensibilidad a la metástasis de ganglios linfáticos en la región paratraqueal derecha (más difícil de acceder con la USE) fue del 67% para la USE-PAAF y del 33% para la mediastinoscopia, y en la región paratraqueal izquierda los resultados fueron aún mejores, con valores del 80 y el 33%, respectivamente. Se trata de un estudio con un número pequeño de pacientes y los resultados para 2L y 4L no llegaron a alcanzar la significación estadística. Es evidente que es necesario investigar más. No obstante, aunque la mediastinoscopia realizada por cirujanos experimentados seguirá desempeñando un papel en la estadificación invasiva del CPNM, en la actualidad debería plantearse si es adecuado realizar la estadificación mediastínica sólo con dicha técnica y, si se incorporan la USE y la USEB al algoritmo de estadificación, cuál debería realizarse primero. En un estudio retrospectivo se realizó una USE-PAAF a 35 pacientes con mediastinoscopia negativa comprobada por biopsia38. Resultó que 13 pacientes presentaban ganglios linfáticos N2 o N3 malignos. En un interesante modelo de análisis de costes que utilizó técnicas de Montecarlo, los autores postularon que si se realizase la USE-PAAF primero (en lugar de la mediastinoscopia) se obtendría un ahorro medio de 11.033 dólares por paciente. Resultados similares obtuvieron Annema et al31 en un estudio con 107 pacientes holandeses. El 16% de las toracotomías podrían haberse evitado al utilizar la USE además de la mediastinoscopia.
Puntos fuertes y limitaciones de la punción aspirativa con aguja fina guiada por ultrasonografía endoscópicaLa USE puede alcanzar de forma fiable las estaciones de los ganglios linfáticos 5, 7, 8 y 9, y Soria et al39 aportaron en esta Revista una buena introducción a la técnica. En el mediastino superior, la tráquea se sitúa ligeramente a la derecha del esófago, lo que a menudo permite llegar a los ganglios linfáticos de las estaciones 2 y 4 del lado izquierdo, y con menos frecuencia a ganglios linfáticos paratraqueales del lado derecho37. A diferencia de la tráquea, el esófago es bastante flexible y es posible realizar considerables desplazamientos laterales, lo que permite visualizar estructuras que parecen relativamente alejadas del esófago en una TAC y tomar muestras para biopsia con la USE, sobre todo si sus dimensiones superan de sobra el centímetro. Sin embargo, por lo general la USE es más idónea para la evaluación del mediastino inferior posterior, mientras que la mediastinoscopia o la USEB son mejores para el mediastino superior anterior. Se considera que la viabilidad de realizar la USE-PAAF en los ganglios linfáticos de la ventana aortopulmonar (subaórtica; estación 5) es la principal ventaja de la USE. La evaluación de esta estación ha requerido tradicionalmente una mediastinotomía paramediana (procedimiento de Chamberlain). Sin embargo, en un reciente estudio retrospectivo realizado en un solo centro se ha cuestionado la fiabilidad de la USE para evaluar los ganglios linfáticos paraaórticos (estaciones 5 y 6)40. En dicho estudio, la USE-PAAF (n=62) resultó correcta en un 66% de los casos, mientras que la cirugía toracoscópica videoasistida, que practicó en 39 pacientes, fue correcta en el 100% de los casos. Lamentablemente, las estaciones 5 y 6 se analizaron de forma conjunta, de manera que no se sabe cuántos de los falsos negativos correspondieron a ganglios linfáticos de la estación 6 (que sólo puede visualizarse por USE pasando a través del arco aórtico o de la aorta descendente, un procedimiento potencialmente peligroso). Además, los autores señalan que durante la toracotomía y/o la USE a veces no se identifican de forma uniforme las estaciones 5 y 6. El sesgo de selección también pudo desempeñar un papel. En el grupo al que se realizó cirugía toracoscópica videoasistida (n=39), sólo hubo 3 verdaderos negativos (9%); por otro lado, hubo 21 verdaderos negativos en el grupo de la USE (34%). Estudios prospectivos que presten especial atención a este grupo de ganglios linfáticos podrían ayudar a resolver este problema.
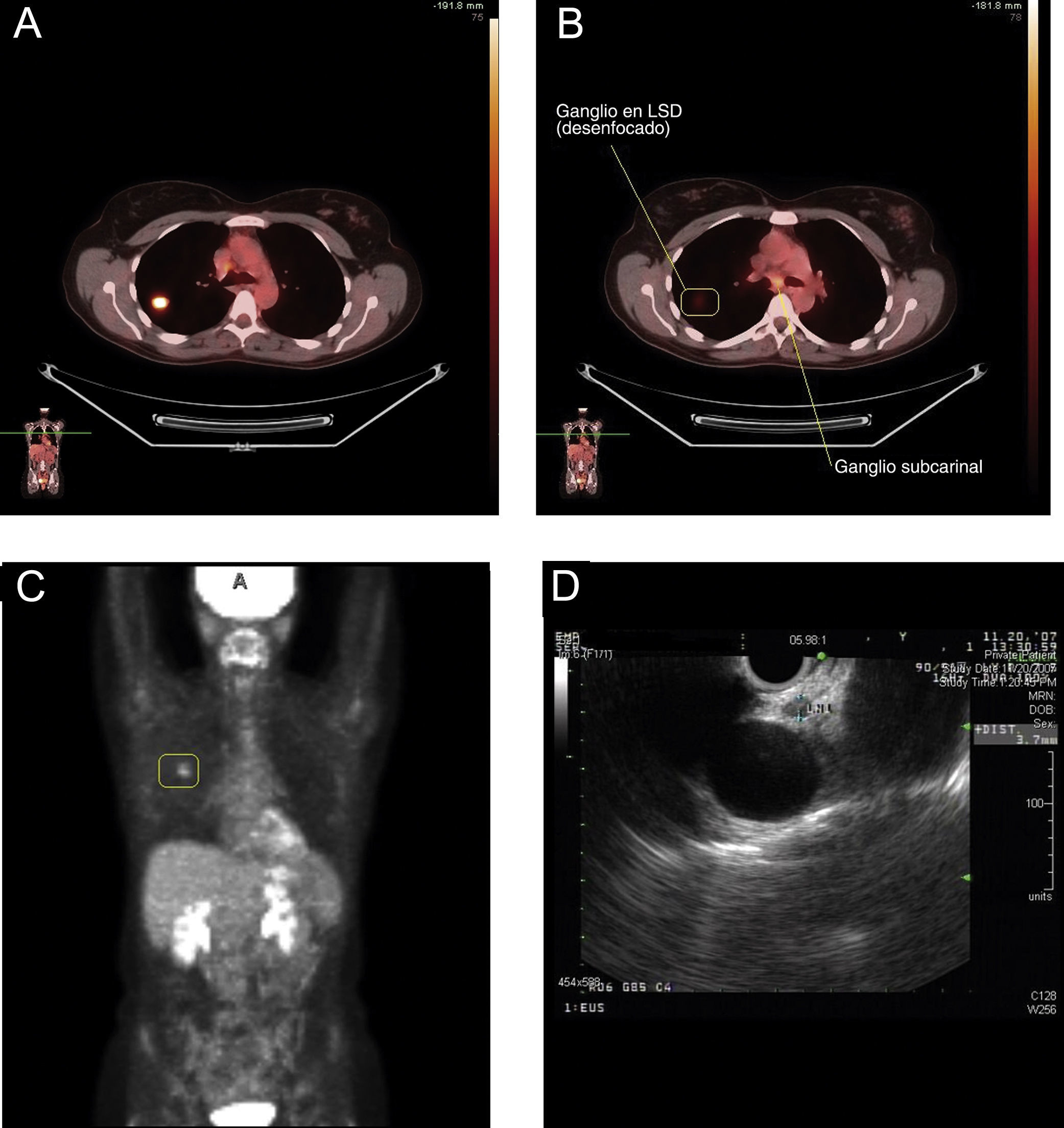
La USE puede muestrear con facilidad los ganglios celíacos a los que no puede accederse por otros métodos de estadificación mediastínica. En un estudio reciente se observó de forma inesperada una elevada incidencia de metástasis en los ganglios celíacos (11%)10. Otros autores ya han señalado la importancia de los ganglios celíacos34,41. La USE también tiene la ventaja de permitir la realización de biopsias de las metástasis suprarrenales izquierdas, si bien resulta más difícil practicar biopsias de la glándula suprarrenal derecha42. Será preciso explorar más profundamente la utilidad de la USE-PAAF en la reestadificación del mediastino en pacientes que hayan recibido quimioterapia y radioterapia para enfermedad N2 (fig. 2). Si la estadificación mediastínica inicial incluye una mediastinoscopia, la mayoría de los cirujanos tratan de evitar su repetición tras la radioterapia. La reestadificación mediante PET y TAC puede ayudar a aportar dianas para la biopsia, pero, como sabemos, es necesario tomar muestras del mediastino incluso cuando la PET es negativa. La USE-PAAF y la USEB-PAAF parecen inclinar claramente la balanza del riesgo-beneficio en estos pacientes43.
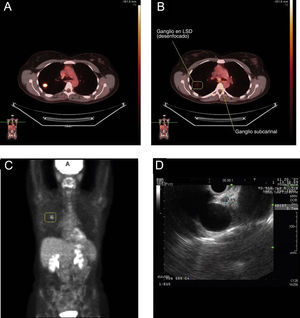
Reestadificación con ultrasonografía endoscópica (USE) del cáncer de pulmón no microcítico después de una mediastinoscopia. A: la estadificación inicial con tomografía por emisión de positrones (PET) muestra un nódulo “caliente” en el lóbulo superior derecho (LSD) con un valor de captación estándar de 7,1. B: corte de la exploración con PET para la estadificación inicial, que muestra un elevado grado de avidez por la glucosa en la región subcarinal, indicativo de metástasis en los ganglios linfáticos. C: PET de reestadificación después de la quimioterapia de inducción y radiación, que muestra una reducción de la intensidad de la masa del LSD y ninguna actividad en el mediastino, lo que indica una buena respuesta al tratamiento. D: 2 ganglios linfáticos pequeños en la ventana aortopulmonar (3mm) visibles en la USE; las biopsias guiadas por USE mostraron, sin embargo, cáncer de pulmón no microcítico.
Buscar información sobre la USEB puede resultar confuso. La bibliografía especializada anterior a 2004 trata exclusivamente de la USEB radial, mientras que a partir de dicho año los artículos se basan en la USEB con sonda convexa, también denominada USEB lineal o curvo-lineal.
Los endoscopios de ultrasonido que se utilizaron por primera vez en el aparato digestivo eran demasiado grandes para las vías respiratorias. Más o menos al mismo tiempo que se desarrollaban los endoscopios ultrasónicos para el aparato digestivo, se concibieron las sondas miniaturizadas capaces de pasar a través del canal de trabajo de un endoscopio o de un broncoscopio convencional. En la punta de estos accesorios hay un pequeño cristal piezoeléctrico que gira mediante una unidad motora mecánica con frecuencias que oscilan entre los 3,5 y los 20MHz. En general estas sondas tienden a presentar frecuencias mayores (20MHz), lo que mejora la resolución de las imágenes a expensas de la profundidad de penetración. Las sondas pequeñas tienen muy poco contacto con la pared bronquial y el aire en el árbol bronquial transmite mal las ondas sonoras. En el aparato digestivo, el acoplamiento acústico puede mejorarse anegando en agua el área de interés; en las vías respiratorias se utiliza con fines similares un globo hinchable alrededor del transductor de ultrasonido. Esta técnica, conocida como USEB con sonda radial, se describió por primera vez en 199244. La empresa Olympus ofrece una sonda miniaturizada de 20MHz con un globo que puede insertarse a través del broncoscopio (UM-BS20-26R, Olympus, Tokio, Japón)45. Estas sondas son útiles para la estadificación de lesiones endobronquiales tempranas, con el fin de evaluar, por ejemplo, su idoneidad para el tratamiento fotodinámico. Se considera que la orientación en el mediastino y la interpretación de las imágenes son difíciles, y en 2003 el ACCP recomendaba la realización de al menos 50 procedimientos de USEB radial supervisados para adquirir una competencia básica46. El uso de la USEB radial como guía también puede aumentar el rendimiento de la PTBA. Sondas aún menores (UM-S20-20R, Olympus) ayudan a detectar lesiones pulmonares periféricas. La USEB radial puede reemplazar a la fluoroscopia en los procedimientos de biopsia guiados. La USEB con sonda radial no permite, sin embargo, el seguimiento en tiempo real de la aguja hasta la diana. Obviamente, las directrices del ACCP de 2003 no abordan la nueva USEB con sonda convexa, que es muy diferente y probablemente más fácil de aprender. La USEB con sonda convexa (XBF-UC260F-OL8, Olympus), introducida en la práctica clínica por Yasufuku et al47 en 2004, es un broncoscopio ultrasónico especial con un conjunto de cristales ultrasónicos con conmutación electrónica que tiene capacidad Doppler, algo que la USEB radial mecánica no puede ofrecer. Estos aparatos de USEB se asemejan a los instrumentos con conjuntos lineales curvos que se emplean para la USE-PAAF en el aparato digestivo, pero son de tamaño mucho menor. La exploración radial no permite visualizar una aguja de PTBA, ya que emerge fuera del broncoscopio, de manera que el campo de visión para un endoscopio de USEB especial para PTBA necesita ser convexo (lineal curvo). La capacidad Doppler es una característica útil para evitar la punción accidental de vasos, y el tamaño grande del transductor ultrasónico permite maniobrar el instrumento sin inflado del globo o con un inflado mínimo. El diámetro de la punta para el broncoscopio de USEB con sonda convexa es de 6,7mm. Es más rígida y más grande, la vista hacia delante es oblicua y la imagen luminosa blanca es más oscura. Sin embargo, este instrumento es ideal para evaluar el mediastino anterior superior, y además puede acceder a los ganglios linfáticos subcarinales. Las primeras experiencias con este instrumento en la estadificación de ganglios linfáticos mediastínicos parecen muy prometedoras, con una sensibilidad que oscila del 92 al 96% en 4 series en que participaron entre 70 y 502 pacientes47–50. Herth et al51 han publicado recientemente un estudio importante en el que se evalúa la utilidad de la USEB-PAAF en pacientes que presentan un mediastino normal según la PET y la TAC (estadio clínico I de cáncer de pulmón). De los 97 pacientes con CPNM confirmado, aparentemente en estadio I, 9 presentaron ganglios linfáticos metastásicos que se descubrieron con USEB; uno resultó ser un falso negativo. Todos los resultados de la USEB se confirmaron con toracotomía.
Al parecer la USEB con sonda convexa es más fácil de aprender que la USEB con sonda radial. En la actualidad no hay directrices publicadas sobre la formación y obtención de certificación para la realización de esta técnica, pero probablemente Sheski y Mathur52 se hacen eco de los sentimientos de muchos cuando dicen que con un instructor competente es posible sentirse cómodo utilizando la USEB de sonda convexa después de unos 20 procedimientos. Si bien los endoscopios de USE para el aparato digestivo no caben en la tráquea, desde luego es posible usar la USEB con sonda convexa en el esófago para llegar a las estaciones de ganglios linfáticos mediastínicos que, de otro modo, es imposible visualizar53. Los centros que sólo puedan costearse un endoscopio ultrasónico deberían tener en cuenta esta consideración.
Mediastinoscopia médica completaLa USEB-PAAF y la USE-PAAF son técnicas complementarias. La USEB es mejor para el mediastino superior anterior y la USE presenta el mejor rendimiento en el mediastino inferior posterior. A ciertas estaciones de ganglios linfáticos sólo puede accederse con un método y no con el otro; por ejemplo, las estaciones 2L, 4L y 3 son difíciles o imposibles de visualizar con la USE. Por otro lado, no es posible realizar biopsias con USEB en las estaciones 5 y 8. Juntas, la USEB y la USE cubren todo el mediastino, salvo, posiblemente, la estación 6, y la combinación de ambos procedimientos debe permitir la estadificación completa del mediastino (fig. 3). Recientemente hemos publicado los resultados de un estudio que incluía a 138 pacientes a quienes se realizaron PTBA, USE-PAAF y USEB-PAAF en una única sesión, de forma combinada54. La USEB-PAAF tuvo una sensibilidad mucho mayor que la broncoscopia-PTBA, ya que detectó 29 (69%) de los ganglios linfáticos malignos, frente a los 15 (36%) de la segunda técnica (p=0,003). La USE y la USEB en combinación presentaron una sensibilidad y un valor predictivo negativo significativamente superiores a los de cualquiera de los 2 métodos por separado, con unos valores del 93% (IC del 95%, 81–99%) y el 97% (IC del 95%, de 91–99%), respectivamente. Con la combinación de las 2 técnicas se obtuvo un aumento estimado de la sensibilidad del 24%. En definitiva, la USE y la USEB combinadas pueden lograr una estadificación casi completa del mediastino de forma mínimamente invasiva. En series con menor número de pacientes, otros autores37,55,56 han obtenido resultados igualmente alentadores con un abordaje combinado.
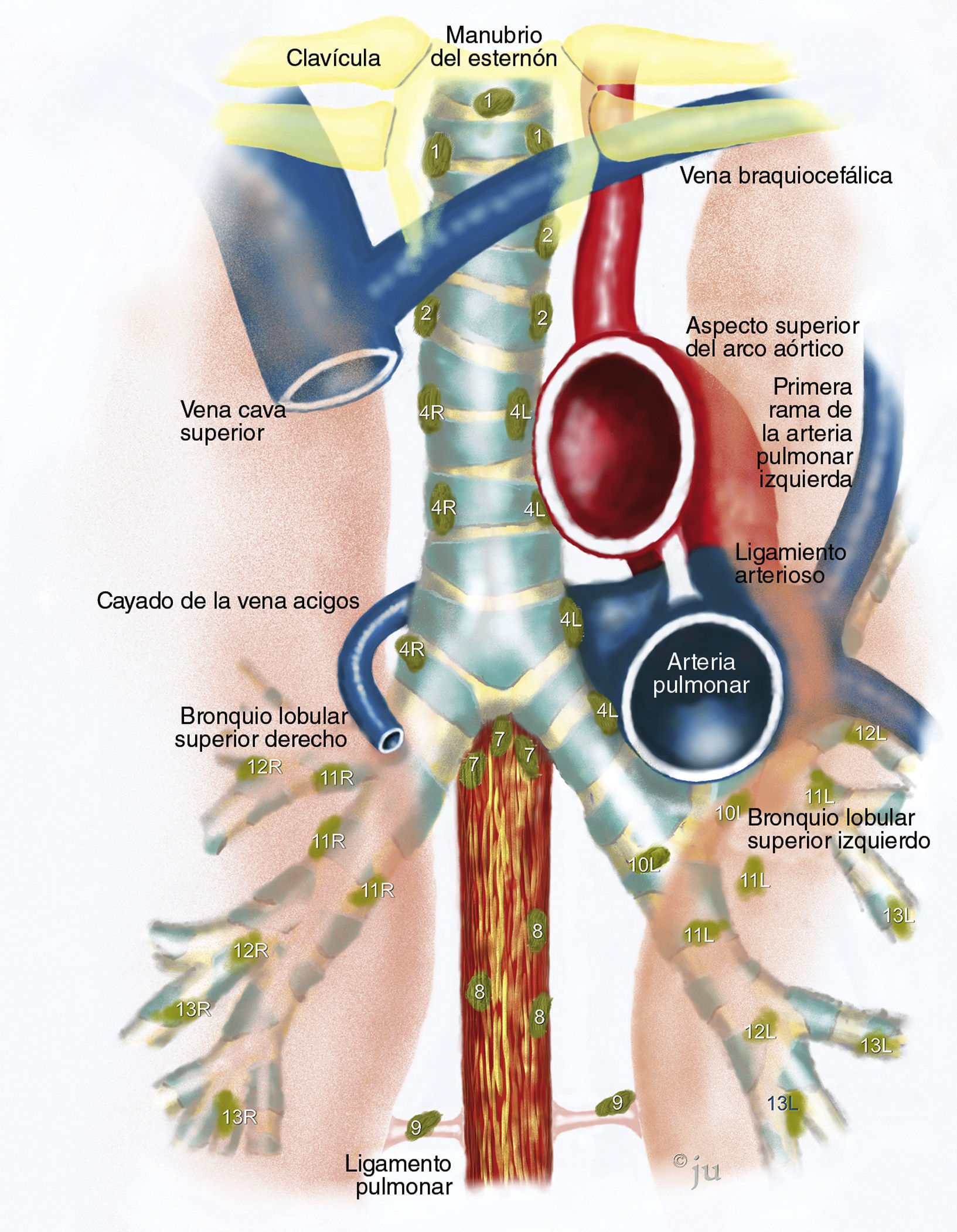
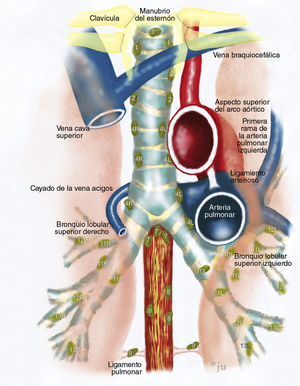
Alcance y papel de la ultrasonografía endoscópica (USE), de la ultrasonografía endobronquial (USEB) y de la mediastinoscopia. En general, la USEB y la mediastinoscopia son mejores que la USE en el mediastino superior. Pueden obtenerse biopsias de algunos ganglios linfáticos en las estaciones 2 y 4 con la USE, siempre que sean lo bastante grandes para ser visibles desde el esófago; esto es más probable en el caso de las estaciones del lado izquierdo. La estación 7 es territorio común para las 3 modalidades. En el mediastino superior, la USE puede llegar fácilmente a los ganglios linfáticos de la estación 5 (ventana subaórtica o aortopulmonar), y es la única modalidad de las 3 que puede utilizarse en el mediastino inferior para obtener biopsias de los ganglios linfáticos en las estaciones 8 y 9, ganglios celíacos y glándulas suprarrenales. (Ilustración de Jens Uhder.)
El sistema TNM de estadificación del CPNM se revisó por última vez en 1997. La Asociación Internacional para el Estudio del Cáncer de Pulmón, que ha creado una base de datos con más de 100.000 entradas correspondientes a 23 instituciones de 12 países de Europa, América del Norte y Australasia, ha planteado algunos cambios importantes57,58. Las propuestas principales se refieren a la clasificación T y M, mientras que el estado N permanecería igual. El tamaño del tumor se ha revelado como un importante factor pronóstico, y dicha organización ha recomendado subdividir el estadio T sobre la base de 5 criterios de tamaño. Por otra parte, la supervivencia es mejor en los pacientes con tumores primarios con ganglios satélite en el mismo lóbulo, por lo que se recomienda que estos pacientes pasen de T4 a T3. Asimismo, la presencia de ganglios adicionales en un lóbulo diferente del pulmón homolateral pasaría de la designación M1 a la T4. El derrame pleural maligno se clasifica actualmente como T4, también denominado 3B wet, a pesar de que la supervivencia de los pacientes de este grupo se asemeja más a la de aquéllos con metástasis que a la de quienes presentan enfermedad localmente avanzada. Por consiguiente, se ha propuesto trasladar a estos pacientes al estadio M1. Además, el estadio M debería dividirse en M1a (enfermedad metastásica limitada al tórax) y M1b (enfermedad metastásica extratorácica) porque se ha observado que la supervivencia es mejor en los pacientes con enfermedad metastásica limitada al tórax. La adopción parcial o total de estas propuestas no cambiará el estadio N ni, más concretamente, las recomendaciones para la estadificación mediastínica invasiva.
El futuro de la endoscopia torácicaLos neumólogos han dominado tradicionalmente el campo del diagnóstico invasivo en las enfermedades pulmonares. Aun con pruebas abrumadoras que respaldan el papel de la endoscopia ultrasónica en la estadificación mediastínica, la USE-PAAF no se incorpora a menudo a los protocolos de diagnóstico y estadificación, aunque pueda disponerse de ella con facilidad. Este hecho se ha observado tanto en EE.UU.59 como en Australia60. Las razones no están claras. Esperamos que esta situación cambie a medida que los especialistas en neumología adopten la USEB. Parafraseando a Annema y Rabe61, la cuestión actual no es si la USE se incorporará a la práctica habitual de la medicina pulmonar, sino cómo, en qué medida y en qué plazo de tiempo. La USEB no permite la estadificación de todo el mediastino. Cualquier neumólogo que desee realizar una “mediastinoscopia médica completa” necesitará también formarse en el uso de la USE-PAAF. Es poco probable que la práctica actual de algunos centros de referencia nacionales de EE.UU. que programan una USE-PAAF y una USEB-PAAF consecutivas realizadas por un gastroenterólogo y un neumólogo se extienda a gran escala en la comunidad. No es sorprendente que los neumólogos hayan expresado su interés por formarse en el manejo de la USE32,62,63. Fritscher-Ravens et al32, por ejemplo, enseñaron en su centro de Alemania a varios neumólogos a utilizar la USE-PAAF transesofágica. Es cierto que la situación en Alemania es diferente, ya que lo que ellos denominan “médico internista general” tiene 6 años de formación de posgrado y a menudo está capacitado para efectuar colonoscopias, endoscopias y broncoscopias del aparato superior. En EE.UU., por otra parte, estos procedimientos se dividen nítidamente entre distintas subespecialidades. Los broncoscopistas pueden formarse en el empleo de la PAAF transesofágica, pero los expertos en USE también pueden formarse en el uso de la USEB. Si queremos que nuestros pacientes se beneficien y acelerar la implementación de la USE y USEB en la estadificación mediastínica, no debería importar la formación de los profesionales. Sin embargo, para ser equitativa, la transferencia de conocimientos debería ser bilateral. En otras palabras, imaginemos una situación en que los endoscopistas ayudan a sus colegas neumólogos a aprender el uso de la USEB, enseñándoles a realizar la USE-PAAF a través del esófago, mientras que los neumólogos enseñan a los especialistas en ultrasonografía a efectuar la USEB a través de las vías respiratorias. Ya se ha demostrado que los gastroenterólogos pueden aprender a efectuar la USEB64. De esta forma, en menos de una década se crearía un cuadro de experimentados endoscopistas torácicos y todos se beneficiarían. Quizá volvamos al punto de partida y la especialidad de la esofagobroncología experimente un renacimiento.