La pirámide población está cambiando como consecuencia de la cada vez mayor longevidad de la población por lo que se hace prioritario conocer en profundidad aquellas enfermedades que impactan con mayor frecuencia en edades avanzadas. El síndrome de apneas-hipopneas durante el sueño (SAHS) afecta al 15–20% de los individuos mayores de 65 años. Sin embargo, y a pesar de esta elevada prevalencia y que en nuestro país uno de 4 estudios de sueño se realiza en ancianos y que más del 60% de estos serán tratados con CPAP, apenas existen estudios específicos para este grupo de edad sobre el diagnóstico y manejo de esta enfermedad. Probablemente el incremento fisiológico con el paso del tiempo del número de trastornos respiratorios durante el sueño sea el mayor obstáculo a la hora de definir, diagnosticar y tratar el SAHS en los ancianos. En cualquier caso y mientras llegan evidencias científicas más sólidas tanto el Consenso Nacional de SAHS como las Normativas sobre el diagnóstico y tratamiento del SAHS recomiendan que, dentro de límites lógicos, la edad por si misma no sea un obstáculo para ofrecer a los ancianos un trato diagnóstico y terapéutico semejante al ofrecido al resto de la población.
The population pyramid is changing due to the increasing longevity of the population, making it a priority to have better knowledge of those diseases that have an increasingly major impact in advanced age. Sleep apnea-hypopnea syndrome (SAHS) affects 15–20% of individuals over 65 years. However, despite this high prevalence and that one in four sleep studies are conducted on the elderly in this country and that more 60% of these were treated with CPAP, there are few specific studies in this age group on the diagnosis and management of this syndrome. The physiological increase of the number of sleep respiratory disorders with the passing of time may be the biggest obstacle when defining, diagnosing and treating SAHS in the elderly. In any case and while more solid scientific evidence is obtained, the National SAHS Consensus, as well as the Guidelines on the diagnosis and treatment of SAHS, recommend that, within logical limits, age itself should not be an obstacle to offering the elderly diagnostic help and treatment similar to that offered to the rest of the population.
No cabe duda de que la pirámide poblacional está cambiando. Gracias al progresivo avance en el conocimiento médico y a la mejora en las condiciones sociales, la longevidad de la población va en aumento, por lo que, en especial en el Primer Mundo, los individuos de edades más avanzadas están adquiriendo un protagonismo especial en el panorama sanitario. Un estudio reciente concluye que las personas nacidas a principios del siglo xxi en el mundo industrializado, tendrán una esperanza de vida por encima de los 100 años y, lo que parece más importante, con una buena calidad de vida en la mayoría de los casos1. Con este panorama, que no solo es futuro sino que ya es también presente, y teniendo en cuenta que a pesar de todo, el inexorable paso del tiempo seguirá provocando que el mayor porcentaje de visitas médicas se produzcan en el último cuarto de vida, nos enfrentamos a una situación en la que habrá que dar respuesta a una demanda creciente de pacientes de edades avanzadas que además exigirán de forma justa un trato diagnóstico y terapéutico semejante al proporcionado a los más jóvenes. En este sentido, España deberá enfrentarse a esta situación de una forma precoz dado que ya es el segundo país del mundo, tras Japón, con una mayor supervivencia media al nacer, estimada en 2006, según el informe del Instituto Nacional de Estadística, en 77 años para los hombres y 83,5 años para las mujeres, 6 años más que la media de la Unión Europea y con un 21% de la población mayor de 65 años que llegará a ser superior al 35% en las próximas décadas2. Lógicamente, aquellas enfermedades más prevalentes en la población con especial impacto en edades avanzadas, o aquellas en las que nuestro conocimiento actual sea deficitario, serán sobre las que de forma prioritaria se deberá incidir con una mayor tenacidad. El síndrome de apneas e hipopneas durante el sueño (SAHS) es un ejemplo claro de esta situación dado que aglutina ambas circunstancias: su elevada prevalencia y el amplio desconocimiento de su impacto en edades avanzadas. Aceptando en nuestro país una prevalencia actual de SAHS cercana al 20% en individuos de más de 65 años y el creciente peso epidemiológico de este grupo de población, se puede estimar que actualmente existen más de 1,7 millones de individuos con SAHS mayores de 65 años, cifra que se duplicará en las próximas 3 décadas. En la siguiente revisión se repasará la evidencia científica actual sobre el SAHS en edades avanzadas y se abordará la problemática que genera la presencia de una enfermedad muy prevalente pero escasamente conocida en una sociedad cada vez más envejecida.
El sueño también envejeceAlgunos estudios epidemiológicos concluyen que más de la mitad de los individuos mayores de 65 años presentan algún tipo de trastorno crónico del sueño3. Es indudable e inevitable que las actividades fisiológicas se vayan deteriorando con el paso del tiempo, y el sueño no es una excepción a esta regla. En líneas generales tanto la estructura como la duración del sueño cambian con la edad. De acuerdo con los resultados extraídos de la muestra del Sleep Heart Health Study con más de 2.500 individuos estudiados, posiblemente los cambios más característicos que se producen en edades avanzadas sean el incremento en el porcentaje de sueño superficial y el decremento de sueño profundo, con escasas variaciones (disminuciones menores al 5%) en el porcentaje de sueño REM, pero con una disminución general del tiempo total de sueño, así como una disminución en la eficiencia del mismo y un incremento en el número de despertares («arousals»). Estos despertares pueden llegar a ser de hasta 15 episodios por hora de sueño, si bien con importantes diferencias de género, ya que en las mujeres los cambios, en general, no parecen tan acusados4. Parece que estas modificaciones en la calidad y cantidad del sueño dependientes de la edad responden a variaciones neurohormonales producidas por cambios tanto en la secreción endocrina del eje hipotálamo-hipofisario-adrenal5–9, como de la actividad neurológica10,11. Entre ellas cabría destacar una disminución en la concentración de hormona del crecimiento, variaciones en el eje hipocretina-orexina, cambios en la secreción de melatonina, aumento del cortisol nocturno o aumento de citoquinas inflamatorias como la interleukina-6 e implicación de los sistemas serotoninérgicos y GABAérgicos, así como la progresiva incapacidad de mantener la regulación homeostática que marca los ritmos circadianos de vigilia-sueño en los individuos de edades avanzadas12. En este sentido con el incremento en la edad suele existir un avance de fase que, según algunos estudios, no depende únicamente de cambios endógenos sino también de cambios en el estilo de vida con la edad y a factores externos como la dieta, la actividad física o la exposición a la luz que se van sucediendo a medida que pasa el tiempo12,13. Por otro lado, la presencia de comorbilidades crónicas en especial el insomnio, el síndrome de piernas inquietas, las artropatías, el uso de hipnóticos, o el incremento en el número de trastornos respiratorios durante el sueño (TRS), más frecuentes en edades avanzadas, inciden en una mayor desestructuración del sueño en esta franja de edad14–17.
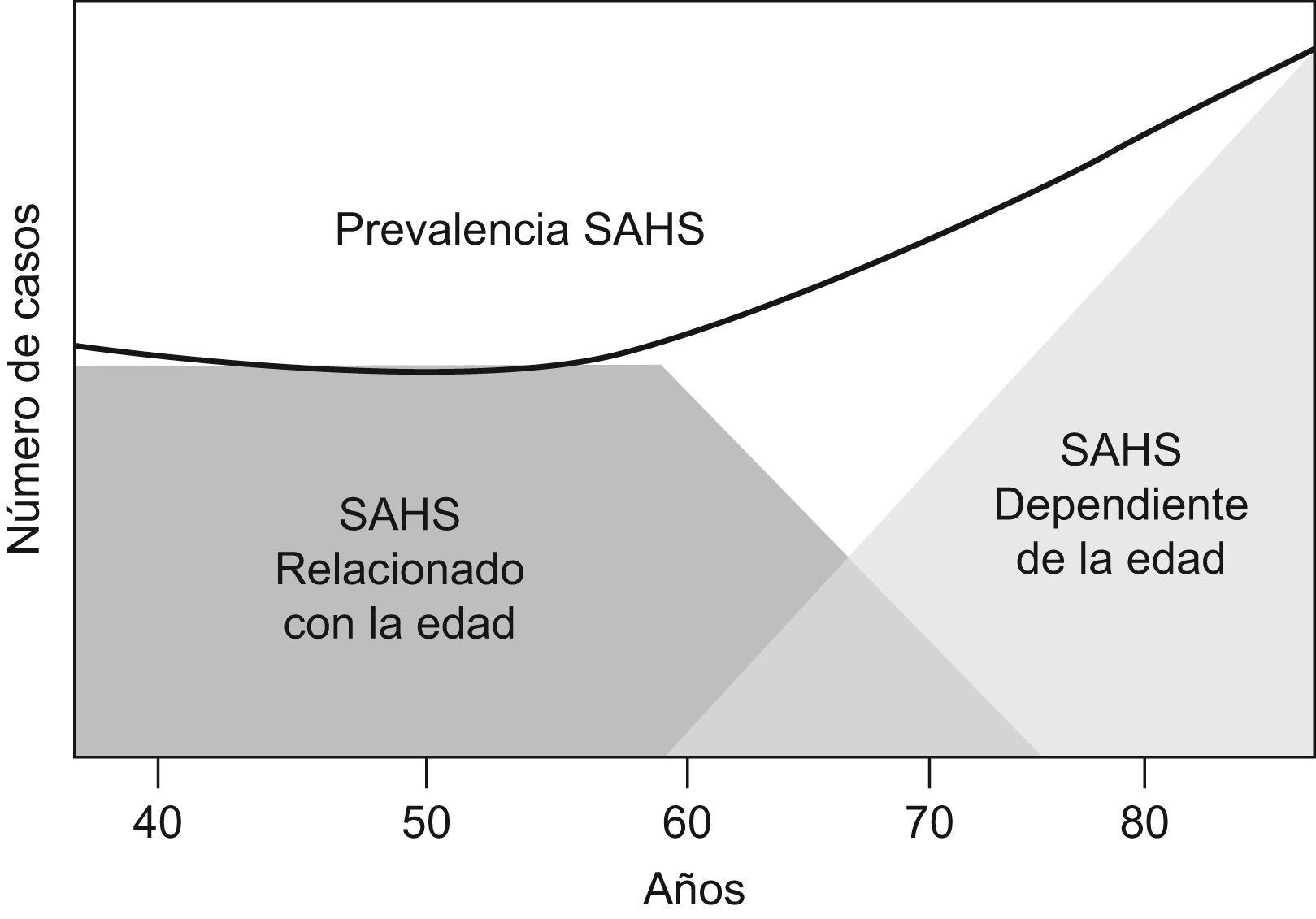
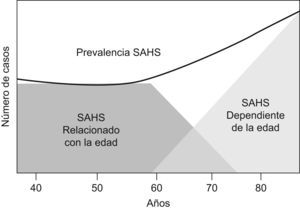
Es un hecho bien estudiado que el número de TRS aumenta con la edad de forma fisiológica, debido a una mayor tendencia al colapso de la vía aérea superior con el paso del tiempo. Entre los numerosos factores que podrían explicar este fenómeno destacan los relacionados en la tabla 1. El grado final de colapso no parece depender de forma exclusiva del papel de uno solo de estos factores sino que mejor, parece el resultado final de la interacción de todos ellos, lo que explicaría, en cualquier caso, la gran heterogeneidad fisiológica observada para una determinada edad y, con ello, la mayor dificultad para el clínico a la hora de decidir en un paciente de edad avanzada con exceso de TRS, qué porcentaje de los eventos es patológico y qué porcentaje es fisiológico, y aún más, si esta situación debe o no ser tratado a pesar de todo18–20. Así, Bwilise et al sugirieron un modelo heurístico con 2 formas de SAHS; por una parte aquel de naturaleza patológica que aparecería en edades medias de la vida y que correspondería a aquellos pacientes que son diagnosticados habitualmente de SAHS en las Unidades de Sueño, y por otro, aquel que aparecería a partir de los 60 años de edad, con cierto solapamiento con el anterior, y que sería causado de forma fisiológica por el propio envejecimiento y el incremento en la colapsabilidad faríngea consiguiente. En cualquier caso este modelo dual no ha sido confirmado de una forma adecuada (fig. 1)21.
Posibles causas de una mayor colapsabilidad de la vía aérea en el individuo de edad avanzada
| Aumento de la resistencia de la vía aérea al dormir |
| Disminución diámetro de la faringe por depósito de grasa mural |
| Disfunción muscular faríngea |
| Alteraciones del os reflejos dilatadores de la faringe |
| Alteración de la estructura del sueño |
| Mayor inestabilidad respiratoria durante el sueño (eventos centrales) |
| Periodo postmenopáusico en la mujer |
| Pérdida de dientes |
| Frecuentes comorbilidades que son factores de riesgo (ictus, insuficiencia cardiaca, hipotiroidismo, etc.) |
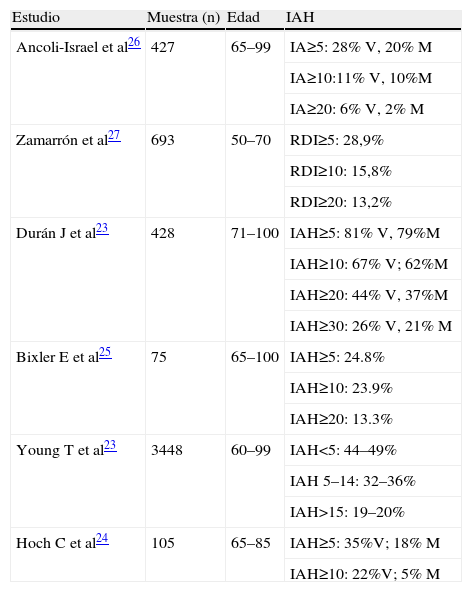
Con el paso del tiempo, el incremento en la colapsabilidad de la vía aérea como consecuencia de diversos factores asociados de forma fisiológica a la edad, explica el aumento en el número de TRS observados18–20, asociados o no a clínica secundaria a los mismos, tal y como ha sido puesto de manifiesto en diversos estudios epidemiológicos de base poblacional realizados en individuos de edad avanzada (tabla 2). Young et al22 constataron que el número de TRS aumenta de forma edad-dependiente hasta alcanzar un techo a partir de los 60 años, si bien este fenómeno de meseta no ha podido ser constatado por otros autores. En España, cabe destacar el estudio realizado por Durán et al23 sobre una muestra de 428 individuos de la población general de entre 71–100 años. Este estudio reveló que el 67% de los hombres y el 62% de las mujeres presentaban un IAH≥10. Aceptando el diagnóstico de SAHS como la presencia de un IAH≥10 con clínica compatible (hipersomnia diurna según una puntuación del cuestionario de Epworth >10), el 20% de los varones y el 15% de las mujeres cumplían criterios para establecer el diagnóstico. Si bien este estudio, como el resto de los estudios que se detallan en la tabla 2, muestran un claro incremento en el número de TRS con síntomas, es importante clarificar que el cuestionario de Epworth, habitualmente utilizado a todas las edades para evaluar subjetivamente el grado de hipersomnia, no está validado para su uso en edades avanzadas. Además existe un incremento importante de individuos con hipersomnia no dependientes de la presencia de SAHS (comorbilidades, inactividad, obesidad, toma de psicotropos, alteraciones cognitivas, etc), y que un punto de corte de 10 en el IAH posiblemente caiga dentro del intervalo fisiológico para la mayoría de individuos. Aún con ello, Durán et al observaron que el 26% de los hombres y el 21% de las mujeres presentaban un IAH≥30, valor probablemente dentro del margen patológico incluso en individuos de edad avanzada, lo cual hace sospechar que efectivamente el SAHS presenta una elevada prevalencia en esta franja etaria, y que esta prevalencia tiende a igualarse entre hombres y mujeres en la tercera edad. Por otro lado, el incremento en el número de TRS se produce tanto a expensas de los de naturaleza obstructiva como central, especialmente de los primeros, si bien algunos autores observan un incremento especialmente acusado en los eventos de tipo central24–27. Por último, Campos-Rodríguez et al no observaron que la edad fuera un factor determinante en el desarrollo de un SAHS localizado en la fase REM28.
Estudios epidemiológicos de base poblacional más relevantes sobre SAHS realizados en población de edad avanzada
| Estudio | Muestra (n) | Edad | IAH |
| Ancoli-Israel et al26 | 427 | 65–99 | IA≥5: 28% V, 20% M |
| IA≥10:11% V, 10%M | |||
| IA≥20: 6% V, 2% M | |||
| Zamarrón et al27 | 693 | 50–70 | RDI≥5: 28,9% |
| RDI≥10: 15,8% | |||
| RDI≥20: 13,2% | |||
| Durán J et al23 | 428 | 71–100 | IAH≥5: 81% V, 79%M |
| IAH≥10: 67% V; 62%M | |||
| IAH≥20: 44% V, 37%M | |||
| IAH≥30: 26% V, 21% M | |||
| Bixler E et al25 | 75 | 65–100 | IAH≥5: 24.8% |
| IAH≥10: 23.9% | |||
| IAH≥20: 13.3% | |||
| Young T et al23 | 3448 | 60–99 | IAH<5: 44–49% |
| IAH 5–14: 32–36% | |||
| IAH>15: 19–20% | |||
| Hoch C et al24 | 105 | 65–85 | IAH≥5: 35%V; 18% M |
| IAH≥10: 22%V; 5% M |
IA: Índice de apneas; IAH: índice de apneas-hipopneas; M: mujer; RDI: Respiratory Disturbance Index; V: varón.
Algunos autores han observado que aquellos pacientes mayores de 65 años que son enviados por sospecha de SAHS a una unidad de sueño presentan un IAH similar a los individuos de menor edad, reflejo probablemente del semejante perfil clínico con el que son derivados15,29. Recientemente ha sido completado un estudio en España con datos analizados de más de 50.000 estudios de sueño realizados entre 2002–2008 procedentes de 16 unidades de sueño que muestra que uno de cada 4 estudios de sueño (24,3%) son realizados en individuos mayores de 65 años, preferentemente varones (64,9%). Más del 70% de los mismos mostraron un IAH>10 y de ellos alrededor del 70% fueron tratado con CPAP, porcentaje que fue aumentando de forma paulatina desde 2005, especialmente en varones de edad avanzada. Estos datos confirman que, a pesar de la escasa evidencia científica disponible sobre el diagnóstico, impacto y tratamiento del SAHS en edades avanzadas, la actividad asistencial en este grupo de edad no solo es importante sino que está creciendo en los últimos años30.
¿Tienen los ancianos una clínica de SAHS diferente?El cuadro clínico del SAHS es probablemente diferente en los ancianos en comparación con el observado en individuos jóvenes, como ocurre con otras muchas enfermedades. La forma de vivir, de contar o de sentir los síntomas quedan perfilados por las especiales características de los ancianos, aún más en una enfermedad en la que muchos de los síntomas deben de ser relatados por el compañero/a de cama, en ocasiones también de edad avanzada y con problemas neurosensoriales o el elevado porcentaje de individuos de edad avanzada que duermen solos. En este sentido, Young et al22 observaron que a partir de los 50 años, no solo disminuye de forma progresiva el número de roncadores, sino que además el porcentaje de mujeres que desconocen si roncan ya es mayor que el porcentaje de mujeres que saben que roncan mientras que en los hombres esta circunstancia aparece a partir de los 70 años, edad en el que el porcentaje de hombres que desconoce si ronca es del 26%. Algo semejante por lo tanto podríamos concluir con la identificación de las apneas presenciadas, ambos síntomas claves para determinar la probabilidad clínica «pretest» de SAHS e iniciar el algoritmo diagnóstico-terapéutico adecuado. Probablemente este fenómeno influya de una forma decisiva en una falta de consulta médica al respecto y por lo tanto en el infradiagnóstico del SAHS en el anciano.
En relación a la hipersomnia, síntoma clave para evaluar la gravedad del SAHS, existen importantes dificultades para establecer su existencia y en especial su relación con un posible SAHS en edades avanzadas por diferentes razones, entre las que destacan las siguientes:
- •
Elevada prevalencia de hipersomnia en el anciano. Algunos autores han observado que hasta el 20% de los ancianos presentan hipersomnia patológica durante el día. Bixler et al31 observaron en más de 16.500 individuos de la población general entre 20–100 años que la prevalencia de hipersomnia aumentaba de forma muy importante, e independientemente de otros factores de confusión, a partir de los 75 años.
- •
Relación con múltiples factores. Whitney et al32 estudiaron a 4.578 individuos mayores de 65 años y observaron que el exceso de hipersomnia se asociaba a múltiples factores, entre ellos: la propia edad, la obesidad, comorbilidades crónicas especialmente cardiorrespiratorias y aquéllas que provocaban dolor físico, presencia de depresión, uso de psicotropos, desestructuración del sueño, peor calidad de vida, actividad motora y clínica relacionada con el SAHS, si bien en este último caso fue una relación débil. Ello hace que la presencia de hipersomnia en el anciano tenga incluso menor especificidad que en el adulto a la hora de la sospecha clínica de SAHS.
- •
Percepción de la hipersomnia como un síntoma «normal» del anciano. Tanto el propio paciente como el equipo médico que lo atiende asumen frecuentemente como normal o relacionado con el deterioro fisiológico la presencia de una excesiva hipersomnia en el anciano. Este hecho hace que en ocasiones el paciente, no sea enviado a las unidades de sueño para su estudio si tiene una edad avanzada o que sea el propio paciente el que no consulte por esta circunstancia y por lo tanto sea una de las causas de infradiagnóstico o de diagnóstico tardío de SAHS en el anciano33, especialmente en el sexo femenino34.
- •
Hipersomnia relacionada con el SAHS. Sin embargo, algunos autores han observado como el grado de hipersomnia en el anciano derivado a una unidad de sueño es similar al de los pacientes a edades más jóvenes lo que apoya el hecho de que los ancianos son derivados por causas semejantes a los jóvenes (clínica típica) a pesar de que en entre los ancianos es muy frecuente la clínica «no típica» o paucisintomática (en relación a la hipersomnia) en aquellos con un perfil sospechoso de SAHS con más rasgos cardiovasculares o neurocognitivos15,29.
- •
Medición de la hipersomnia en el anciano. Un obstáculo más es la ausencia de herramientas diagnósticas de uso extendido pero validadas específicamente en el anciano para la medición subjetiva de la hipersomnia. En este sentido el cuestionario de Epworth no está validado para su uso en edades avanzadas, por lo que algunas preguntas (como las relacionadas con la conducción) no tendrían sentido en un porcentaje elevado de ancianos que ya no conducen. Su uso debe realizarse con precaución35.
Por lo tanto, se puede concluir que muchos de los datos clínicos y antropométricos como la roncopatía crónica, las apneas observadas, la presencia de hipersomnia, el índice de masa corporal, el perímetro del cuello o el perímetro de la cintura pelviana, que suelen relacionarse con la clínica típica de SAHS en el individuo de mediana edad, parecen tener un valor predictivo más limitado en el anciano tanto por la disminución de su especificidad como por la dificultad en su medición o la presencia con la edad de mecanismos adaptativos22,36. En contrapartida, sin embargo, la presencia de un SAHS en el anciano parece relacionarse mejor con una serie de aspectos clínicos más específicos de este grupo de edad habitualmente de la esfera neurocognitiva y cardiovascular, especialmente la primera, y que pueden ser la forma de presentación de esta enfermedad en muchas ocasiones por lo que siempre han de ser tenidos en cuenta. En este sentido algunos autores han relacionado el SAHS en el anciano con la aparición o empeoramiento de síntomas depresivos37,38, crisis epilépticas39, glaucoma40, nicturia no explicada41, caídas frecuentes42, demencia43,44 y posiblemente también un exceso de eventos cardiovasculares45–48. Por ello es probable que el concepto de elevada, media o baja probabilidad clínica «pretest» que se suele utilizar para clasificar a los pacientes enviados por sospecha clínica de SAHS no sea válido en el grupo de ancianos y deba ser revisado para su utilización en este grupo de edad49.
Diagnóstico del SAHS en el ancianoLa polisomnografía (PSG) completa es el «gold standard» actual para el diagnóstico del SAHS en todas la edades50–52. La gran presión asistencial en los últimos años a causa de la creciente frecuencia de pacientes derivados por sospecha de SAHS y la escasa accesibilidad para algunos centros de la PSG han hecho que hayan proliferado algunos dispositivos que evitan las variables neurofisiológicas, simplificando con ello técnicamente la prueba con una pérdida de eficacia diagnóstica asumible bajo determinadas circunstancias53. Sin embargo, en pacientes con patología cardiopulmonar de base, inestabilidad del sueño, toma de psicotropos capaces de modificar la arquitectura del sueño, la posibilidad de diagnósticos alternativos al SAHS o clínica sugestiva de SAHS a pesar de la negatividad de la prueba de sueño simplificada, se recomienda la realización de un estudio completo mediante PSG53. En el paciente anciano, se reúnen frecuentemente muchas de estas circunstancias que impactan sobre la duración y la arquitectura del sueño, lo que hace que, siempre que sea posible, sea preferible la realización de una PSG completa para el diagnóstico del SAHS54. Por otro lado, la frecuencia de eventos centrales24,25 y la prevalencia de síndrome de piernas inquietas55 en el paciente de edad avanzada son mayores que en el individuo joven lo que suponen otros inconvenientes a la hora de utilizar un dispositivo simplificado, habitualmente no validado para este tipo de eventos o sin posibilidad de electromiogramas tibiales. Aún con ello, y debido a las dificultades logísticas ya comentadas para la realización de una PSG en muchos centros, la realización de una prueba simplificada sería aceptable en algunos casos y circunstancias de falta de accesibilidad o en los ancianos de menor edad con clínica sugestiva de SAHS sin comorbilidades cardiopulmonares significativas o en el seno de estudios epidemiológicos. Si la decisión es la de utilizar un dispositivo simplificado es posible que la realización de estudios domiciliarios tenga una especial relevancia en edades avanzadas dado que permite que el paciente descanse en su ambiente habitual, si bien tiene la desventaja de la menor habilidad del anciano en el manejo del dispositivo y los frecuentes despertares por nicturia o alteraciones neurocognitivas y por lo tanto en un probable aumento de estudios no válidos. A pesar de que la variabilidad noche a noche de los resultados de la PSG es mayor en individuos de edad avanzada56, se acepta que, al igual que en los jóvenes, la realización de una sola PSG completa válida es suficiente para establecer el diagnóstico. La mayoría de estudios en los que se basan los algoritmos diagnósticos de decisión (probabilidad clínica pretest y pruebas diagnósticas) han sido construidos en base a estudios realizados en varones de entre 30–70 años para después ser extrapolados al resto de la población adulta (mujeres y ancianos), por lo que el diagnóstico del SAHS en el anciano, que además suele presentar una clínica atípica, es otro de los retos científicos a resolver en los próximos años. Son necesarios estudios que confirmen la validez de los dispositivos simplificados en esta franja de edad bajo determinadas circunstancias.
Impacto del SAHS en el anciano. Un dilema que continuaExisten muy pocos estudios con un suficiente nivel de evidencia científica que analicen el impacto de la existencia de un exceso de TRS o de síntomas de SAHS en el anciano. Probablemente los principales problemas estriban en que se desconoce cuál es el punto de corte en el IAH que puede ser considerado como patológico, si el IAH es la mejor forma de identificación del SAHS en el anciano, qué porcentaje de TRS son debidos a la propia edad y no impactan negativamente en el anciano o finalmente qué síntomas/signos clínicos debemos tomar en consideración. De estos escasos estudios, las conclusiones que se extraen son confusas y en ocasiones contradictorias.
Impacto sobre la calidad de vidaAlgunos estudios han puesto de manifiesto que tanto la presencia de un exceso de TRS como de hipersomnia diurna, si bien son menos específicos de SAHS en el anciano, son capaces sin embargo de deteriorar la calidad de vida del mismo. Stepnowsky et al57 observaron que el impacto sobre la calidad de vida era evidente a partir de un IAH >15 mientras que Baldwin et al58 en un amplio grupo de 6.440 individuos con una edad media superior de 63 años (aunque no exclusivamente ancianos) en el seno del Sleep Heart Health Study mostraron que este impacto era significativo con un punto de corte por encima de 30 utilizando un cuestionario general de calidad de vida (SF-36). De la misma forma estos autores observaron que la presencia de hipersomnia diurna (Epworth >11) también se relacionaba con un descenso en todas las dimensiones del cuestionario. En este sentido, un estudio reciente realizado sobre 198 pacientes que acudieron por sospecha de SAHS y en los que se confirmó este diagnóstico (98 de ellos mayores de 65 años) comparables según la puntuación del cuestionario de Epworth (alrededor de 12 puntos) y en el IAH (entre 37–40) reveló que aquellas variables que influían de forma significativa en la calidad de vida de los individuos jóvenes por orden de importancia eran la hipersomnia, la edad, el IMC y el IAH, pero que en el anciano el impacto de la presencia de comorbilidades y la propia edad era muy superior al de las variables relacionadas con el SAHS, quedando la hipersomnia en cuarto lugar si bien producía descensos significativos sobre todo en la dimensión física del cuestionario de calidad de vida15. Otros estudios sin embargo no han evidenciado tal relación, así recientemente Kezirian et al no observaron ninguna asociación entre los valores en el cuestionario de Pittsburg (PSQI) o el cuestionario FOSQ y el IAH en 2.849 individuos varones con una edad media de 76,4 años, tras ajustar los resultados por el tiempo total de sueño59.
Impacto cardiovascularDe aquellos estudios que analizan el impacto del SAHS en la esfera cardiovascular, muy pocos están realizados de forma exclusiva en pacientes con edad avanzada. Desde un punto de vista fisiopatológico, Chung et al60 han observado que en individuos mayores de 60 años con SAHS, el IAH se correlacionó con los niveles de proteína C reactiva, conocido factor de riesgo cardiovascular61. En el mismo sentido Roche et al recientemente observaron en 851 pacientes (58,5% mujeres) con una edad media de 68 años, una correlación significativa entre el valor de la PCR y la presencia de un índice de desaturación de la oxihemoglobina (ODI)>10 pero no con el IAH, apoyando el hecho de la importancia de la hipoxemia intermitente en esta asociación62. Por otra parte, Nieto et al63 en una amplia cohorte de pacientes ancianos (n=1.037) de entre 68–96 años extraídos de la cohorte del Sleep Heart Health study/Cardiovascular Health Study mostraron que tanto el IAH como la hipoxemia, especialmente esta última, se asociaron a una disfunción endotelial cuantificada mediante el análisis del flujo de la arteria braquial, si bien esta relación fue especialmente intensa por debajo de los 80 años, lo que pone de evidencia que si bien existe cierta plausibilidad biológica para explicar una posible relación entre el SAHS y un exceso de eventos cardiovasculares entre los ancianos, es posible que a la vez exista algún factor protector o resistente en los individuos de mayor edad al efecto de las apneas e hipoxemia, como ha sido sugerido por algunos autores al intentar explicar la menor mortalidad generada por el SAHS en edades avanzadas64,65 y ratificado en estudios animales66. En el campo de los estudios clínicos realizados exclusivamente en ancianos, algunos autores han observaron que la presencia de TRS centrales (pero no obstructivos) se relacionaron con una peor función cardiaca sistólica y la presencia de fibrilación auricular, mientras que los eventos obstructivos se asociaron con una mayor intensidad a extrasistolia ventricular nocturna67–69. Por último, Endershow et al observaron en 70 individuos (57% mujeres) con una edad media de 74,9 años que la presencia de un IAH >15 se asoció, tras ajustarlo para diferentes variables de confusión, con un incremento en las cifras tensionales nocturnas tanto sistólicas como diastólicas69. Asimismo cabría destacar algunos grandes estudios que analizan el impacto cardiovascular del SAHS y que no excluyen a pacientes de edad avanzada70–72 en los que en general se observa un incremento en el riesgo cardiovascular incluso en pacientes con SAHS leve-moderado, si bien como han puesto de manifiesto análisis a posteriori de alguno de estos estudios, este riesgo parecía más pronunciado en los pacientes con menor edad73. Mención aparte merecen los estudios que analizan la relación entre SAHS y el ictus, dado que esta enfermedad aparece fundamentalmente en ancianos, Muñoz et al analizaron48, tras 6 años de seguimiento, a 394 individuos entre 70–100 años constatando que la presencia de un IAH >30 suponía un riesgo ajustado de ictus 2’5 veces mayor. Los resultados son semejantes en aquellos estudios tanto transversales como longitudinales que no excluyen a los pacientes ancianos pero en los que son predominantes45,46,74–76. Sin embargo otros autores no observan una relación significativa entre un exceso de TRS o de sintomatología de SAHS con una mayor frecuencia de eventos cardiovasculares o hipertensión arterial al analizar cohortes amplias de sujetos con una edad mayor de 60 años77–79.
Impacto sobre la mortalidadEl análisis de la mortalidad general es uno de los factores clave a la hora de valorar el impacto del SAHS sobre los individuos de edad avanzada. Sin embargo, hasta el momento, los resultados ofrecidos por la literatura son contradictorios. Dado que los últimos grandes estudios sobre mortalidad general en SAHS no incluyen a sujetos mayores de 65 años80,81, quizá el estudio de mayor calado sea el liderado por Lavie et al64 sobre 14.583 individuos varones entre 20–95 años seguido durante algo más de 4,5 años en los que observó que la presencia de un IAH>30 (con respecto a los individuos con un IAH<10) presentaban un exceso de mortalidad solo identificable en varones menores de 50 años ajustado por edad e IMC. Una circunstancia sorprendente en este estudio en cualquier caso fue que los individuos de más de 70 años presentaban una mortalidad incluso menor que los individuos de igual edad de la población general. Estos hechos son explicados por los autores por la existencia de algún mecanismo protector de las consecuencias de las apneas en individuos de edad avanzada64,65,73, si bien no puede ser descartado que la diferencia de mortalidad sea debida a diversas limitaciones en la metodología de los estudios relativas a sesgos de gravedad, por diferentes adherencias al tratamiento con CPAP, o por cambios en el número de TRS a lo largo del tiempo en individuos seguidos durante años en el seno de estos estudios en los que se toma el valor del IAH al comienzo del estudio para generar conclusiones al final del mismo tras años de seguimiento. Otros estudios han encontrado resultados semejantes como He et al en su clásico estudio sobre mortalidad, uno de los pioneros sobre el tema, al observar un exceso de mortalidad entre aquellos individuos con un IAH>20, si bien dependiente de la edad dado que solo era significativa en individuos por debajo de los 50 años82 u otros estudios más recientes en los que, si bien observaron un exceso de mortalidad en individuos con un exceso de TRS70,83,84, análisis a posteriori parecen indicar que dicha mortalidad se centra fundamentalmente en individuos de menor edad que no siguieron el tratamiento con CPAP70.
Otros autores, sin embargo, si bien con estudios de menor tamaño, han llegado a conclusiones diferentes. Así, Ancoli-Israel et al85 observaron en 426 individuos que aquellos individuos de entre 65–95 años (edad media al inicio del estudio 72,5 años) con un IAH>30 seguidos durante 11 años presentaban una mayor mortalidad, si bien el IAH no fue un factor directo de mortalidad sino probablemente el exceso de patología cardiovascular que inducía, que sí se relacionó directamente con este exceso de mortalidad. Por otra parte nuestro grupo de trabajo siguió durante 5 años a un grupo de 223 pacientes que habían sufrido un ictus con una edad media superior a los 73 años observando que aquellos con un SAHS no tratado (IAH>20) presentaban una mortalidad entre 1,6–2,7 veces superior al grupo de pacientes sin SAHS o con SAHS tratado de forma efectiva con CPAP45. Resultados semejantes fueron encontrados por Parra et al al seguir durante una media de 2 años a 161 pacientes con una edad media de 72 años que habían sufrido un ictus y observar que por cada incremento de 1 punto en el IAH se evidenciaba un incremento del 5% de mortalidad86.
En resumen, las evidencia actuales invitan a pensar que si bien un exceso de TRS (en especial un IAH>30) supone un incremento en la mortalidad general y especialmente cardiovascular, este efecto es menor en individuos de edad avanzada, en los que este exceso de mortalidad se desvanece. Si bien no podemos descartar sesgos metodológicos, especialmente sesgos de gravedad en los estudios, algunos autores han señalado que la explicación podría residir en que los efectos cardiovasculares del SAHS afectan fundamentalmente a jóvenes en los que podrían producir este exceso de mortalidad y que por lo tanto los individuos de mayor edad serían supervivientes con una menor tasa de mortalidad y de alguna forma resistentes a la acción dañina de las apneas, hipopneas y desestructuración del sueño producido por el SAHS.
Impacto neurocognitivoSi bien la presencia de un SAHS ha demostrado presentar efectos negativos sobre diferentes parámetros neurocognitivos en la población general que mejoran tras el tratamiento con CPAP (vigilancia psicomotora, déficit en el grado de atención, ejecución de labores, capacidad motora, habilidades de construcción, velocidad de respuesta ante estímulos)87,88, nuevamente los resultados de la literatura se muestran contradictorios al estudiar al grupo especifico de ancianos, dado que tanto el deterioro de estas funciones producido por la propia edad como la presencia de enfermedades neurocognitivas en el anciano son en ocasiones variables de confusión insalvables. Phillips et al89,90 observaron tras 3 años de seguimiento en 92 individuos mayores de 50 años que la presencia de un IAH>5 no producía deterioro cognitivo significativo si bien los resultados negativos de este estudio podrían atribuirse a un escaso tiempo de seguimiento y a un punto de corte excesivamente bajo en el IAH. Por otro lado Cohen-Zion et al91 observaron en 140 ancianos, sin embargo, que el IAH se asociaba a un deterioro cognitivo objetivable mediante el cuestionario Mini-Mental. Dentro del apartado de deterioro cognitivo merecen especial atención 2 enfermedades y su relación en el anciano con un exceso de TRS: la demencia (en especial la enfermedad de Alzheimer) y la depresión. Tanto la demencia como un exceso de TRS son muy frecuentes en el anciano por lo que ambas enfermedades puede coexistir en el mismo individuo92,93, si bien más allá del cruce de prevalencias, algunos autores encuentran una relación entre ambas enfermedades con una base fisiopatológica plausible centrada en la fragmentación del sueño y la hipoxia intermitente nocturna94,95. En este sentido, algunos estudios ha observado una relación entre la gravedad del SAHS y la presencia de enfermedad de Alzheimer96,97 con un impacto negativo sobre la memoria en especial en aquellos pacientes portadores del genotipo APOE epsilon498. Por último en relación con el diagnóstico de depresión o síntomas depresivos, si bien se ha relacionado en ancianos con la presencia de un exceso de TRS99,100, no existen hasta la fecha estudios con un suficiente nivel de evidencia que confirmen esta relación. Analizando en conjunto los resultados de la literatura la idea que subyace podría ser que la relación entre el IAH y un impacto negativo sobre la esfera neurocognitiva en el anciano podría producirse a partir de IAH>30, o un índice incluso menor si se acompaña de hipersomnia patológica.
Impacto económicoIndependientemente de las importantes dudas relacionadas con el impacto del SAHS en el individuo anciano, Tarasiuk et al101 demostraron al comparar a 158 ancianos (67–89 años) con 1.166 individuos control más jóvenes (40–64 años) con una proporción 1:1 de pacientes con y sin SAHS y seguidos durante 2 años que aquellos pacientes con SAHS generaban un gasto sanitario previo al diagnóstico 1,8 veces mayor que aquellos individuos sin SAHS y que a su vez los ancianos con SAHS provocaban un gasto 1,9 veces mayor que los jóvenes con SAHS. Un análisis multivariado puso de manifiesto que gran parte del gasto de los ancianos con SAHS se relacionaron con enfermedades cardiovasculares y la toma de psicotropos.
Opciones terapéuticasSi bien en general la evidencia científica alcanzada en el estudio del SAHS en el anciano es escasa, como ya ha sido comentado, en relación a los aspectos terapéuticos es especialmente preocupante. A pesar de que el primer tratamiento con CPAP se prescribió hace ya más de un cuarto de siglo y de que en nuestro país uno de cada 4 estudios de sueño son realizados en individuos mayores de 65 años, con más del 70% de ellos en tratamiento con CPAP30, no existe ningún ensayo clínico que demuestre la efectividad de este tratamiento sobre los aspectos fundamentales referidos a síntomas o efecto sobre la estructura del sueño en pacientes de edad avanzada102. Por ello, las decisiones actuales se basan en la evidencia obtenida a partir de la extrapolación de los resultados de ensayos clínicos sobre la eficacia del tratamiento con CPAP en adultos jóvenes o en aquellos estudios en los que participan también ancianos, pero sin un análisis específico de este grupo de edad. Por ello el Consenso Nacional sobre el SAHS publicado en 2005 acepta que la edad no debe de ser por si sola un obstáculo para el tratamiento con CPAP en pacientes de edad avanzada con SAHS, siempre dentro de límites razonables49, mientras que no aparezcan estudios con un nivel de evidencia suficiente que demuestren lo contrario.
Ensayos clínicos aleatorizadosPara el estudio pormenorizado de la información relevante que ofrece la literatura sobre el efecto del tratamiento con CPAP en el individuo de edad avanzada fue realizada una búsqueda en la base de datos Medline con los siguientes términos: «CPAP or continuous positive airway pressure» en el título del manuscrito restringiendo la búsqueda a los ensayos clínicos aleatorizados en los que participaran de forma exclusiva o parcial individuos de al menos 65 años de edad con elección manual posterior de aquellos relevantes para la presente revisión. La pauta general fue la falta de inclusión de individuos mayores de 60–70 años en los ensayos clínicos y dentro del grupo de estudios en los que sí que estaban incluidos, se observó un mayor número de ellos acerca del efecto de la CPAP sobre diferentes aspectos de la patología cardiovascular en la última década mientras que los estudios relacionados con la efectividad del tratamiento con CPAP sobre la sintomatología relacionada con SAHS se remontaban a unos años anteriores. Fueron finalmente identificados 38 ensayos clínicos relevantes103–141 de los que 8 utilizaron comprimidos como grupo control, 22 usaron sham-CPAP (con presiones por debajo de 2cmH20), 7 compararon la CPAP con un tratamiento conservador y 1 incluyó a individuos sanos como grupo control. Como resultado global podría comentarse que en lo referente al efecto sobre las variables clínicas y de estructura del sueño, en general el tratamiento con CPAP disminuyó de forma significativa el número de TRS, produciendo una normalización de la arquitectura del sueño con disminución de la fase I de sueño superficial e incremento de las fases de sueño profundo. Ello produjo una mejoría en los síntomas relacionados con el SAHS en especial la hipersomnia, salvo en individuos sin hipersomnia valorada mediante pruebas objetivas y en las formas leves de la enfermedad. Más controvertidos resultan los resultados referentes al efecto de la CPAP sobre las variables neurocognitivas en los que algunos estudios muestran mejorías con CPAP y otros no, sobre variables como la memoria, funciones ejecutivas, procesos cognitivos o mantenimiento de la atención. En este sentido, cabe destacar, el estudio de Chong et al113 que observaron una mejoría significativa de la hipersomnia tras 6 semanas de tratamiento con CPAP en 39 pacientes diagnosticados de enfermedad de Alzheimer con una edad media de 78 (7,04) años; rango (53–91), que además mostraron una buena tolerancia al dispositivo de alrededor de 5h/noche. En lo referente al efecto sobre la calidad de vida los resultados también son inconsistentes utilizando como medidas el SF-36, un cuestionario de calidad de vida general o el Functional Outcomes of Sleep Questionnaire (FOSQ) especifico del impacto de la hipersomnia, a pesar de que como ya se ha indicado en general el efecto de la CPAP sobre la medición de la hipersomnia fue positiva.
Dentro del análisis del efecto de la CPAP sobre diferentes aspectos de la esfera cardiovascular se encuentran los 2 únicos estudios que fueron realizados de forma exclusiva en pacientes con más de 60 años. Zhang et al122 incluyeron a pacientes con una rango de edad entre 60–74 años observando que aquellos con SAHS (IAH medio 37 [9,6]) con respecto a controles sanos no presentaban un deterioro de diversas variable analíticas entre los cuales se encontraban el hematocrito, viscosidad sanguínea, agregación plaquetaria, la coagulabilidad sanguínea y los niveles de fibrinógeno. Por otro lado Hsu et al124 no observaron efecto del tratamiento con CPAP sobre la somnolencia, calidad de vida o recuperación neurológica en 30 pacientes con un rango de edad entre 65–81 años con ictus y un IAH >30 tras ser aleatorizados a recibir CPAP o tratamiento conservador durante 8 semanas si bien la adherencia al tratamiento por parte de los pacientes fue muy pobre (media de 1,3h/noche). Para el resto de estudios, que no excluyeron a los ancianos, los resultados son dispares. Algunos estudios muestran descensos en las cifras tensionales sistólicas y/o diastólicas con el tratamiento con CPAP mientras que otros no observan este efectos. Cabe destacar en este sentido 3 estudios españoles finalizados recientemente sobre el efecto de la CPAP sobre diferentes parámetros y que no excluyen a pacientes ancianos. Barbé et al137 y Durán et al138 concluyen un descenso aproximado de 2mmHg en las cifras tensionales, en especial en individuos con buena tolerancia a la CPAP independientemente de los síntomas. Por otro lado Parra et al139 no observaron un efecto apreciable del tratamiento con CPAP sobre la recuperación funcional, calidad de vida y mortalidad a 2 años en un grupo amplio de individuos con una edad media de 64,04 años (rango: 34–80 años) en fase aguda de un ictus. En cualquier caso es necesario recalcar que sería necesario el análisis de la distribución de los pacientes por edades para valorar de forma adecuada los resultados en especial aquellos relacionados con el efecto de la CPAP sobre las cifras de hipertensión arterial y su impacto sobre la morbimortalidad posterior en el anciano.
Estudios observacionalesDe la misma forma que en los ensayos clínicos, existen muy pocos estudios que analicen el efecto de la CPAP en individuos de edad avanzada de forma exclusiva o casi exclusiva utilizando estudios observacionales. La mayoría de ellos se refieren a subgrupos de individuos afectos de enfermedades que impactan sobre todo en edades avanzadas como los trastornos neurocognitivos o la enfermedad cerebrovascular. Aloia et al141 observaron en un grupo reducido de pacientes mayores de 55 años con SAHS (IAH>10) que el uso de CPAP durante 3 meses producía una mejoría de algunos parámetros neuropsicológicos como la capacidad de atención y diferentes habilidades psicomotoras y verbales. Por otra parte, Martínez-García et al15 observaron que a pesar de que el impacto del SAHS sobre la calidad de vida en pacientes mayores de 65 años era menor que en individuos de menor edad, el tratamiento con CPAP mejoró de forma significativa algunos aspectos de la calidad de vida tanto en individuos ancianos como en jóvenes al compararlo con los parámetros de normalidad obtenidos en población general de igual edad y sexo, fundamentalmente a través de una mejoría de la hipersomnia. Desde el punto de vista cardiovascular, además del extenso estudio de Marín et al70 sobre un efecto positivo del tratamiento con CPAP sobre la incidencia de eventos cardiovasculares mortales y no mortales en pacientes con SAHS que toleraron la CPAP, cabe destacar 2 estudios realizados sobre una cohorte acumulada de pacientes tras sufrir un ictus seguidos durante 2 años45 y 5 años46 en los que se observó que el tratamiento con CPAP redujo respectivamente tanto la incidencia de nuevos eventos cardiovasculares (especialmente un segundo ictus) como de mortalidad hasta llegar a unas cifras semejantes a aquellos pacientes sin SAHS o con enfermedad leve.
Cumplimiento de la CPAPUn aspecto importante en el tratamiento con CPAP en el anciano es el nivel de cumplimiento de este tratamiento que pueden alcanzar. El paciente anciano puede presentar una serie de características que se han asociado a un peor cumplimiento como vivir solo, menor sintomatología en especial hipersomnia, menos destreza o alteración de las capacidades cognitivas, comorbilidades, deficiencias neurológicas142. Sin embargo los estudios realizados al respecto han puesto de evidencia que el grado de cumplimiento de la CPAP no es peor que en individuos más jóvenes, incluso en pacientes con deterioro neurocognitivo. Por otro lado Kostikas et al observaron que la presión necesaria en individuos ancianos es de 2,5mmHg menor por término medio para una gravedad de SAHS semejante, quizá reflejo de la menor resistencia las vías aéreas a su dilatación por factores externos por el menor tono muscular de base, o de la mayor distensibilidad pulmonar, lo cual probablemente sea la causa de una adherencia semejante a los jóvenes a pesar de estas características negativas para el cumplimiento143.
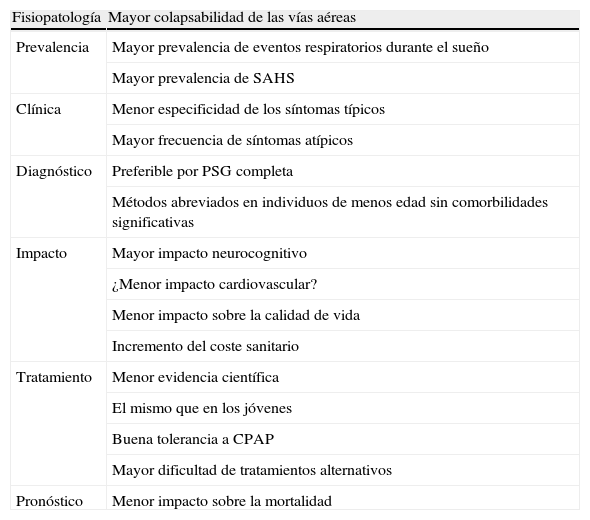
ConclusionesSi bien es digna de admiración y necesaria la investigación básica o aplicada compleja tanto en el SAHS como en otras disciplinas, no debemos ni podemos dejar más de lado la búsqueda de respuestas a preguntas básicas con un impacto directo en nuestra práctica clínica diaria. En este sentido, descubrir qué es y cómo debemos realizar el manejo diagnóstico y terapéutico del SAHS en el anciano es un excelente ejemplo. Por otro lado, acercarse a estas respuestas probablemente no sea especialmente complejo, dado que disponemos de la materia prima: el elevado número de ancianos en nuestro país, y las variables a investigar no son otras que las fundamentales o básicas en un estudio de investigación: impacto, diagnóstico y efecto del tratamiento. Tal y como recomienda tanto el Consenso Nacional sobre SAHS como la reciente Normativa sobre el diagnóstico y tratamiento del SAHS deberíamos tomar en consideración algunos aspectos importantes referentes al SAHS en el anciano: realizar siempre una anamnesis que incluya aspectos específicos del anciano; no considerar que la hipersomnia es un síntoma fisiológico inherente del anciano, ya que una excesiva hipersomnia diurna es siempre patológica independientemente de la edad del paciente y por último no negar métodos diagnósticos o terapéuticos en el paciente con sospecha de SAHS aduciendo motivos relativos únicamente a la edad del paciente (tabla 3). El resto, y hasta que se consiga una mejor evidencia científica, deberemos dejárselo a nuestro sentido común.
Características comparativas del SAHS en los ancianos con respecto a individuos de menor edad
| Fisiopatología | Mayor colapsabilidad de las vías aéreas |
| Prevalencia | Mayor prevalencia de eventos respiratorios durante el sueño |
| Mayor prevalencia de SAHS | |
| Clínica | Menor especificidad de los síntomas típicos |
| Mayor frecuencia de síntomas atípicos | |
| Diagnóstico | Preferible por PSG completa |
| Métodos abreviados en individuos de menos edad sin comorbilidades significativas | |
| Impacto | Mayor impacto neurocognitivo |
| ¿Menor impacto cardiovascular? | |
| Menor impacto sobre la calidad de vida | |
| Incremento del coste sanitario | |
| Tratamiento | Menor evidencia científica |
| El mismo que en los jóvenes | |
| Buena tolerancia a CPAP | |
| Mayor dificultad de tratamientos alternativos | |
| Pronóstico | Menor impacto sobre la mortalidad |
Los autores declaran no tener ningún conflicto de intereses.