El glatirámero acetato (GA) es un copolímero-1 sintético autorizado para el tratamiento de primera línea de la esclerosis múltiple remitente-recurrente (EMRR). Algunos estudios han indicado que el GA modula la respuesta inmunitaria a diferentes niveles, pero nadie ha advertido específicamente de la posibilidad de reactivación de una tuberculosis (TB) latente1.
Un varón de 37 años de edad, ingeniero, fumador activo (10 paquetes/año) y sin otras enfermedades de interés que una EMRR de 6 años de evolución, acudió a nuestra consulta de neumología refiriendo tos productiva, fiebre, dolor torácico pleurítico izquierdo y malestar de una semana de evolución. El paciente recibía tratamiento diario con GA subcutáneo desde el diagnóstico de la EMRR y no tomaba otros medicamentos concomitantes. Entre los antecedentes médicos relevantes destacaba un ciclo de 9 meses de duración de quimioprofilaxis primaria para TB con isoniazida debido a un resultado positivo en una prueba de la tuberculina efectuada en el contexto de un estudio de contacto de TB, 16 años atrás. El paciente negó otros contactos o exposiciones subsiguientes a entornos de alto riesgo. La exploración física fue normal y la analítica reveló una ligera elevación en sangre de los reactantes de fase aguda. La tomografía computarizada de tórax mostró un infiltrado alveolar en el lóbulo superior izquierdo y una cavidad pulmonar de 1,8cm. El frotis de esputo fue positivo para bacilos ácido-alcohol resistentes y se inició tratamiento empírico con 4 fármacos. El cultivo de esputo confirmó la presencia de Mycobacterium tuberculosis (M. tuberculosis), y se constató recuperación completa 6 meses más tarde.
Los mecanismos inmunomoduladores periféricos del GA comprenden la unión a moléculas del complejo mayor de histocompatibilidad de clase II, la alteración de la respuesta inmunológica innata, el antagonismo al receptor de los linfocitos T, la desviación de linfocitos T y la modificación de los linfocitos B1. El GA inhibe la reactividad de los monocitos, modificando la secreción de las células dendríticas y monocitos para producir menos factor de necrosis tumoral (TNF)-α e interleucina (IL)-12 y más IL-10 y factor de crecimiento transformante (TGF)-ß. Estimula la respuesta antiinflamatoria de los linfocitos T-helper (Th)-2 en detrimento de los efectos proinflamatorios de los linfocitos Th1, con la consiguiente disminución de las concentraciones de interferón (IFN)-γ.
Los macrófagos alveolares están involucrados en la defensa inicial frente a la infección de TB. Aunque intervienen diferentes tipos de linfocitos, la principal célula efectora de la inmunidad celular en la TB es el linfocito T-helper. Se ha demostrado en algunos estudios que la respuesta de los pacientes con TB activa es básicamente de tipo Th2, mientras que en pacientes con enfermedad latente es de tipo Th1. La potencia de la respuesta Th1 está directamente relacionada con las manifestaciones clínicas de la enfermedad, pues la TB clínicamente grave y la enfermedad avanzada se asocian a bajas concentraciones de IFN-γ circulante en sangre periférica2. La inhibición del TNF-α y las bajas concentraciones de IL-12, efecto del tratamiento con GA en ambos casos, incrementan el riesgo de enfermedad micobacteriana. El GA también afecta a la activación de los macrófagos, crítica durante el proceso de muerte micobacteriana, puesto que la elevación de las concentraciones de IL-10 y TGF-ß y la reducción de las concentraciones de IFN-γ se asocian a la inactivación y la activación de los macrófagos, respectivamente2.
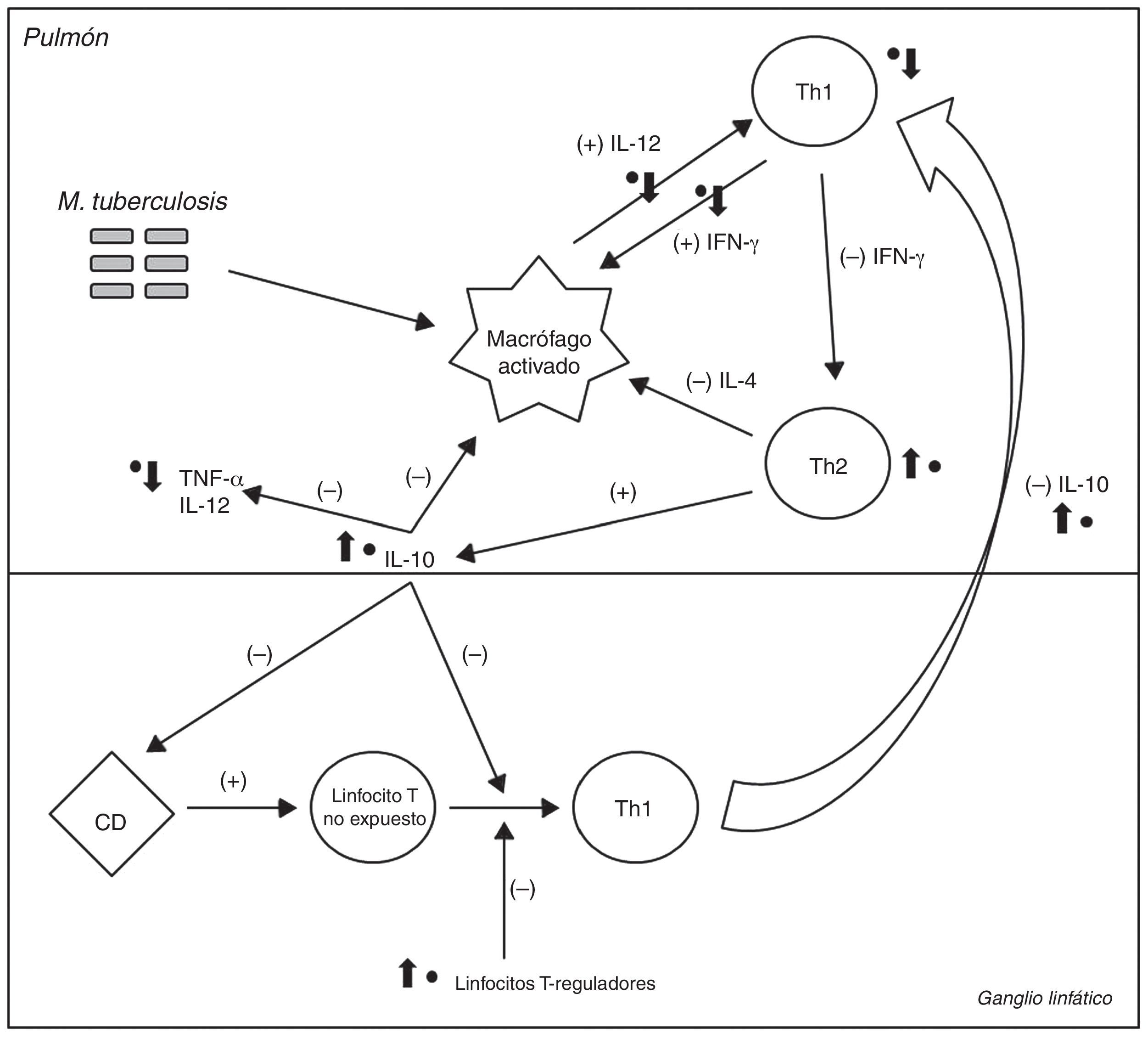
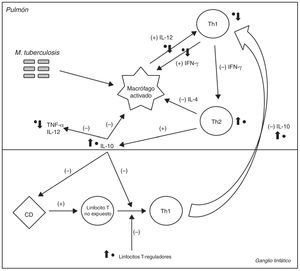
La figura 1 ilustra los diferentes puntos de la respuesta inmunitaria a M. tuberculosis en los que intervendría el GA. Estos efectos podrían inducir un desequilibrio entre los factores pro y antiinflamatorios que controlan la infección tuberculosa, facilitando la reactivación de la enfermedad3.
Esquema simplificado de la respuesta inmunológica celular a la bacteria M. tuberculosis. Los signos (+) y (–) indican la retroalimentación positiva o negativa inducida por cada una de las células o citocinas en condiciones normales. Los puntos negros (●) indican los principales sitios en los que el glatirámero acetato (GA) participa directamente y las flechas indican si induce un efecto de aumento o de disminución. El GA afecta directamente a la activación de macrófagos, inhibiendo la respuesta de linfocitos T-helper 1 (Th1) y reduciendo la concentración de interferón (IFN)-γ circulante, que es fundamental para la activación de estos últimos. También induce una menor producción de interleucina (IL) 12, que amplifica la respuesta de los Th12. La producción de IL-10 se incrementa, lo que inhibe directamente la activación de macrófagos y bloquea los efectos de las células dendríticas (CD) y la diferenciación de linfocitos T no expuestos en linfocitos Th14. Bloquea la migración de linfocitos Th1 desde los ganglios linfáticos hacia los pulmones, e inhibe la expresión y liberación de TNF-α4. Finalmente, el GA estimula a los linfocitos T-reguladores, que también bloquean la respuesta de los linfocitos Th14.
Hasta donde sabemos, este es el primer caso documentado de reactivación de una TB pulmonar en un paciente que recibía tratamiento con GA. El cribado de una posible infección de TB latente podría ser un primer paso importante antes de iniciar tratamiento con GA en pacientes con EMRR.
FinanciaciónLos autores no percibieron financiación alguna para llevar a cabo este estudio.