Evaluar si los cambios en los parámetros bioquímicos del líquido pleural (LP) entre 2 toracocentesis sucesivas permiten predecir derrames pleurales (DP) malignos o benignos.
MétodosEstudio retrospectivo de los pacientes con exudado linfocitario y citología negativa para malignidad que se sometieron a una segunda toracocentesis en nuestro centro durante los últimos 15 años (muestra de derivación), y en los que se alcanzó un diagnóstico final. Las diferencias absolutas (Δa) o porcentuales (Δp) de diferentes parámetros bioquímicos del LP capaces de predecir la naturaleza maligna o benigna del DP en la muestra de derivación se evaluaron en una población independiente.
ResultadosSe incluyeron 214 pacientes con DP (70 malignos y 144 benignos) en la muestra de derivación. Las Δp LDH (lactato deshidrogenasa) >0%, Δp neutrófilos >–10% (cualquier aumento o bien un descenso inferior al 10%), y Δa proteínas <0,1g/dL (cualquier descenso o bien un aumento inferior a 0,1g/dL) entre la segunda y primera toracocentesis mostraron unas odds ratio de 6,4, 3,9 y 2,1 para discriminar DP maligno de benigno, respectivamente. La presencia de las 3 condiciones conjuntamente se asoció con una likelihood ratio positiva de 5,6, mientras que la ausencia de cualquiera ellas se asoció con una likelihood ratio negativa de 0,04 para predecir malignidad. Los resultados se reprodujeron en la población de validación.
ConclusiónEl aumento de LDH y neutrófilos, junto con el descenso de proteínas en una segunda toracocentesis, aumenta la probabilidad de que el origen del DP sea neoplásico, mientras que lo contrario la reduce significativamente.
To assess whether changes in pleural fluid (PF) biochemistries between two consecutive thoracenteses enable clinicians to predict malignant or benign pleural effusions (PE).
MethodsRetrospective study of patients with lymphocytic exudates and negative PF cytology, who underwent a second thoracentesis in our center in the last 15 years in whom a final diagnosis was reached (derivation sample). Absolute (Δa) and percentage differences (Δp) in PF biochemistries which predicted a malignant or benign PE in the derivation sample were evaluated in an independent population (validation sample).
ResultsThe derivation sample included 214 PE patients (70 malignant and 144 benign PE). Δp lactate dehydrogenase (LDH) >0%, Δp neutrophils >–10% (any increase or less than 10% decrease) and Δa protein <0.1g/dL (any increase or less than 0.1g/dL decrease) between the second and the first thoracentesis had an odds ratio of 6.4, 3.9 and 2.1, respectively, to discriminate malignant from benign PE. The presence of the three conditions together had a positive likelihood ratio of 5.6, whereas the absence of any of the 3 parameters had a likelihood ratio of 0.04 for predicting malignancy. These results were reproduced in the validation sample.
ConclusionAn increase in LDH and neutrophils along with a decrease in protein in a second thoracentesis increase the probability of malignant PE, while the opposite reduces it significantly.
El derrame pleural (DP) es un problema médico común con más de 60 causas reconocidas1. El cáncer es la etiología más frecuente de DP que se somete a una toracocentesis, representando cerca del 30% de los casos2. El diagnóstico de DP maligno es definitivo cuando un estudio citológico del líquido pleural (LP) demuestra células neoplásicas. Sin embargo, en un primer análisis esto solo ocurre en el 51% de los casos2. Los análisis de nuevas muestras de LP pueden incrementar la rentabilidad diagnóstica hasta alrededor del 60%, lo que deja un porcentaje significativo de citologías falsamente negativas3. Por otro lado, solo en el 34% de los DP malignos existe un antecedente previo de neoplasia que oriente al clínico sobre la potencial naturaleza maligna del DP4.
Los parámetros bioquímicos del LP constituyen la información disponible más inmediata de este espécimen biológico. El DP maligno es típicamente un exudado con predominio de linfocitos5. En numerosas ocasiones se realiza una segunda toracentesis diagnóstica en espera de los resultados del primer bloque celular o como consecuencia de un análisis citológico negativo en la primera muestra. Si 2 estudios citológicos del LP, que incluyan frotis y bloque celular, son negativos y se sospecha malignidad, es recomendable realizar una toracoscopia diagnóstica5. Sin embargo, al tratarse de una técnica invasiva sería deseable seleccionar aquellos pacientes que puedan beneficiarse de la misma6.
Algunos expertos sugieren que la medición seriada de lactato deshidrogenasa (LDH) en LP puede ser útil en la orientación diagnóstica del paciente con DP de etiología incierta, ya que esta enzima es un indicador fiable del grado de inflamación pleural7. Si al repetir una toracocentesis se observa que los niveles de LDH se elevan progresivamente, el grado de inflamación en el espacio pleural está aumentando y deberíamos persistir en la búsqueda de un diagnóstico preciso. Sin embargo, si los niveles de LDH se reducen, el proceso probablemente se esté resolviendo y podríamos evitar procedimientos diagnósticos invasivos. No obstante, este razonamiento está basado en la opinión de expertos y ningún estudio lo ha corroborado.
El objetivo de este estudio fue evaluar y validar la utilidad de los cambios de la LDH y de otras variables bioquímicas del LP en sucesivas toracocentesis, como predictores de DP maligno o benigno. Esto podría ayudar a seleccionar a los pacientes que precisarían de la búsqueda intensiva de un diagnóstico definitivo mediante procedimientos como la toracoscopia.
Material y métodosSelección de pacientesSe trata de un estudio retrospectivo, que incluyó a todos los pacientes consecutivos con DP atendidos en el Hospital Universitario Arnau de Vilanova de Lleida desde enero de 2001 hasta diciembre de 2016, que cumplían las siguientes características (muestra de derivación): a) se habían sometido al menos a 2 toracocentesis diagnósticas, de las que se disponía de los datos bioquímicos del LP (en caso de 3 o más toracocentesis, solo se consideraron las 2 primeras); b) el LP de la primera toracocentesis era un exudado (según los criterios de Light8) con >50% de linfocitos en el recuento leucocitario y citología negativa para malignidad, y c) se alcanzó un diagnóstico definitivo de la causa del DP o bien este se consideró idiopático (ver definición más adelante). El Hospital Universitario Arnau de Vilanova es un hospital de referencia con 440 camas, que atiende a una población potencial de 450.000 habitantes, y en el que se efectúan unas 400 toracocentesis diagnósticas al año.
Según el diagnóstico final, se clasificó a los pacientes en 2 grupos: DP malignos y DP benignos. A su vez, estos últimos se subdividieron en idiopáticos y de otras etiologías. Los cambios absolutos y relativos de las variables bioquímicas del LP entre 2 toracocentesis sucesivas considerados significativos en la muestra de derivación se validaron en una población, con los mismos criterios de inclusión, atendida en el Hospital de Mendaro desde enero de 1995 hasta agosto de 2015 (muestra de validación). Se trata de un hospital comarcal de 125 camas, que da cobertura sanitaria a 80.000 habitantes y donde se realizan alrededor de 50 toracocentesis diagnósticas anuales.
Se recogieron las siguientes variables: datos demográficos (sexo y edad); fecha de ambas toracocentesis; concentraciones séricas de proteínas y LDH; y recuento de hematíes y leucocitos, porcentaje de neutrófilos y linfocitos, y concentraciones de glucosa, LDH, proteínas, adenosina desaminasa (ADA), pH y proteína C reactiva (PCR) en LP. El comité de ética local aprobó el protocolo del estudio (CEIC-1592).
Criterios diagnósticosSe consideró que un DP era maligno cuando se identificaban células malignas en el LP o en la biopsia pleural. El DP secundario a insuficiencia cardiaca se diagnosticó basándose en la historia clínica, examen físico, radiografía de tórax, electrocardiograma, ecocardiograma (si estaba disponible) y una respuesta adecuada al tratamiento diurético. El diagnóstico de tuberculosis pleural confirmada requirió el aislamiento del bacilo tuberculoso en muestras de esputo, LP o biopsia pleural; o bien la demostración de granulomas en esta última. Se consideró que la tuberculosis pleural era probable en pacientes con un exudado linfocitario y ADA en LP ≥35U/L, cuyo DP se resolvía con tratamiento antituberculoso. Los DP paraneumónicos fueron aquellos que se asociaron con una neumonía, bronquiectasias o absceso pulmonar. Finalmente, un DP se clasificó como idiopático cuando se resolvió sin ningún tratamiento específico y su etiología no se pudo determinar a pesar de un estudio exhaustivo que incluyó análisis del LP (bioquímico, citológico), una tomografía computarizada (TC) toracoabdominal y, en casos seleccionados, una biopsia pleural. Otros diagnósticos se establecieron según criterios clínicos ampliamente aceptados2. Todos los pacientes con enfermedades pleurales benignas disponían de un seguimiento clínico hasta la resolución completa del DP que, en el caso de los DP idiopáticos, fue de al menos un año.
Análisis del líquido pleuralEl LP de la población de derivación se recogió en tubos heparinizados de 5mL y el análisis bioquímico se realizó inmediatamente después de la toracocentesis en un analizador automático, usando métodos estandarizados espectrofotométricos (Hitachi 717 y 911 o Hitachi Modular DP, Roche Diagnostics, Mannheim, Alemania) hasta agosto de 2013; posteriormente, se cambió a un analizador AU5800 de Beckman Coulte (Brea, CA, EE.UU.). El pH se analizó en una máquina de gasometría arterial y la ADA se midió con métodos cinéticos automatizados. El recuento celular del LP se efectuó manualmente en una cámara de recuento Thoma hasta febrero de 2012 y posteriormente con contadores automáticos (Sysmex XN-2000 y Sysmex XN-350; Roche Diagnostics, Mannheim, Alemania).
En la población de validación, el LP se recogió en tubos Falcon de 15mL que contenían 1mL de heparina. Las variables bioquímicas se analizaron con un autoanalizador Cobas 6000 (Roche Diagnostics, Mannheim, Alemania). Para la medición del pH se utilizó una máquina de gasometría arterial y la ADA también se midió con métodos cinéticos automatizados. El recuento celular del LP hasta diciembre de 2016 se efectuó en una cámara de recuento Neubauer Improved y, posteriormente, de forma automática (Sysmex SN-2000 y Sysmex XN-350, Roche Diagnostics, Mannheim, Alemania).
Análisis estadísticoLas variables categóricas se expresaron con números absolutos (porcentajes) y las continuas con medianas (percentiles 25 y 75), comparándose entre DP malignos y benignos con las pruebas exacta de Fisher y Mann-Whitney, respectivamente. La comparación de variables entre los DP malignos, idiopáticos y otros benignos se realizó con las pruebas exacta de Fisher y Kruskall-Wallis, según correspondiera.
Para la comparación de los parámetros bioquímicos entre una primera y una segunda toracocentesis se utilizó la prueba de Wilcoxon. Para aquellas variables que mostraron diferencias significativas entre las 2 toracocentesis en cualquiera de los grupos etiológicos (maligno, idiopático u otros benignos), se calcularon tanto las diferencias absolutas (Δa=valor de la variable en la segunda toracocentesis menos el valor de la variable en la primera toracocentesis) como las porcentuales (Δp=valor de la variable en la segunda toracocentesis menos el valor de la variable en la primera toracocentesis, dividido por el valor de la variable en la primera toracocentesis).
Un análisis del área bajo la curva (ABC) de eficacia diagnóstica ayudó a elegir el mejor punto de corte de las variables continuas (Δa y Δp) capaz de predecir un DP maligno o benigno. Un análisis multivariante de regresión logística, que incluyó las Δa o Δp en forma dicotómica de las variables bioquímicas significativas en el análisis bivariante, calculó las odds ratio (OR) de las Δa y Δp para identificar la naturaleza maligna o benigna del DP. Las características operativas de las Δa y Δp se calcularon a través de una tabla de contingencia 2×2 (sensibilidad, especificidad, likelihood ratio [LR] positiva y negativa) tanto para la población de derivación como de validación. La significación estadística se estableció para una p≤0,05. Todos los análisis se realizaron con el paquete estadístico SPSS versión 24.0 (Chicago, IL, EE.UU.).
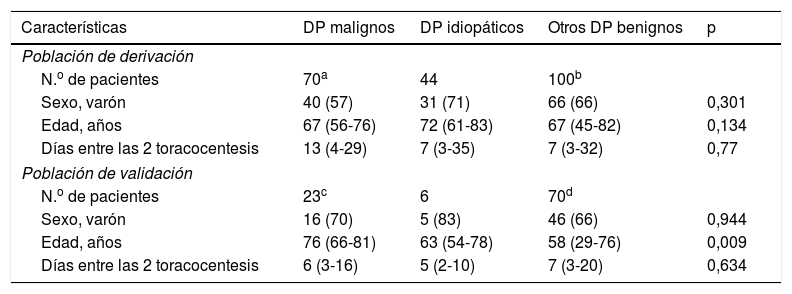
ResultadosCaracterísticas de la población de estudioEn la muestra de derivación se incluyeron 214 pacientes; cifra que representó el 12% de todos los sujetos con exudado linfocitario evaluados en nuestro centro durante el periodo de estudio. Setenta (33%) tenían un DP maligno, siendo los tumores más frecuentes el cáncer de pulmón (19, 27%), mama (14, 20%) y mesotelioma (10, 14%). El diagnóstico final de malignidad se obtuvo mediante estudios citológicos ulteriores del LP (41 pacientes), estudio fenotípico celular del LP por citometría de flujo (3 pacientes), biopsia pleural dirigida por TC (11 pacientes), biopsia pleural guiada por ecografía (6 pacientes) y biopsia pleural toracoscópica (9 pacientes). De los 144 DP benignos, 44 (31%) se clasificaron como idiopáticos. De estos últimos, solo se realizó biopsia pleural en 11 (25%); en 28 (64%) la biopsia se consideró un procedimiento de riesgo (y no se realizó) por la presencia de un DP que ocupaba un tercio o menos del hemitórax.
La muestra de validación incluyó 99 pacientes (esto es, el 15% de todos los exudados linfocitarios diagnosticados en el hospital correspondiente durante el periodo de estudio). De ellos, 23 se diagnosticaron de DP maligno mediante estudios citológicos posteriores del LP (6 pacientes), inmunofenotipo celular del LP por citometría de flujo (3 pacientes) y biopsia toracoscópica (14 pacientes). En la tabla 1 se exponen las características de las poblaciones de derivación y validación. No hubo diferencias en los días transcurridos entre las 2 toracocentesis en los diferentes grupos etiológicos de DP. Tampoco las hubo entre las poblaciones de derivación y validación consideradas globalmente (medianas de 8 [3-31] vs. 6 [3-16] días, p=0,132), o por grupos etiológicos: DP malignos (medianas de 13 [4-29] vs. 6 [3-16] días, p=0,147), y DP benignos (medianas de 7 [3-33] vs. 6 [3-18] días, p=0,389).
Características de la población de estudio
| Características | DP malignos | DP idiopáticos | Otros DP benignos | p |
|---|---|---|---|---|
| Población de derivación | ||||
| N.o de pacientes | 70a | 44 | 100b | |
| Sexo, varón | 40 (57) | 31 (71) | 66 (66) | 0,301 |
| Edad, años | 67 (56-76) | 72 (61-83) | 67 (45-82) | 0,134 |
| Días entre las 2 toracocentesis | 13 (4-29) | 7 (3-35) | 7 (3-32) | 0,77 |
| Población de validación | ||||
| N.o de pacientes | 23c | 6 | 70d | |
| Sexo, varón | 16 (70) | 5 (83) | 46 (66) | 0,944 |
| Edad, años | 76 (66-81) | 63 (54-78) | 58 (29-76) | 0,009 |
| Días entre las 2 toracocentesis | 6 (3-16) | 5 (2-10) | 7 (3-20) | 0,634 |
Las variables se expresan con n (%) o mediana (cuartiles 25-75).
DP: derrame pleural.
Cáncer de pulmón, 19; mama, 14; mesotelioma, 10; linfoma, 7; origen desconocido, 4; ovario, 4; páncreas, 3; gástrico, 2; colon, 2; endometrio, 2; riñón, 1; próstata, 1; hepatocarcinoma, 1.
Tuberculosis, 33 (19 probables y 14 confirmadas); insuficiencia cardiaca, 24; pericarditis, 14; poscirugía, 9; paraneumónicos, 7; conectivopatías, 4; secundario a absceso hepático, 2; pancreatitis aguda, 2; uremia, 2; postraumático, 1; quilotórax yatrógeno, 1; atelectasia, 1.
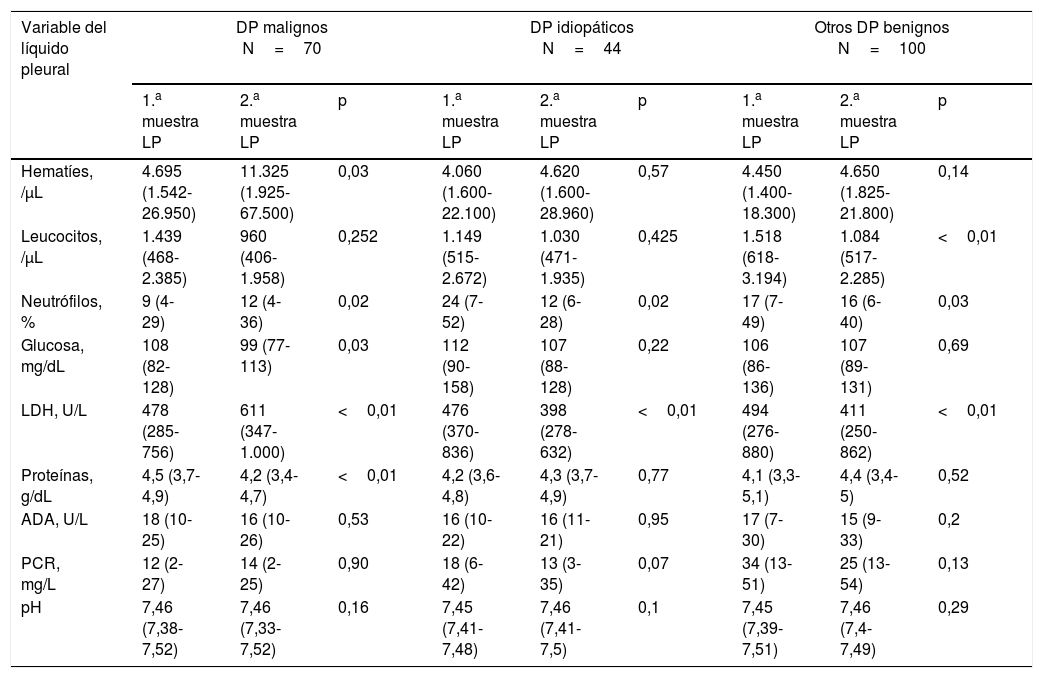
Como se observa en la tabla 2, el porcentaje de neutrófilos y las concentraciones de LDH en LP fueron inferiores en una segunda toracocentesis, respecto a la inicial, en el subgrupo de DP idiopáticos (12% vs. 24%, p=0,02; y 398U/L vs. 476U/L, p<0,01) y resto de DP benignos (16% vs. 17%, p=0,03; y 411U/L vs. 494U/L, p<0,01), mientras que aumentaron en el grupo de DP malignos (12% vs. 9%, p=0,02; y 611U/L vs. 478U/L, p<0,01). Solo en el grupo de DP malignos se observó un aumento del número de hematíes, y un descenso de las concentraciones de glucosa y proteínas en la segunda muestra de LP en comparación con la primera (11.325/μL vs. 4.695/μL, p=0,03; 99mg/dL vs. 108mg/dL, p=0,03; y 4,2g/dL vs. 4,5g/dL, p<0,01, respectivamente). En el grupo de otros DP benignos se observó también un descenso de leucocitos en la segunda toracocentesis (1.084/μL vs. 1.518/μL, p<0,01). Otras variables bioquímicas (ADA, pH y PCR) no mostraron diferencias entre las 2 toracocentesis, por lo que se descartaron como posibles predictoras de DP maligno.
Comparación de variables del líquido pleural entre 2 toracocentesis consecutivas (población de derivación)
| Variable del líquido pleural | DP malignos N=70 | DP idiopáticos N=44 | Otros DP benignos N=100 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 1.a muestra LP | 2.a muestra LP | p | 1.a muestra LP | 2.a muestra LP | p | 1.a muestra LP | 2.a muestra LP | p | |
| Hematíes, /μL | 4.695 (1.542-26.950) | 11.325 (1.925-67.500) | 0,03 | 4.060 (1.600-22.100) | 4.620 (1.600-28.960) | 0,57 | 4.450 (1.400-18.300) | 4.650 (1.825-21.800) | 0,14 |
| Leucocitos, /μL | 1.439 (468-2.385) | 960 (406-1.958) | 0,252 | 1.149 (515-2.672) | 1.030 (471-1.935) | 0,425 | 1.518 (618-3.194) | 1.084 (517-2.285) | <0,01 |
| Neutrófilos, % | 9 (4-29) | 12 (4-36) | 0,02 | 24 (7-52) | 12 (6-28) | 0,02 | 17 (7-49) | 16 (6-40) | 0,03 |
| Glucosa, mg/dL | 108 (82-128) | 99 (77-113) | 0,03 | 112 (90-158) | 107 (88-128) | 0,22 | 106 (86-136) | 107 (89-131) | 0,69 |
| LDH, U/L | 478 (285-756) | 611 (347-1.000) | <0,01 | 476 (370-836) | 398 (278-632) | <0,01 | 494 (276-880) | 411 (250-862) | <0,01 |
| Proteínas, g/dL | 4,5 (3,7-4,9) | 4,2 (3,4-4,7) | <0,01 | 4,2 (3,6-4,8) | 4,3 (3,7-4,9) | 0,77 | 4,1 (3,3-5,1) | 4,4 (3,4-5) | 0,52 |
| ADA, U/L | 18 (10-25) | 16 (10-26) | 0,53 | 16 (10-22) | 16 (11-21) | 0,95 | 17 (7-30) | 15 (9-33) | 0,2 |
| PCR, mg/L | 12 (2-27) | 14 (2-25) | 0,90 | 18 (6-42) | 13 (3-35) | 0,07 | 34 (13-51) | 25 (13-54) | 0,13 |
| pH | 7,46 (7,38-7,52) | 7,46 (7,33-7,52) | 0,16 | 7,45 (7,41-7,48) | 7,46 (7,41-7,5) | 0,1 | 7,45 (7,39-7,51) | 7,46 (7,4-7,49) | 0,29 |
Las variables se expresan como medianas (cuartiles 25-75).
ADA: adenosina desaminasa; DP: derrame pleural; LDH: lactato deshidrogenasa; LP: líquido pleural; PCR: proteína C reactiva.
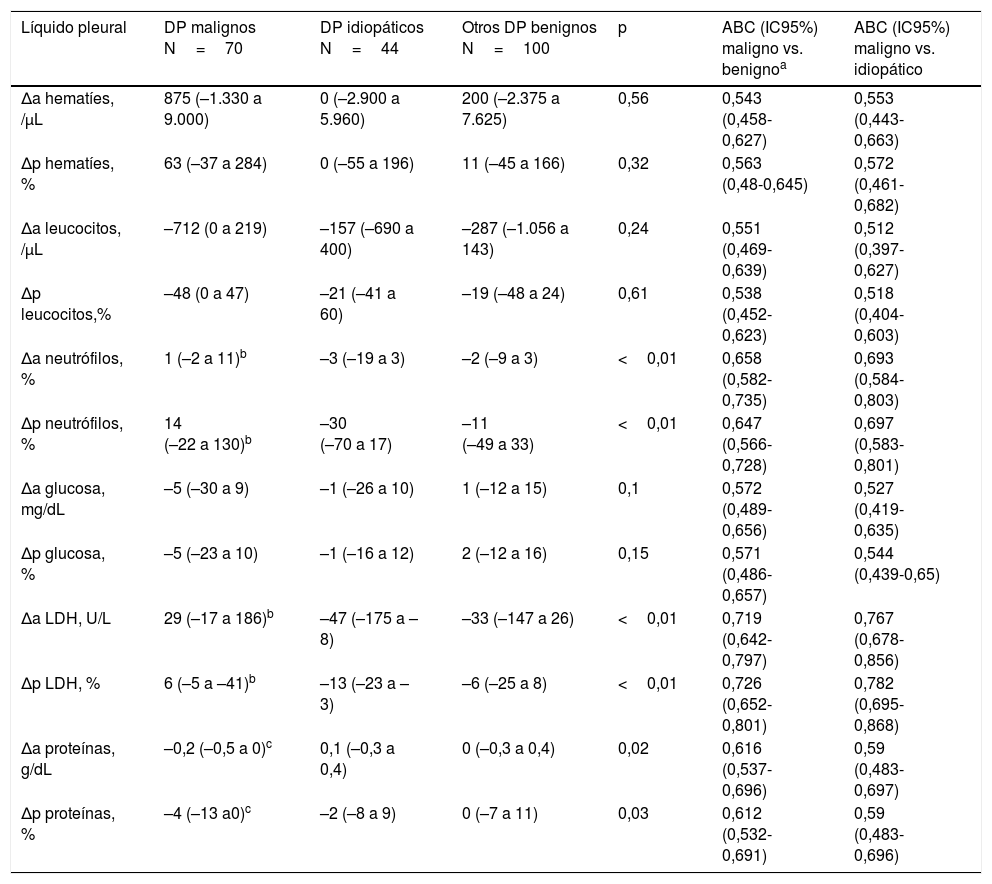
Se analizaron las Δa y Δp de las variables bioquímicas del LP que habían sido significativamente diferentes entre las 2 toracocentesis (tabla 3). Las que mejor discriminaron entre un DP maligno y un DP benigno (incluyendo los DP idiopáticos) fueron: la Δp de LDH (ABC de 0,73, intervalo de confianza del 95% [IC95%]: 0,65-0,8), la Δp de neutrófilos (ABC de 0,65, IC95%: 0,57-0,73) y la Δa de proteínas (ABC de 0,61, IC95%: 0,54-0,7).
Medianas (25 y 75 percentiles) de las diferencias absolutas y porcentuales de variables bioquímicas del líquido pleural entre 2 toracocentesis sucesivas (población de derivación)
| Líquido pleural | DP malignos N=70 | DP idiopáticos N=44 | Otros DP benignos N=100 | p | ABC (IC95%) maligno vs. benignoa | ABC (IC95%) maligno vs. idiopático |
|---|---|---|---|---|---|---|
| Δa hematíes, /μL | 875 (–1.330 a 9.000) | 0 (–2.900 a 5.960) | 200 (–2.375 a 7.625) | 0,56 | 0,543 (0,458-0,627) | 0,553 (0,443-0,663) |
| Δp hematíes, % | 63 (–37 a 284) | 0 (–55 a 196) | 11 (–45 a 166) | 0,32 | 0,563 (0,48-0,645) | 0,572 (0,461-0,682) |
| Δa leucocitos, /μL | –712 (0 a 219) | –157 (–690 a 400) | –287 (–1.056 a 143) | 0,24 | 0,551 (0,469-0,639) | 0,512 (0,397-0,627) |
| Δp leucocitos,% | –48 (0 a 47) | –21 (–41 a 60) | –19 (–48 a 24) | 0,61 | 0,538 (0,452-0,623) | 0,518 (0,404-0,603) |
| Δa neutrófilos, % | 1 (–2 a 11)b | –3 (–19 a 3) | –2 (–9 a 3) | <0,01 | 0,658 (0,582-0,735) | 0,693 (0,584-0,803) |
| Δp neutrófilos, % | 14 (–22 a 130)b | –30 (–70 a 17) | –11 (–49 a 33) | <0,01 | 0,647 (0,566-0,728) | 0,697 (0,583-0,801) |
| Δa glucosa, mg/dL | –5 (–30 a 9) | –1 (–26 a 10) | 1 (–12 a 15) | 0,1 | 0,572 (0,489-0,656) | 0,527 (0,419-0,635) |
| Δp glucosa, % | –5 (–23 a 10) | –1 (–16 a 12) | 2 (–12 a 16) | 0,15 | 0,571 (0,486-0,657) | 0,544 (0,439-0,65) |
| Δa LDH, U/L | 29 (–17 a 186)b | –47 (–175 a –8) | –33 (–147 a 26) | <0,01 | 0,719 (0,642-0,797) | 0,767 (0,678-0,856) |
| Δp LDH, % | 6 (–5 a –41)b | –13 (–23 a –3) | –6 (–25 a 8) | <0,01 | 0,726 (0,652-0,801) | 0,782 (0,695-0,868) |
| Δa proteínas, g/dL | –0,2 (–0,5 a 0)c | 0,1 (–0,3 a 0,4) | 0 (–0,3 a 0,4) | 0,02 | 0,616 (0,537-0,696) | 0,59 (0,483-0,697) |
| Δp proteínas, % | –4 (–13 a0)c | –2 (–8 a 9) | 0 (–7 a 11) | 0,03 | 0,612 (0,532-0,691) | 0,59 (0,483-0,696) |
Δa: diferencia absoluta (ver definición en texto); Δp: diferencia porcentual (ver definición en texto); ABC: área bajo la curva ROC; IC95%: intervalo de confianza al 95%; DP: derrame pleural; LDH: lactato deshidrogenasa.
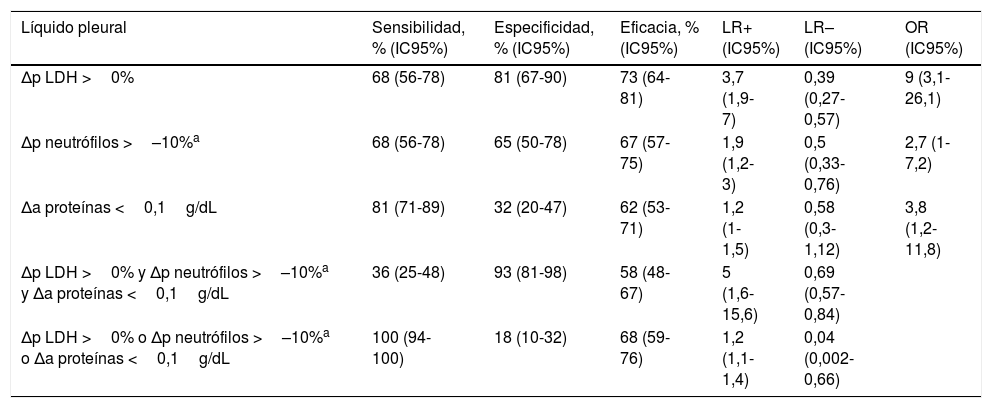
Los mejores puntos de corte de estas Δa o Δp para discriminar entre DP maligno y DP benigno fueron: Δp LDH >0% (es decir, cualquier aumento de LDH en una segunda toracocentesis), Δp neutrófilos >–10% (es decir, cualquier aumento o bien una disminución que no alcanzase el 10%) y Δa proteínas <0,1g/dL (es decir, cualquier descenso o bien un incremento que no superase 0,1g/dL). En este sentido, y según un modelo multivariante, la Δp LDH >0% mostró una OR de 6,4 (IC95%: 3,1-12,9); la Δp neutrófilos >–10% una OR de 2,1 (IC95%: 1-4,2) y la Δa proteínas <0,1g/dL una OR de 3,9 (IC95%: 1,7-8,9) para identificar malignidad. El mismo análisis entre DP malignos vs. idiopáticos ofreció los siguientes resultados: Δp LDH >0%, OR de 9 (IC95%: 3,1-26,1); Δp neutrófilos >–10%, OR de 2,7 (IC95%: 1-7,2); y Δa proteínas <0,1g/dL, OR de 3,8 (IC95%: 1,2-11,8).
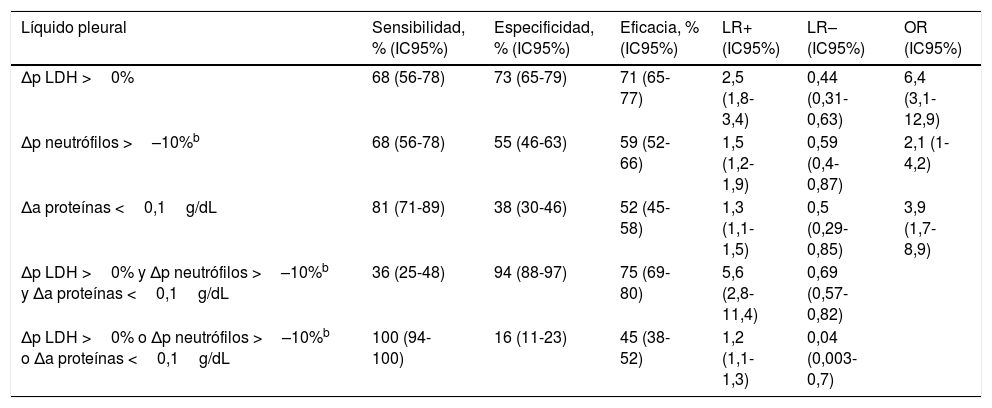
En la tabla 4 se muestran las características operativas de las variables seleccionadas como predictoras de DP maligno versus benigno. Las Δp LDH, Δp neutrófilos y Δa proteínas no fueron útiles de forma individual. Sin embargo, sí lo fueron las combinaciones de las 3 variables. De este modo, una combinación en «y» de las mismas (esto es, la presencia conjunta de Δp LDH >0%, Δp neutrófilos >–10% y Δa proteínas <0,1g/dL) mostró una LR positiva de 5,6 (IC95%: 2,8-11,4). Por otro lado, con las combinaciones utilizando una regla en «o» (se debe cumplir al menos una de las condiciones de la tríada) las LR negativas fueron de 0,04 (IC95%: 0,003-0,7). Se observaron resultados similares para la discriminación entre DP maligno y DP idiopático (tabla 5).
Características operativas de las diferencias absolutas o porcentuales de diversos parámetros bioquímicos del líquido pleural para discriminar derrames malignos vs. benignosa (población de derivación)
| Líquido pleural | Sensibilidad, % (IC95%) | Especificidad, % (IC95%) | Eficacia, % (IC95%) | LR+ (IC95%) | LR– (IC95%) | OR (IC95%) |
|---|---|---|---|---|---|---|
| Δp LDH >0% | 68 (56-78) | 73 (65-79) | 71 (65-77) | 2,5 (1,8-3,4) | 0,44 (0,31-0,63) | 6,4 (3,1-12,9) |
| Δp neutrófilos >–10%b | 68 (56-78) | 55 (46-63) | 59 (52-66) | 1,5 (1,2-1,9) | 0,59 (0,4-0,87) | 2,1 (1-4,2) |
| Δa proteínas <0,1g/dL | 81 (71-89) | 38 (30-46) | 52 (45-58) | 1,3 (1,1-1,5) | 0,5 (0,29-0,85) | 3,9 (1,7-8,9) |
| Δp LDH >0% y Δp neutrófilos >–10%b y Δa proteínas <0,1g/dL | 36 (25-48) | 94 (88-97) | 75 (69-80) | 5,6 (2,8-11,4) | 0,69 (0,57-0,82) | |
| Δp LDH >0% o Δp neutrófilos >–10%b o Δa proteínas <0,1g/dL | 100 (94-100) | 16 (11-23) | 45 (38-52) | 1,2 (1,1-1,3) | 0,04 (0,003-0,7) |
Δa: diferencia absoluta; Δp: diferencia porcentual; IC95%: intervalo de confianza al 95%; LDH: lactato deshidrogenasa; LR: likelihood ratio; OR: odds ratio.
Características operativas de las diferencias absolutas o porcentuales de diversos parámetros bioquímicos del líquido pleural para discriminar derrames malignos vs. idiopáticos (población de derivación)
| Líquido pleural | Sensibilidad, % (IC95%) | Especificidad, % (IC95%) | Eficacia, % (IC95%) | LR+ (IC95%) | LR– (IC95%) | OR (IC95%) |
|---|---|---|---|---|---|---|
| Δp LDH >0% | 68 (56-78) | 81 (67-90) | 73 (64-81) | 3,7 (1,9-7) | 0,39 (0,27-0,57) | 9 (3,1-26,1) |
| Δp neutrófilos >–10%a | 68 (56-78) | 65 (50-78) | 67 (57-75) | 1,9 (1,2-3) | 0,5 (0,33-0,76) | 2,7 (1-7,2) |
| Δa proteínas <0,1g/dL | 81 (71-89) | 32 (20-47) | 62 (53-71) | 1,2 (1-1,5) | 0,58 (0,3-1,12) | 3,8 (1,2-11,8) |
| Δp LDH >0% y Δp neutrófilos >–10%a y Δa proteínas <0,1g/dL | 36 (25-48) | 93 (81-98) | 58 (48-67) | 5 (1,6-15,6) | 0,69 (0,57-0,84) | |
| Δp LDH >0% o Δp neutrófilos >–10%a o Δa proteínas <0,1g/dL | 100 (94-100) | 18 (10-32) | 68 (59-76) | 1,2 (1,1-1,4) | 0,04 (0,002-0,66) |
Δa: diferencia absoluta; Δp: diferencia porcentual; IC95%: intervalo de confianza al 95%; LDH: lactato deshidrogenasa; LR: likelihood ratio; OR: odds ratio.
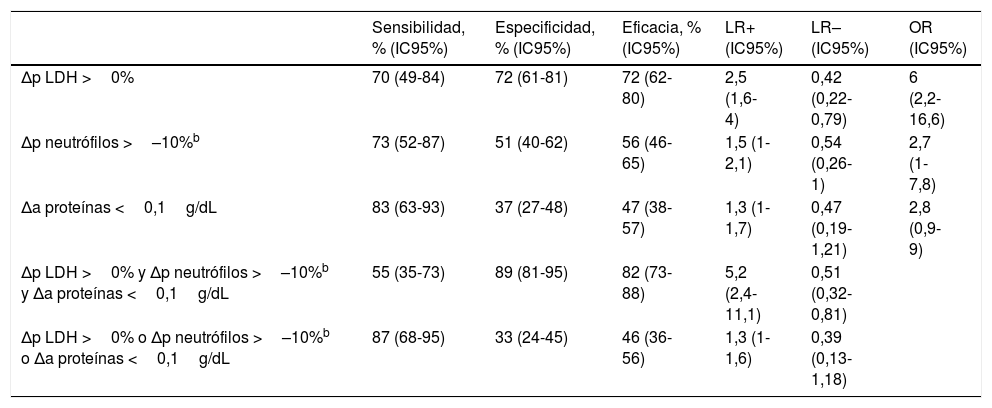
En la población de validación no se consideró al grupo de DP idiopáticos como independiente puesto que solo incluyó 6 pacientes. Como muestra la tabla 6, la combinación de las 3 variables predictoras de DP maligno utilizando una regla en «y» mostró una LR positiva de 5,2 (IC95%: 2,4-11,1), mientras que con el empleo de una regla en «o» la LR negativa fue de 0,39 (IC95%: 0,13-1,18); confirmándose, al menos por lo que respecta a la combinación en «y», los resultados obtenidos en la población de derivación.
Características operativas de las diferencias absolutas o porcentuales de diversos parámetros bioquímicos del líquido pleural para discriminar derrames malignos vs. benignosa (población de validación)
| Sensibilidad, % (IC95%) | Especificidad, % (IC95%) | Eficacia, % (IC95%) | LR+ (IC95%) | LR– (IC95%) | OR (IC95%) | |
|---|---|---|---|---|---|---|
| Δp LDH >0% | 70 (49-84) | 72 (61-81) | 72 (62-80) | 2,5 (1,6-4) | 0,42 (0,22-0,79) | 6 (2,2-16,6) |
| Δp neutrófilos >–10%b | 73 (52-87) | 51 (40-62) | 56 (46-65) | 1,5 (1-2,1) | 0,54 (0,26-1) | 2,7 (1-7,8) |
| Δa proteínas <0,1g/dL | 83 (63-93) | 37 (27-48) | 47 (38-57) | 1,3 (1-1,7) | 0,47 (0,19-1,21) | 2,8 (0,9-9) |
| Δp LDH >0% y Δp neutrófilos >–10%b y Δa proteínas <0,1g/dL | 55 (35-73) | 89 (81-95) | 82 (73-88) | 5,2 (2,4-11,1) | 0,51 (0,32-0,81) | |
| Δp LDH >0% o Δp neutrófilos >–10%b o Δa proteínas <0,1g/dL | 87 (68-95) | 33 (24-45) | 46 (36-56) | 1,3 (1-1,6) | 0,39 (0,13-1,18) |
Δa: diferencia absoluta; Δp: diferencia porcentual; IC95%: intervalo de confianza al 95%; LDH: lactato deshidrogenasa; LR: likelihood ratio; OR: odds ratio.
Los datos de este estudio muestran que un exudado linfocitario con una primera citología negativa tiene mayor probabilidad de ser maligno si concurren en un segundo análisis bioquímico las siguientes 3 características: Δp LDH >0%, Δp neutrófilos >–10% y Δa proteínas <0,1g/dL.
Varios estudios han tratado de buscar predictores de DP maligno. Harris et al.9, en una serie de 198 toracoscopias (98 pacientes con DP maligno y 100 con DP benigno), observaron que los pacientes con DP maligno tenían con más frecuencia una historia previa de neoplasia, eran mayores de 50 años, y mostraban un LP hemático y con mayores concentraciones de LDH (647U/L vs. 192U/L vs. 308U/L en DP malignos, idiopáticos y otros benignos, respectivamente, p=0,02). Posteriormente, Ferrer et al.6 publicaron una serie de 93 toracoscopias realizadas a pacientes con DP de etiología incierta después de al menos un estudio bioquímico y citológico de LP, una radiografía y una TC de tórax. La toracoscopia demostró neoplasia en 50 casos. Los predictores de DP maligno en contraposición a las etiologías benignas (en su mayoría DP idiopáticos o asbestósicos benignos) fueron: una TC torácica con datos sugestivos de neoplasia, un LP hemático, un periodo sintomático superior a 30 días y la ausencia de fiebre. Si se cumplían conjuntamente estas 4 condiciones, el ABC para identificar un DP maligno fue de 0,95 (IC95%: 0,91-0,99). Sin embargo, 6 pacientes que habían sido catalogados como benignos por la toracoscopia (también mediante el análisis de los predictores) desarrollaron una neoplasia durante el seguimiento. Por otro lado, Alemán et al.10 no encontraron ningún parámetro bioquímico del LP que ayudase a diferenciar entre DP maligno y DP idiopático, aunque se valoró una única toracocentesis.
Chung et al.11 realizaron toracocentesis durante 3 días consecutivos a 26 pacientes con DP maligno con el objetivo de evaluar el efecto de este procedimiento sobre las características del LP. Objetivaron, como en nuestro estudio, un descenso en los niveles de proteínas y un aumento de neutrófilos, sugiriéndose que existía un efecto inflamatorio inducido por la propia toracocentesis. El estudio no incluyó otros grupos etiológicos de DP. Nuestra hipótesis es que los DP benignos (en nuestro estudio, principalmente tuberculosis, idiopáticos o pericarditis) tienen una noxa etiológica que se va resolviendo, lo que podría neutralizar este efecto inflamatorio del procedimiento de la toracocentesis y favorecer, por tanto, un descenso de LDH y neutrófilos.
El mismo grupo de investigadores repitió el experimento en 21 pacientes con DP secundario a insuficiencia cardiaca, y observó un aumento significativo de LDH, hematíes, leucocitos y neutrófilos entre una segunda y tercera toracocentesis12. En el caso de la insuficiencia cardiaca ya se había descrito que el tratamiento diurético extraía del LP más agua que solutos y, probablemente, también células, facilitando el incremento de LDH en la segunda toracocentesis13.
Sobre los DP idiopáticos suele recaer un elevado número de técnicas diagnósticas, a pesar de que la mayoría (más del 91% y el 96% en 2 series de 75 y 53 pacientes) presentan un curso benigno14,15. Esta evolución apoyaría una actitud conservadora y subraya la importancia de identificar predictores de DP idiopático que eviten procedimientos invasivos innecesarios.
Este estudio posee limitaciones. Es retrospectivo y el número de pacientes es escaso, ya que se priorizó seleccionar solo a la población que supone un mayor reto diagnóstico16: exudados linfocitarios con una primera citología negativa para malignidad que se someten a una segunda toracocentesis, como sería preceptivo según las guías de manejo del DP1,17. Por otro lado, durante el desarrollo del estudio se han utilizado diferentes técnicas de laboratorio para la medición de los parámetros bioquímicos del LP que, a su vez, están sujetos a variaciones interensayo (reproducibilidad) e intraensayo (repetibilidad). Sin embargo, las diferencias observadas entre dichos parámetros se correspondían siempre con la misma técnica de laboratorio en ambas toracocentesis, lo que impediría cualquier influencia sobre los resultados finales. Por último, la proporción relativa de DP idiopáticos en las poblaciones de derivación y validación difirió (20,5% y 6%, respectivamente), lo que podría haber influido en que no se alcanzase en esta última una LR negativa con significación clínica para la combinación de las 3 variables bioquímicas relevantes del estudio.
La relevancia práctica de los resultados obtenidos se puede ejemplificar en el siguiente supuesto. Si la probabilidad pre-prueba de que un LP con características de exudado linfocitario sea maligno es aproximadamente del 24%2, la realización de una segunda toracocentesis que demostrase, respecto a la primera, un ascenso porcentual de las concentraciones pleurales de LDH y del porcentaje de neutrófilos (o una disminución inferior al 10%), junto con un descenso absoluto de proteínas (o un ascenso inferior a 0,1g/dL), aumentaría dicha probabilidad al 64% (LR=5,6). Por el contrario, si en la segunda toracocentesis no se cumple alguna de las características indicadas, la probabilidad de malignidad descendería al 1,2% (LR=0,04).
En conclusión, el hallazgo de un aumento de la Δp LDH y Δp neutrófilos, junto con el descenso de la Δa proteínas del LP en una segunda toracocentesis de un paciente cuya primera toracocentesis muestra un exudado linfocitario de origen incierto, favorece el empleo ulterior de los procedimientos invasivos necesarios para llegar a un diagnóstico etiológico definitivo. Sin embargo, los hallazgos opuestos (descenso de la Δp LDH o Δp neutrófilos, o aumento de la Δa proteínas), probablemente permiten ser más conservadores en la búsqueda de un diagnóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.