La enfermedad pulmonar es la principal causa de mortalidad en el 80% de los pacientes con fibrosis quística (FQ). La influencia de la circulación extracorpórea (CEC) no está completamente establecida. Los objetivos son evaluar los resultados del trasplante pulmonar por FQ en un solo centro y la influencia de la CEC sobre la supervivencia de estos pacientes.
MétodosEstudio observacional retrospectivo de todos los pacientes afectados de FQ trasplantados en un solo centro entre 1992 y 2011. En este período se han realizado 64 trasplantes pulmonares por FQ.
ResultadosLa supervivencia de los pacientes trasplantados a los 5 y 10 años fue del 56,7 y el 41,3%, respectivamente. El requerimiento de oxígeno suplementario previo al trasplante no parece afectar a la supervivencia (p = 0,44), al igual que los pacientes que se trasplantaron con ventilación mecánica no invasiva (p = 0,63). La supervivencia a los 5 y 10 años para los pacientes que no se trasplantan con CEC es del 75,69 y el 49,06%, respectivamente, mientras que los que se trasplantan bajo CEC tienen un supervivencia a los 5 y 10 años del 34,14 y el 29,87%, respectivamente (p = 0,001). La PaCO2 es un factor de riesgo independiente para la necesidad de CEC.
ConclusionesLos pacientes con FQ trasplantados pulmonares en nuestro centro tiene una supervivencia similar a la descrita por los registros internacionales. Los pacientes trasplantados bajo CEC tienen una menor supervivencia. La PaCO2 es factor de riesgo de necesidad de CEC durante el trasplante pulmonar.
Lung disease is the major cause of death among cystic fibrosis (CF) patients, affecting 80% of the population. The impact of extracorporeal circulation (ECC) during transplantation has not been fully clarified. This study aimed to evaluate the outcomes of lung transplantation for CF in a single center, and to assess the impact of ECC on survival.
MethodsWe performed a retrospective observational study of all trasplanted CF patients in a single center between 1992 and 2011. During this period, 64 lung transplantations for CF were performed.
ResultsFive- and 10-year survival of trasplanted patients was 56.7% and 41.3%, respectively. Pre-transplantation supplemental oxygen requirements and non-invasive mechanical ventilation (NIMV) do not seem to affect survival (P=.44 and P=.63, respectively). Five- and 10-year survival among patients who did not undergo ECC during transplantation was 75.69% and 49.06%, respectively, while in those did undergo ECC during the procedure, 5- and 10-year survival was 34.14% and 29.87%, respectively (P=.001). PaCO2 is an independent risk factor for the need for ECC.
ConclusionsThe survival rates of CF patients undergoing lung transplantation in our hospital are similar to those described in international registries. Survival is lower among patients receiving ECC during the procedure. PaCO2 is a risk factor for the need for ECC during lung transplantation.
La fibrosis quística (FQ) es la enfermedad genética más frecuente en la raza blanca, con una frecuencia de 1:5.500 nacidos vivos1.
La enfermedad pulmonar es la principal causa de mortalidad en el 80% de los pacientes y la única terapia que ha demostrado mejorar la supervivencia de los pacientes con enfermedad pulmonar avanzada es el trasplante pulmonar (TP)2.
Con el aumento progresivo del TP bilateral secuencial y la mejora en la técnica quirúrgica, las indicaciones para la circulación extracorpórea (CEC) en el TP han disminuido.
Los estudios que valoran la implicación de la CEC en el TP son exclusivos de las enfermedades más prevalentes: enfermedad pulmonar obstructiva crónica (EPOC) y fibrosis pulmonar (FP)3,4.
El objetivo principal del presente estudio es evaluar los resultados del TP por FQ en un solo centro y la supervivencia a largo plazo. Los objetivos secundarios son valorar la influencia de la CEC en la supervivencia e identificar los posibles factores que puedan determinar la necesidad de dicha terapia.
MétodosEstudio observacional retrospectivo de todos los pacientes afectados de FQ trasplantados en el Hospital Vall d’Hebron entre el 1 de abril de 1992 y el 30 de septiembre del 2011. En este período se han realizado 64 TP por FQ en nuestro centro.
El seguimiento de los pacientes trasplantados se ha realizado hasta septiembre del 2014, por lo que el tiempo mínimo de seguimiento posible, en caso de no haber fallecido antes, es de 3 años.
La indicación para la utilización de CEC durante el trasplante ha dependido del equipo que realizaba la intervención, siguiendo los criterios detallados a continuación y previamente publicados en la literatura5:
- 1.
De forma programada: corrección de defectos cardíacos durante el trasplante.
- 2.
Dificultades técnicas durante el acto quirúrgico: lesión de estructuras cardíacas o pulmonares, imposibilidad de colapso pulmonar, etc.
- 3.
Disfunción cardíaca y fallo de ventrículo derecho.
- 4.
Disfunción hiperaguda del injerto o edema pulmonar tras la implantación del primer pulmón.
- 5.
Índice cardíaco < 2 l/min/m2.
- 6.
Saturación venosa mixta de oxígeno < 60%.
- 7.
Saturación arterial de oxígeno < 85%.
- 8.
Presión media de arteria pulmonar > 50-60mmHg.
- 9.
pH < 7,00
Se ha definido la ventilación mecánica (VM) prolongada como la necesidad de VM mayor a 21 días6.
Para la descripción de las variables nominales se utilizaron medidas de frecuencias absolutas y porcentajes. Las variables cuantitativas se compararon mediante la prueba de la χ2 o el test de Fisher cuando era necesario. La supervivencia se calculó empleando el test de Kaplan-Meier. Dado que la probabilidad de requerir CEC puede ser diferente entre los individuos y que los factores que condicionan la CEC también pueden condicionar la supervivencia, se ha utilizado un propensity score para controlar la posible confusión de estos factores.
El programa informático utilizado para el análisis estadístico ha sido el Stata 13.1
ResultadosLa edad media fue de 20,7 ± 8 (r: 9-49) años. Veintiséis (40,6%) pacientes corresponden al programa de TP infantil (0-17 años), con una media de edad de 13,9 (r: 9-17) años. Los 38 pacientes restantes corresponden al programa de TP de adultos (18-49 años), con una media de edad de 35,3 (r: 18-49) años.
De los 64 TP, 33 (51,5%) eran del sexo masculino y 31 (48,5%) del sexo femenino, dando lugar a una proporción hombre/mujer del 1,06/1.
Respecto al IMC, la media fue de 16,9 ± 2,7 (r: 10-22,9) kg/m2. Según la clasificación de la OMS7, 25 pacientes presentaban desnutrición severa.
El tiempo medio en lista de espera fue de 9,3 ± 8,5 (r: 0-34) meses. El grupo de trasplante infantil tuvo un tiempo medio en lista de 9 (r: 0,7-34,7) meses, mientras que la media del grupo de adulto fue de 10,5 (r: 0,1-30,2) meses.
Respecto a la necesidad de oxígeno previo al TP, 51 (79,6%) pacientes eran portadores de oxigenoterapia crónica domiciliaria y 13 (20,3%) pacientes requerían ventilación mecánica no invasiva (VMNI) previa al TP. El tiempo medio de necesidad de oxigenoterapia previa al TP fue de 15,9 ± 21,4 (r: 1-96) meses.
En el momento de ser incluidos en lista de espera para TP, los pacientes presentaban medianas de PaO2 de 63 (r: 27-85) mmHg y de PaCO2 de 43,5 (r: 30-84) mmHg. Respecto a las pruebas funcionales respiratorias (PFR), la media en porciento para FVC fue de 38,4 ± 14 (r: 14-82) y de FEV1 26 ± 10 (r: 13-60). En el 6WT, los pacientes recorrieron una distancia media de 323 ± 111 (r: 72-636) m.
Los receptores del TP estuvieron una media de 10 días con VM (r: 1-60 días). Doce pacientes (18,7%) requirieron VM prolongada. La media de estancia en UCI fue de 17,7 ± 16,7 (r: 1-90) días.
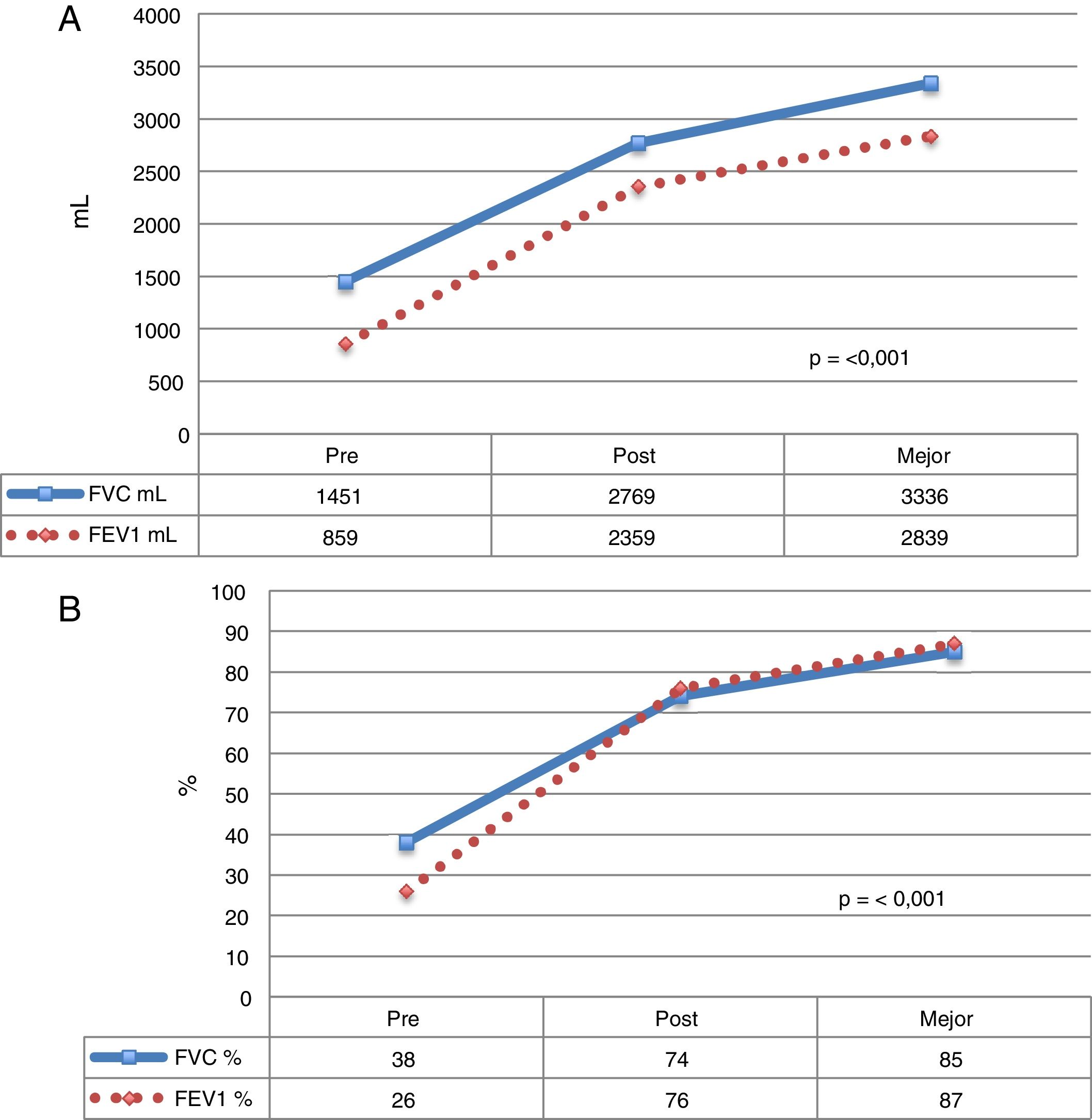
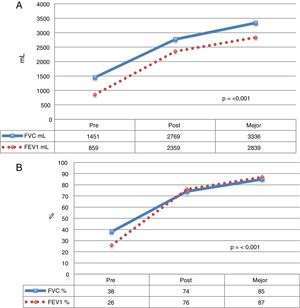
La media de tiempo hasta conseguir el mejor funcionalismo pulmonar fue de 41,1 (r: 1,7-167,5) meses posteriores al TP (fig. 1).
Evolución de los valores funcionales de los pacientes con FQ que recibieron un TP. Se muestra la media de cada valor, antes del TP, durante el postoperatorio y la media de los mejores valores alcanzados durante el seguimiento. A) Valores expresados en mililitros(ml). B) Valores expresados en porcentaje de acuerdo con el peso y la talla de cada paciente.
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada.
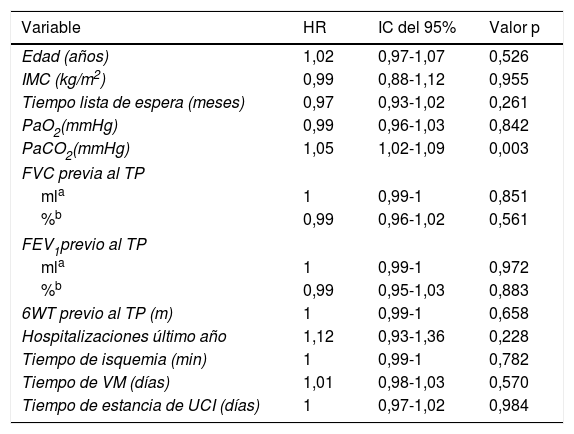
El análisis univariante no identificó ninguna variable que aumente la probabilidad de muerte excepto la PaCO2 preoperatoria (HR: 1,05; IC del 95%: 1,02-1,09) (tabla 1).
Análisis univariante de los factores de riesgo de mortalidad por el método riesgos proporcionales de Cox
| Variable | HR | IC del 95% | Valor p |
|---|---|---|---|
| Edad (años) | 1,02 | 0,97-1,07 | 0,526 |
| IMC (kg/m2) | 0,99 | 0,88-1,12 | 0,955 |
| Tiempo lista de espera (meses) | 0,97 | 0,93-1,02 | 0,261 |
| PaO2(mmHg) | 0,99 | 0,96-1,03 | 0,842 |
| PaCO2(mmHg) | 1,05 | 1,02-1,09 | 0,003 |
| FVC previa al TP | |||
| mla | 1 | 0,99-1 | 0,851 |
| %b | 0,99 | 0,96-1,02 | 0,561 |
| FEV1previo al TP | |||
| mla | 1 | 0,99-1 | 0,972 |
| %b | 0,99 | 0,95-1,03 | 0,883 |
| 6WT previo al TP (m) | 1 | 0,99-1 | 0,658 |
| Hospitalizaciones último año | 1,12 | 0,93-1,36 | 0,228 |
| Tiempo de isquemia (min) | 1 | 0,99-1 | 0,782 |
| Tiempo de VM (días) | 1,01 | 0,98-1,03 | 0,570 |
| Tiempo de estancia de UCI (días) | 1 | 0,97-1,02 | 0,984 |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; HR: razón de tasas de riesgo; IC del 95%: intervalo de confianza del 95%; IMC: índice de masa corporal; PaO2: presión parcial de oxígeno; PaCO2: presión parcial de dióxido de carbono; VM: ventilación mecánica; 6WT: test de la marcha en 6 min.
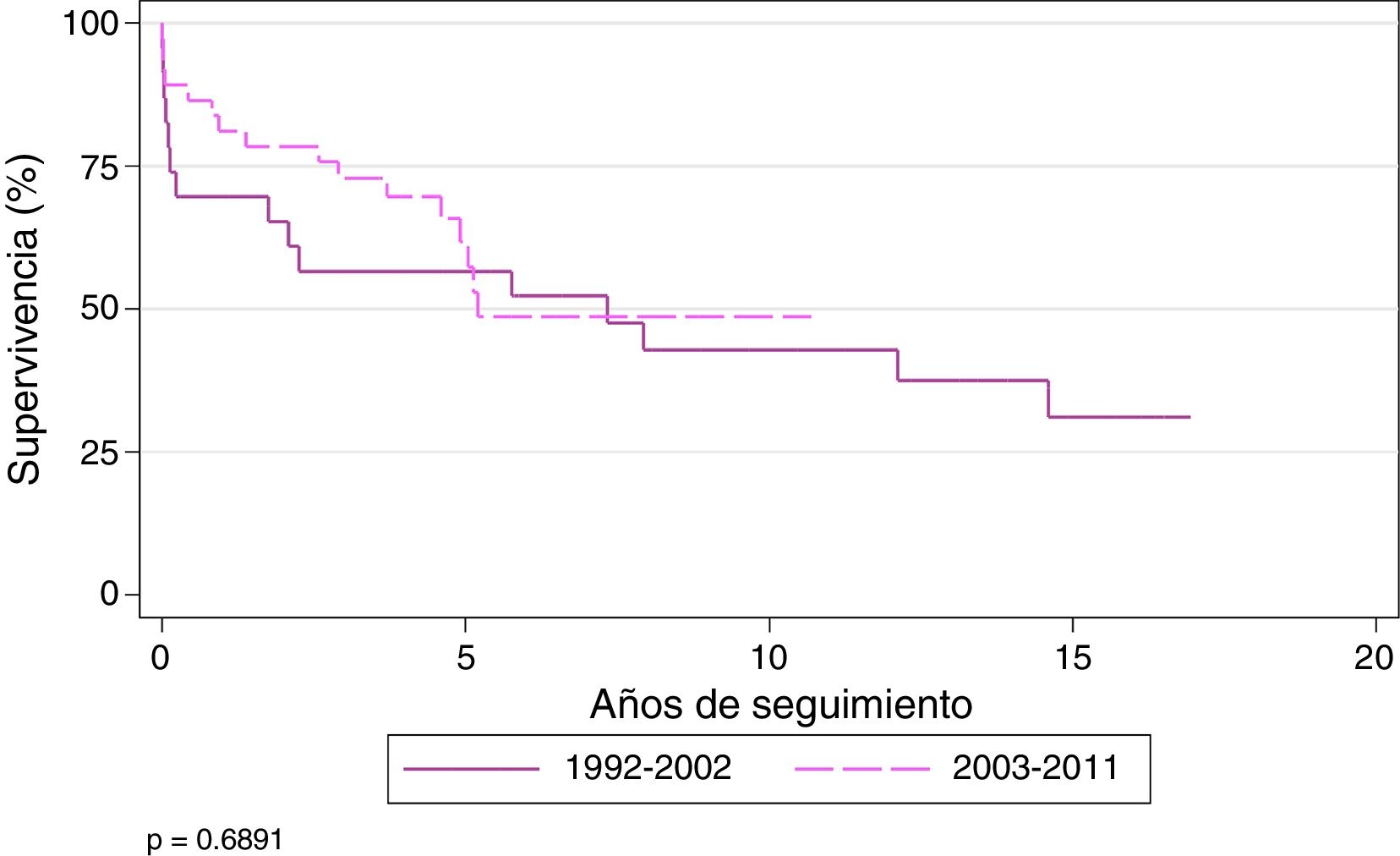
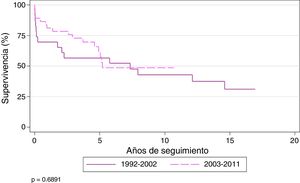
La supervivencia actuarial (Kaplan-Meier) de los pacientes trasplantados por FQ al año y a los 3, 5y 10años fue del 71,8, el 62,4, el 56,7 y el 41,3%, respectivamente, con una mediana de supervivencia de 5,7 años. Los pacientes del estudio fueron divididos en 2 eras: 1992-2002 y 2003-2011. La supervivencia al año y a los 3, 5y 10 años fue del 61,5, el 50, el 50 y el 37%, respectivamente, para los pacientes trasplantados durante la era inicial y del 78,9, el 70,9, el 60 y el 42%, respectivamente, durante el período 2003-2011 (p = 0,68). La mediana de supervivencia para la segunda era fue de 7,3 años (fig. 2).
Al finalizar el estudio, el paciente con mayor supervivencia había sido trasplantado hacía 17 años.
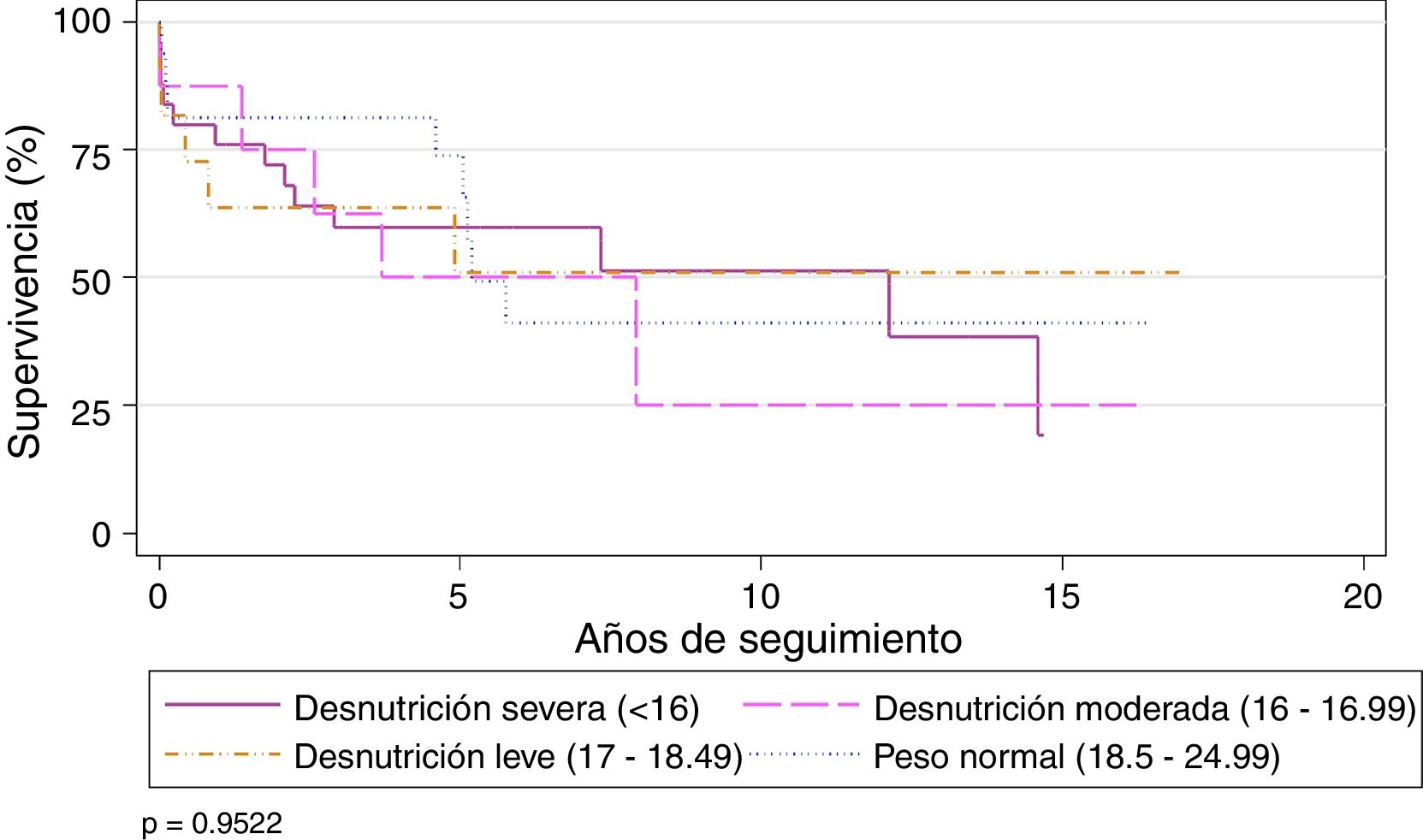
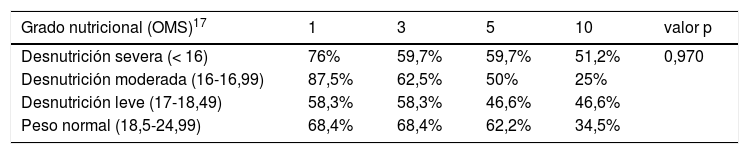
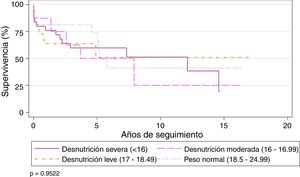
El IMC preoperatorio no parece influir significativamente en la supervivencia global de la serie. La supervivencia estratificada por grados de desnutrición fue similar, con una ligera mejoría no significativa del grupo con desnutrición severa a partir del quinto año del TP (tabla 2) (fig. 3).
Supervivencia actuarial de acuerdo con los diferentes grados nutricionales
| Grado nutricional (OMS)17 | 1 | 3 | 5 | 10 | valor p |
|---|---|---|---|---|---|
| Desnutrición severa (< 16) | 76% | 59,7% | 59,7% | 51,2% | 0,970 |
| Desnutrición moderada (16-16,99) | 87,5% | 62,5% | 50% | 25% | |
| Desnutrición leve (17-18,49) | 58,3% | 58,3% | 46,6% | 46,6% | |
| Peso normal (18,5-24,99) | 68,4% | 68,4% | 62,2% | 34,5% |
OMS: Organización Mundial de la Salud.
Los receptores que se trasplantaron con oxigenoterapia tuvieron una supervivencia al año y a los 3, 5 y 10 años del 72,5, el 60,7, el 53,8 y el 38%, respectivamente, en comparación con los que no requerían oxígeno suplementario, con supervivencias del 69,2, el 69,2, el 69,2 y el 55,3%, respectivamente (p = 0,44).
El análisis de los pacientes que se trasplantaron con VMNI no demostró diferencias con los pacientes que no utilizaban dicho tipo de terapia. Los pacientes trasplantados con VMNI tuvieron una supervivencia al año y a los 3, 5 y 10 años del 69,2, el 53,8, el 43 y el 43%, y los que no requerían VMNI del 72,5, el 64,7, el 60,1 y el 42,1%, respectivamente (p = 0,63).
Veintinueve pacientes (45,3%) fueron intervenidos bajo CEC, con un tiempo medio de soporte extracorpóreo de 198 ± 115 (r: 53-410) min.
De los 51 pacientes que fueron trasplantados mientras eran portadores de oxígeno domiciliario, 25 (49%) necesitaron soporte extracorpóreo durante la cirugía (p = 0,351). Respecto a la VMNI, de los 13 pacientes trasplantados con dicho tratamiento, 9 necesitaron CEC durante el TP (p = 0,052).
En el momento del TP, los pacientes que necesitaron CEC para la cirugía tenían medias de PaO2 de 58,2mmHg y de PaCO2 de 53,7mmHg, aunque los valores de PaO2 eran menores en los pacientes que requirieron CEC, dicho resultado no alcanza la significación estadística (p = 0,291), no así la PaCO2, que parece ser un factor que influye a favor de la necesidad de CEC (p = 0,018).
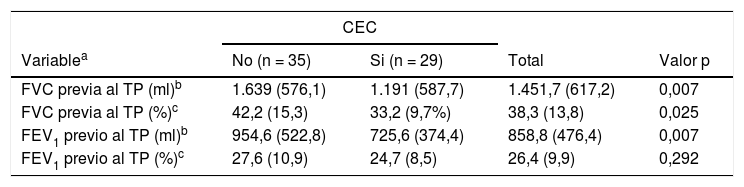
Respecto a las PFR determinadas antes del TP, todas las variables parecen influir en la necesidad de CEC excepto el FEV1 en porcentaje (tabla 3).
Características demográficas y clínicas de los pacientes incluidos en el análisis, divididos en función de la CEC
| CEC | ||||
|---|---|---|---|---|
| Variablea | No (n = 35) | Si (n = 29) | Total | Valor p |
| FVC previa al TP (ml)b | 1.639 (576,1) | 1.191 (587,7) | 1.451,7 (617,2) | 0,007 |
| FVC previa al TP (%)c | 42,2 (15,3) | 33,2 (9,7%) | 38,3 (13,8) | 0,025 |
| FEV1 previo al TP (ml)b | 954,6 (522,8) | 725,6 (374,4) | 858,8 (476,4) | 0,007 |
| FEV1 previo al TP (%)c | 27,6 (10,9) | 24,7 (8,5) | 26,4 (9,9) | 0,292 |
CEC: circulación extracorpórea; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada.
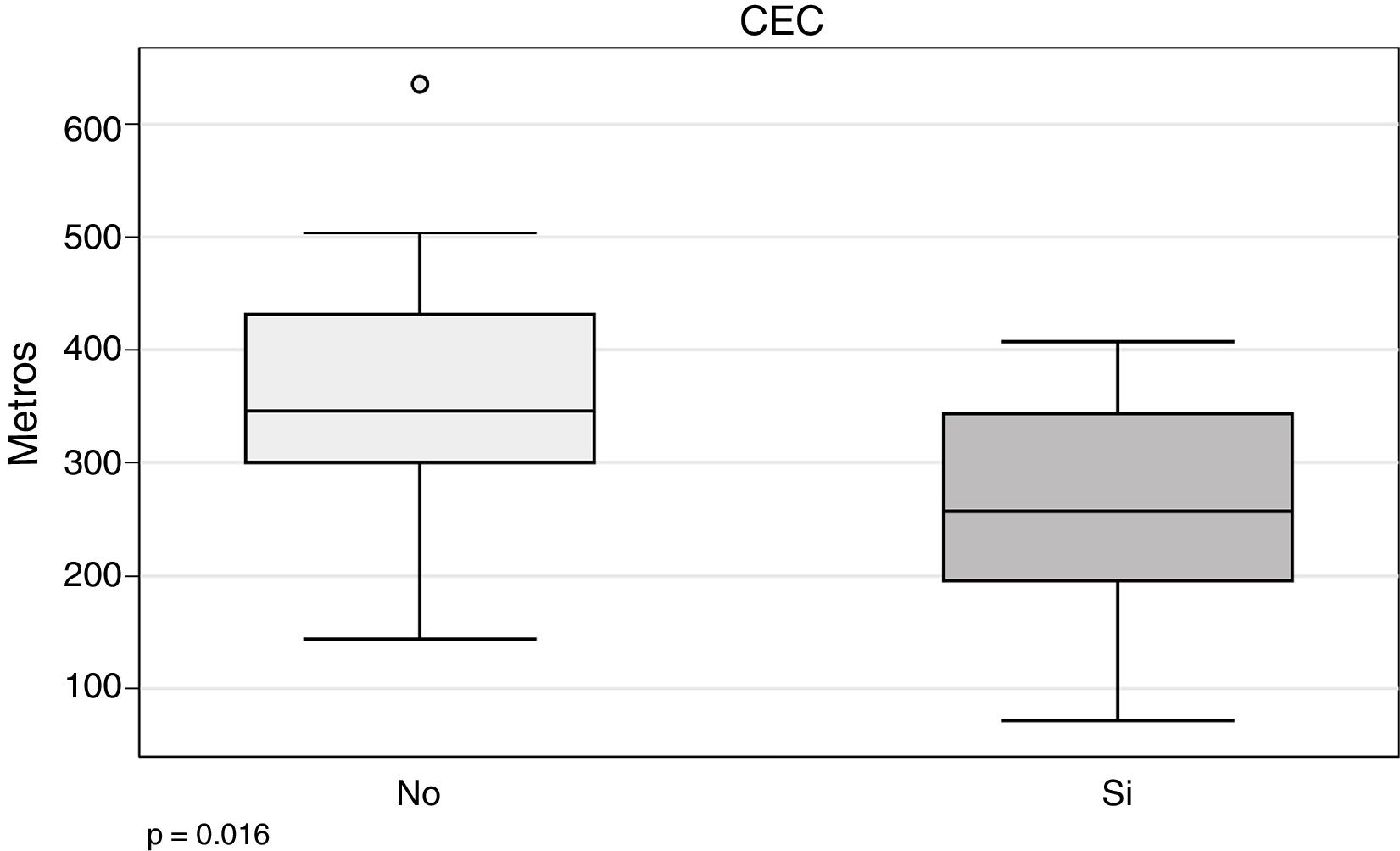
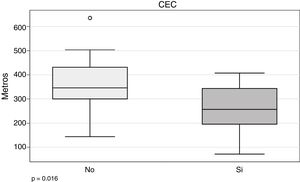
En nuestra serie, una de las variables que parece tener relación con la necesidad de CEC es el 6WT (266,5 ± 94,7 vs. 352,4 ± 109 m; p = 0,016) (fig. 4).
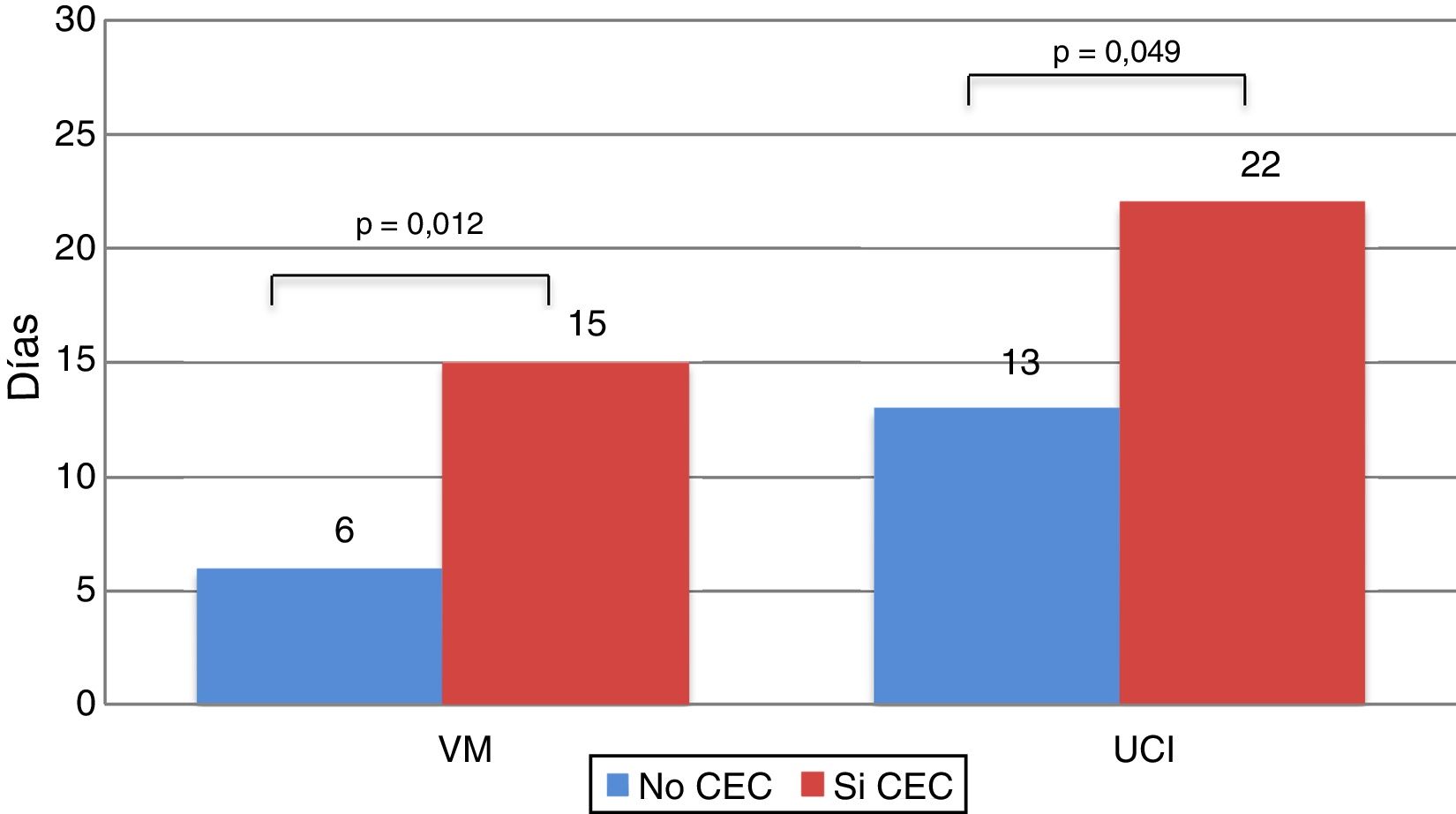
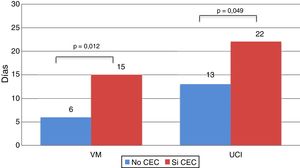
Los receptores que se trasplantaron con CEC estuvieron más tiempo con VM (15,29 ± 16,81 vs. 6,19 ± 8,72 días; p = 0,012) y requirieron más tiempo de ingreso en UCI (22,56 ± 20,20 vs. 13,77 ± 12,19 días; p = 0,049) (fig. 5).
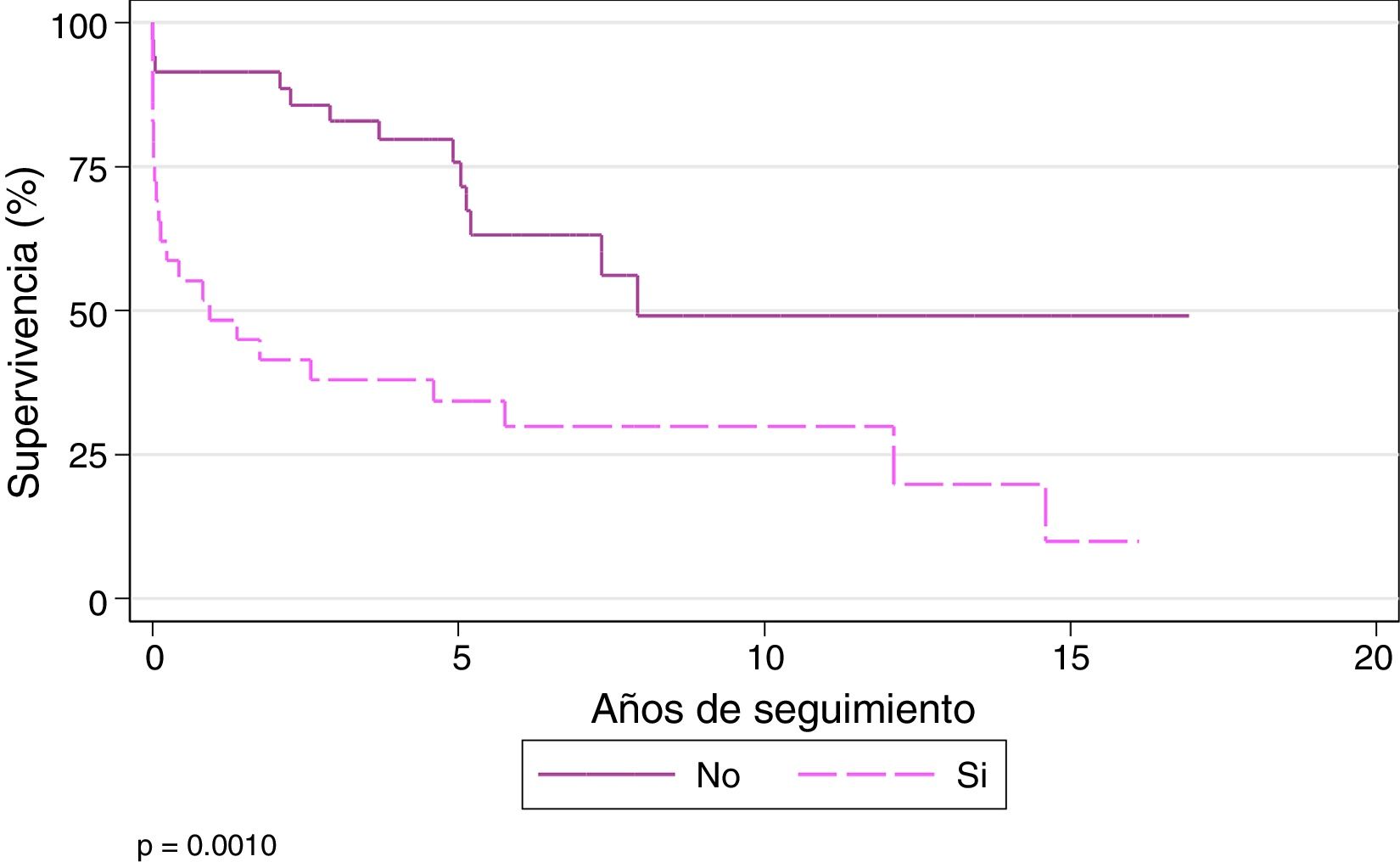
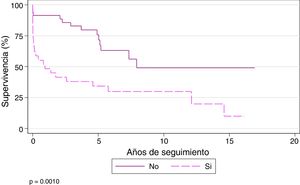
La supervivencia al año y a los 3, 5 y 10 años para los pacientes que no se trasplantan con CEC es del 91,43, el 82,86, el 75,69 y el 49,06%, respectivamente, mientras que los pacientes que se trasplantan bajo CEC tienen un supervivencia al año y a los 3, 5 y 10 años del 48,28, el 37,93, el 34,14 y el 29,87%, respectivamente (p = 0,001) (fig. 6).
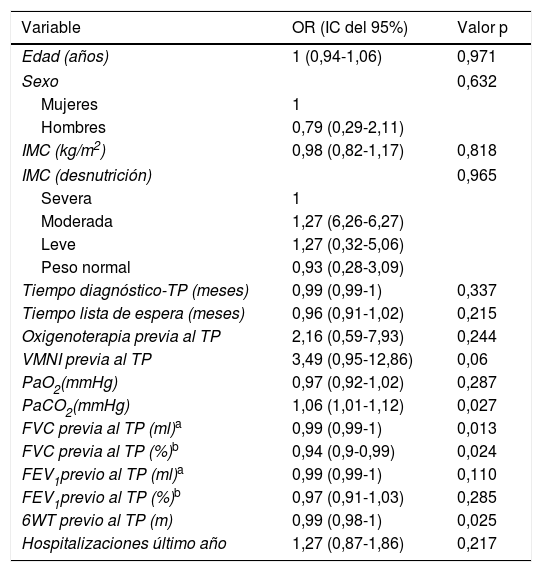
En el análisis univariante, para el posterior cálculo del propensity score, se han identificado 4 variables con significación estadística (tabla 4).
Análisis univariante de los factores de riesgo de CEC por el método de riesgos proporcionales de Cox
| Variable | OR (IC del 95%) | Valor p |
|---|---|---|
| Edad (años) | 1 (0,94-1,06) | 0,971 |
| Sexo | 0,632 | |
| Mujeres | 1 | |
| Hombres | 0,79 (0,29-2,11) | |
| IMC (kg/m2) | 0,98 (0,82-1,17) | 0,818 |
| IMC (desnutrición) | 0,965 | |
| Severa | 1 | |
| Moderada | 1,27 (6,26-6,27) | |
| Leve | 1,27 (0,32-5,06) | |
| Peso normal | 0,93 (0,28-3,09) | |
| Tiempo diagnóstico-TP (meses) | 0,99 (0,99-1) | 0,337 |
| Tiempo lista de espera (meses) | 0,96 (0,91-1,02) | 0,215 |
| Oxigenoterapia previa al TP | 2,16 (0,59-7,93) | 0,244 |
| VMNI previa al TP | 3,49 (0,95-12,86) | 0,06 |
| PaO2(mmHg) | 0,97 (0,92-1,02) | 0,287 |
| PaCO2(mmHg) | 1,06 (1,01-1,12) | 0,027 |
| FVC previa al TP (ml)a | 0,99 (0,99-1) | 0,013 |
| FVC previa al TP (%)b | 0,94 (0,9-0,99) | 0,024 |
| FEV1previo al TP (ml)a | 0,99 (0,99-1) | 0,110 |
| FEV1previo al TP (%)b | 0,97 (0,91-1,03) | 0,285 |
| 6WT previo al TP (m) | 0,99 (0,98-1) | 0,025 |
| Hospitalizaciones último año | 1,27 (0,87-1,86) | 0,217 |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC del 95%: intervalo de confianza del 95%; IMC: índice de masa corporal; OR: razón de riesgo; PaCO2: presión parcial de dióxido de carbono; PaO2: presión parcial de oxígeno; VMNI: ventilación mecánica no invasiva; 6WT: test de la marcha en 6 min.
Las variables que alcanzaron la significación estadística corresponden al funcionalismo pulmonar previo al TP. La PaCO2 (OR: 1,06; IC del 95%: 1,01-1,12), el FVC ml (OR: 0,99; IC del 95%: 0,99-1), el FVC % (OR: 0,94; IC 95%: 0,9-0,99) y, finalmente, el 6WT (OR: 0,99; IC del 95%: 0,98-1).
Con las variables que obtienen un resultado significativo en el estudio univariante se realiza un modelo logístico para calcular la probabilidad de necesidad de CEC durante el TP. En el estudio multivariante, se aprecia que dichas variables tienen 3 veces más probabilidades de requerir CEC durante el TP en comparación con el resto de variables analizadas (tabla 5).
Análisis multivariante de los factores de riesgo de CEC. Modelo final de regresión de riesgos proporcionales de Cox con las variables estadísticamente significativas del estudio univariante
| Variable | HR | IC del 95% | Valor p |
|---|---|---|---|
| CEC | |||
| No | 1 | 0,006 | |
| Sí | 3,11 | 1,38-7 | |
| PaCO2(mmHg) | 1,04 | 1,01-1,04 | 0,035 |
| FVC previa al TP (ml)a | 1 | 1-1 | 0,903 |
| 6WT previo al TP (m) | 1 | 1-1 | 0,064 |
FVC: capacidad vital forzada; HR: razón de tasas de riesgo; IC del 95: intervalo de confianza del 95%; PaCO2: presión parcial de dióxido de carbono; 6WT: test de la marcha en 6 min.
La mayoría de las publicaciones de pacientes trasplantados por FQ presentan resultados similares de acuerdo con la edad8-12.
Una de las series más amplias de pacientes con FQ con base en 176 trasplantados reporta una ligera mayoría del sexo femenino (51,7%)13.
Los resultados del IMC de nuestra serie son muy similares a los publicados por una serie italiana de 55 pacientes con FQ que recibieron un TP (IMC 17,3 ± 2,1 kg/m2)14.
En el estudio publicado por Snell et al.15 sobre 45 pacientes trasplantados por FQ se concluye que el sexo femenino con IMC < 18 kg/m2 tiene mayor riesgo de mortalidad a los 12 meses siguientes al inicio de la lista de espera para TP.
En nuestra serie, se ha dividido a los receptores en grupos de IMC de acuerdo con la clasificación nutricional de la OMS7. No se encontraron diferencias respecto a la mortalidad independientemente de su grado nutricional (p = 0,92).
El tiempo medio en lista de espera para TP de nuestra serie fue de 9,3 ± 8,5 (r: 0-34) meses, resultado que se encuentra dentro de los tiempos en lista de espera publicados en la literatura, que varía entre 6,8 y 47 meses12,14-19.
En cuanto a la necesidad de oxigenoterapia previa al trasplante, nuestro trabajo identifica que un 79,6% de los receptores eran portadores de oxigenoterapia antes del TP. Es importante mencionar que la indicación de oxigenoterapia de los pacientes de nuestra serie, aparte de los criterios gasométricos, se instauró en los pacientes que presentaban desaturación al esfuerzo (mejora del trabajo ventilatorio y aumento de la capacidad del ejercicio), disminución de la saturación por debajo del 90% durante más del 10% del registro nocturno de saturación y en algunos casos que, pese a no presentar hipoxemia, existía una mejoría sintomática de la dificultad respiratoria20.
La publicación de Merlo et al.16 sobre la influencia de los seguros médicos en el TP por FQ reporta que la necesidad de oxigenoterapia previa al TP es del 72,8% en los pacientes de Reino Unido y del 83,8% en los Estados Unidos de Norteamérica.
Un 20,3% de los pacientes de nuestra serie requerían VMNI previa al TP. Madden et al. publican una de las series más amplias en evaluar el estado de la VMNI en los pacientes con FQ. El tiempo medio de requerimiento de la VMNI para los pacientes que están en lista de espera de TP fue de 61 (r: 1-600) días y reportan que la VMNI mejora la hipoxia de estos pacientes pero que no corrige la hipercapnia21.
En cuanto a los valores espirométricos medios, el FVC y FEV1 fueron del 38,4 y el 26%, respectivamente. Los resultados del funcionalismo pulmonar son similares a los publicados en la literatura9,16,22-25.
En una serie nacional, los valores previos al TP de FVC son del 40% y de FEV1 del 20-30%. Los autores reportan que los mejores valores alcanzados durante el seguimiento del FVC % fueron > 80% y del FEV1 del 80%26.
En nuestra serie, la media de metros caminados en el 6WT fue de 323, resultado muy similar al de otras series9. El estudio publicado por Vizza et al., el 6WT es considerado un factor de riesgo independiente de mortalidad previo al TP, siendo de 343 m de media para los pacientes que fallecen mientras esperaban un TP22.
Los receptores de nuestro trabajo estuvieron una media de VM de 10 (r: 1-60) días y 12 (18,7%) pacientes requirieron VM prolongada. Hadem et al., en su estudio de VM prolongada en receptores de TP, entre los cuales se encuentra la FQ (total 690, FQ = 179), encuentran que casi el 12% de los pacientes con FQ son catalogados de VM prolongada (> 21 días de VM)27.
En nuestra serie, el tiempo medio de estancia en la UCI durante el postoperatorio del TP fue de 17,7 ± 16,7 (r: 1-90) días. Aunque no se ha diferenciado la estancia en la UCI entre el grupo infantil y el de adultos, la estancia es similar a la presentada en otras series, con medias de estancia de 20 ± 19 para los infantiles y de 10 ± 9 para los adultos26.
La supervivencia de la serie general, aunque similar a la de otras series publicadas9,26, es inferior a la aportada por el registro internacional, si bien cuando se aplica el «efecto era» la mediana de supervivencia mejora para los trasplantes realizados entre el 2003 y el 201128.
El 45,3% de los paciente de nuestra serie fueron trasplantados bajo CEC; la frecuencia varía entre los diferentes centros entre el 6,89 y el 69%18,23,26,29-33.
En nuestra serie, el tiempo medio de soporte extracorpóreo fue de 198 ± 115 (r: 53-410) min, similar a los tiempos de CEC en el TP publicados en la literatura34.
El grupo de Newcastle presenta su serie de 259 pacientes que recibieron un trasplante unipulmonar por diferentes diagnósticos, en los cuales se utilizó CEC en el 20,5% de los pacientes. Reportan que la VM no estuvo influida por la presencia de CEC (p = 0,15), con una media de VM de 31,3 (r: 6,2-78,3) h para los pacientes que necesitaron CEC. Sin embargo, sí encuentran diferencias significativas respecto a la estancia en la UCI, siendo de 5,2 días de media para los del grupo CEC y de 2,8 días para el grupo no CEC (p = ≤ 0,01)3. Resultados similares se presentaron de otro estudio que publica una estancia mayor en UCI en los pacientes que requirieron CEC (5,2 vs. 2,8 días para los que no necesitan CEC, p = < 0,01)35.
En nuestra serie, la supervivencia al año y a los 3 y 10 años es del 91,43, el 82,86% y el 49,06%, respectivamente, para los pacientes que no se trasplantan bajo CEC, mientras que los pacientes trasplantados bajo CEC tienen una supervivencia al año y a los 3 y 10 años del 48,28, el 37,93% y el 29,87%, respectivamente (p = 0,001).
Existen múltiples trabajos en los que se valora la supervivencia de los pacientes trasplantados con base en la CEC, pero la práctica totalidad de estos trabajos son en pacientes trasplantados por EPOC o FP.
Un estudio de 50 pacientes trasplantados por EPOC en el que se valora la influencia de la CEC sobre la mortalidad reporta que la supervivencia para los trasplantados bajo CEC al año y 3 años es del 85,7 y el 64,3%, respectivamente4.
Nuestro trabajo identifica 3factores que pueden considerarse de riesgo para la necesidad de CEC durante el TP por FQ; estos son: la PaCO2, el FVC y el 6WT previo al trasplante.
Aunque en nuestra serie no se ha analizado cuáles son los factores que pueden condicionar la mortalidad en la lista de espera, se ha indicado que valores de la función pulmonar pueden desempeñar un papel importante en la estratificación del riesgo previo al TP.
Una serie de pacientes con FQ candidatos a trasplante cardiopulmonar evalúa diferentes parámetros que puedan condicionar la supervivencia en la lista de espera. Las 2variables que encuentra el estudio son el FEV1 y la PaCO2. Los pacientes que tienen valores de FEV1 superiores al 17% tienen la mitad de riesgo de morir en la lista de espera en comparación con los que tienen valores < al 17% (RR 0,47; IC del 95%: 0,23-0,97). Respecto a la PaCO2, mencionan que el riesgo relativo de mortalidad en lista de espera es del 1,44 (IC del 95%: 1,17-1,77) por cada 7mmHg de aumento de PaCO236.
Ciriaco et al. también evalúan los variables de riesgo de los pacientes con FQ candidatos a TP y en su estudio, comparando a los pacientes que fueron trasplantados y los que fallecieron en la lista de espera, el FEV1 (21,2% vs. 16,5, p = < 0,02) y el 6WT (391,8 vs. 290,1 m, p = < 0,02) fueron las variables más significativas. También refieren la importancia de la PaCO2, aunque dicho resultado no alcanza la significación estadística (46 vs. 54mmHg, p = NS)12.
Definir cuáles son los factores de riesgo de mortalidad previos al TP fue el objetivo de un estudio multicéntrico con base en 343 pacientes con FQ en lista de espera para TP y, entre los resultados, el FEV1 ≤ 30% (HR 6,8; IC del 95%: 2,4-19,3, p = < 0,01) y la PaCO2 ≥ 50mmHg (HR 6,9; IC del 95%, 1,5-32,1, p = 0,01) fueron factores de riesgo de mortalidad37.
Aunque existen estudios que valoran la influencia del 6WT en pacientes con enfermedad coronaria y en el postoperatorio de cirugía cardíaca38-40, no se han encontrado publicaciones que relacionen dicho parámetro con la necesidad de CEC durante el TP. Así mismo, tampoco se han encontrado publicaciones que relacionen la PaCO2 y el FVC como factores de riesgo para la necesidad de CEC durante el TP.
Con el progreso de los programas de trasplantes se han instaurado nuevas formas de asistencia, como la oxigenación por membrana extracorpórea (ECMO), que constituye actualmente una de las formas más importantes de asistencia extracorpórea no solo durante el acto quirúrgico, sino también como puente al TP y durante el postoperatorio. Actualmente, se encuentra pendiente definir cuál es la influencia de la ECMO en la supervivencia de los pacientes trasplantados por FQ.
Una de las limitaciones más importantes de la presente serie, aparte del carácter retrospectivo, es el escaso número de pacientes y, por lo tanto, los resultados se tienen que interpretar con cautela. Otra de las limitaciones es la heterogeneidad de los pacientes del estudio al incluirse a todos los pacientes con FQ trasplantados, tanto infantiles como adultos, para intentar solventar dicha limitación se ha utilizado técnicas estadísticas como el propensity score para conseguir comparaciones más homogéneas entre pacientes. También es importante mencionar que no disponer de las causas de mortalidad precoz en los pacientes del grupo de CEC es otra de las limitaciones importantes del presente estudio. Su conocimiento podría haber sido relevante para identificar las causas de la disminución de la supervivencia a corto plazo en este grupo de pacientes.
En conclusión, los pacientes con FQ trasplantados pulmonares en nuestro centro tienen una supervivencia similar a la descrita por los registros internacionales aunque los pacientes trasplantados bajo CEC parecen tener una menor supervivencia. Se ha identificado la PaCO2 como factor de riesgo independiente de la necesidad de CEC durante el TP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.