Los valores de referencia de las pruebas de función pulmonar están basados históricamente en factores antropométricos como el peso, la altura, el género y la edad. La FVC y el FEV1 disminuyen con la edad y, en contraposición, volúmenes y capacidades como el RV y la FRC se incrementan. La TLC, CV, RV, FVC y FEV1 se ven afectados por la altura, puesto que son proporcionales al tamaño corporal. Esto significa que un individuo alto sufrirá un mayor decremento de sus volúmenes pulmonares a medida que aumente su edad. Algunas variables decrecen exponencialmente con el incremento del peso, como la FRC y el ERV, de tal forma que los sujetos con obesidad mórbida pueden llegar a alcanzar un volumen corriente cercano al RV. Los hombres poseen vías aéreas de conducción más largas que las mujeres, dando lugar a una mayor resistencia específica de las vías respiratorias. El mayor trabajo respiratorio en mujeres para aumentar la ventilación provoca que, en condiciones con la misma intensidad física, el consumo de oxígeno sea más alto que en hombres. En posición vertical los volúmenes pulmonares son más altos que en el resto de las posturas. La DLCO es significativamente mayor en posiciones supinas que en posición sentada y vertical, no existiendo diferencias significativas en posición sentada y de pie. Las características antropométricas no son suficientes para explicar las diferencias existentes en la función pulmonar entre diferentes etnias y ponen de manifiesto la importancia de considerar otros factores adicionales a los clásicos antropométricos para su medición.
Lung function reference values are traditionally based on anthropometric factors, such as weight, height, sex, and age. FVC and FEV1 decline with age, while volumes and capacities, such as RV and FRC, increase. TLC, VC, RV, FVC and FEV1 are affected by height, since they are proportional to body size. This means that a tall individual will experience greater decrease in lung volumes as they get older. Some variables, such as FRC and ERV, decline exponentially with an increase in weight, to the extent that tidal volume in morbidly obese patients can be close to that of RV. Men have longer airways than women, causing greater specific resistance in the respiratory tract. The increased work of breathing to increase ventilation among women means that their consumption of oxygen is higher than men under similar conditions of physical intensity. Lung volumes are higher when the subject is standing than in other positions. DLCO is significantly higher in supine positions than in sitting or standing positions, but the difference between sitting and standing positions is not significant. Anthropometric characteristics are insufficient to explain differences in lung function between different ethnic groups, underlining the importance of considering other factors in addition to the conventional anthropometric measurements.
Las pruebas de función pulmonar (PFP) son una combinación de test que son realizados en la práctica clínica para determinar la capacidad pulmonar, así como el posible deterioro de la función mecánica de los pulmones, los músculos respiratorios y la pared torácica. Estas pruebas son útiles para confirmar posibles patologías pulmonares y su severidad, permitiendo también la evaluación de la respuesta respiratoria ante posibles intervenciones terapéuticas1.
Los valores de referencia tomados en la práctica clínica para la realización de las PFP son a menudos complejos de estimar. La interpretación de la función pulmonar expuesta por estándares clínicos ha estado basada históricamente en los factores antropométricos más importantes, incluyendo el peso, la estatura, el género y la edad2. Sin embargo, a medida que el conocimiento en este ámbito ha aumentado, otros factores han ido cobrando una especial relevancia. Entre ellos pueden destacarse algunos corporales (ritmos circadianos3, ciclo menstrual4, diámetro torácico5, tamaño de la tráquea6), sociosanitarios (nivel educativo7, estatus socioeconómico8, exposiciones en el ámbito laboral9) medioambientales (contaminación, polución atmosférica10, condiciones climatológicas11, desastres naturales12, altitud13), raza o grupo étnico14, los asociados a hábitos de vida (nutrición15, nivel de actividad física16, tabaquismo17), a patologías (diabetes18, trastornos musculares u hormonales19), la postura del individuo20, factores genéticos21, contiendas bélicas (conflictos militares22, ataques terroristas23) e incluso factores que pueden influir durante la etapa infantil24 o el embarazo25.
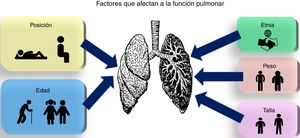
A pesar de que existe en mayor o menor medida una amplia bibliografía acerca de cómo afectan cada uno de los factores comentados con anterioridad a la morfología y a la función pulmonar, hasta el conocimiento de los autores no existe una revisión reciente que incluya todos estos aspectos y sean integrados en una única fuente completa. Esta revisión va a centrarse en los factores antropométricos, la posición del individuo y la raza o grupo étnico, tratando de dar una visión integrada de cómo afectan estos factores a la función pulmonar (fig. 1).
Material y métodosEl presente estudio se ha fundamentado principalmente en una búsqueda sistemática de la bibliografía existente acerca de los factores que afectan a la función pulmonar. Para ello se ha recurrido a diferentes motores de búsqueda de libre acceso, entre los que se encuentran las bases de datos PubMed, Lilacs, SciELO, GoPEDro, Google Scholar y Scopus. Revisiones, estudios observacionales, experimentos clínicos y modelos matemáticos han sido seleccionados, particularizando en los últimos 5años, aunque también se han considerado otros trabajos más antiguos pero de especial trascendencia con la temática tratada.
La búsqueda bibliográfica se ha fundamentado en diferentes palabras clave utilizadas de forma independiente o en combinación mediante el uso de operadores de tipo OR y AND. Entre las expresiones buscadas se encuentran: «lung function testing», «pulmonary function tests», «pulmonary function», «pulmonary impairment», «spirometry», «plethysmograph», «lung volumes», «diffusing capacity», «arterial blood gases», «chronic obstructive pulmonary disease» y «lung function values», así como todas y cada una de las variables espirométricas que son tratadas en este trabajo, relaciones entre ambas, etnias (caucásicos, afroamericanos y asiáticos principalmente) y cada uno de los factores influyentes en la función pulmonar.
ResultadosEn esta sección se irán desglosando uno a uno los factores de mayor influencia en la función pulmonar y que han sido considerados de interés para este estudio.
EdadLa edad ha sido históricamente uno de los componentes fundamentales en la evaluación de la función pulmonar. La madurez pulmonar es alcanzada aproximadamente a los 20-25años26, momento tras el cual comienza un deterioro progresivo de la función pulmonar27.
Las variables afectadas son principalmente la FVC y el FEV1, que disminuyen con la edad28 debido a la reducción de la adherencia en la pared torácica, a la caída de la fuerza muscular espiratoria y a una mayor tendencia de las vías respiratorias más pequeñas a cerrarse durante el esfuerzo espiratorio forzado29. Concretamente para el FEV1, su caída es alrededor de 20ml/año en edades comprendidas entre los 25 y los 39años, mientras que paulatinamente este declive se acentúa hasta los 35ml/año a partir de los 65años30. La relación FEV1/FVC también disminuye con la edad, con una caída más pronunciada en las edades comprendidas entre los 3 y los 10años debido al aumento más notorio de la FVC respecto al FEV1 en esas edades. Esta tendencia es revertida temporalmente durante la infancia, donde se produce una subida ligera de la relación FEV1/FVC hasta los 16años y una disminución continua a partir de esa edad. Esta caída es debida presumiblemente a la pérdida gradual de la elasticidad del pulmón. En contraposición, los volúmenes y las capacidades como el RV y la FRC se incrementan, mientras que la VC y la IC disminuyen como resultado del cierre de las vías respiratorias, del progresivo endurecimiento del tejido pulmonar y de la disminución del retroceso de las fuerzas elásticas del pulmón31. Por último, la TLC generalmente permanece constante en ausencia de patología30,32.
El intercambio de gases tiende a disminuir con la edad debido a la pérdida de la superficie alveolar y a la caída del volumen sanguíneo33. Durante la infancia, la PAO2 y la PACO2 no cambian significativamente, pero la PaO2 se incrementa paulatinamente durante la adolescencia. Las respuestas ventilatorias tanto a la hipercapnia como a la hipoxia son más altas en la infancia temprana y disminuyen progresivamente hasta la edad adulta34. Concretamente, en relación con la DLCO la caída es alrededor de 0,2mlCO/min/mmHg/año30,35. Esto provoca también una disminución progresiva de la PaO2 desde los 95mmHg a los 20años hasta los 75mmHg a los 70años, aunque la PaCO2 permanece inalterada a costa del aumento de la ventilación.
Con respecto al impacto del incremento de la edad sobre la capacidad de ejercicio, existen pocos trabajos en la literatura que hayan tratado de abordar esta problemática mediante estudios longitudinales36. El VO2max disminuye con la edad, aunque este declive se retrasa considerablemente en los sujetos físicamente activos. La caída de la capacidad de esfuerzo se vuelve más drástica a partir de los 60años, momento en el cual una persona con salud normal puede comenzar a sufrir episodios de disnea con frecuencia durante la realización de la práctica física27.
Trabajos más específicos centrados en el deterioro del sistema respiratorio a partir de la edad, y también con cierta relevancia clínica, tratan de estudiar aspectos centrados en niños con bajo peso al nacer37, mujeres menopáusicas38 o el papel de la senescencia celular en el envejecimiento de los pulmones39. También existe bibliografía centrada en el estudio de algunos factores que influyen a edades tempranas y su incidencia en la etapa adulta40.
EstaturaDistintos parámetros, como la TLC, la CV, el RV, la FVC y el FEV1, se ven afectados por la estatura, puesto que son proporcionales al tamaño corporal41. Esto significa que un individuo alto —y, por tanto, con gran capacidad pulmonar— sufrirá un mayor decremento de sus volúmenes pulmonares a medida que aumente su edad con respecto a individuos con talla más baja42. Por otra parte, el flujo espiratorio máximo (PEF) también aumenta con la estatura, existiendo ecuaciones predictoras como la escala Wright43, la EN1382 o la NHANESIII44, que son ampliamente utilizadas en la práctica clínica. Por último, a nivel de intercambio gaseoso se ha comprobado que el valor de la DLCO aumenta con la estatura45.
PesoEn general, puede afirmarse que la TLC decae con el incremento del índice de masa corporal (IMC), aunque el declive se produce de forma poco significativa, incluso en obesidad mórbida46. Esta preservación de la TLC, junto al mantenimiento también de la VC, es debida al efecto compensatorio de la CI, que aumenta en la obesidad. Este incremento de la CI, y la consecuente disminución del RV, se deben al desplazamiento que experimenta el diafragma hacia el tórax como resultado de la carga mecánica a la que es sometido por el exceso de grasa. Como consecuencia, el VT en reposo y en el ejercicio físico tiende a ocurrir en volúmenes pulmonares operacionales más bajos, lo que provoca que las reservas de flujo espiratorio sean más pequeñas47.
Otras variables que se han observado que decrecen exponencialmente con el incremento del IMC son la FRC y el ERV, de tal forma que los sujetos con obesidad mórbida pueden llegar a alcanzar un VT cercano al RV14. Este declive de la FRC puede provocar que su valor disminuya rebasando a la capacidad de cierre. Este fenómeno tiene implicaciones clínicas, pudiendo provocar el colapso de los pulmones y convertir las zonas inferiores de los pulmones en atelectasias, conduciendo a una distribución no uniforme caracterizada por un intercambio de gases que principalmente tiende a producirse en las zonas altas48.
En cuanto a los flujos inspiratorios/espiratorios, el PEF decae con el incremento del IMC. Con respecto al FEV1 y a la FVC, existen discrepancias en la literatura. Por una parte, algunos autores afirman que la obesidad generalmente no disminuye el FEV1 y la FVC, a menos que los pacientes sufran de obesidad mórbida, por lo que la relación FEV1/FVC también se mantiene constante49. Sin embargo, otros estudios sugieren que la obesidad puede causar una limitación en las vías respiratorias, lo que conlleva una reducción paralela del FEV1 y de la FVC y, en consecuencia, a una preservación de la relación FEV1/FVC50. Se ha observado que la obesidad abdominal está generalmente relacionada con reducciones del FEV1 y de la FVC en mujeres y en ciertos grupos de edades51.
Respecto a la DLCO, los estudios publicados al respecto presentan también resultados contradictorios. Algunas publicaciones han encontrado que su valor baja con el incremento del IMC, mientras que otros trabajos exponen que sube o se mantiene52,53. Estas contradicciones pueden ser debidas a que la DLCO depende de diversos factores no asociados exclusivamente a la función pulmonar como, por ejemplo, la concentración de hemoglobina o el KCO. En general, el incremento de IMC provoca el deterioro del intercambio de gases a nivel alveolar, produciendo un declive de la PaO254.
Con respecto a las implicaciones respiratorias derivadas del peso durante el ejercicio, puede afirmarse que el VT es más bajo y la frecuencia respiratoria más alta en sujetos obesos que en no obesos55. Además, el exceso de grasa en la pared torácica provoca el aumento del VO2 para cada respiración, intensificando la demanda ventilatoria que es manifestada mediante un mayor coste metabólico, incrementando el VO2 y el VCO247,56.
Por último, los sujetos delgados presentan un relativo impacto sobre la función pulmonar. En general, la mayoría de los valores espirométricos decaen con el bajo peso, lo que repercute en una disminución de la capacidad ventilatoria. De esta forma, individuos con bajo peso poseen reducidas FVC y FEV1 y deficitaria musculatura respiratoria. Otros valores espirométricos que disminuyen son la VC y el ERV57. Estos mismos efectos son aplicables también en niños y en neonatos con bajo peso al nacer58.
Algunas contradicciones halladas en los estudios centrados en la incidencia del peso sobre la función pulmonar podrían ser debidas al uso exclusivo de estos trabajos del concepto de IMC como medida de la obesidad. En este sentido, otros aspectos que podrían tener una incidencia relevante habitualmente son ignorados, como la obesidad central (predominante principalmente en los hombres), la adiposidad periférica (más común en mujeres)59, así como el espesor del pliegue cutáneo, la circunferencia de la cintura o la relación cintura/cadera60.
GéneroMétodos morfométricos estándares confirman que los hombres poseen pulmones de mayor tamaño que las mujeres y, en consecuencia, un mayor número de bronquios, una mayor superficie alveolar y un diámetro de las vías respiratorias más amplio, considerando sujetos del mismo peso y estatura61.
El desarrollo pulmonar posnatal ocasiona un aumento del número y el tamaño de los alveolos, y aunque el pulmón femenino es más pequeño que el masculino y posee un menor número de bronquiolos respiratorios, el número de alveolos por unidad de superficie tanto en niños como en niñas es el mismo. Durante la adolescencia se produce un fenómeno conocido como disanapsis, o desproporción en la relación entre el tamaño pulmonar y el tamaño de las vías respiratorias. En este sentido, el crecimiento de las vías respiratorias es proporcional al del tejido pulmonar en mujeres, mientras que en hombres se produce un crecimiento desmesurado de las vías respiratorias que se manifiesta con un número de alveolos desproporcionadamente menor en relación con el número de vías respiratorias. De este modo, los hombres poseen unas vías aéreas de conducción más largas que las mujeres, estando en clara desventaja durante el proceso de espiración durante esta etapa de la vida, dando lugar a una mayor resistencia específica de las vías respiratorias y a menores tasas de PEF62. Incluso con pulmones del mismo tamaño, los hombres siguen teniendo vías respiratorias mayores que las mujeres. Sin embargo, cuando el crecimiento cesa y va acercándose la madurez pulmonar, la situación se normaliza y la FRC, la VC, la TLC, el RV y los flujos máximos son mayores en hombres que en mujeres. Con relación a las propiedades de retroceso del pulmón o a las características de la pared torácica y de la compliancia pulmonar, no parece haber diferencias significativas entre hombres y mujeres, aunque el diámetro de la tráquea sí es más pequeño en mujeres63,64.
Los hombres también poseen valores más altos de flujos que las mujeres, aunque la relación entre FEV1/FVC se mantiene65. La ventilación, el pico inspiratorio y los flujos de espiración también son más altos en hombres que en mujeres. El FEV1 disminuye con la edad, pero la reducción es más rápida en hombres que en mujeres, puesto que la fuerza muscular respiratoria disminuye más drásticamente en hombres que en mujeres26,30.
Respecto al proceso de difusión de gases, la DLCO es mayor en hombres que en mujeres, con un decremento de aproximadamente 0,2mlCO/min/mmHg/año en hombres y de 0,15mlCO/min/mmHg/año en mujeres30. Esta diferencia puede ser debida a la influencia del estrógeno, que mantiene la integridad de los vasos sanguíneos en las mujeres. Se ha comprobado también que el ciclo menstrual modifica los mecanismos de difusión de gases, caracterizándose por una máxima DLCO justo antes del comienzo de la menstruación y una sucesiva bajada rápida que alcanza su punto mínimo al tercer día4. Las razones de estos cambios son presumiblemente debidas al nivel del volumen capilar sanguíneo66. Por otra parte, no hay diferencias significativas en la relación DLCO/VA para los dos sexos.
A nivel de ejercicio físico, el menor diámetro de las vías respiratorias y los reducidos volúmenes pulmonares en mujeres da lugar a picos de flujo espiratorio más bajos. Así, las mujeres poseen una capacidad mucho menor para aumentar la ventilación durante el ejercicio en comparación con los hombres. Sin embargo, ni hombres ni mujeres alcanzan su máxima ventilación efectiva durante un ejercicio físico de gran intensidad, acercándose más las mujeres a este valor que los hombres. Este mayor trabajo respiratorio en mujeres para aumentar la ventilación provoca que en condiciones con la misma intensidad física, el consumo de oxígeno sea más alto que en hombres, influyendo negativamente en el rendimiento general del ejercicio67. Además, las mujeres son más propensas a la desaturación arterial durante un ejercicio intenso, por lo que su rendimiento se ve aún más limitado68,69. En general, el VO2max disminuye en razón de 32ml/min/año en hombres y de 14ml/min/año en mujeres a partir de los 20-30 años30. Asimismo, las particularidades morfológicas de los pulmones de las mujeres pueden contribuir a una inadecuada hiperventilación y a un consecuente incremento de hipoxemia inducida por el ejercicio70. Por último, durante la práctica del ejercicio físico la DLCO de los hombres es casi el doble que la de las mujeres, debido al mayor volumen de sangre pulmonar (alrededor del 40% más)53.
PosiciónLa distensibilidad pulmonar se reduce significativamente con los cambios de postura, desde la postura vertical y sentada hasta el decúbito supino, decúbito prono o decúbito lateral. En posición vertical los volúmenes pulmonares son más altos que en el resto de las posturas debido al aumento del volumen de la cavidad torácica. La VC y la TLC muestran un decremento en la posición supina en comparación con la posición vertical, posiblemente debido a la alteración del flujo sanguíneo desde los miembros inferiores a la cavidad torácica71. Para las posiciones de decúbito, la VC es más alta en supino que en prono, mientras que la TLC no presenta variaciones significativas. Por otra parte, la FRC también experimenta una caída en posiciones de decúbito y más concretamente en la posición de supino debido a que el abdomen empuja al diafragma hacia la cavidad torácica. En consecuencia, los valores de la FRC y del ERV son más elevados en la posición vertical que en las posiciones de sentado y de supino, mientras que en la posición de sentado los valores son más altos que en supino. Entre las posiciones de supino y prono no existen diferencias reseñables72. Por tanto, el aumento de la presión intraabdominal conduce al incremento de la FRC y del ERV. Con respecto al VT, su valor es mayor en posición sentada que en supina. Esto es debido a que una inclinación progresiva del tronco determina una reducción del desplazamiento de la caja torácica y de la ventilación, por lo que el VT se incrementa paulatinamente con el incremento de la inclinación de la espalda73. Sin embargo, los valores más altos del VT se alcanzan en posición vertical. En la posición sentada también existe un decremento en el VT.
Existen estudios que demuestran que el FEV1, la FVC y la relación FEV1/FVC son más altos en posición de pie que en posición sentada y decúbito74. Sin embargo, existen discrepancias con otros estudios que afirman que la posición sentada produce valores de FVC y FEV1 más altos que en posición vertical y supina, sin encontrar variaciones destacables del FEF25-75. Sí parece consistente que los valores reportados para FVC y FEV1 son inferiores en posiciones supina y prona en comparación a la posición sentada75. Con respecto al PEF, también la postura corporal le afecta de forma significativa76.
El valor de la DLCO es mayor en posiciones supinas que en posición sentada y vertical77. Por otra parte, no existen diferencias significativas de la DLCO en sujetos en posición sentada y de pie. Respecto a las diferencias entre la posición supina y prona, existen estudios que evidencian una ligera disminución observada en sujetos sanos cambiando de la posición supina a la posición prona78.
Raza o grupo étnicoMuchos de los estudios que analizan el efecto de la raza sobre la función pulmonar utilizan el denominado índice córmico (razón entre la estatura en posición sentada y la estatura en posición vertical) como base metodológica a emplear durante la clasificación de medidas. Sin embargo, a pesar de que las características antropométricas juegan un papel fundamental, no son suficientes para explicar las diferencias existentes en la función pulmonar entre diferentes etnias. En este sentido, el color de la piel tampoco es un buen indicativo79,80.
La American Throracic Society (ATS) y la European Respiratory Society (ERS) han publicado recomendaciones de valores espirométricos de referencia mediante ecuaciones derivadas de muestras de diferentes razas/etnias, siempre y cuando la información estuviera disponible81. La adaptación de los estándares se realiza mediante una normalización a partir de una «corrección racial», también denominada «ajuste étnico», utilizando generalmente un determinado factor de escala para todas las personas que no son consideradas blancas o caucásicas82.
En general puede afirmarse que existen diferencias proporcionales del nivel de la función pulmonar entre las principales razas del mundo sobre las que hay suficientes datos83, que son las siguientes cuatro: blancos o caucásicos (europeos, israelíes, australianos, estadounidenses, canadienses, brasileños, chilenos, mexicano-americanos, uruguayos, venezolanos, argelinos, tunecinos), negros (afroamericanos), asiáticos del noreste (coreanos y chinos del norte) y asiáticos del sudeste (tailandeses, taiwaneses, chinos del sur y hongkoneses).
ConclusionesLa revisión bibliográfica sistemática realizada pone de manifiesto que existe un gran interés en el estudio de los factores que afectan a la función pulmonar, incluyendo los clásicos antropométricos. En este sentido, el uso de estándares de referencia en la práctica clínica provee de valores teóricos razonables para un importante sector de la población, aunque algunos factores que pueden llegar a ser relevantes en determinados casos no son considerados. Entre ellos se encuentran la distribución de la grasa en personas obesas, los cambios en el sistema respiratorio durante la infancia, la pubertad y la menopausia, los hábitos de vida o la posición del cuerpo durante la realización de las pruebas. Futuras líneas de trabajo también deben centrarse en el estudio de las variaciones pulmonares para determinadas razas y etnias de algunas regiones del mundo, dada la escasez de datos en la literatura en este sentido. No existe un tratamiento multivariante de las distintas variables analizadas. Sin embargo, existe la necesidad de una visión integrada de todos estos factores que determinan la medida de la función pulmonar, al igual que la incorporación de los mismos a las tablas de referencia que son utilizadas en la práctica clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses