La Organización Mundial de la Salud define el tumor de células gigantes (TCG) óseo como una neoplasia ósea primaria benigna pero localmente agresiva compuesta por una proliferación de células mononucleares entre las que se encuentran dispersas numerosos macrófagos y células gigantes multinucleadas de tipo osteoclasto1. Existen formas de TCG extraóseas con histología superponible a los TGC del hueso. En localización pulmonar estos tumores son excepcionales. Presentamos un caso de un TCG primario pulmonar, de comportamiento agresivo.
Se trataba de un paciente varón de 80 años, exfumador de 50 paquetes/año, en estudio por hemoptisis. En las pruebas de imagen (TAC) se identificó una masa pulmonar derecha de 8×5×5cm, de bordes polilobulados, sólida, hipodensa, que captaba contraste de manera homogénea, situada en la confluencia de las cisuras mayor y menor derechas, infrahiliar, centrada en lóbulo medio, aunque con lobulaciones que invadían el segmento apical LID y el segmento anterior LSD, sugestiva de neoplasia broncopulmonar primaria. En la PET-TAC preoperatoria no existía evidencia de enfermedad metastásica. Se realizó neumectomía derecha con linfadenectomía aortopulmonar y subcarinal con un postoperatorio favorable.
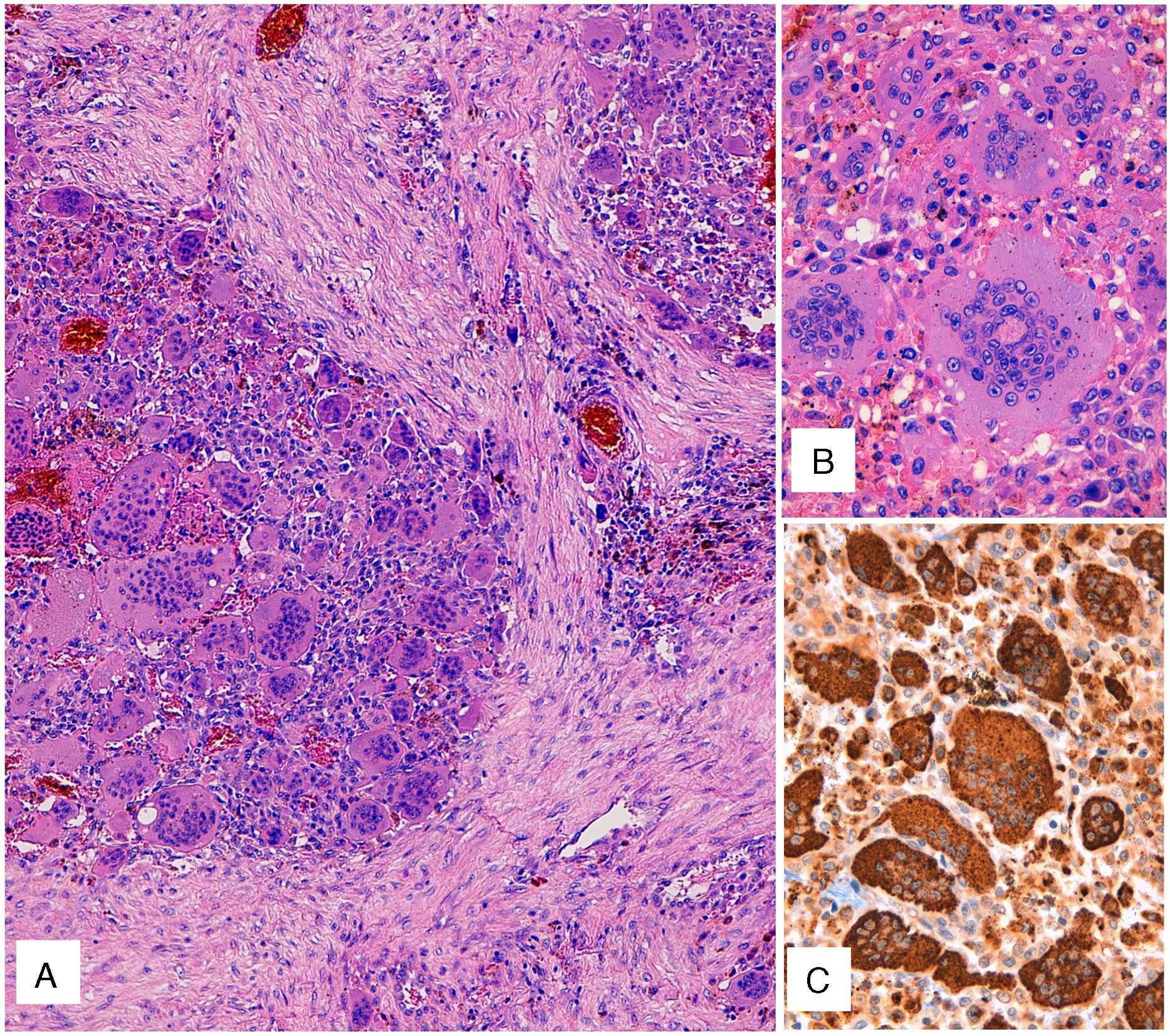
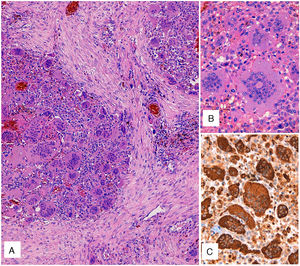
El estudio macroscópico de la pieza puso de manifiesto una masa multinodular de aspecto hemorrágico, de 7,6cm, localizada principalmente en lóbulo medio, con un nódulo satélite de 1,4cm en el mismo lóbulo. Histológicamente el tumor estaba constituido por una proliferación de patrón sólido con células mononucleares de tamaño medio y citoplasma eosinófilo. Los núcleos eran redondos u ovales, de cromatina finamente granular y presencia de nucléolos pequeños sin atipia citológica ni figuras de mitosis. Existían, además, numerosas células gigantes multinucleadas de tipo osteoclasto (fig. 1A), muchas de ellas con numerosos núcleos (fig. 1 B) sin atipia ni actividad mitósica significativa. Tras un amplio muestreo de la pieza, no se identificó componente de carcinoma, de sarcoma ni de otros tipos tumorales.
A) Tinción con hematoxilina-eosina. Proliferación celular de patrón sólido con células mononucleares y numerosas células gigantes multinucleadas de tipo osteoclasto. B) Detalle de las células gigantes de tipo osteoclasto, con numerosos núcleos sin atipia ni actividad mitósica significativa. C) Inmunotinción para CD68, tanto del componente mononuclear como de las células gigantes de tipo osteoclasto.
El estudio inmunohistoquímico fue positivo solo para CD68, tanto el componente mononuclear como las células gigantes de tipo osteoclasto (fig. 1C). La inmunorreacción resultó negativa para amplia batería de marcadores epiteliales (CK7, CK20, panCK [AE1/AE3], antígeno de membrana epitelial, CK34BE12), actina, desmina, CD34, TTF1, napsina, S100. Con estos datos, el diagnóstico fue de TCG.
A los 2meses y medio de la cirugía, el paciente acudió por dolor en la zona de la herida quirúrgica y en la región inguinal derecha. En la broncoscopia se observó un tumor intrabronquial en el muñón de la neumonectomía. En la TAC se identificaron 3lesiones de carácter metastásico: una en el tejido celular subcutáneo de la raíz del muslo izquierdo, otra en situación intramuscular del vasto externo izquierdo y una tercera lesión ósea del ilíaco izquierdo con destrucción cortical y masa de partes blandas asociada. Se realizó biopsia del muñón bronquial y de una de las lesiones metastásicas en la que se apreciaron similares características histológicas a las del tumor primario. En dichas muestras se realizó inmunotinción para p63, con resultado focalmente positivo.
Tras tratamiento oncológico paliativo, el paciente falleció a los 8 meses del diagnóstico.
El TCG representa el 4-5% de los tumores primarios de hueso y el pico de incidencia se encuentra entre los 20 y los 45 años (adultos jóvenes esqueléticamente maduros), con un ligero predominio en mujeres. La recidiva local es frecuente, pero las metástasis pulmonares se producen en el 2% de los casos. No existe ningún sistema de gradación con significación pronóstica1.
Los tumores puros de células gigantes extraóseos, con histología totalmente superponible a la de tumores óseos, son muy infrecuentes y se han descrito por orden de frecuencia en páncreas, mama, pulmón, estómago, glándula tiroides y tracto urinario; son especialmente infrecuentes en el pulmón2. Sobre esta entidad la nomenclatura ha sido confusa y la mera presencia de células gigantes no implica el diagnóstico de TCG, debido a que tumores de otro tipo también pueden presentar células gigantes de tipo osteoclasto.
El diagnóstico diferencial incluye la metástasis de un tumor de células gigantes primario óseo y los tumores mesenquimales o epiteliales malignos que contengan células gigantes de tipo osteoclasto.
La primera posibilidad se descarta por la ausencia de antecedentes de lesiones óseas y de tumores esqueléticos en el estudio preoperatorio y por la edad del paciente3. En el caso de existir un componente tumoral identificable adicional (carcinoma o sarcoma), el tumor debe ser clasificado a todos los efectos como carcinoma o sarcoma con células gigantes de tipo osteoclasto. En nuestro caso, dicho componente no fue identificado y los marcadores epiteliales fueron negativos, por lo que descartamos este último diagnóstico. Con relación a esta posibilidad, se describe en los TCG óseos la posibilidad de inmunotinción con p63, tal y como sucedió en el presente caso4. Se señala que esta tinción reafirma el diagnóstico de TCG frente a otros tumores. Es importante conocer esta posibilidad para evitar errores diagnósticos con el carcinoma de células escamosas, especialmente cuando los marcadores epiteliales son negativos.
De algunos estudios se deduce un comportamiento clínico más agresivo en las formas viscerales del TCG que en su contrapartida ósea, tal y como sucedió en nuestro caso3,5. Existen muy pocos casos descritos de TCG primarios de pulmón que cumplan criterios estrictos para este diagnóstico: ausencia histológica de asociación con otras neoplasias malignas (carcinoma o sarcoma). En la revisión de la literatura que hemos realizado, tan solo hemos encontrado 6 casos en total de TCG primarios de pulmón. De ellos, 3hombres, de 63, 61 y 40 años, respectivamente, y una mujer de 77. Solo existen datos de seguimiento de uno de los pacientes que se encontraba libre de enfermedad a los 15 meses. De los otros 3casos no pudimos acceder a datos clínicos ni epidemiológicos5-11.
En conclusión, presentamos un caso muy infrecuente de neoplasia pulmonar primaria con una patogénesis aún por esclarecer, un curso evolutivo agresivo y que plantea problemas de diagnóstico diferencial histopatológico. Es importante que nuevos casos sean publicados para establecer directrices en cuanto al pronóstico y tratamiento de estos tumores.