Debido a que los resultados del trasplante pulmonar son todavía inferiores a los obtenidos en otros trasplantes como el cardiaco, el renal o el hepático, los retos de la medicina se deben centrar en aumentar la supervivencia funcional de los injertos. La intervención provoca marcados cambios fisiopatológicos posquirúrgicos a nivel del parénquima pulmonar, la caja torácica, las vías aéreas y la circulación pulmonar. No obstante, el paciente está sometido a riesgos que es importante conocer y controlar, como las complicaciones atribuibles total o parcialmente al tratamiento inmunosupresor, entre ellas la patología cardiovascular, la aparición de tumores, infecciones y, por supuesto, la disfunción crónica del injerto.
El pronóstico del paciente va a depender, en gran medida, de la mayor o menor eficacia en prevenir, diagnosticar precozmente y en su caso tratar de forma adecuada las posibles complicaciones. Por ello, independientemente del tiempo postrasplante, los receptores son sometidos a una estrecha monitorización funcional y clínica. En este artículo revisaremos las alteraciones funcionales características del receptor de un trasplante pulmonar y la utilidad en el seguimiento del paciente de las diferentes técnicas diagnósticas.
Since the outcomes of lung transplants are still poorer than those obtained with others, such as heart, kidney or liver transplants, the challenge for medicine remains focused on prolonging functional graft survival. The procedure triggers significant post-surgical physiopathological changes in the lung parenchyma, the rib cage, the airways and pulmonary circulation. The patient is exposed to risks that must be identified and controlled, such as complications fully or partially attributable to immunosuppressive treatment, including cardiovascular disease, tumors and infections and, of course, chronic graft dysfunction.
The patient's prognosis will depend largely on the degree of efficacy in the prevention, early diagnosis and appropriate treatment of possible complications. Accordingly, regardless of how long it is since the transplantation, graft recipients undergo close functional and clinical monitoring. In this article, we will review the functional changes that characterize a lung transplant recipient and the usefulness of the various diagnostic techniques for patient follow-up.
Con los avances obtenidos durante los últimos años, el trasplante constituye la alternativa necesaria en el tratamiento de algunas enfermedades pulmonares irreversibles. El paciente deberá afrontar los riesgos derivados del tratamiento inmunosupresor y del desarrollo de alteraciones en el pulmón trasplantado. La estricta monitorización del paciente permitirá sospechar y diagnosticar las complicaciones previsibles en una fase temprana fácilmente reversible, y antes de que sus manifestaciones sean floridas e irreversibles. El protocolo de seguimiento debe adaptarse a cada paciente individualmente y a cada momento en concreto en función del tiempo trascurrido desde el trasplante y de su evolución.
Los objetivos del seguimiento postrasplante son mantener el grado de inmunosupresión óptimo de cada paciente en concreto, intentando maximizar la eficacia de los fármacos y minimizando su toxicidad, y detectar y controlar los posibles efectos secundarios sistémicos de los fármacos1-4 (tabla 1) y las complicaciones generadas sobre el injerto como son la disfunción precoz, las infecciones, el desarrollo de tumores y el rechazo agudo y crónico del injerto.
Principales efectos secundarios de los fármacos inmunosupresores
| Fármaco | Efecto adverso |
| Esteroides | Hipertensión, hiperlipidemia, hipocalcemia-osteoporosis, aumento ponderal, cataratas, alteraciones psicológicas |
| Antimetabolitos (micofenolato, azatioprina) | Mielosupresión, hepatotoxicidad, alopecia, intolerancia gastrointestinal, pancreatitis aguda, infecciones, procesos malignos |
| Inhibidores de la calcineurina (ciclosporina, tacrolimus) | Nefrotoxicidad, hipertensión, hiperuricemia, hipercaliemia, diabetes, hiperlipidemia, neurotoxicidad, hiperplasia gingival, infecciones, enfermedad linfoproliferativa |
| Inhibidores de los m-TOR (everolimus, rapamicina) | Hiperlipidemia, diabetes, edemas, proteinuria, neumonitis |
El conocimiento de la evolución funcional del órgano trasplantado es una herramienta imprescindible en el manejo del paciente. Los cambios fisiopatológicos posquirúrgicos se ven influidos en gran medida por factores como la denervación irreversible del injerto y la afectación muscular. Los nervios aferentes y eferentes son seccionados durante la cirugía sin que haya evidencia de reinervación posterior. Por ello, aunque el paciente alcance una recuperación prácticamente completa de la función pulmonar, la tolerancia al ejercicio suele estar disminuida, y existen alteraciones en la respuesta a la hipercapnia, en el reflejo tusígeno y en el aclaramiento mucociliar. La evolución funcional del trasplante se puede evaluar a través de la máxima función posquirúrgica, la tolerancia al esfuerzo, la calidad de vida y la supervivencia.
Máxima función posquirúrgicaLa cicatrización del trauma quirúrgico y la adaptación del injerto a la caja torácica del receptor condicionan una mejora funcional progresiva.
La función pulmonar postoperatoria depende del tipo de trasplante —unilateral o bilateral—, de la enfermedad de base y de las complicaciones postoperatorias5.
En los receptores de trasplante bilateral la máxima función pulmonar postoperatoria es independiente de la enfermedad de base y está condicionada por las características del injerto, de la caja torácica del receptor y de las complicaciones postoperatorias. A los 6-9meses de la intervención se puede alcanzar cifras de FEV1 entre 75-86% y de FVC del 66 al 92%. En los primeros meses de la cirugía se observa un trastorno restrictivo leve, que se normaliza a partir del sexto mes, y que es debido a 2 mecanismos diferentes: a la alteración en la mecánica de la pared torácica secundaria a la toracotomía, y a la disparidad de volumen entre el injerto y la capacidad torácica del receptor. La DLCO y el intercambio de gases suelen ser normales a partir del tercer mes, y la tolerancia al ejercicio mejora progresivamente con el paso del tiempo6,7.
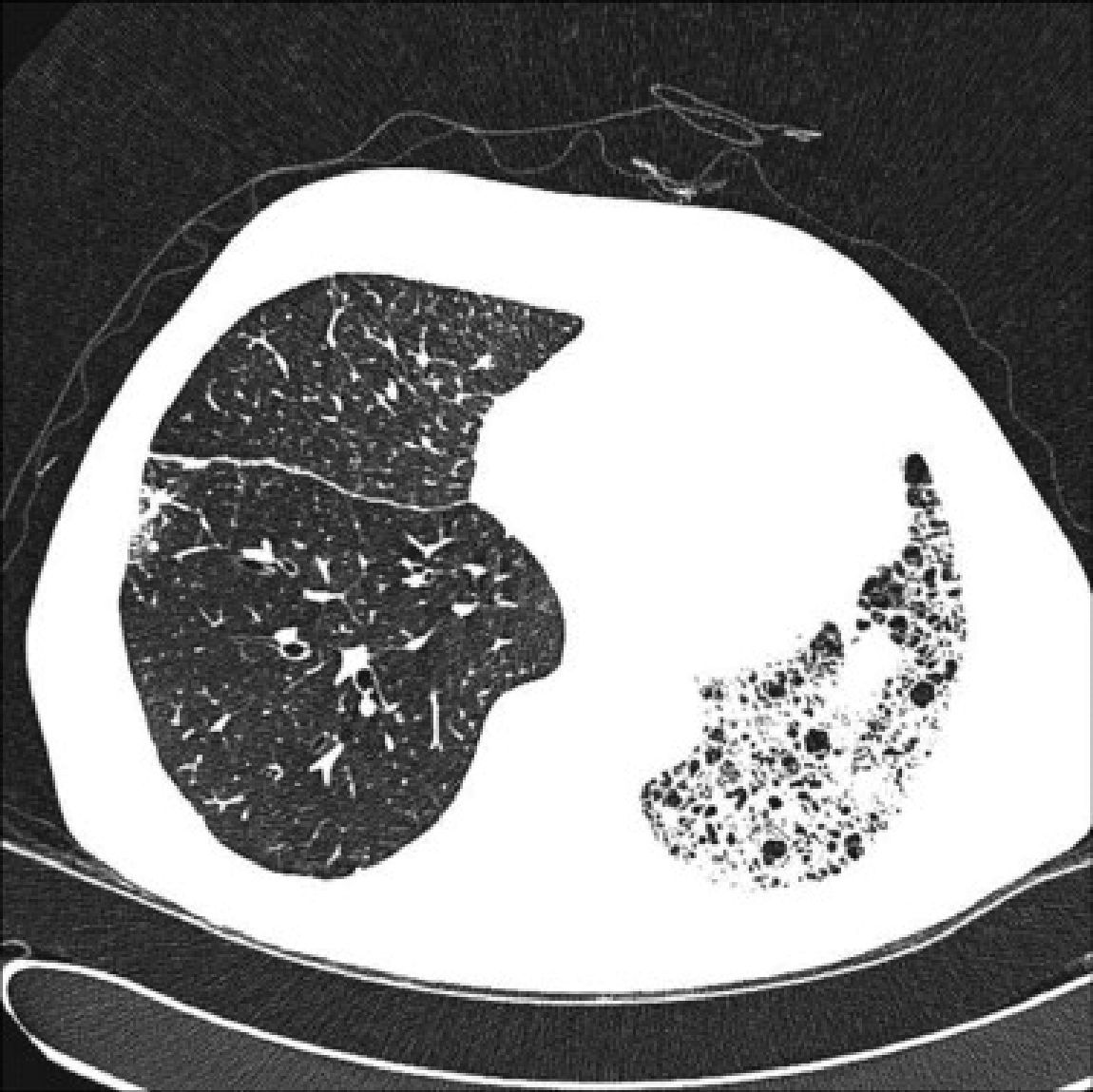
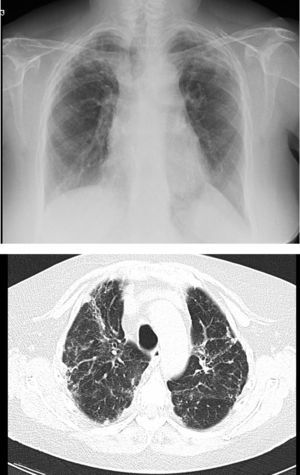
En los receptores de trasplante unilateral la función pulmonar se estabiliza de forma más precoz, alrededor del tercer mes, por el menor trauma quirúrgico. En estos pacientes la máxima función pulmonar es menor que en los receptores de trasplante bilateral, y depende, además, de las características del pulmón nativo residual. En los receptores afectos de patología intersticial el pulmón nativo tiende a colapsarse, por lo que el injerto se expande libremente en el hemitórax correspondiente (fig. 1). Puede persistir un trastorno restrictivo leve o moderado, y alteraciones de la difusión debido a la persistencia del pulmón nativo8.
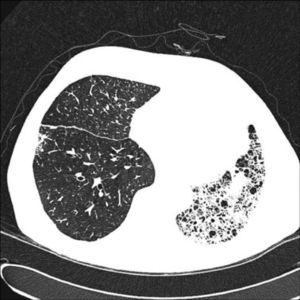
Cuando la enfermedad de base es el enfisema, el pulmón nativo residual tiende a distenderse y a herniarse en el hemitórax contralateral colapsando parcialmente el injerto (fig. 2). El atrapamiento aéreo progresivo produce hiperinsuflación en el pulmón nativo, que no suele ocasionar complicaciones cuando el injerto funciona de forma adecuada. En ocasiones la distensión progresiva del pulmón enfisematoso puede comprometer la función del injerto, por lo que es necesario realizar cirugía de reducción de volumen en el pulmón nativo. La interferencia del pulmón enfisematoso condiciona que la mejoría funcional sea menor en estos receptores que en los afectos de patología intersticial. Se observa también mejoría de los volúmenes pulmonares, de la DLCO, del intercambio de gases y de la capacidad de ejercicio9.
Tolerancia al esfuerzoTras el trasplante pulmonar existe una mejoría muy importante en la capacidad ventilatoria que no se correlaciona en muchos casos con el aumento de la capacidad de ejercicio. Existe una rápida mejoría en la tolerancia al ejercicio en el test de los 6min de marcha que aparece tras 3-6meses del trasplante. No obstante, los receptores de trasplante pulmonar presentan una disminución en el consumo máximo de oxígeno medido durante la prueba de esfuerzo que no es atribuible a alteraciones cardiacas, pulmonares, anemia u otra causa subyacente. Los pacientes atribuyen fundamentalmente su limitación durante el ejercicio al desarrollo de fatiga muscular. La frecuente malnutrición preoperatoria, asociada a debilidad muscular y desacondicionamiento físico con pérdida de masa muscular, son responsables en parte de la limitación en la tolerancia al ejercicio. Algunos estudios han observado una disminución de la actividad mitocondrial, con atrofia de las fibras tipo2 y descenso en el número de fibras tipo1, que podría estar en relación con la hipoxemia crónica10. En biopsias de los músculos intercostales se ha observado una disminución preoperatoria de la capacidad oxidativa11,12.
El tratamiento inmunosupresor postrasplante, especialmente los anticalcineurínicos como la ciclosporina y el tacrolimus, y los corticoides, pueden contribuir en la persistencia de las alteraciones musculares.
Calidad de vidaDistintos estudios han demostrado que la calidad de vida de los receptores de trasplante es mejor que la de los candidatos, y las mejoras de la calidad de vida suelen mantenerse en el tiempo hasta el desarrollo de rechazo crónico13,14.
Aunque los receptores tienen mejor salud general, física y psicológica que los candidatos, ambos presentan en relación con la población normal mayores problemas de ansiedad, autoestima y depresión. Esto debemos tenerlo en cuenta en el seguimiento clínico del paciente y, ante la sospecha, valorar la conveniencia de remitir al psicólogo o al psiquiatra.
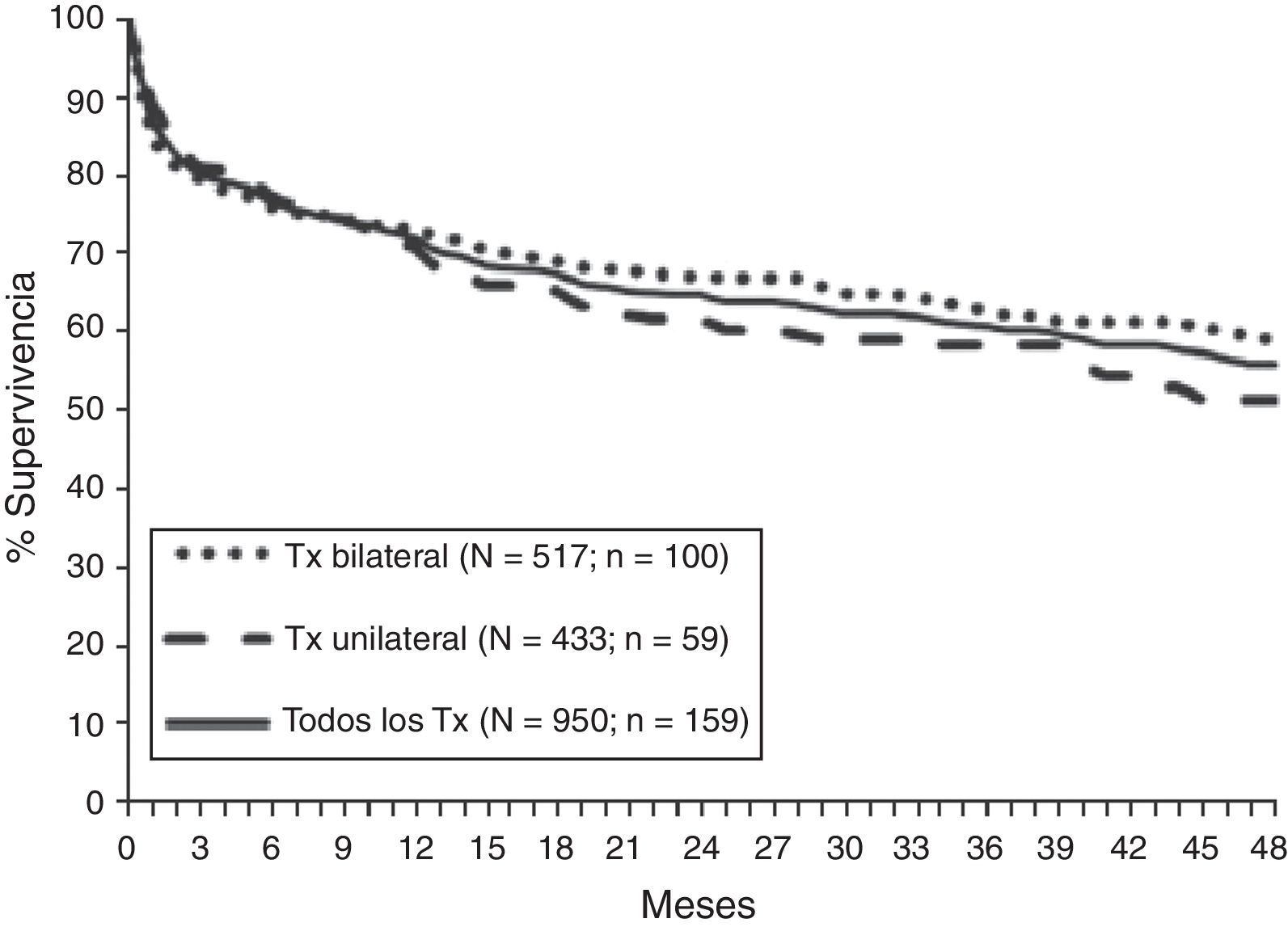
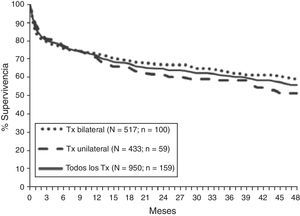
SupervivenciaSegún los datos del Registro Internacional la supervivencia global del trasplante pulmonar es de alrededor del 79% al primer año, del 64% a los 3años, del 53% a los 5años y del 30% a los 10años de la intervención Se aprecia un aumento de la supervivencia tanto a corto como a largo plazo en la última década15. Estos datos son similares a los obtenidos en el Registro Español con una supervivencia no ajustada a los 3meses, al año y a los 3años del 79, del 71 y del 60%, respectivamente (fig. 3)16.
Por enfermedades, los pacientes con EPOC y fibrosis quística son los que presentan una mejor supervivencia precoz, mientras que la fibrosis quística y la hipertensión pulmonar presentan mejor supervivencia a los 10años del trasplante pulmonar15.
Seguimiento postrasplanteLa precocidad y la sensibilidad de las pruebas utilizadas para la monitorización del estado del injerto son fundamentales para detectar alteraciones en la evolución funcional habitual. Entre las principales herramientas se encuentran:
Pruebas de función pulmonarLa espirometría forzada se realiza periódicamente y de forma rutinaria en el seguimiento de estos pacientes. A lo largo de la evolución postoperatoria se producen variaciones en el volumen espiratorio máximo en el primer segundo (FEV1) que son consideradas «normales». Esta variabilidad en los valores espirométricos es más marcada durante el primer año y en los receptores de trasplante unilateral. Con objeto de valorar adecuadamente las variaciones del FEV1 es preciso calcular el FEV1 basal postoperatorio, que se define como la media de los 2 valores más altos, no necesariamente consecutivos, obtenidos al menos con 3semanas de diferencia, sin la administración previa de ningún fármaco broncodilatador. Dado que la función pulmonar mejora con el tiempo postrasplante, el FEV1 basal debe ser recalculado de forma periódica. El deterioro en el FEV1 puede indicar múltiples problemas, como rechazo agudo o crónico, infección o hiperinsuflación del pulmón nativo. Se considera un criterio de síndrome de bronquiolitis obliterante (BOS) cuando las cifras del FEV1 descienden más del 20% en 2 medidas consecutivas entre 3-6semanas respecto al basal, tras excluir otras causas como infección, rechazo agudo o alteraciones de la anastomosis bronquial17,18. Y además, la caída del FEV1 debe acompañarse del descenso del índice FEV1/FVC, ya que, en pacientes en los que el FEV1 baje en el contexto de un defecto ventilatorio restrictivo no se considera como BOS. Según lo acordado por ISHLT en 1993, la gravedad del BOS se pondera en función de la disminución del FEV1 respecto al basal (tabla 2). Aunque el descenso del FEV1 sigue siendo el criterio de función pulmonar que establece el diagnóstico de BOS, los parámetros que miden la obstrucción de la vía área pequeña, como el FEF25-75%, pueden preceder al descenso del FEV1 y resultar útiles en la detección precoz del BOS19,20. Los parámetros funcionales que traducen las alteraciones de la vía aérea pequeña no han sido utilizados de forma rutinaria por su gran variabilidad intraindividual, en especial en los receptores de trasplante unilateral, en los que las variaciones funcionales en el pulmón nativo residual actúan siempre como factor de confusión. Sin embargo, algunos autores han observado que estos parámetros tienen una alta sensibilidad para la detección precoz del BOS incluso antes de que comience a observarse el descenso del FEV1. Por ello, en la clasificación del BOS se incluyó el estadio BOSO-p, en el que se afecta exclusivamente el FEF25-75%21.
Estadios de clasificación del síndrome de bronquiolitis obliterante (BOS)
| Estadios | Criterios funcionales |
| BOS O | FEV1 >90% del basal y FEF >75% del basal |
| BOS O-p | FEV1 81-90% del basal y/o FEF ≤75% del basal |
| BOS 1 | FEV1 66-80% del basal |
| BOS 2 | FEV1 51-65% del basal |
| BOS 3 | FEV1 ≤50% del basal |
Fuente: Estenne et al.19.
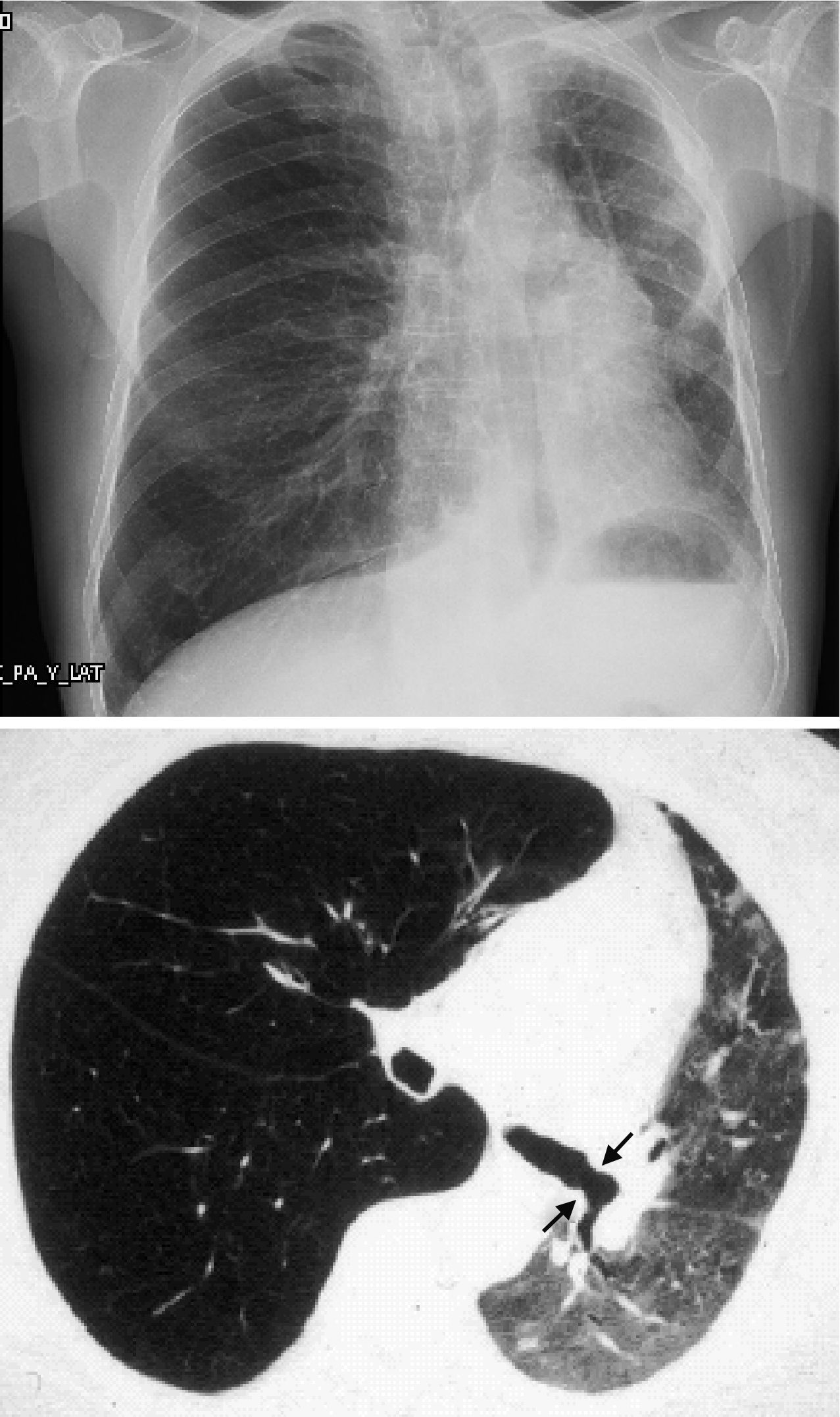
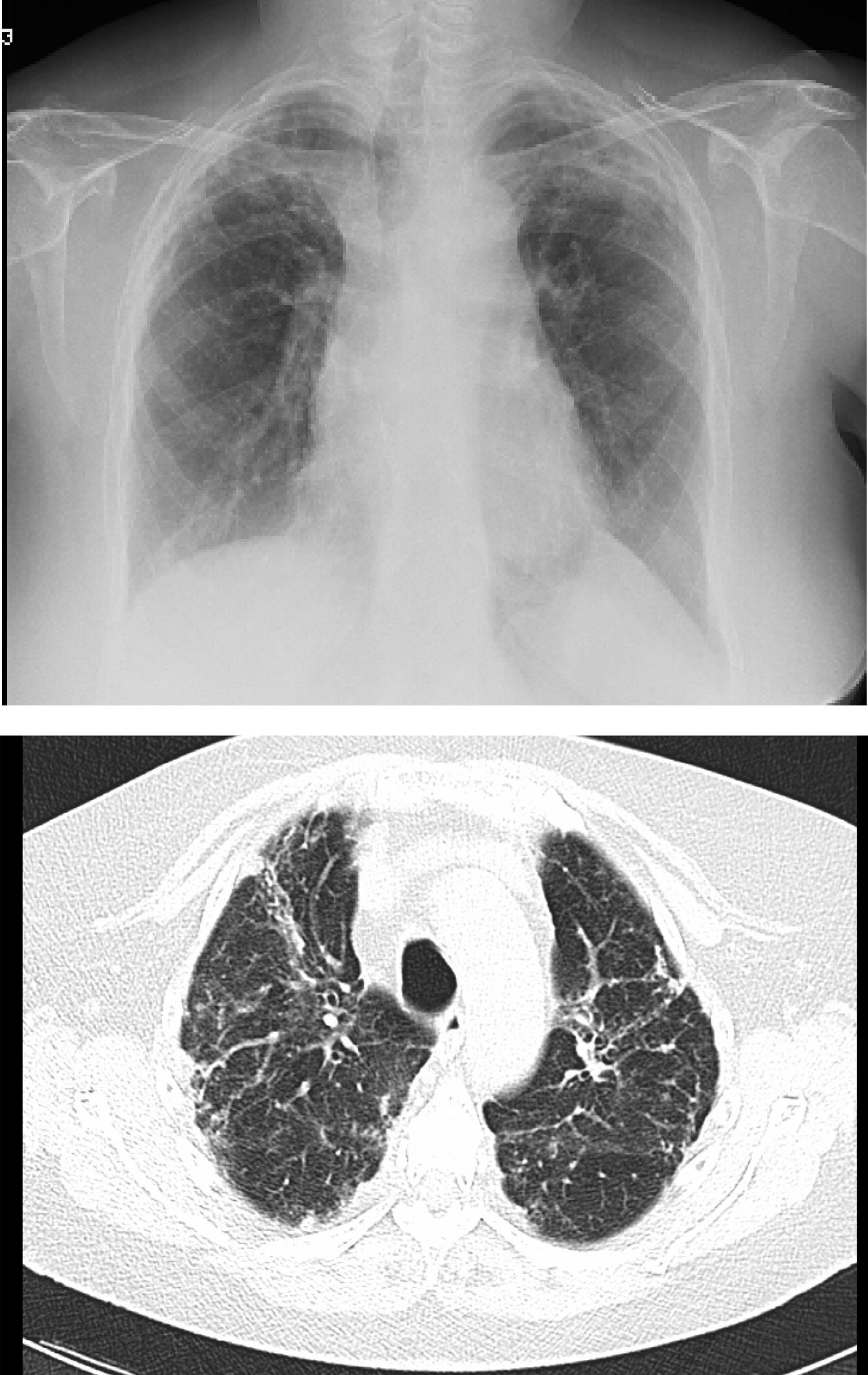
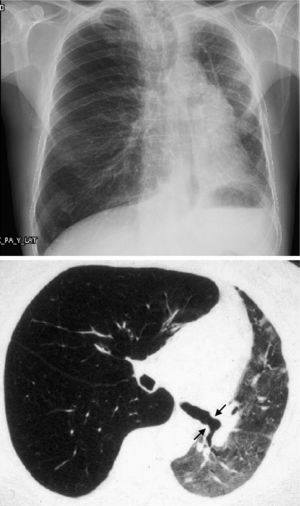
Pero el BOS no es la única forma de manifestarse el rechazo crónico: Se han descrito otros patrones diferentes al obstructivo, que no quedan incluidos con esta definición. La disfunción crónica del injerto (CLAD) probablemente sea mejor concepto que el BOS para definir el declinar crónico del FEV1. En los últimos años se ha visto que la CLAD muestra una condición heterogénea definiendo diferentes fenotipos, entre los que se encuentran, además del clásico BOS, otros patrones que incluyen reversibilidad parcial a la obstrucción de la vía aérea, deterioro ventilatorio restrictivo y alteraciones en el parénquima pulmonar22. La disfunción del injerto neutrofílica reversible (NRAD) se caracteriza por presentar neutrofilia en la vía aérea (lavado broncoalveolar [BAL] >15% neutrófilos) y mejoría funcional (>10% del FEV1) tras el tratamiento con azitromicina23-26. El síndrome del injerto restrictivo (RAS) representa el 25-35% de las CLAD y se define por una caída en la capacidad pulmonar total (TLC) mayor del 10% respecto al valor basal y fibrosis de predomino en lóbulos superiores (fig. 4). Progresa de forma más rápida y tiene peor pronóstico que el BOS27,28.
Cambios de fibrosis pulmonar en lóbulos superiores en paciente diagnosticada de síndrome del injerto restrictivo (radiografía de tórax y TAC de tórax).
Fuente: Registro Español de Trasplante Pulmonar: primer informe de resultados (2006-2010)16.
Por tanto, en el seguimiento rutinario postrasplante debemos realizar pruebas funcionales completas que incluyan volúmenes pulmonares.
Para detectar precozmente alteraciones del injerto es de gran utilidad la monitorización domiciliaria de la función pulmonar con un espirómetro portátil29. Antes del alta hospitalaria el paciente es entrenado en el manejo del espirómetro domiciliario para realizar 3 determinaciones de FVC y FEV1 por la mañana y por la noche. Cuando se produce un descenso de más del 10% de los valores basales del FEV1, el paciente debe consultar con su centro de referencia. Si se confirma la disminución de la función pulmonar en la espirometría convencional, es preciso realizar una evaluación exhaustiva del paciente que incluya radiología de tórax y fibrobroncoscopia con BTB y BAL, para descartar rechazo o infección intercurrente.
Óxido nítrico exhaladoEl óxido nítrico es sintetizado en las células del tracto respiratorio a partir de la L-arginina, y puede ser determinado en el aire exhalado (eNO). Las determinaciones de eNO son reproducibles en los individuos sanos, y los niveles de eNO medidos en la boca se correlacionan bien con los que se miden a nivel de las vías respiratorias inferiores30,31. Los niveles de eNO se elevan en presencia de procesos inflamatorios de la vía aérea, como en el asma o las infecciones bronquiales. En el trasplante pulmonar se ha observado que los pacientes con BOS presentan niveles de eNO elevados, y que dicha elevación precede en el tiempo al desarrollo de obstrucción de la vía área. En determinaciones seriadas durante el seguimiento postrasplante, diversos estudios han observado que la elevación de eNO se produce hasta 6meses antes del diagnóstico de BOS32. La detección precoz del BOS en la fase inflamatoria de la enfermedad podría ser de utilidad al permitir el tratamiento antes de que se desarrollen las lesiones fibróticas irreversibles de la vía aérea33.
El eNO aumenta en las fases iniciales del BOS cuando predominan los procesos inflamatorios sobre los fibróticos, sin observase diferencias significativas entre los receptores de trasplante unilateral o bilateral. En ausencia de actividad inflamatoria los niveles de eNO se normalizan, por lo que no se observan diferencias en los niveles de eNO de los pacientes con BOS estable, receptores libres de BOS y el grupo control30.
Aunque diversos estudios han observado que el eNO es una prueba muy sensible para el diagnóstico de BOS, su especificidad es baja, sobre todo cuando se realiza solo una determinación, ya que otros factores como la infección, especialmente bacteriana, pueden producir su elevación.
Monitorización inmunológicaLa técnica ImmuKnow® (Cylex) permite medir el estado de la inmunidad celular en sangre periférica.
La respuesta global inmune se cuantifica determinando el ATP liberado por los linfocitos CD4+ tras la estimulación in vitro con fitohemaglutinina (PHA).
Los estudios realizados en pacientes con trasplante renal y hepático han observado una buena correlación entre el desarrollo de rechazo y/o infecciones y los valores de ImmuKnow® por debajo o por encima de los observados en receptores estables34.
En pacientes con trasplante pulmonar se han observado niveles bajos de ImmuKnow® en receptores con infección en comparación con los no infectados, sin poder identificar niveles asociados con rechazo del injerto35–37.
La FDA ha aprobado recientemente el ImmuKnow® como herramienta de seguimiento del estado de inmunosupresión en sangre periférica en receptores de trasplante. No obstante, el valor de corte indicativo de riesgo de rechazo o infección puede variar de una población a otra, y existe solo un estudio en receptores de trasplante pulmonar.
BroncoscopiaEste tipo de exploración preferiblemente debe ser realizada en el centro trasplantador. Permite diagnosticar alteraciones en la sutura bronquial, episodios de rechazo y ciertas infecciones o colonizaciones que requieren tratamiento precoz o anticipado.
La fibrobroncoscopia con BAL permite realizar estudios histológicos (biopsia transbronquial), bacteriológicos (cultivos del BAL) y citológicos (recuento celular y proteínas) para controlar el estado del injerto38-40. Puede realizarse por indicación clínica tras la aparición de síntomas (tos, disnea, fiebre) con o sin descenso de los parámetros espirométricos, o por control rutinario del injerto.
Múltiples estudios41,42 han valorado proteínas y células en el BAL y su correlación con el rechazo agudo, entre ellos la elevación de linfocitos TCD8, la activación de linfocitos TCD4, la activación de células NK43 y la elevación de IL-1744, de IL-1545 y de interferón gamma46. Ningún marcador ha sido suficientemente validado para identificar pacientes con rechazo agudo con adecuada especificidad y ninguno suplanta directamente al estudio histológico del tejido pulmonar. De la misma forma, se ha tratado de identificar en diferentes estudios biomarcadores en el BAL que ayuden a detectar de forma precoz la CLAD. El predominio neutrofílico en el BAL, que en algunos casos llega a ser superior al 20%, se ha observado en pacientes con alto riesgo de desarrollar rechazo crónico, y ha ayudado a identificar un subtipo de disfunción crónica del injerto que responde funcionalmente al tratamiento con azitromicina (NRAD). En el caso de no respuesta o posterior deterioro, la neutrofilia en el BAL se ha identificado como factor predictor de estabilidad funcional al tratamiento de segunda línea con fotoaféresis47. Otras citoquinas relacionadas con el desarrollo de bronquiolitis obliterante son las relacionadas con la inflamación (IL-8, MCP-1), el estrés oxidativo (mieloperoxidasas, MPO), y el remodelado de la matriz extracelular (metaloproteinasas, MMP-2, MMP-9)48.
La broncoscopia realizada por indicación clínica presenta una gran rentabilidad diagnóstica (75-95% para el rechazo agudo) y baja morbimortalidad, siempre que se realice en ausencia de contraindicaciones absolutas49. En ausencia de síntomas, el control rutinario del injerto mediante fibrobroncoscopia protocolizada se encuentra actualmente en discusión, ya que, aunque permite diagnosticar episodios de rechazo asintomáticos, no parece modificar la supervivencia de los pacientes. Valentine et al.50 mostraron a 3años que la supervivencia en pacientes con broncoscopias indicadas clínicamente era comparable a los que la tenían protocolizada. Además, experiencias actuales51,52 han demostrado que existe una gran variabilidad interobservador en la interpretación de la biopsia transbronquial por parte del patólogo, por lo que la sospecha clínica pretest y la evolución funcional son esenciales para el diagnóstico de rechazo agudo.
Pruebas de imagenLa radiografía de tórax se realiza de forma rutinaria en la fase temprana postrasplante, cada 3-6meses en la fase tardía, y siempre que exista una indicación clínica. La gammagrafía de perfusión pulmonar cuantificada nos hace sospechar estenosis en la sutura de la arteria pulmonar si observamos déficit de perfusión en el pulmón trasplantado. La TAC durante el primer mes de la cirugía permite detectar alteraciones en la anastomosis vasculares y/o del parénquima pulmonar, posteriormente no parece aportar ventajas en cuanto al diagnóstico precoz de la bronquiolitis obliterante, por lo que estaría indicado solicitarlo si la clínica o las pruebas de función pulmonar sugirieran cualquier alteración no visible en la radiografía de tórax53,54.
ConclusiónEl trasplante pulmonar es un procedimiento complejo y costoso que involucra a una gran cantidad de profesionales antes, durante y después de la cirugía. Sus resultados no son todo lo óptimos que cabría esperar, pero actualmente constituye la única opción terapéutica capaz de mejorar la supervivencia y la calidad de vida de algunos pacientes con enfermedad pulmonar en fase final.
El éxito del trasplante pulmonar depende de una monitorización cuidadosa del paciente y de su injerto encaminada a identificar los problemas en una fase temprana en la que el tratamiento pueda influir en su evolución, y esto es especialmente importante en lo que se refiere a la bronquiolitis obliterante, que es el principal condicionante de los resultados del trasplante pulmonar a medio y a largo plazo. Los métodos actuales de seguimiento, como la espirometría y la fibrobroncoscopia, son bastante específicos pero poco sensibles, por lo que es de esperar el desarrollo futuro de nuevas herramientas de seguimiento que resulten más sensibles, más específicas y no invasivas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.