Los grupos de Tabaquismo y de Enfermedades Pulmonares Intersticiales Difusas (EPID) de ALAT y SEPAR han colaborado para la realización de este documento.
Material y métodosEn el mismo se da respuesta, siguiendo metodología PICO, a diferentes interrogantes sobre la relación entre el consumo de tabaco y las EPID.
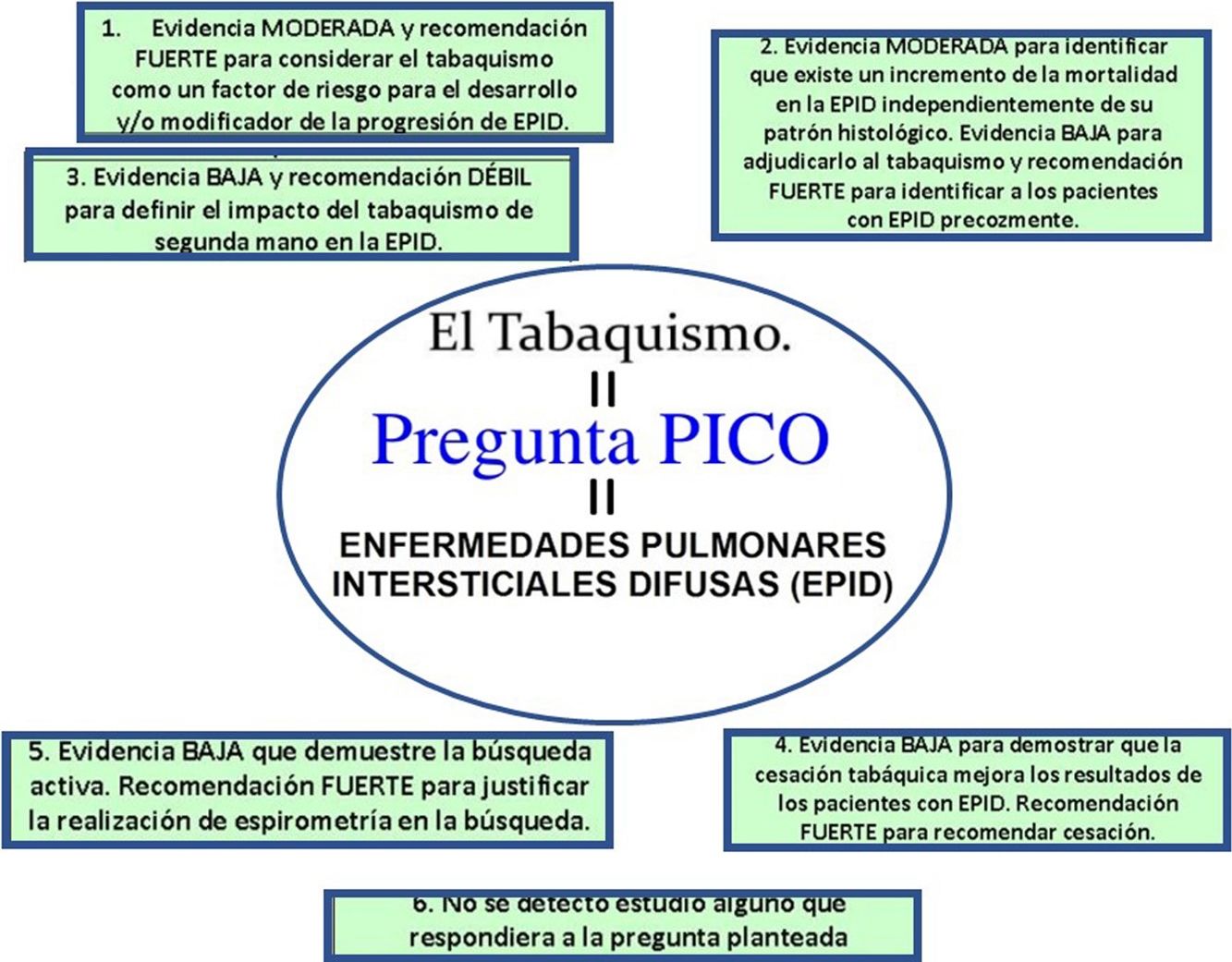
Resultados y conclusionesSus principales recomendaciones son: a) evidencia moderada y recomendación fuerte para considerar el tabaquismo como un factor de riesgo para el desarrollo y/o modificador de la progresión de EPID; b) evidencia moderada para identificar que existe un incremento de la mortalidad en la EPID independientemente de su patrón histológico. Evidencia baja para adjudicarlo al tabaquismo y recomendación fuerte para identificar a los pacientes con EPID precozmente. Se hacen necesarios nuevos estudios que evalúen el efecto de la cesación tabáquica en los pacientes con EPID; c) evidencia baja y recomendación débil para definir el impacto del tabaquismo de segunda mano en la EPID; d) evidencia baja para demostrar que la cesación tabáquica mejora los resultados de los pacientes diagnosticados de EPID y recomendación fuerte para aconsejar la cesación tabáquica en casos de EPID en fumadores, y e) evidencia baja que demuestre la utilidad clínica o epidemiológica de la búsqueda activa de los casos de EPID en los programas de cesación tabáquica y recomendación fuerte para justificar la realización de espirometría durante esta búsqueda independientemente del estatus actual de tabaquismo pero con la dosis acumulada previamente, aun en casos asintomáticos.
The Smoking and the Diffuse Interstitial Lung Diseases (ILD) groups of ALAT and SEPAR collaborated in the preparation of this document.
Materials and methodsThis document uses PICO methodology to answer various questions on the relationship between tobacco use and diffuse ILD.
Results and conclusionsThe main recommendations are: a) moderate level of evidence and strong recommendation to consider smoking as a risk factor for the development and/or modification of the progression of diffuse ILD; b) moderate level of evidence to identify an increase in mortality in diffuse ILD, irrespective of histologic pattern. Low evidence for ascribing it to smoking and strong recommendation for the early identification of patients with diffuse ILD. Further studies are needed to evaluate the effect of smoking cessation in patients with diffuse ILD; c) low level of evidence and weak recommendation for defining the impact of passive smoking in diffuse ILD; d) low level of evidence to demonstrate that smoking cessation improves the outcomes of patients diagnosed with diffuse ILD and strong recommendation to advise smoking cessation in smokers with diffuse ILD, and e) low level of evidence to support the clinical or epidemiological usefulness of active case finding for diffuse ILD in smoking cessation programs, and strong recommendation justifying the performance of spirometry in active case finding, based not on current smoking status, but on previous accumulated consumption, even in asymptomatic cases.
El tabaquismo está implicado en un grupo heterogéneo de enfermedades pulmonares intersticiales difusas (EPID) con una asociación variable entre ellas; con un espectro que va desde una asociación causal en la bronquiolitis respiratoria con enfermedad pulmonar intersticial, en la neumonía intersticial descamativa y en la histiocitosis pulmonar de células de Langerhans hasta aquellas donde el tabaco actúa como un cofactor, como en la fibrosis pulmonar idiopática (FPI) y en las enfermedades intersticiales asociadas a enfermedad del tejido conectivo1. La siguiente revisión discute una serie de preguntas de interés actual relativas al tabaquismo y las EPID.
Los grupos de control y tratamiento del Tabaquismo y de Enfermedades Intersticiales de la Asociación Argentina de Medicina Respiratoria (AAMR), de la Asociación Latinoamericana del Tórax (ALAT) y de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) han colaborado para la realización de este documento en el que se da respuesta, siguiendo metodología con preguntas en formato PICO, a diferentes interrogantes clínicos relacionados con la asistencia sanitaria desde 2 enfoques (tabaco e intersticio) de este problema de salud tan complejo y heterogéneo.
MetodologíaFormación del grupo colaborador de la guía y formulación de preguntas clínicasEn reunión presencial (junio 2018) se discutió la metodología y se seleccionaron los escenarios clínicos para abordar las preguntas a desarrollar. Se realizó una primera búsqueda exhaustiva que permitiera definir la factibilidad para responder, basada en evidencias científicas, las preguntas inicialmente planteadas; posteriormente a través de teleconferencias y correos electrónicos se discutieron y acordaron las preguntas finales a contestar (tabla 1). Se formaron pares de trabajo (expertos en tabaquismo y expertos en intersticio) con la participación de miembros de 3 sociedades médicas involucradas.
Términos MeSh para la búsqueda ampliada de las preguntas PICO
| 1) Tabaquismo y EPID: 47 resultados (octubre 2018) |
| Search («Tobacco Smoke Pollution»[Mesh] OR pollution, tobacco smoke OR pollutions, tobacco smoke OR smoke pollution, tobacco OR smoke pollution, tobacco OR tobacco smoke pollutions OR environmental tobacco smoke pollution OR environmental smoke pollution, tobacco OR air pollution, tobacco smoke OR environmental pollution, tobacco smoke OR smoking, passive passive smoking OR smoking, passive OR second hand smoking OR second hand smoking OR smoking, second hand OR smoking, second hand second hand smoke OR hand smoke, second OR hand smoke, second OR second hand smoke OR smoke, second hand OR smokes, second hand second hand smoke OR second hand smoke OR smoke, second hand OR smokes, second hand OR involuntary smoking OR involuntary smoking OR smoking, involuntary OR smoking, involuntary OR passive smoking)) AND («Lung Diseases, Interstitial»[Mesh] OR Lung Disease, Interstitial OR Interstitial Lung Diseases OR Diffuse Parenchymal Lung Diseases OR Pneumonia, Interstitial OR Interstitial Pneumonia OR Interstitial Pneumonias OR Pneumonias, Interstitial OR Pneumonitis, Interstitial OR Interstitial Pneumonitides OR Interstitial Pneumonitis OR Pneumonitides, Interstitial) Sort by: Best Match |
| 2) EPID y cesación tabáquica: 176 resultados (octubre 2018) |
| Search («Lung Diseases, Interstitial»[Mesh] OR Lung Disease, Interstitial OR Interstitial Lung Diseases OR Diffuse Parenchymal Lung Diseases OR Pneumonia, Interstitial OR Interstitial Pneumonia OR Interstitial Pneumonias OR Pneumonias, Interstitial OR Pneumonitis, Interstitial OR Interstitial Pneumonitides OR Interstitial Pneumonitis OR Pneumonitides, Interstitial)) AND (((cessation, smoking OR cessations, smoking OR smoking cessation) OR «Smoking Cessation»[Mesh]) |
Con la finalidad de concentrar la búsqueda de las evidencias disponibles, todas las preguntas clínicas fueron transformadas al formato PICO o su variante PECO: Paciente (Problema o Población), Intervención o Exposición, Comparación y Outcome (desenlace relevante)2.
La estrategia de búsqueda bibliográfica se realizó simultáneamente en 2 metabuscadores: Tripdatabase y PubMed mediante el uso del MeSh (tabla 1). Se siguió un abordaje en 2 direcciones: desde la importancia del tabaco en las EPID y el impacto de la cesación tabáquica sobre las EPID.
Criterios de elegibilidadPara evaluar los resultados obtenidos de las preguntas PICO se priorizó la selección al nivel más alto de evidencia que mejor respondiera a la pregunta clínica. Si esto no era posible se seleccionaron estudios de nivel moderado o bajo en la jerarquización de evidencias. Se siguió la recomendación de selección algorítmica, principalmente para las preguntas terapéuticas3. Se consideraron publicaciones en idiomas español, portugués e inglés. La fecha de cierre de la última búsqueda fue octubre de 2018. En la tabla 2 se resumen los resultados de la búsqueda y el tipo de estudio seleccionado para responder las preguntas PICO.
Cantidad y tipo de trabajos seleccionados para responder las preguntas clínicas
| Pregunta clínica | Número de referencias para responder la pregunta y tipo de estudio seleccionado |
|---|---|
| ¿Es el tabaquismo un factor de riesgo para el desarrollo o progresión de EPID? | 1 Estudio de casos y controles73 Estudios de cohorte8–10 |
| ¿Las EPID están asociadas a aumento de mortalidad en fumadores? | 5 Estudios de cohorte11–15 |
| ¿Cuál es la importancia del tabaquismo de segunda mano en la EPID? | 1 Estudio observacional17 |
| ¿La cesación tabáquica puede mejorar los resultados del paciente diagnosticado de EPID? | 1 Estudio de casos y controles221 Estudio de cohorte23 |
| ¿Se justifica la búsqueda activa de los casos de EPID durante los programas de cesación tabáquica? | 1 Estudio de cohorte24 |
| ¿El tabaquismo activo influye en la eficacia y seguridad de los fármacos antifibróticos utilizados en pacientes con fibrosis pulmonar idiopática? | NA |
Para el análisis crítico de las referencias seleccionadas se usaron las recomendaciones y plantillas propuestas por la red CASPE (www.redcaspe.org). Se utilizó el «ACCP grading system» que clasifica las recomendaciones en FUERTE1 o DÉBIL2 de acuerdo con el balance entre riesgo, beneficio, carga y, en ocasiones, el coste. La calidad de la evidencia fue clasificada en ALTA (A), MODERADA (B) o BAJA (C) según el diseño del estudio, consistencia de los resultados y claridad de la evidencia para responder a la pregunta PICO4.
Los autores propusieron un grupo de revisores externos con experiencia en el campo de las EPID y el tabaquismo, que aparece en la sección de «Autores y colaboradores».
Alcance y objetivosEl principal objetivo de este documento es proporcionar a todos los profesionales sanitarios en general y, en particular, a aquellos que trabajan en los ámbitos asistenciales del tabaquismo y las EPID, información científica actualizada sobre algunas preguntas clínicas relevantes para el manejo del tabaquismo en pacientes con EPID, así como para el diagnóstico de EPID en los programas de cesación tabáquica.
Relación de preguntas PICOPregunta 1: ¿Es el tabaquismo un factor de riesgo para el desarrollo o progresión de EPID?JustificaciónEl tabaquismo es una epidemia mundial que provoca la muerte de casi 7 millones de personas cada año5. Existe evidencia contundente sobre la relación que existe entre fumar y el desarrollo de enfermedades cardiovasculares, respiratorias y/o cáncer6,7. En los últimos años se han publicado estudios de cohortes de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) que muestran una prevalencia aumentada de anormalidades pulmonares intersticiales (API)1 lo cual pudiera reflejar una potencial relación causal entre el tabaquismo y el desarrollo de EPID8. Sin embargo, dichos estudios no consideran, en muchos casos, variables de confusión. También se ha observado que el tabaquismo es un factor de riesgo para el desarrollo de ciertas enfermedades autoinmunes y que muchas de ellas pueden incluso presentar EPID, aunque se desconoce con exactitud si existe una relación independiente entre el tabaquismo y el desarrollo de esta patología en dicho contexto1. Por todo lo expuesto, resulta necesario determinar la relación causal entre el tabaquismo y el desarrollo de una EPID.
Selección de búsquedaSe incluyeron 4 estudios: un estudio de casos y controles9 y 3 estudios de cohortes10–12.
Resumen de la evidenciaEn un estudio de casos y controles cuyo objetivo fue evaluar la asociación entre EPOC y la presencia de API9, se incluyeron pacientes provenientes de 2 estudios, un estudio sobre cribado de cáncer de pulmón (MILD trial)10 y otro, sobre hallazgos tomográficos en una población de pacientes con EPOC11. Se seleccionaron 457 pacientes (casos) con EPOC y 914 pacientes (controles) sin obstrucción. Las imágenes fueron evaluadas por 2 radiólogos independientes. El análisis de regresión logística mostró que el tabaquismo actual (OR: 4,05; IC 95%: 2,2-7,4) y una mayor carga tabáquica (OR: 1,01; IC 95%: 1-1,02) eran factores asociados a la presencia de API definitivas. Los sujetos con API fibróticas eran más frecuentemente hombres (OR: 8,58; IC 95%: 1,58-68,9) y de mayor edad (OR 1,17; IC 95%: 1,58-68,9). La presencia de obstrucción al flujo aéreo no se asoció significativamente con la presencia de API definitivas o de API fibrótica9.
Un estudio poblacional longitudinal retrospectivo de 9 años evaluó los factores de riesgo asociados con el desarrollo de EPID sobre un grupo de pacientes mayores de 40 años. Se analizaron 312.519 sujetos, de los cuales 1.972 desarrollaron EPID durante el período estudiado, siendo la incidencia de EPID de 70,1 casos por cada 100.000 personas/año. La presencia de EPID fue más frecuente en el sexo masculino y el riesgo de padecerla aumentaba con la edad. Finalmente, en el análisis multivariado se observó que el tabaquismo se encontraba asociado de manera significativa con el desarrollo de EPID (HR: 1,2; IC 95%: 1,1-1,4)12.
Por otro lado, hay estudios que muestran que el tabaquismo aumenta el riesgo de desarrollar enfermedades autoinmunes8, presentando muchas de ellas compromiso pulmonar intersticial. Se ha observado que los pacientes caucásicos fumadores con diagnóstico de miopatías inflamatorias presentaban mayor probabilidad de tener una EPID que los no fumadores (OR: 1,52; IC 95%: 1,002-2,29; p=0,049) y se encontró un aumento del 2% de posibilidades de presentar EPID por cada paquete/año en la población evaluada (OR: 1,02; IC 95%: 1,004-1,03; p=0,010)13.
Finalmente, un estudio, con muestra pequeña, analizó retrospectivamente la influencia del tabaquismo en un grupo de 31 pacientes con neumonía intersticial no específica, siendo 16 de ellos neumonía intersticial no específica idiopática y 15 neumonía intersticial no específica secundaria a enfermedad del tejido conectivo; el tabaquismo influyó negativamente en la progresión de la enfermedad (clínica-radiológica) (p=0,0489), así como en la reducción de la capacidad de difusión de monóxido de carbono ajustados al volumen alveolar (DLCO/VA); aunque las limitaciones del estudio no permitieron demostrar pronóstico ni causalidad14.
Conclusiones y recomendacionesEvidencia MODERADA y recomendación FUERTE para considerar el tabaquismo como un factor de riesgo para el desarrollo y/o modificador de la progresión de EPID.
RECOMENDACIÓN 1B
Pregunta 2: ¿La mortalidad de la EPID aumenta en fumadores?JustificaciónEl tabaquismo es la principal causa evitable de mortalidad y produce la muerte prematura del 50% de sus consumidores5.Por ello, resulta trascendental conocer si existe asociación en términos de mortalidad entre EPID y la condición de fumador.
Selección de búsquedaSe incluyeron 5 estudios de cohorte15–19.
Resumen de la evidenciaAnalizando los resultados de grandes estudios poblacionales de cohorte como el Framingham Heart Study20, el Age Gene/Environment Susceptibility-Reykjavik study21, COPD gene22,23 y ECLIPSE24, el hallazgo de API fue asociado con mayor riesgo de mortalidad por todas las causas en un seguimiento promedio de 3 a 9 años. Si bien en 2 cohortes algunos datos resultaron discordantes20,21, el gran riesgo de mortalidad asociado con las API en el Framingham Heart Study entre los no fumadores se debió al pequeño número de muertes en este grupo16.
Se ha realizado un estudio prospectivo, aleatorizado y controlado de cribado de cáncer de pulmón, usando tomografía computarizada, en el que se incluyeron 4.101 hombres y mujeres de 50 a 70 años, con historia de tabaquismo de, al menos, 20 paquetes/año25. Posteriormente15, 1.920 pacientes de este estudio fueron incluidos en un segundo análisis a fin de investigar si el hallazgo incidental de AIP que en ellos se observó tenía un aumento de mortalidad en un seguimiento de 12 años. Un 16,7% de estos fumadores «sanos» tenían afectación intersticial y tuvieron mayor mortalidad por todas las causas que los pacientes sin compromiso intersticial, independiente del patrón histológico de EPID. Los hallazgos se asociaron con muerte tanto por cáncer de pulmón (HR: 3,2; IC 95%: 1,7-6,2; p<0,001) como por enfermedad maligna no pulmonar (HR: 2,1; IC 95%: 1,1-4; p=0,02)15.
En una propuesta de agrupación en fenotipos recientemente publicada, el fenotipo masculino, de mayor edad, fumador y con patrón en panal de abejas, fue el que mostró menor supervivencia17. Adicionalmente, entre los 8.266 pacientes reclutados en el COPD gene, en fumadores, la combinación de EPID y enfisema se asoció con mayor severidad clínica y funcional y un 82% de aumento en la mortalidad (p<0,01), con respecto a solo enfisema18.
En otro estudio que analizó los patrones de afectación intersticial y mortalidad en artritis reumatoide, ser fumador no fue asociado a mayor mortalidad, sin embargo, el 63% de los pacientes incluidos eran fumadores o exfumadores, lo que implica al tabaquismo como factor asociado a mayor prevalencia de artritis reumatoide y compromiso intersticial. Adicionalmente, el riesgo de mortalidad fue mayor entre los pacientes con DLCO<40% del predicho (HR: 2,48; IC 95%: 1,55-3,95). El sexo, el tabaquismo y la EPOC no se asociaron con la mortalidad19.
Conclusiones y recomendacionesEvidencia MODERADA para identificar que existe un incremento de la mortalidad en la EPID independientemente de su patrón histológico. Evidencia BAJA para adjudicarlo al tabaquismo y recomendación FUERTE para identificar a los pacientes con EPID precozmente.
Se hace necesario nuevos estudios que evalúen el efecto de la cesación tabáquica en los pacientes con EPID.
RECOMENDACIÓN 1B
Pregunta 3: ¿Cuál es la importancia del tabaquismo de segunda mano en la EPID?JustificaciónEl consumo pasivo de tabaco es causante de graves enfermedades tumorales, cardiovasculares y respiratorias. Dicho daño presenta una relación directa con la intensidad y el tiempo de la exposición26. Convendría establecer si existe una relación entre el tabaquismo de segunda mano y la probabilidad de sufrir EPID.
Resumen de la evidenciaSe evaluó un estudio transversal multicéntrico27 que analizó la relación entre el tabaquismo de segunda mano y el hallazgo de diversas alteraciones intersticiales en la tomografía computarizada de alta resolución de tórax en trabajadores expuestos al asbesto. La evaluación de la exposición al tabaco de segunda mano se valoró mediante cuestionarios. Los resultados mostraron que la exposición involuntaria al humo del tabaco se acompañaba de un incremento de las opacidades en vidrio deslustrado en la tomografía computarizada de alta resolución de tórax. Por otro lado, se observó una relación entre la exposición a lo largo de la vida y la presencia de opacidades lineales, aunque no alcanzó diferencias estadísticamente significativas. Cuando se analizó por separado la exposición a humo de tabaco de segunda mano en el hogar en los últimos 12 meses, se encontró una relación estadísticamente significativa con la presencia de opacidades lineales irregulares (OR: 1,873; IC 95%: 0,512-3,23; p=0,007) y con las imágenes de panalización (OR: 1,10; IC 95%: 0,675-1,524; p=0,0001). No obstante, existen algunas limitaciones en este estudio27.
Conclusiones y recomendacionesEvidencia BAJA y recomendación DÉBIL para definir el impacto del tabaquismo de segunda mano en la EPID.
RECOMENDACIÓN 2C
Pregunta 4: ¿La cesación tabáquica puede mejorar los resultados del paciente diagnosticado de EPID?JustificaciónHay EPID en las que fumar está considerado el principal factor patogénico1. Se ha descrito una nueva entidad, la fibrosis intersticial asociada al tabaco (SRIF), que aparece casi exclusivamente en grandes fumadores28. Por otro lado, en la FPI y en la afectación intersticial en pacientes con artritis reumatoide el tabaco desempeña un papel de sinergia con factores genéticos importante1,8. Se sabe que, en las enfermedades intersticiales relacionadas con el tabaco, la cesación tabáquica es la principal recomendación para la curación o mejoría de estos procesos ya que no existe un tratamiento específico con demostrada eficacia. Se ha descrito estabilización radiológica o incluso mejoría de la función pulmonar en pacientes con histiocitosis pulmonar de células de Langerhans al abandonar el tabaco29,30. Por otra parte, el hecho de seguir fumando parece tener un efecto negativo en cuanto a la progresión de las enfermedades intersticiales31. Además, en los pacientes fumadores con enfermedad intersticial aumenta el riesgo de padecer cáncer de pulmón12. Por lo tanto, parece lógico pensar que en los pacientes con EPID el abandono del consumo del tabaco puede mejorar los resultados en salud y mejorar su pronóstico.
Selección de búsquedaSe incluyeron 2 estudios: un caso-control32 y una cohorte33.
Resumen de la evidenciaNakanishi et al.32 estudiaron de manera retrospectiva los cambios que se producen en las alteraciones radiológicas y funcionales de 5 pacientes con bronquiolitis respiratoria-EPID diagnosticados por biopsia quirúrgica tras el abandono del tabaco como único tratamiento. Ninguno de ellos recibió tratamiento con esteroides o cualquier otra terapia inmunosupresora. El consumo de tabaco en los pacientes previamente era de 30, 32, 40, 28 y 56 paquetes/año respectivamente. Todos los pacientes dejaron de fumar tras el diagnóstico. El seguimiento se realizó durante 15-62 meses (46,4±20,8 meses). Se analizaron las alteraciones radiológicas mediante un método visual semicuantitativo. Todos los pacientes mejoraron su sintomatología tras dejar de fumar. Se produjo mejoría de la difusión de CO (DLCO) y en la oxigenación. También se produjo una mejoría de las alteraciones radiológicas en todos los casos. Los autores concluyeron que con solo dejar de fumar se produce una mejoría radiológica y funcional tras un seguimiento de 46,4±20,8 meses.
Fabre et al.33 analizaron de forma prospectiva la presencia de SRIF en 20 pacientes sometidos a lobectomía por cáncer de pulmón. Todos ellos eran fumadores. Se comparan con un grupo retrospectivo de SRIF obtenidos del estudio histológico de pacientes sometidos a trasplante de pulmón y con los resultados de los estudios publicados sobre SRIF. En el primer grupo el 40% (8/20) tenían SRIF y estos pacientes con SRIF tenían más probabilidad de ser fumadores que los no SRIF (p=0,02). En el grupo de pacientes trasplantados se encontró SRIF en un 10% de los pacientes con FPI y en un 35% entre los EPOC. Del análisis de todos los casos agrupados, los autores encuentran que los pacientes con SRIF son 15,05 años mayores que los no SRIF, tienen más probabilidad de ser antiguos fumadores y tienen menos alteraciones radiológicas de bronquiolitis respiratoria, lo que indica que el abandono del tabaco puede suponer una regresión en las alteraciones radiológicas derivadas del tabaco.
Conclusiones y recomendacionesEvidencia BAJA para demostrar que la cesación tabáquica mejora los resultados de los pacientes diagnosticados de EPID. Los estudios hasta ahora no han sido diseñados para evaluar el desenlace objeto de la pregunta PICO.
Recomendación FUERTE para aconsejar la cesación tabáquica en casos de EPID en fumadores.
RECOMENDACIÓN 1C
Pregunta 5: ¿Se justifica la búsqueda activa de los casos de EPID durante los programas de cesación tabáquica?JustificaciónLa existencia de EPID asociadas exclusivamente al consumo del tabaco18, el conocimiento de que el tabaquismo es un importante factor de riesgo para el desarrollo de otras EPID1 e, incluso, la evidencia de que el consumo de tabaco puede ejercer un mal pronóstico en la evolución de enfermedades como la FPI34 o la EPID asociada a artritis reumatoide1,35,36 podrían justificar la búsqueda activa de casos de EPID en los programas de cesación tabáquica.
Selección de búsquedaSe incluyó un estudio de cohorte37.
Resumen de la evidenciaLederer et al.37 llevaron a cabo el estudio MESA-Lung Study cuyo objetivo fue determinar si el consumo de tabaco se asociaba con enfermedades pulmonares parenquimatosas subclínicas valorado por restricción en la espirometría y áreas de alta atenuación en la tomografía computarizada. Los autores encontraron un 10% de restricción en la espirometría y que esta restricción aumentaba un 8% por cada 10 paquetes/año. Asimismo, encontraron que la media del volumen de alta atenuación fue de 119cm3 y que este se incrementaba a razón de 1,6cm3 por cada 10 paquetes/año. Los autores concluyeron que ser fumador activo y el acumulado previo de tabaco (paquetes/año) se asociaba independientemente con restricción en la espirometría y un incremento de la atenuación pulmonar.
Conclusiones y recomendacionesEvidencia BAJA que demuestre la utilidad clínica o epidemiológica de la búsqueda activa de los casos de EPID en los programas de cesación tabáquica. Recomendación FUERTE para justificar la realización de espirometría durante la búsqueda activa de casos de EPID independientemente de su estatus actual de fumador, pero con tasa acumulada de tabaquismo previo, aun en casos asintomáticos.
RECOMENDACIÓN 1C
Pregunta 6: ¿El tabaquismo activo influye en la eficacia y seguridad de los fármacos antifibróticos utilizados en pacientes con FPI?No hemos detectado estudio alguno que respondiera específicamente sobre la interacción del tabaquismo en la eficacia de pirfenidona y nintedanib en el tratamiento de la FPI. Teniendo en cuenta la eficacia similar demostrada por los 2 fármacos en su impacto sobre función pulmonar y mortalidad, la elección del tratamiento en pacientes fumadores con FPI será individualizada y estará influenciada por su perfil de seguridad, contraindicaciones e interacciones farmacológicas38,39.
FinanciaciónEste artículo ha sido posible gracias a una beca no condicionada del Laboratorio Boeringher-Ingelhein.
Conflicto de interesesTodos los autores declaran no tener conflicto de intereses en relación con el artículo que se remite para publicación. El Dr. Efrain Sánchez Angarita declara que ha cobrado honorarios por su trabajo para ITSalud/Medsolid. El Dr. Agustín Acuña Izcaray declara que ha cobrado honorarios por su trabajo para ITSalud/Medsolid.
Expresamos nuestro agradecimiento a la Dra. Ángela Ramos Pinedo (Hospital Fundación Alcorcón, Madrid, España) y a la Dra. Eva de Higes Martínez (Hospital Fundación Alcorcón, Madrid, España), quienes fueron las revisoras externas de este documento.