Investigaciones recientes sobre la relación entre el sistema inmune y el cáncer han desvelado los mecanismos moleculares mediante los cuales las células neoplásicas aprovechan algunos receptores de los linfocitos T, con función inhibitoria de la respuesta citotóxica, para defenderse del ataque inmune desarrollado frente a ellas. Estos hallazgos han permitido identificar dianas precisas (receptores de los linfocitos T o ligandos que se acoplan a ellos) frente a los que se han diseñado anticuerpos monoclonales, capaces de desbloquear la respuesta inmunitaria.
Estos fármacos (immune check point inhibitors), de eficacia demostrada en el melanoma metastásico o el carcinoma renal, han sido probados con éxito frente al carcinoma de pulmón no microcítico en ensayos recientes. Tras su aprobación e incorporación a la práctica clínica en 2.ª línea después de una pauta inicial de quimioterapia (QT), se han comunicado en el último año resultados positivos en ensayos aleatorizados que los comparaban con QT estándar en 1.ª línea. Se han observado respuestas sorprendentes y duraderas, aunque no superan el 20-25% en pacientes no seleccionados, por lo que es crucial detectar rasgos predictivos de eficacia, como el biomarcador PD-L1, si bien los diferentes métodos para su detección han producido resultados dispares.
En esta revisión no sistemática se discuten los resultados de los últimos ensayos, las posibilidades de incorporar estos fármacos en primera línea, los criterios de selección de pacientes, los efectos adversos y las perspectivas de su empleo asociados a modalidades terapéuticas tradicionales como QT, radioterapia o antiangiogénicos.
Recent research on the relationship between the immune system and cancer has revealed the molecular mechanisms by which cancer cells co-opt certain T cell receptors which block the cytotoxic response to defend themselves from the antitumor immune attack. These findings have helped identify specific targets (T cell receptors or their corresponding ligands) for the design of monoclonal antibodies that can unlock the immune response.
These drugs, known as immune checkpoint inhibitors, have shown efficacy in metastatic melanoma and kidney cancer, and have been successfully tested in non-small cell lung cancer in recent trials. Immune checkpoint inhibitors were included in clinical practice as a second-line option after an initial chemotherapy (CT) regimen, and in the last year positive results have been reported from randomized trials in which they were compared in first line with standard CT. Responses have been surprising and durable, but less than 20%-25% in unselected patients, so it is essential that factors predicting efficacy be identified. One such biomarker is PD-L1, but the different methods used to detect it have produced mixed results.
This non-systematic review discusses the results of the latest trials, the possibilities of incorporating these drugs in first-line regimens, the criteria for patient selection, adverse effects, and the prospects of combinations with conventional treatment modalities, such as CT, radiation therapy, and antiangiogenic agents.
La idea de estimular y potenciar la respuesta del sistema inmune frente al cáncer fue concebida por Paul Ehrlich hace más de un siglo1, y ha despertado el interés de muchos autores, pero solo en los últimos años ha podido traducirse en avances terapéuticos aplicables a la clínica práctica2. Durante mucho tiempo el esquema conceptual de las investigaciones se basaba en introducir antígenos diversos, en general poco específicos, con la intención de inducir en el paciente una respuesta inmunitaria capaz de detener el crecimiento de las células neoplásicas. Se trataba de emular el éxito obtenido por las vacunas tradicionales en la prevención de las enfermedades alérgicas e infecciosas. Así, se probaron múltiples vacunas derivadas de células neoplásicas inactivadas e incluso se experimentó introduciendo agentes infecciosos en tumores, con la esperanza de activar el sistema inmune3,4.
Aunque hace años se creía que el cáncer de pulmón (CP) no era muy inmunogénico, algunos hechos conocidos sugieren lo contrario. Así, se sabe que en pacientes con VIH o sometidos a trasplante de órganos en los que se induce inmunosupresión, la incidencia de CP, entre otros cánceres, es elevada5. Además, se ha encontrado que la presencia de linfocitos infiltrantes de tumores en piezas de CP resecados se asociaba a mejor pronóstico. Asimismo, se conoce la capacidad de muchos CP no microcíticos (CPNM) para producir antígenos capaces de inducir respuesta inmune2,5,6.
Se han elaborado vacunas antineoplásicas y sustancias inmunoestimuladoras (interferón y diversas interleuquinas) que han mostrado resultados preliminares alentadores frente a varios tumores, incluyendo el CP7, pero, salvo excepciones como el melanoma metastásico y el carcinoma de células renales, la falta de especificidad y los efectos adversos han limitado su uso de forma generalizada3.
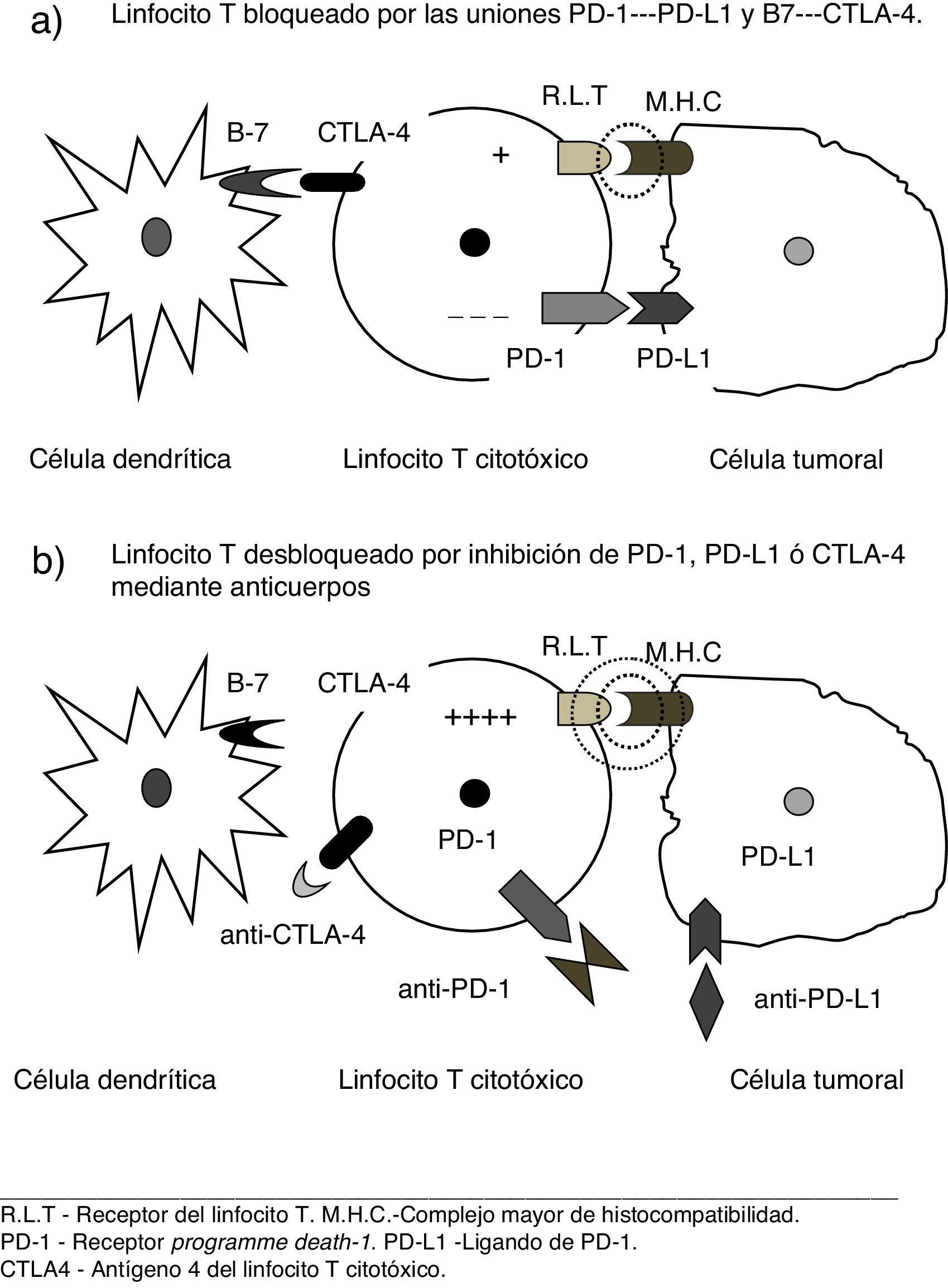
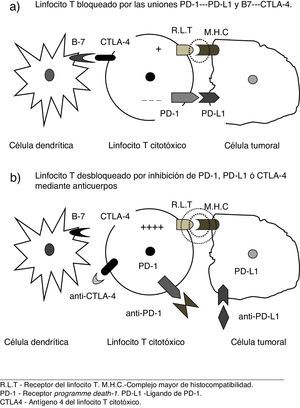
Nuevos conceptos patogénicos sobre inmunidad y cáncerInvestigaciones recientes6–8 han proporcionado una comprensión más profunda de las complejas relaciones entre el sistema inmune y las células tumorales, así como de los mecanismos moleculares por los que estas pueden evadir su destrucción por los linfocitos T. Se ha comprobado que, además de la presentación de antígenos por las células dendríticas, otras señales estimuladoras son precisas para activar las células T citotóxicas y se han identificado vías que bloquean dichas señales, promoviendo así el crecimiento del tumor. La teoría de la vigilancia inmunológica, referida al mero reconocimiento de las células cancerosas como extrañas al organismo, ha sido sustituida por el concepto de inmunoedición, según el cual el sistema inmune interactúa con el tumor en 3 fases: 1) eliminación de las células neoplásicas recientemente desarrolladas por parte de mecanismos inmunes innatos y adaptativos; 2) algunas células capaces de evadir ese ataque inmune pueden entrar en estado durmiente; y 3) finalmente, tales células pueden escapar al control inmune y proliferar, conduciendo a la enfermedad clínicamente aparente, rasgo que se considera hoy característico de las célula cancerosas6. Es decir, el tumor elude el ataque de células T, aprovechando ciertos puntos de control inmunes (immune check point inhibitors). Entre los receptores identificados el programme death-1 (PD-1) y los ligandos que se acoplan a él (PD-L1), así como el antígeno 4 del linfocito T citotóxico (CTL4-A) son dianas terapéuticas de especial interés frente a las cuales ya se dispone de agentes terapéuticos eficaces6–8.
Además de estas vías reguladoras, el perfil inmune de un individuo depende de múltiples factores que incluyen propiedades intrínsecas del tumor (composición genética, secreción de citoquinas, etc.) y circunstancias extrínsecas, como el microbioma intestinal, la presencia de infecciones o la exposición a carcinógenos ambientales. El balance final que resulta de tales influencias define un estado concreto de la inmunidad frente al cáncer que determina la respuesta a los posibles agentes inmunoterápicos8.
Nuevos conceptos terapéuticos. «Inmunodesbloqueadores»El uso de estas vías inhibitorias por la célula neoplásica puede ser neutralizado mediante el bloqueo de los mencionados receptores, o los correspondientes ligandos por parte de anticuerpos monoclonales específicos2–8. Dado el mecanismo de acción de estos agentes, cuyo resultado es desbloquear la acción citodestructora de los linfocitos al neutralizar los frenos empleados por la célula tumoral (véase fig. 1), una denominación para los mismos podría ser la de «inmunodesbloqueadores», neologismo que usaremos provisionalmente en este trabajo.
Los primeros resultados positivos con «inmunodesbloqueadores» en ensayos aleatorizados se obtuvieron en el melanoma metastásico, con el fármaco ipilimumab, anticuerpo monoclonal que neutraliza al receptor CTLA-4, inhibitorio de la célula T; un ensayo publicado en 2010 demostró superioridad de ipilimumab en segunda línea de tratamiento frente a la pauta de comparación basada en la vacuna gp100 (medianas de supervivencia de 10,1 y 6,4 meses, respectivamente)9, lo que favoreció su rápida aprobación por las agencias regulatorias en EE. UU. Posteriormente, se han realizado numerosos estudios en otras neoplasias. La tabla 1 muestra algunos de estos fármacos y sus dianas.
Fármacos inmunodesbloqueadores utilizados en CP y sus dianas específicas
| Diana molecular | Inmunodesbloqueador/es |
|---|---|
| Programme death receptor (PD-1) | Nivolumab, pembrolizumab |
| Ligando frente a PD-1 (PD-L1) | atezolizumab, durvalumab, avelumab, |
| Antígeno 4 del linfocito T citotóxico (CTL4-A) | ipililumab |
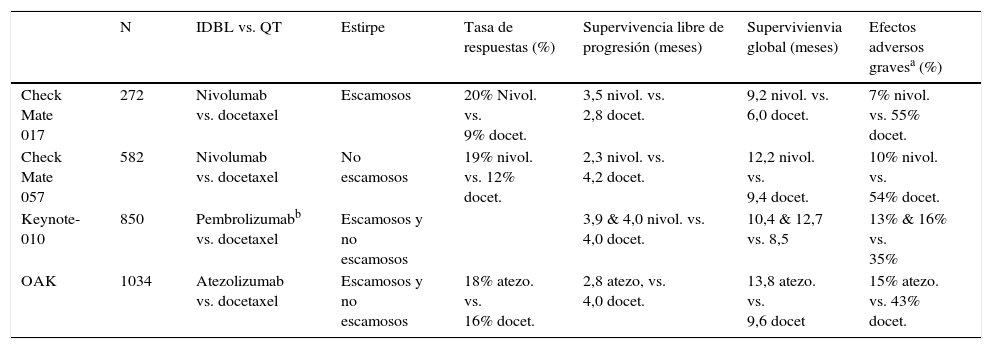
Los primeros indicios de la eficacia de estos agentes frente al CP se obtuvieron en 2 ensayos clínicos fase i, que incluían CPNM, entre otros tumores. Se probaron diferentes dosis de los fármacos en estudio (anti PD-1 en un ensayo y anti PD-L1 en el otro) y se observaron respuestas objetivas favorables en el 18% de los CPNM, y hasta en el 36% entre los que expresaban PD-L1. La mayoría de estas respuestas duró más de un año, y el perfil de seguridad fue aceptable, con un 14% de efectos adversos grados 3 y 4 de la OMS10,11. Estos resultados pronto fueron seguidos por los primeros ensayos aleatorizados en pacientes con CPNM en 2.ª línea que habían fracasado o presentado recidiva tras una 1.ª línea de QT estándar basada en dobletes de platino; uno de los ensayos incluyó solo tumores de estirpe escamosa, y el otro no escamosos. Los resultados, en tasas de respuestas y supervivencia global fueron significativamente mejores con el fármaco en estudio (nivolumab) que con la QT de control, basada en docetaxel. Además, los efectos adversos graves fueron significativamente inferiores en el grupo tratado con nivolumab (tabla 2)12,13. La ausencia de ventajas en la supervivencia libre de progresión (SLP) puede explicarse por los efectos peculiares de estos fármacos, que a veces producen al comienzo un aparente aumento del volumen tumoral, como se comentará más abajo en el apartado dedicado a los criterios de evaluación de respuesta. Ensayos posteriores han confirmado la eficacia de otros «inmunodesbloqueadores» en segunda línea de pacientes con CPNM14,15 (tabla 2) y la National Comprehensive Cancer Network (NCCN), (versión 6.2017) recomienda su uso en dicha situación con grado 1 de evidencia16. Fármacos más recientes (durvalumab, avelumab) han mostrado resultados prometedores en ensayos fase i-ii17–19 (tabla 1).
Inmunodesbloqueadores (IDBL) en CPNM con estadio avanzado. Ensayos aleatorizados después de recidiva
| N | IDBL vs. QT | Estirpe | Tasa de respuestas (%) | Supervivencia libre de progresión (meses) | Supervivienvia global (meses) | Efectos adversos gravesa (%) | |
|---|---|---|---|---|---|---|---|
| Check Mate 017 | 272 | Nivolumab vs. docetaxel | Escamosos | 20% Nivol. vs. 9% docet. | 3,5 nivol. vs. 2,8 docet. | 9,2 nivol. vs. 6,0 docet. | 7% nivol. vs. 55% docet. |
| Check Mate 057 | 582 | Nivolumab vs. docetaxel | No escamosos | 19% nivol. vs. 12% docet. | 2,3 nivol. vs. 4,2 docet. | 12,2 nivol. vs. 9,4 docet. | 10% nivol. vs. 54% docet. |
| Keynote-010 | 850 | Pembrolizumabb vs. docetaxel | Escamosos y no escamosos | 3,9 & 4,0 nivol. vs. 4,0 docet. | 10,4 & 12,7 vs. 8,5 | 13% & 16% vs. 35% | |
| OAK | 1034 | Atezolizumab vs. docetaxel | Escamosos y no escamosos | 18% atezo. vs. 16% docet. | 2,8 atezo, vs. 4,0 docet. | 13,8 atezo. vs. 9,6 docet | 15% atezo. vs. 43% docet. |
Las expectativas suscitadas por estos fármacos han originado una intensa actividad investigadora, y se dispone ya de información relevante con respecto a su eficacia en primera línea: en un ensayo fase i el nivolumab (dosis de 3mg/kg de peso cada 2 semanas), aplicado como tratamiento inicial en monoterapia a 52 pacientes con CPNM, deparó un 23% de respuestas objetivas, y un 28% en el subgrupo que expresaba el biomarcador PD-L1. La mediana de supervivencia global fue 19,4 meses y la proporción de efecto adversos graves 19%20.
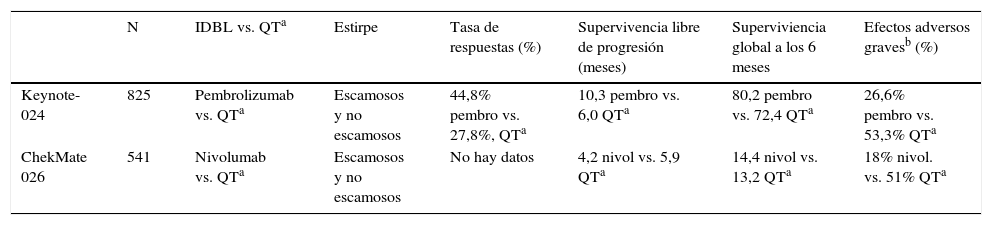
Actualmente, están en curso numerosos ensayos fase iii en primera línea de pacientes con CPNM21 y se conocen resultados de algunos ya concluidos (Keynote-024. tabla 4). En uno de ellos se comparó el «inmunodesbloqueador» anti-PD-1 pembrolizumab frente a QT basada en platino, si bien se exigió como criterio de inclusión la expresión de PD-L1 en más del 50% de las células tumorales, criterio que cumplen el 20-25% de pacientes con CPNM avanzado. Este ensayo (Keynote-024, tabla2) demostró superioridad del pembrolizumab en supervivencia global y SLP, con menor toxicidad que la observada en el grupo de QT22. A partir de estos resultados, la NCCN (versión 3.2017) aconseja comenzar el tratamiento de primera línea en CPNM avanzado con este «inmunodesbloqueador» en aquellos pacientes cuyo tumor exprese las elevadas concentraciones de PD-L1 exigidas en el mencionado estudio16. En el otro ensayo aleatorizado (presentado en congreso, pero aún no publicado) (CheckMate 026) se comparó nivolumab frente a QT estándar y se exigió expresión de PD-L1 en al menos el 1% de las células tumorales; la supervivencia global fue similar en ambos grupos, con menos toxicidad en el grupo del «inmunodesbloqueador»23. Aunque se requieren nuevos análisis, la falta de superioridad de nivolumab en este ensayo puede explicarse por el umbral demasiado bajo de expresión de PD-L1 (1%), requerido como criterio de inclusión en el diseño original.
Inmunodesbloqueadores (IDBL) en CPNM con estadio avanzado y PD-L1 positivo. Ensayos aleatorizados en primera línea
| N | IDBL vs. QTa | Estirpe | Tasa de respuestas (%) | Supervivencia libre de progresión (meses) | Superviviencia global a los 6 meses | Efectos adversos gravesb (%) | |
|---|---|---|---|---|---|---|---|
| Keynote-024 | 825 | Pembrolizumab vs. QTa | Escamosos y no escamosos | 44,8% pembro vs. 27,8%, QTa | 10,3 pembro vs. 6,0 QTa | 80,2 pembro vs. 72,4 QTa | 26,6% pembro vs. 53,3% QTa |
| ChekMate 026 | 541 | Nivolumab vs. QTa | Escamosos y no escamosos | No hay datos | 4,2 nivol vs. 5,9 QTa | 14,4 nivol vs. 13,2 QTa | 18% nivol. vs. 51% QTa |
En los 2 ensayos en primera línea se incluyeron solo pacientes seleccionados en función de la expresión del biomarcador PD-L1.
Estos «inmunodesbloqueadores» producen a veces resultados llamativos, incluso remisiones completas de larga duración, pero las respuestas objetivas suceden como mucho en el 15-20% de los pacientes no seleccionados4,24. Es de suma importancia, pues, identificar algún rasgo clínico o marcador tumoral que permita predecir qué pacientes tienen mayor probabilidad de obtener beneficios. Dado que algunos de estos fármacos son anticuerpos monoclonales diseñados frente al receptor PD-1 arriba mencionado, parece razonable que la concentración de PD-L1 (ligandos que se acoplan al receptor), expresada en el tumor o en células inmunes, sea útil como predictiva de eficacia. Sin embargo, la diversidad en el tipo de reactivos fabricados por diferentes empresas y en los puntos de corte establecidos por diferentes autores ha producido resultados discordantes25,26: así, en el citado ensayo CheckMate 017 (tabla 2), realizado en pacientes con carcinoma escamoso, las concentraciones de PD-L1 no influyeron en los resultados12; por el contrario, en el CheckMate 057, en pacientes con carcinoma no escamoso, se observó que los que presentaron expresión de PD-L1 superior al 10% en las biopsias tumorales tenían supervivencia media global más larga que aquellos con niveles menores de 10% (19,4 y 9,9 meses, respectivamente13). La evaluación global de los hallazgos de estos y otros estudios sugiere un valor predictivo de respuesta de este biomarcador, y se están haciendo trabajos cooperativos para homogeneizar, estandarizar y validar las técnicas de análisis, lo que permitirá generalizar su uso del modo más sencillo posible en la práctica clínica25.
Además de PD-L1, puede haber otros rasgos con valor predictivo: así, se cree que cuanto mayor sea el número de mutaciones de un tumor, tanto mayor será la sensibilidad del mismo frente a estos fármacos, porque también será mayor la cantidad de antígenos susceptibles de ser reconocidos por el sistema inmune. Por ello, se ha propuesto evaluar la carga mutacional mediante la secuenciación del genoma completo del tumor o de un panel preseleccionado de genes representativos25,26. En concordancia con esta hipótesis, está el hecho de que los cánceres atribuidos a excesiva exposición a la luz ultravioleta (cáncer de piel) o al humo del tabaco (cáncer de pulmón), que tienen gran cantidad de mutaciones, son los que mejor responden a estos fármacos. En ensayos realizados en CPNM, al analizar las respuestas obtenidas en función de diversos rasgos, se observó que los pacientes fumadores respondían mejor que los no fumadores20,22,25. Aunque aún no hay claras recomendaciones al respecto, en ausencia de biomarcadores disponibles, este dato epidemiológico podría ser orientativo en la práctica clínica en casos de difícil decisión terapéutica.
Criterios de evaluación de respuestaLa SLP es un criterio primordial para evaluar la eficacia de una pauta terapéutica en pacientes con CPNM avanzado. Sin embargo, con estos fármacos se han observado notables discordancias entre la SLP y la supervivencia global, lo que puede explicarse por los efectos peculiares que resultan del desbloqueo de la reacción inmune; así, puede apreciarse un aparente aumento del volumen tumoral debido a infiltración del tumor por linfocitos, lo que traduce la eficacia del efecto «inmunodesbloqueador» del fármaco. A este fenómeno paradójico que aparenta progresión de la enfermedad cuando en realidad sucede lo contrario se le ha llamado «pseudoprogresión»2, de modo que solo después de mucho tiempo el seguimiento estrecho del paciente mostrará la reducción del tamaño tumoral. Por ello, se ha sugerido que la supervivencia global, y no la SLP, es el criterio que puede reflejar con mayor precisión los beneficios reales27,28. Esta peculiar respuesta del tumor obliga también a modificar los tradicionales criterios de evaluación terapéutica en los tumores sólidos (criterios RECIST), que ahora deberán tener en cuenta esta posible «pseudoprogresión»28,29. Incluso, puede ser necesario considerar diferentes parámetros estadísticos en la evaluación de la SLP, pues este fenómeno favorece entrecruzamientos en las curvas de Kaplan-Meier que vulneran la condición de proporcionalidad de los riesgos, exigida por algunas pruebas27.
Pautas combinadas de «inmunodesbloqueadores» y quimioterapiaDado el mecanismo de acción antitumoral radicalmente diferente de los «inmunodesbloqueadores» y la QT tradicional, resulta atractiva la idea de probar la combinación de ambos fármacos, cuestión que ha sido explorada en 2 recientes ensayos fase i y ii: a) el CheckMate 012 en el que se asoció QT basada en platino a diferentes dosis de nivolumab, seguida por mantenimiento con nivolumab hasta progresión o toxicidad inaceptable. Aunque se incluyeron solo 52 pacientes, las respuestas objetivas (entre 33% y 47%) y la supervivencia global a 2 años (entre 25% y 62%) son alentadoras30; y b) el Keynote 021 en el cual se comparó pembrolizumab más QT (carboplatino y pemetrexed) frente a la misma pauta de QT aislada; ambos brazos recibieron después pemetrexed de mantenimiento. Las tasas de respuesta favorable fueron 55% y 19%, respectivamente, con similar frecuencia de efectos adversos31.
«Inmunodesbloqueadores» en el carcinoma microcítico de pulmónEl carcinoma microcítico de pulmón, tumor muy agresivo y sensible a la QT, está muy relacionado con el consumo de tabaco, con la consiguiente carga mutacional elevada, lo que le convierte en teoría en excelente candidato para estos nuevos agentes32. Estudios fase ii que combinaban ipilimumab (anti-CTL4-A) con derivados del platino y etopósido (pauta habitual en este tumor), mostraron modestas mejorías en la SLP, pero en un amplio ensayo aleatorizado la adición de ipilimumab a la pauta de QT habitual no superó a dicha pauta aislada33. Recientemente, una combinación de 2 «inmunodesbloqueadores» (anti-CTL4-A y anti-PD-1) que actúan sobre diferentes dianas ha deparado respuestas objetivas en el 10-19%, con toxicidad aceptable, en pacientes con recidiva del carcinoma microcítico de pulmón34. Sobre la base de estos resultados la NCCN (versión 3.2017) recomienda su empleo en caso de recidiva ocurrida dentro de 6 meses después del primer tratamiento (grado de evidencia 2A)35.
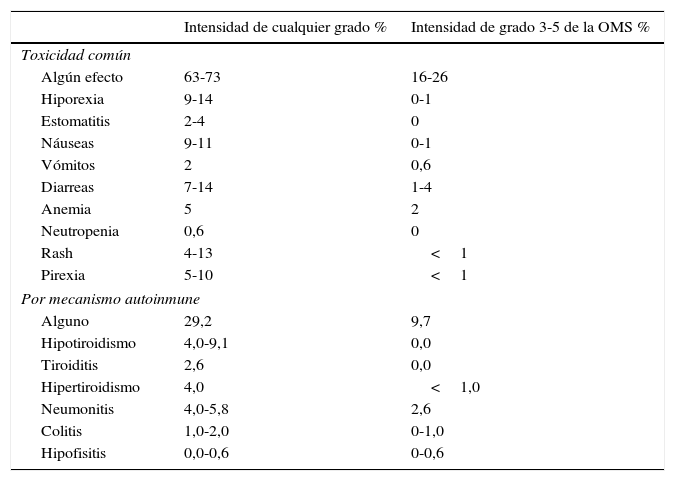
Contraindicaciones. Efectos adversos «inmunorrelacionados»En los ensayos realizados con estos fármacos, los efectos adversos graves (grados iii y iv de la OMS) fueron significativamente menores en comparación con la QT estándar (tablas 2 y 3)12–15,22. Sin embargo, debido a su particular mecanismo de acción, los «inmunodesbloqueadores» presentan un perfil de toxicidad singular. En efecto, la vía PD-1/PD-L1 tiene un papel crucial en la homeostasis inmune y en la supresión de la actividad de las células T frente a autoantígenos. Por tanto, al anular su acción, puede desencadenarse un ataque inmune no solo frente al tumor, sino frente a tejidos normales, causando enfermedad autoinmune32,36,37. En la mayoría de ensayos una historia clínica con antecedentes de enfermedades autoinmunes, infección crónica por VIH o hepatitis B o C, enfermedad intersticial pulmonar activa u otras enfermedades tratadas con corticoides fue considerada criterio de exclusión. Sin embargo, aunque la experiencia al respecto es limitada, informes de casos aislados y de series pequeñas en estudios no controlados sugieren que, incluso en esas circunstancias, estos fármacos pueden usarse, bajo estricta vigilancia, con toxicidades manejables36,37.
Efectos adversos de los «inmunodesbloqueadores» anti-PD-1 y anti-PD-L1 en ensayos aleatorizados de pacientes con CP
| Intensidad de cualquier grado % | Intensidad de grado 3-5 de la OMS % | |
|---|---|---|
| Toxicidad común | ||
| Algún efecto | 63-73 | 16-26 |
| Hiporexia | 9-14 | 0-1 |
| Estomatitis | 2-4 | 0 |
| Náuseas | 9-11 | 0-1 |
| Vómitos | 2 | 0,6 |
| Diarreas | 7-14 | 1-4 |
| Anemia | 5 | 2 |
| Neutropenia | 0,6 | 0 |
| Rash | 4-13 | <1 |
| Pirexia | 5-10 | <1 |
| Por mecanismo autoinmune | ||
| Alguno | 29,2 | 9,7 |
| Hipotiroidismo | 4,0-9,1 | 0,0 |
| Tiroiditis | 2,6 | 0,0 |
| Hipertiroidismo | 4,0 | <1,0 |
| Neumonitis | 4,0-5,8 | 2,6 |
| Colitis | 1,0-2,0 | 0-1,0 |
| Hipofisitis | 0,0-0,6 | 0-0,6 |
Entre estos efectos «inmunorrelacionados», los más comunes son rash cutáneo, colitis, hepatopatías, neumonitis y endocrinopatías, como hipofisitis y tiroiditis (tabla 3). Cuando se sospechen estos efectos, tras descartar infección o progresión del tumor, deberán emplearse corticoides tópicos o por vía oral o i.v., dependiendo de la gravedad de aquellos36,37.
Análisis de coste efectividadLos precios de los «inmunodesbloqueadores» varían en función del país y del modelo de sistema sanitario, pero en general son muy elevados: entre 150.000 y 180.000 dólares por año de vida ganado ajustado a la calidad38,39. Un reciente análisis económico, realizado en Suiza, concluye que, con los precios actuales, nivolumab no es coste-efectivo en comparación con docetaxel. Sería necesario una reducción del precio o una selección más estricta de la población según niveles de PD-L139.
Perspectivas futuras. Combinaciones con quimioterapia y radioterapiaEl desarrollo en la aplicación clínica de los «inmunodesbloqueadores» ha obtenido un gran impulso en EE. UU. porque la Food and Drug Administration otorgó a estos fármacos la designación de interés prioritario, lo que permite acelerar los trámites para la revisión y aprobación de nuevos medicamentos25.
Actualmente numerosos estudios están evaluando el uso de estos fármacos como tratamiento neoadyuvante y adyuvante, y como terapia de consolidación tras una pauta inicial de QT y radioterapia. También hay datos preliminares que sugieren que los antiangiogénicos (bevacizumab, nintedanib, etc.) pueden estimular el sistema inmune, y ensayos que parecen indicar que, combinados con los «inmunodesbloqueadores», producen un efecto sinérgico sin aumento sustancial de toxicidad40. Para estas combinaciones, aún en fase temprana de investigación, no se conocen las dosis ni la secuencia óptima de administración de cada fármaco. Sin embargo, el foco principal de la investigación está hoy en la posible incorporación de estos nuevos fármacos en primera línea, y en la selección idónea de candidatos para iniciar este cambio de paradigma terapéutico. Así, la expresión inmunohistoquímica de PD-L1ha sido el biomarcador predictivo de respuesta favorable más estudiado hasta la fecha, aunque algunos ensayos han mostrado resultados asimismo positivos en pacientes con concentraciones escasas o nulas de PD-L128. La disparidad en los anticuerpos usados y en los métodos analíticos empleados ha sido un obstáculo para validad dicho biomarcador25,26, lo que ha promovido un esfuerzo internacional para estandarizar los procedimientos y alcanzar un método común y fiable. Al mismo tiempo, se investiga la utilidad de otros marcadores, que van desde el consumo de tabaco hasta la presencia de linfocitos infiltrantes de tumores o la determinación de la carga mutacional mediante secuenciación genómica del tumor26.
Los datos disponibles hasta hoy sugieren que, a medio plazo, es muy improbable que estos fármacos desplacen totalmente a la QT basada en platino en el tratamiento del CPNM, pero el desarrollo de marcadores fiables puede permitir la identificación de pacientes con mayor probabilidad de beneficiarse de los «inmunodesbloqueadores», ya sea en monoterapia, en combinación con otros similares o con diferentes modalidades terapéuticas, incluyendo la QT tradicional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses