El cáncer de pulmón de célula pequeña (CPCP) es el tipo histológico más agresivo de las neoplasias broncopulmonares. Representa en torno al 10-15% de todos los casos. Muy pocos estudios han analizado la influencia del radón residencial. Se pretende conocer los factores de riesgo del CPCP.
MétodosSe diseñó un estudio de casos y controles multicéntrico y de base hospitalaria, con 11 hospitales de 4 comunidades autónomas.
ResultadosSe analizan los primeros 113 casos reclutados y de ellos 63 con resultados de radón residencial. La edad mediana al diagnóstico fue de 63 años y un 11% de los casos eran menores de 50 años. El 22% de los casos eran mujeres. El 57% tenían enfermedad en estadioIV y el 95% eran fumadores o exfumadores. La concentración mediana de radón residencial era de 128Bq/m3. Un 8% de los casos tenían concentraciones superiores a 400Bq/m3. Por sexo, la única diferencia relevante fue en el porcentaje de mujeres nunca fumadoras, más elevado que para los hombres (p<0,001). La concentración de radón fue superior para los sujetos con enfermedad en estadioIV (diferencias no significativas) y fue más elevada en los pacientes diagnosticados con 63 años o más (p=0,032).
ConclusionesExiste un diagnóstico a una edad temprana en buena parte de los casos con CPCP y predomina la enfermedad metastásica al diagnóstico. El radón residencial parece jugar un papel importante en la aparición de la enfermedad, existiendo casos diagnosticados con concentraciones de radón muy elevadas.
Small cell lung cancer (SCLC) is the most aggressive histologic type of lung cancer, and accounts for approximately 10%-15% of all cases. Few studies have analyzed the effect of residential radon. Our aim is to determine the risk factors of SCLC.
MethodsWe designed a multicenter, hospital-based case-control study with the participation of 11 hospitals in 4 autonomous communities.
ResultsResults of the first 113 cases have been analyzed, 63 of which included residential radon measurements. Median age at diagnosis was 63 years; 11% of cases were younger than 50 years of age; 22% were women; 57% had extended disease; and 95% were smokers or former smokers. Median residential radon concentration was 128Bq/m3. Concentrations higher than 400Bq/m3 were found in 8% of cases. The only remarkable difference by gender was the percentage of never smokers, which was higher in women compared to men (P<.001). Radon concentration was higher in patients with stageIV disease (non-significant difference) and in individuals diagnosed at 63 years of age or older (P=.032).
ConclusionsA high percentage of SCLC cases are diagnosed early and there is a predominance of disseminated disease at diagnosis. Residential radon seems to play an important role on the onset of this disease, with some cases having very high indoor radon concentrations.
El cáncer de pulmón es un grave problema sanitario en la actualidad. Según GLOBOCAN 2012, el número anual de nuevos casos en el mundo se sitúa en torno a 1.825.000, con un total de defunciones anuales de 1.590.000, siendo la primera causa de muerte en países desarrollados. En Europa supone el 26,3% de todas las muertes por cáncer1,2. En España en 2014 fallecieron por cáncer de pulmón un total de 21.251 personas, el 19,1% de las cuales eran mujeres3.
Los factores de riesgo del cáncer de pulmón de células pequeñas (CPCP) han sido poco estudiados, con excepción del efecto del consumo de tabaco4, debido a que significa en torno al 14% de todos los casos de cáncer de pulmón, lejos de la frecuencia del adenocarcinoma o del carcinoma epidermoide. En España, se ha observado que esta frecuencia ronda el 20%5. Aunque la incidencia del CPCP está en descenso, la incidencia en mujeres se encuentra en aumento, con una relación hombre/mujer de 1:16,7.
De todos los tumores pulmonares, el CPCP es el de peor pronóstico. Si bien este tumor presenta una elevada tasa de respuesta inicial, prácticamente todos los pacientes se hacen refractarios al tratamiento al cabo de un tiempo corto, por lo que este tipo histológico presenta una elevada letalidad. Tiene una supervivencia a 5 años del 10% en los casos con estadiosI-III, siendo de tan solo un 4,6% a 2 años en los casos diagnosticados en estadioIV. En ambos casos la tasa de supervivencia es ligeramente mayor en mujeres que en hombres (5,94% vs. 3,57% en estadioIV y 12,25% vs. 7,51% en estadiosI-III)8,9.
El CPCP es el tumor pulmonar más asociado al consumo de tabaco, aunque podría tener otros factores de riesgo10. Debido a su relativa baja frecuencia, estos factores de riesgo no han sido estudiados en profundidad. Entre ellos podría aparecer el radón residencial11,12, la dieta10–15, la ocupación16, o también ciertas actividades de tiempo libre17.
Por esta razón, es necesario realizar estudios multicéntricos con el fin de caracterizar mejor su etiología. Tales estudios multicéntricos permitirían, además, en aquellos casos en los que se obtengan muestras biológicas, conocer qué genes o polimorfismos pueden influir tanto en su etiología como en la respuesta al tratamiento.
El objetivo del presente trabajo es dar a conocer el inicio del estudio SMALL CELL, describir su metodología y comunicar las características de los primeros 113 casos reclutados. Este estudio se realiza en su mayor parte en una zona de alta concentración de gas radón y pretende ser una referencia internacional para conocer en profundidad las causas del CPCP y el papel que en ellas desempeña el radón residencial.
Sujetos y métodosDiseño y asentamientoEl estudio SMALL CELL es un estudio multicéntrico de casos y controles, de base hospitalaria, en el que participan 11 hospitales españoles de 4 comunidades autónomas y un hospital portugués: Hospital Clínico Universitario de Santiago de Compostela, Hospital Álvaro Cunqueiro de Vigo, Complejo Hospitalario Universitario de Pontevedra, Complejo Hospitalario Universitario de Ourense, Complejo Hospitalario Universitario de A Coruña, Centro Oncológico de Galicia, Hospital Universitario Lucus Augusti de Lugo, Complejo Hospitalario Arquitecto Marcide de Ferrol, Hospital Universitario Central de Asturias, Complejo Asistencial Universitario de León, Complejo Asistencial de Ávila, Hospital Universitario Puerta de Hierro y Centro Hospitalar do Porto.
Se están reclutando casos incidentes con diagnóstico anatomopatológico de CPCP y los controles serán sujetos intervenidos por cirugía no compleja no relacionada con el consumo de tabaco. Tanto casos como controles son mayores de 25 años y sin antecedentes neoplásicos. Se obtendrá la misma información de todos los participantes en la investigación (tanto casos como controles). El protocolo del estudio fue aprobado por el CEIC del Área Sanitaria de Santiago de Compostela con la referencia 2015/222. Para la ejecución de la investigación se ha seguido en la medida de lo posible la guía STROBE para la comunicación de resultados de estudios observacionales18.
Recogida de informaciónLos investigadores de cada centro seleccionan los casos con CPCP, realizando a cada participante una entrevista personal con un cuestionario acerca de sus datos de filiación, lugar de residencia, antecedentes familiares y de enfermedades pulmonares previas, combustión de biomasa en el hogar, ocupaciones laborales y actividades de tiempo libre (bricolaje, pintura artística, barnizado, modelismo), así como consumo de tabaco (tipo, cantidad) y exposición a humo ambiental de tabaco, consumo de alcohol, y hábitos dietéticos.
Muestras biológicasA todos los participantes se les han extraído 3ml de sangre total, en la que se determinará al final del reclutamiento la deleción completa de los genes GSTM1 y GSTT1, un polimorfismo en el gen XRCC1 (Arg399Gln), un polimorfismo en el gen OGG1 (Ser326Cys), un polimorfismo en el gen ERCC1 (C8092A), dos polimorfismos en el gen ERCC2 (Asp312Asn y Lys751Gln)19, déficit de alfa-1-antitripsina y presencia de virus de papiloma humano20. La finalidad de analizar dichos genes es conocer si sus polimorfismos o presencia influyen en la mayor o menor probabilidad de desarrollar un CPCP.
Determinación de radón residencialA todos los sujetos del estudio se les ha entregado un detector de radón, así como las instrucciones de colocación. El detector de radón permanece durante al menos 3 meses en el dormitorio principal, lejos de puertas, ventanas y fuentes de electricidad. A todos los participantes se les llama por teléfono en dos ocasiones, la primera para asegurar la adecuada colocación del detector y la segunda para recordar el envío de vuelta una vez transcurridos, al menos, 3 meses. Posteriormente, los detectores se envían al centro coordinador. Una vez recibidos, se realiza la lectura de los detectores en el Laboratorio de Radón de Galicia. El sistema de medición implica un algoritmo de cálculo con ajuste estacional y la duración del período de exposición, entre otros factores. El Laboratorio de Radón de Galicia ha participado en ejercicios de intercomparación que indican que la calidad de las mediciones es excelente21,22.
Análisis estadísticoSe ha realizado un análisis univariante y bivariante de los primeros casos incluidos en el estudio. Se han realizado subanálisis por sexo y por el estadio al diagnóstico (limitado o extendido). Para describir la concentración de radón residencial se han utilizado medidas basadas en ordenaciones en lugar de medidas de tendencia central debido a que la distribución de radón es log-normal. El análisis estadístico se ha llevado a cabo con SPSS v22.
ResultadosHasta el día 25/10/2016 se habían reclutado 113 pacientes, y el 22,1% eran mujeres (25). La edad mediana al diagnóstico fue de 63 años, con un rango intercuartílico (RIQ) de 57 a 70 años, y el 11,5% de los casos eran menores de 50 años. El 42,9% (48 casos) tuvieron enfermedad limitada al diagnóstico (estadiosI-III). El 4,5% nunca habían fumado y el 49,1% fumaban en el momento del diagnóstico. El porcentaje de devolución de detectores fue del 79,8%, con 63 casos con mediciones de radón residencial. La mediana de la concentración de radón fue de 128Bq/m3, y el 25% de los casos presentaban concentraciones superiores a los 223Bq/m3 en su domicilio en el momento del diagnóstico. El 7,9% de los casos tenían concentraciones superiores a los 400Bq/m3. Los casos nunca fumadores tenían una concentración mediana de radón residencial de 233Bq/m3. Solo uno de estos 5 casos de nunca fumadores había estado expuesto en su domicilio a humo ambiental de tabaco. El consumo acumulado mediano de tabaco de fumadores y exfumadores fue de 48paquetes-año. El tiempo mediano de abstinencia de los exfumadores era de 5 años y medio y un 25% de los exfumadores llevaban más de 19 años sin fumar. Una descripción detallada de los sujetos incluidos se presenta en la tabla 1
Descripción de los sujetos incluidos
| Variable | n (%)a |
|---|---|
| Sexo | |
| Hombre | 88 (77,9) |
| Mujer | 25 (22,1) |
| Edad | |
| Media | 63,4 |
| Mediana (pct 25-75) | 63 (57,2-69,7) |
| Rango | 42-86 |
| Tabacob | |
| Nunca fumadorc | 5 (4,5) |
| Exfumador | 52 (46,4) |
| Fumador | 55 (49,1) |
| Estadio al diagnósticob | |
| Enfermedad limitada | 48 (42,9) |
| Enfermedad extendida | 64 (57,1) |
| Concentración de radón residencial (Bq/m3) | |
| Media | 173 |
| Mediana (pct 25-75) | 128 (85,5-218,5) |
| Rango | 17-952 |
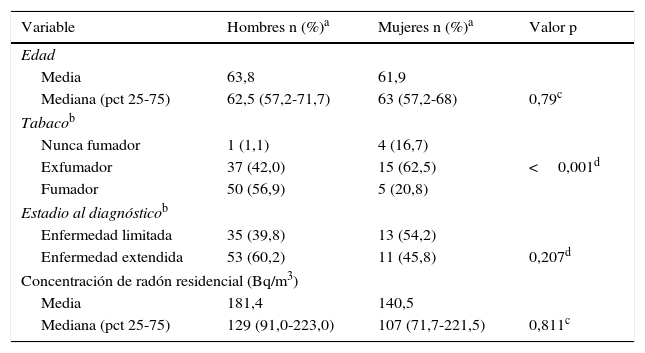
La distribución de las distintas características del cáncer microcítico por sexo se observa en la tabla 2. Las mujeres tuvieron una edad mediana de 63 años, con un rango intercuartílico de 57 a 68 años. En este sexo, el 54,2% presentaron enfermedad limitada y la concentración de radón mediana era de 107Bq/m3, con un rango intercuartílico de 72 a 221Bq/m3. El 16,7% de las mujeres eran nunca fumadoras y un 20,8% fumaban en el momento del diagnóstico. Para los hombres, su edad mediana al diagnóstico se situó en 63 años, con un rango intercuartílico de 57 a 72 años. El 39,8% presentaron enfermedad limitada a estadiosI-III. El 1,1% de los hombres eran nunca fumadores y el 56,8% fumaban al momento del diagnóstico. La concentración mediana de radón se situó en 129Bq/m3, con un rango intercuartílico de 91 a 223Bq/m3. No hubo diferencias significativas entre ambos sexos para ninguna de las variables anteriores, excepto para el consumo de tabaco en el momento del diagnóstico (p<0,001).
Diferencias por sexo en las características de los casos incluidos
| Variable | Hombres n (%)a | Mujeres n (%)a | Valor p |
|---|---|---|---|
| Edad | |||
| Media | 63,8 | 61,9 | |
| Mediana (pct 25-75) | 62,5 (57,2-71,7) | 63 (57,2-68) | 0,79c |
| Tabacob | |||
| Nunca fumador | 1 (1,1) | 4 (16,7) | |
| Exfumador | 37 (42,0) | 15 (62,5) | <0,001d |
| Fumador | 50 (56,9) | 5 (20,8) | |
| Estadio al diagnósticob | |||
| Enfermedad limitada | 35 (39,8) | 13 (54,2) | |
| Enfermedad extendida | 53 (60,2) | 11 (45,8) | 0,207d |
| Concentración de radón residencial (Bq/m3) | |||
| Media | 181,4 | 140,5 | |
| Mediana (pct 25-75) | 129 (91,0-223,0) | 107 (71,7-221,5) | 0,811c |
Respecto al consumo de tabaco y a la estadificación de la enfermedad (estadiosI-III frente a estadio IV), los nunca fumadores y fumadores presentaron más frecuentemente enfermedad diseminada al diagnóstico. De hecho, un 39,6% de los sujetos con enfermedad en estadiosI-III eran fumadores en el momento del diagnóstico, mientras que el 55,6% de los sujetos con enfermedad en estadioIV eran fumadores al diagnóstico.
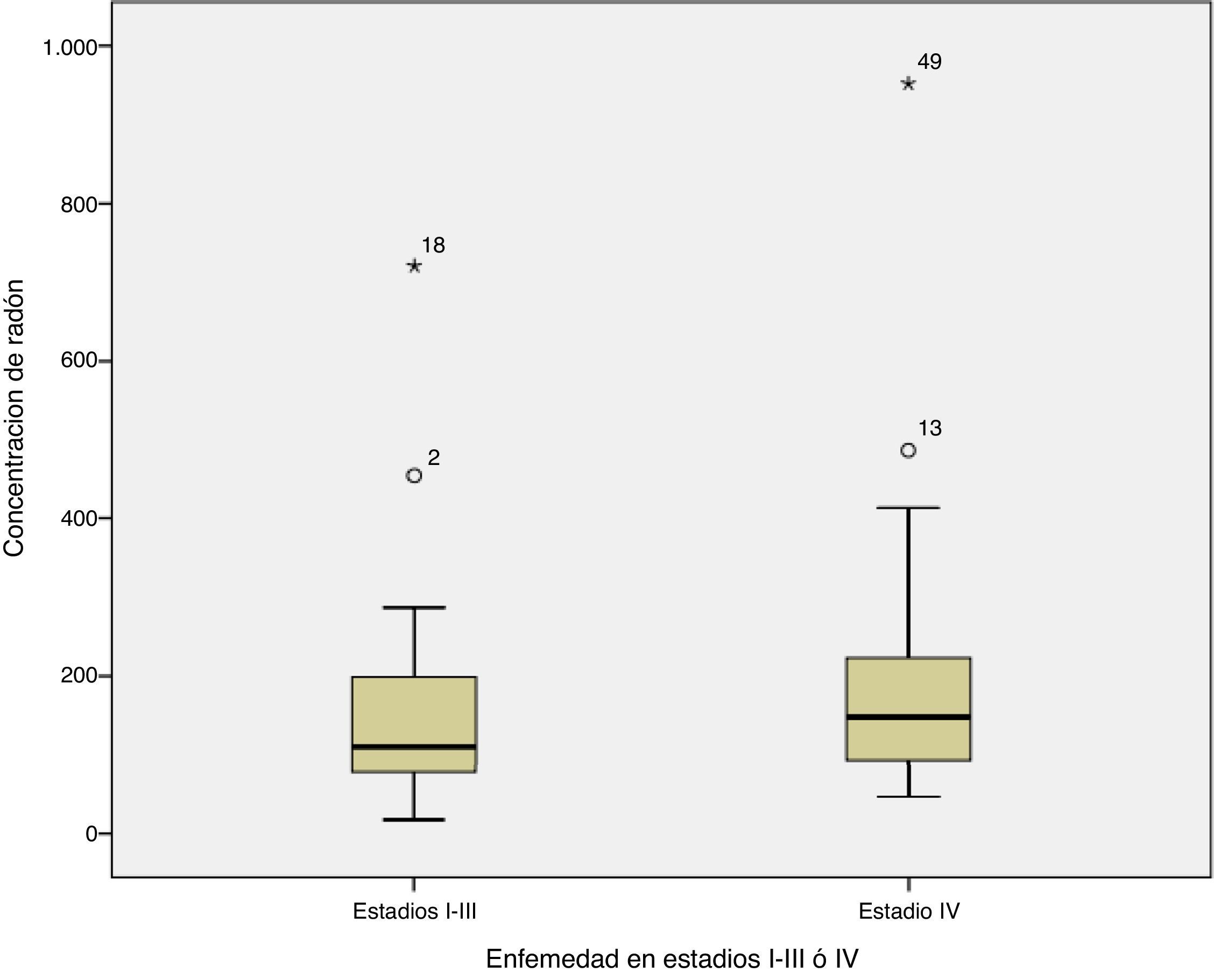
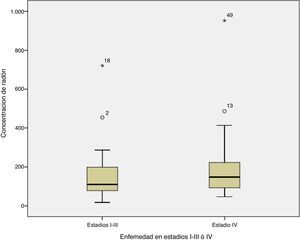
Al comparar la concentración de radón con el estadio de la enfermedad al diagnóstico se observó que la concentración mediana en los casos diagnosticados con enfermedad limitada a estadiosI-III era de 109Bq/m3 frente a 148Bq/m3 para la concentración de radón interior en aquellos pacientes diagnosticados con enfermedad en estadioIV (prueba de comparación de medianas p=0,254). La figura 1 muestra la concentración de radón para el estadio al diagnóstico.
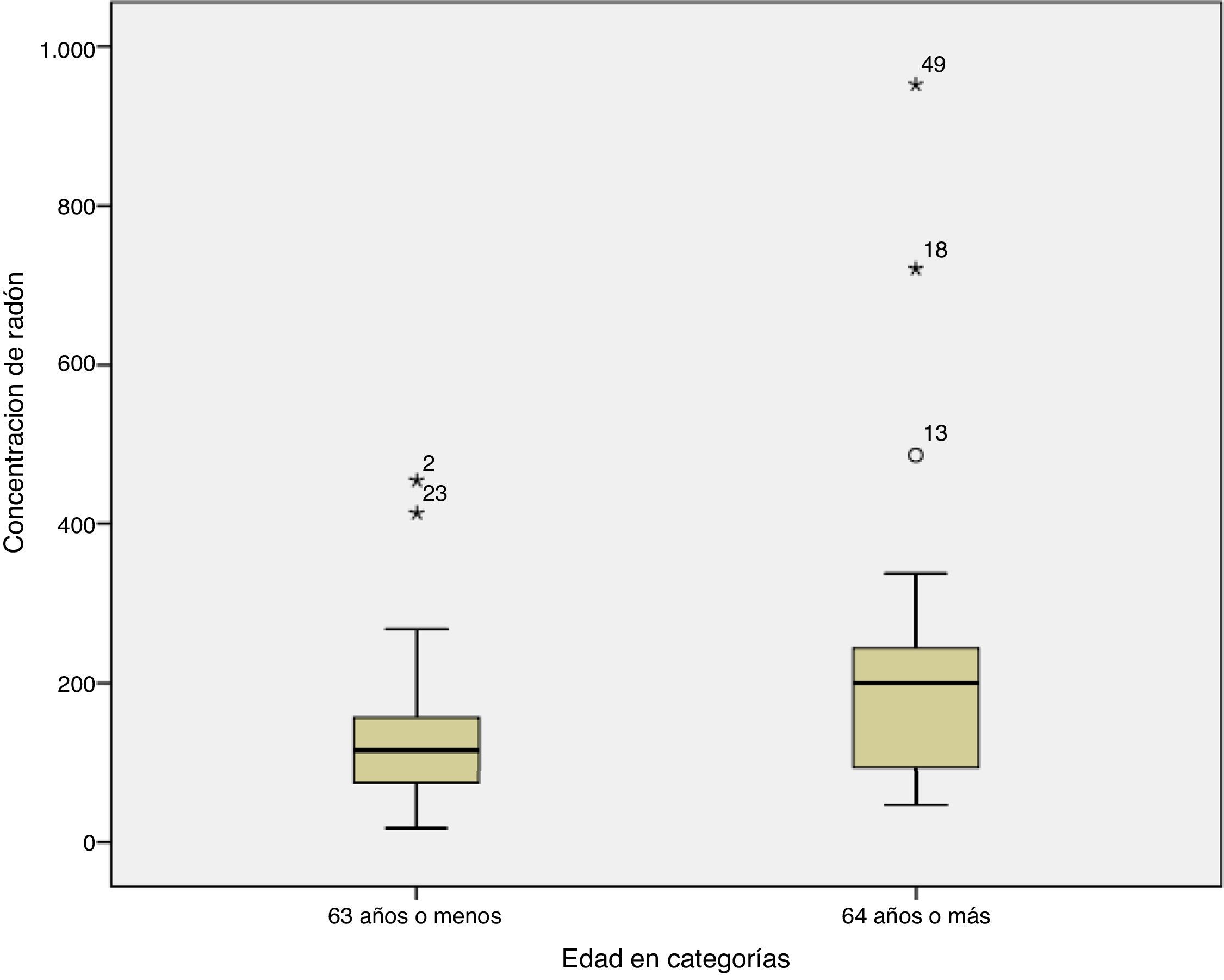
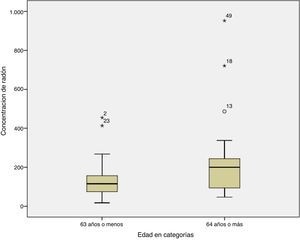
Finalmente, al relacionar la concentración de radón con la edad al diagnóstico, se observó que aquellos sujetos con una edad de 63 años o menos, frente a los sujetos diagnosticados con 64 años o más, tenían concentraciones medianas de radón residencial de 116Bq/m3 y 200Bq/m3, respectivamente, siendo la diferencia estadísticamente significativa (p=0,032). En la figura 2 se puede ver la distribución de radón para la edad al diagnóstico, observándose que los sujetos con mayor edad parecen presentar mayores concentraciones de radón.
La tabla 3 muestra la distribución del radón interior y del consumo de tabaco, simultáneamente, en la extensión de la enfermedad al diagnóstico para los fumadores. Si bien solo se incluyen 48 participantes que tenían datos completos de radón y paquetes-año, se puede observar que el mayor porcentaje de sujetos con enfermedad extensa (16,7%) aparece para los participantes con más radón y consumo de tabaco.
Cáncer de pulmón de célula pequeña limitado o extendido en función del consumo de tabaco y de la exposición a radón residencial (n=48)
| Consumo de tabaco | Exposición a radón | Enfermedad limitada n (%) | Enfermedad extensa n (%) |
|---|---|---|---|
| ≤48 paquetes-año | ≤132Bq/m3 | 6 (12,5) | 6 (12,5) |
| >132Bq/m3 | 5 (10,4) | 7 (14,6) | |
| >48 paquetes-año | ≤132Bq/m3 | 6 (12,5) | 6 (12,5) |
| >132Bq/m3 | 4 (8,3) | 8 (16,7) |
Solo se incluyen fumadores. El consumo de tabaco y la exposición a radón se ha clasificado según la mediana.
Según nuestro conocimiento, el estudio SMALL CELL es el primero en analizar directamente los factores de riesgo del cáncer de pulmón exclusivamente microcítico, destacando entre ellos la exposición a radón residencial. Los resultados preliminares en los sujetos incluidos ponen de manifiesto varios aspectos. En primer lugar, cabe destacar el diagnóstico a edad más temprana del cáncer microcítico respecto a los carcinomas de célula no pequeña (63 años vs. 70 años)7. El porcentaje de casos diagnosticados en estadioIV ronda el 57%, igual al diagnosticado en estadioIV en los cánceres de pulmón no microcíticos (CPCNP) según datos norteamericanos23. La edad y el estadio al diagnóstico son similares entre hombres y mujeres, aunque parece que los hombres tienden a ser diagnosticados con cánceres en estadioIV con más frecuencia. Respecto a la concentración de radón, esta es elevada en los cánceres microcíticos si se compara, por ejemplo, con datos de la población general de Galicia. Se observa que los sujetos con cáncer extendido tienen una concentración de radón ligeramente mayor y que los sujetos con más edad al diagnóstico tienen concentraciones de radón significativamente más elevadas respecto a los casos más jóvenes.
La edad mediana al diagnóstico de los casos incluidos ha sido de 63 años. Es algo menor que la edad mediana al diagnóstico de cánceres no microcíticos (70 años) y es llamativo que más de un 11% de los casos se diagnostiquen antes de los 50 años. Este diagnóstico más temprano probablemente se deba a un período de inducción algo más reducido que en el CPCNP debido a un mayor consumo de tabaco en los pacientes con CPCP24.
La edad al diagnóstico es muy parecida para hombres y mujeres, aunque para ellos se observa un mayor porcentaje de sujetos diagnosticados con enfermedad en estadioIV que para las mujeres (un 15% más). Es posible que esta diferencia se deba al mayor número de hombres fumadores y exfumadores frente a las mujeres y a que el tabaco pueda influir en una mayor probabilidad de presentar enfermedad metastásica al diagnóstico. Así, un 17% de las mujeres diagnosticadas son nunca fumadoras, un porcentaje alto. Estudios previos en la misma zona han permitido observar que el CPCP en nunca fumadoras es un cáncer relativamente frecuente en Galicia, y que el radón puede tener algún papel en su aparición25.
El consumo de tabaco es sin lugar a dudas el factor de riesgo más importante del CPCP. El 95,5% de los casos incluidos son fumadores o exfumadores y el consumo de tabaco es más prevalente en los hombres que en las mujeres. Los no fumadores con CPCP son más frecuentes en mujeres que en hombres, lo que concuerda con la literatura, al igual que el hecho de que el CPCP es el tipo histológico más asociado con el consumo de tabaco26. Por otra parte, hemos observado que los fumadores actuales al diagnóstico presentan mayor porcentaje de enfermedad extensa que los exfumadores, indicando una posible relación entre intensidad del hábito y extensión de la enfermedad al diagnóstico. Además, los resultados parecerían indicar que los sujetos con una concentración de radón superior a la mediana y mayor consumo de tabaco presentarían un mayor porcentaje de diagnósticos con enfermedad extensa, indicando una posible influencia de ambos factores de riesgo en el diagnóstico de la enfermedad en estado avanzado.
Los hallazgos referentes a la concentración de radón y su posible influencia en el CPCP son relevantes. En primer lugar, la concentración de radón observada en los casos (128Bq/m3) supera la concentración de radón observada en población general en Galicia (99Bq/m3)27, lo que sugiere que el radón residencial es un factor de riesgo del cáncer de pulmón microcítico. La OMS considera como nivel de acción 100Bq/m328. Si comparamos la concentración observada en este estudio con la que presentan los casos de cáncer de pulmón nunca fumadores (237Bq/m3)29 se observa que es menor. Esto se debe probablemente a que es necesaria una concentración de radón más elevada para provocar un cáncer de pulmón en nunca fumadores30, y en este estudio se han incluido fundamentalmente fumadores y nunca fumadores con CPCP. De hecho, si analizamos la concentración mediana de radón en los nunca fumadores del presente trabajo, esta es de 233Bq/m3, lo que sustenta la afirmación anterior. El mayor estudio de cáncer de pulmón y radón residencial publicado hasta la fecha31 indica que el cáncer de pulmón microcítico es el que presenta mayor asociación con el radón interior. Otras investigaciones realizadas en nuestra área también apuntan a una mayor asociación causal con el CPCP y otros tipos histológicos menos frecuentes11. Otras investigaciones que han analizado la polución ambiental y su efecto sobre el cáncer de pulmón han observado que el mayor riesgo por tipo histológico también es para el CPCP32.
Respecto a la relación entre la concentración de radón y la extensión de la enfermedad al diagnóstico, parece que aquellos casos con enfermedad en estadioIV tienen algo más de radón residencial que los diagnosticados con enfermedad en estadiosI-III, si bien la diferencia no es estadísticamente significativa, no pudiéndose establecer ninguna conclusión al respecto. Sí se observa que aquellos casos que se diagnostican a edades más tardías están expuestos a una concentración de radón significativamente más elevada frente a aquellos casos diagnosticados a edades más tempranas.
No hay muchos estudios publicados acerca del mecanismo molecular por el cual el radón residencial puede producir cáncer de pulmón y menos aún que expliquen su influencia en la aparición del CPCP. Se ha especulado que podría tener un papel en la aparición de mutaciones en el gen p5333, K-Ras34 o incluso en mutaciones en driver genes del cáncer de pulmón como EGFR o ALK35. Se necesitan más investigaciones a nivel molecular para conocer más en detalle esta asociación.
La presente investigación tiene algunas limitaciones. Una de ellas es su tamaño muestral, aunque son resultados preliminares y el estudio continúa reclutando pacientes. A pesar de ello, es uno de los trabajos que ha incluido un número muy elevado de casos de CPCP entre los realizados en España. Otra limitación es la de no disponer actualmente de datos biológicos sobre genes de susceptibilidad y tener por ahora solo 63 mediciones de radón residencial. Esto se debe a que los detectores necesitan estar colocados en la vivienda un mínimo de 3 meses y luego hay un proceso de revelado. El retorno de detectores es muy elevado, del 90%, y hay que tener en cuenta que muchos pacientes ya han fallecido en el momento del envío del detector al Laboratorio de Radón de Galicia.
Este estudio también presenta importantes fortalezas. Una de ellas es su naturaleza multicéntrica, lo que permite tener mayor tamaño muestral y también mayor validez externa. Por otra parte, el estudio se realiza fundamentalmente en una zona de elevada exposición a radón interior, lo que permite valorar su efecto con mayor facilidad al haber mayor variabilidad en la exposición. Por último, los sujetos se caracterizan por residir un número elevado de años en la misma vivienda y tener por tanto poca movilidad, facilitando la atribución causal del radón al CPCP30.
En conclusión, los resultados de este estudio indican que el CPCP se inicia a una edad más temprana que el CPCNP y que una parte importante de los casos se diagnostican antes de los 50 años. Más de la mitad de los casos en esta serie presentan enfermedad extendida al diagnóstico, lo que indica un pronóstico adverso para muchos de estos pacientes. El radón parece influir en la aparición de este tipo histológico de cáncer de pulmón y aquellos sujetos diagnosticados a más edad presentan concentraciones superiores de radón en el domicilio. Un porcentaje relevante de casos presentan concentraciones de radón muy elevadas en su vivienda. Se hace muy necesario fomentar la mayor investigación en los factores de riesgo del cáncer de pulmón microcítico y establecer políticas de prevención de la exposición a radón residencial, sin olvidar la lucha contra el consumo de tabaco.
FinanciaciónInstituto de Salud Carlos III. PI15/01211. «Cáncer de pulmón de célula pequeña, factores de riesgo y susceptibilidad genética. Un estudio multicéntrico de casos y controles en España (Small Cell Study)».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo forma parte de la tesis doctoral de Ángeles Rodríguez Martínez.