Las bronquiectasias son la consecuencia final de múltiples patologías. Establecer la etiología tiene implicaciones clínicas y pronósticas. El objetivo fue evaluar la etiología de las bronquiectasias en una amplia muestra de pacientes, su posible relación con factores demográficos, clínicos o de gravedad, así como analizar las diferencias entre las idiopáticas, las postinfecciosas y las debidas a otras causas.
MétodosEstudio multicéntrico, transversal, del Registro Histórico Español de la SEPAR (RHEBQ-SEPAR). Se incluyeron prospectivamente pacientes adultos con bronquiectasias seguidos por neumólogos. Para el estudio etiológico se siguieron las recomendaciones y pruebas diagnósticas protocolizadas en el registro que posteriormente fueron recogidas en la normativa SEPAR de bronquiectasias.
ResultadosSe analizaron 2.047 pacientes de 36 centros españoles. La edad media fue de 64,9años y el 54,9% fueron mujeres. La etiología se identificó en el 75,8% de los casos (postinfecciosa: 30%; fibrosis quística: 12,5%; inmunodeficiencias: 9,4%; EPOC: 7,8%; asma: 5,4%; discinesia ciliar: 2,9%, y enfermedades sistémicas: 1,4%). Las distintas etiologías presentaban diferencias demográficas, clínicas y microbiológicas. Las bronquiectasias postinfecciosas y las secundarias a EPOC y asma presentaban más riesgo de tener peor función pulmonar. Los pacientes con bronquiectasias postinfecciosas eran mayores y se diagnosticaban más tarde. Las bronquiectasias idiopáticas predominaban en mujeres no fumadoras y se asociaban a mejor función pulmonar, mayor índice de masa corporal y menor frecuencia de infección por Pseudomonas aeruginosa que las de causa conocida.
ConclusionesLa etiología de las bronquiectasias se ha identificado en una gran proporción de los pacientes incluidos en el RHEBQ-SEPAR. Se pueden reconocer diferentes fenotipos relacionados con las distintas causas.
Bronchiectasis is caused by many diseases. Establishing its etiology is important for clinical and prognostic reasons. The aim of this study was to evaluate the etiology of bronchiectasis in a large patient sample and its possible relationship with demographic, clinical or severity factors, and to analyze differences between idiopathic disease, post-infectious disease, and disease caused by other factors.
MethodsMulticenter, cross-sectional study of the SEPAR Spanish Historical Registry (RHEBQ-SEPAR). Adult patients with bronchiectasis followed by pulmonologists were included prospectively. Etiological studies were based on guidelines and standardized diagnostic tests included in the register, which were later included in the SEPAR guidelines on bronchiectasis.
ResultsA total of 2,047 patients from 36 Spanish hospitals were analyzed. Mean age was 64.9years and 54.9% were women. Etiology was identified in 75.8% of cases (post-Infection: 30%; cystic fibrosis: 12.5%; immunodeficiencies: 9.4%; COPD: 7.8%; asthma: 5.4%; ciliary dyskinesia: 2.9%, and systemic diseases: 1.4%). The different etiologies presented different demographic, clinical, and microbiological factors. Post-infectious bronchiectasis and bronchiectasis caused by COPD and asthma were associated with an increased risk of poorer lung function. Patients with post-infectious bronchiectasis were older and were diagnosed later. Idiopathic bronchiectasis was more common in female non-smokers and was associated with better lung function, a higher body mass index, and a lower rate of Pseudomonas aeruginosa than bronchiectasis of known etiology.
ConclusionsThe etiology of bronchiectasis was identified in a large proportion of patients included in the RHEBQ-SEPAR registry. Different phenotypes associated with different causes could be identified.
Las bronquiectasias (BQ) son la consecuencia final de múltiples procesos patológicos. El espectro etiológico y el porcentaje de BQ idiopáticas varía dependiendo de la procedencia de los sujetos y del protocolo diagnóstico1-11. Está justificada la búsqueda de las causas con un protocolo extenso de pruebas diagnósticas, ya que establecer la etiología tiene implicaciones terapéuticas y pronósticas12-14. En una revisión1 que analizó 35 estudios europeos, 8 asiáticos, 6 de Oceanía, 5 sudamericanos, uno norteamericano y uno africano, las causas globales identificadas con más frecuencia fueron: postinfecciosas: 29,9%; inmunodeficiencias: 5%; enfermedad pulmonar obstructiva crónica (EPOC): 3,9% (aunque fue criterio de exclusión en muchos estudios)1-4; enfermedades del tejido conectivo (ETC): 3,8%; aspergilosis broncopulmonar alérgica (ABPA): 2,6%; disfunción ciliar (DC): 2,5%, y asma: 1,4%. El 44,8% se clasificaron como idiopáticas. Lonni et al.9 han publicado la mayor cohorte hasta el momento, con 1.258 pacientes europeos. En España no se han publicado datos globales centrados en la etiología de las BQ (aunque se han comunicado datos de etiología en otros estudios)15-20. El Registro Histórico Español de BQ de la Sociedad Española de Patología Respiratoria (RHEBQ-SEPAR) se creó en 2002 para establecer criterios uniformes de diagnóstico y tratamiento de los pacientes con BQ y para conocer los diferentes aspectos de esta patología en España. Era una base de datos electrónica, accesible en la página web de SEPAR (www.separ.es/bronquiectasias) y en la que se invitó a participar a todos los neumólogos. El objetivo del estudio fue evaluar la etiología de las BQ en una amplia cohorte de pacientes (incluidos en el RHEBQ-SEPAR) que es la mayor publicada hasta ahora y una muestra bastante homogénea y representativa de los pacientes controlados por los neumólogos. Además, analizar la posible relación entre las diferentes etiologías y factores demográficos, clínicos o de gravedad, así como las diferencias existentes entre los pacientes con BQ idiopáticas respecto a aquellos con BQ postinfecciosas y debidas al resto de causas.
MétodosDiseño y poblaciónEstudio multicéntrico, transversal, de los pacientes incluidos en el RHEBQ-SEPAR. Se incluyeron prospectivamente, de 2002 a 2011, pacientes adultos con BQ seguidos en las consultas de neumología de 36 centros de 11 comunidades autónomas españolas (tabla 1). Se establecieron recomendaciones de diagnóstico y seguimiento para la inclusión y la recogida de los datos que fueron posteriormente publicadas en la normativa SEPAR de BQ (NSBQ)12. Cada paciente fue revisado por el equipo de coordinación del RHEBQ antes de ser validado. En caso de omisiones o inconsistencias, se solicitaban las correcciones oportunas al investigador como control de calidad.
Distribución por comunidades autónomas de los pacientes incluidos
| Comunidad autónoma | n (%) |
|---|---|
| Andalucía | 283 (13,8) |
| Aragón | 88 (4,3) |
| Asturias | 51 (2,5) |
| Baleares | 6 (0,3) |
| Canarias | 46 (2,2) |
| Cantabria | 5 (0,2) |
| Castilla León | 40 (2) |
| Cataluña | 930 (45,4) |
| Comunidad Valenciana | 178 (8,7) |
| Galicia | 28 (1,4) |
| Madrid | 380 (18,6) |
| País Vasco | 12 (0,6) |
Los participantes recibieron información detallada y se les garantizó la confidencialidad con disociación de los datos identificativos y utilización de códigos alfanuméricos. El análisis de la información se hizo de forma agregada. Los usuarios del registro se comprometieron a cumplir la Ley de Protección de Datos21.
Criterios diagnósticos de bronquiectasiasLas BQ podían ser diagnosticadas por criterios clínico-radiológicos, broncografía o tomografía computarizada (TC) siguiendo los criterios de Naidich et al.22. Se clasificaron en localizadas, bilaterales o difusas (≥4lóbulos). Los pacientes diagnosticados solo por criterios clínico-radiológicos fueron excluidos.
Criterios etiológicosPara el estudio etiológico, el RHEBQ-SEPAR requería las siguientes variables y pruebas diagnósticas12: características sociodemográficas; antecedentes familiares; tabaquismo o exposición a tóxicos; radioterapia o quimioterapia previa; infertilidad; infecciones pulmonares (virus, neumonías, micobacterias…) o de otra localización en la infancia o previas a la inclusión en el registro; coexistencia de otras patologías (diagnosticadas según guías específicas) como rinosinusitis, reflujo gastroesofágico, atopia, asma, ABPA, EPOC, enfermedades hematológicas, inflamatoria intestinal, ETC o trasplante. Se recogían también variables clínicas (edad de inicio de los síntomas, tos, esputo…) y exploración física. Se registraban la espirometría (flujo espiratorio forzado [FEV1] en mililitros y como porcentaje del teórico)23, radiografía de senos, cultivos de esputo (con estudio para bacterias, hongos y micobacterias) y valores analíticos como inmunoglobulinas, α1-antitripsina (si estaba disminuida se aconsejaba genotipado), anticuerpos antinucleares (ANA) y factor reumatoide. Si se sospechaba inmunodeficiencia, se completaba con subclases de inmunoglobulinas y producción de anticuerpos y, con sospecha clínica de asma y/o ABPA, pruebas cutáneas y RAST-aspergillus. En pacientes con historia familiar o sospecha de fibrosis quística (FQ), prueba del sudor y estudio genético y, si referían infertilidad masculina, seminograma. Ante la sospecha de DC (si no presentaban dextrocardia) se aconsejaban pruebas para valorar el aclaramiento mucociliar (sacarina, seroalbúmina-marcada u óxido nítrico) y, si el cribado era positivo, estudio de ultraestructura ciliar12. Los pacientes con síntomas de reflujo se evaluaban con pHmetría. Para el síndrome de uñas amarillas debían presentar uñas distróficas con coloración amarilla (sin infección micótica) junto con BQ y sinusitis12.
Con la TC era posible identificar situs inversus, anomalías traqueobronquiales, BQ postobstructivas o enfisema. En BQ localizadas, sin antecedentes que lo justificaran, se aconsejaba fibrobroncoscopia.
Antes de clasificar unas BQ como idiopáticas, debían ser negativas al menos las siguientes pruebas diagnósticas: estudio inmunológico, prueba del sudor, IgE total, prick cutáneo, RAST-aspergillus, aclaramiento mucociliar, α1-antitripsina, ANA y factor reumatoide12.
Para considerar las BQ como de causa postinfecciosa se requería historia clara de infecciones respiratorias previas, presentando clínica sugestiva de BQ posterior al episodio, TC compatible y negatividad de las pruebas descritas anteriormente12.
Evaluación microbiológica y clasificación de gravedadSe consideró infección bronquial crónica (IBC): 3 o más cultivos positivos para un microorganismo en 6meses12. Se recogieron datos de los 12meses previos a la inclusión en el registro.
Se clasificó a los pacientes, en función del FEV1, en 3 grupos: los que presentaban FEV1% >80%, entre 50-80% y <50%.
Estudio estadísticoLos datos se analizaron utilizando el programa estadístico **R24. Para los análisis comparativos se excluyeron los pacientes con FQ. Se realizó un análisis descriptivo con medidas de tendencia central y dispersión para variables cuantitativas (media y desviación estándar) y distribución de frecuencias para las cualitativas. Para la comparación de variables resultado respecto a variables independientes cuantitativas, se utilizó la prueba de t de Student (o ANOVA en caso de 3 o más categorías), y la prueba de chi-cuadrado para variables independientes categóricas. Se construyeron modelos de regresión logística multivariada para valorar la gravedad de la función pulmonar y las BQ idiopáticas, mediante modelo por pasos hacia delante (Wald), con criterio de entrada p<0,1 y de salida 0,05, valorando la odds ratio con el respectivo IC95%. En dichos modelos se incluyeron como variables independientes aquellas con significación estadística en el análisis bivariado. Para algunos análisis comparativos se incluyeron aquellas BQ no FQ (BQNFQ) cuya causa representaba una frecuencia mayor del 1%. Se estableció el nivel de significación estadística en p<0,05.
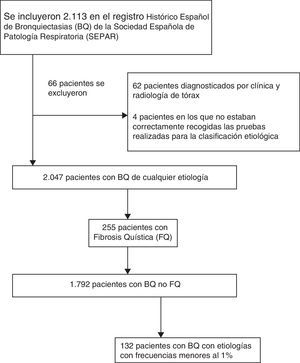
ResultadosPoblación estudiadaSe incluyeron en el RHEBQ-SEPAR 2.113 pacientes, reclutados en 36 centros de 11 comunidades autónomas españolas. Se excluyeron 62 pacientes diagnosticados por radiología simple y 4 en los que no estaban recogidas las pruebas realizadas para la clasificación etiológica (fig. 1 y tabla 1). De ellos, 255 pacientes (12,5%) presentaban FQ25, y por sus especiales características se excluyeron para el resto de los análisis (tabla 2). Las características de los pacientes con BQNFQ se muestran en la tabla 3. La edad media fue de 64,9años, el 54,9% fueron mujeres y el 38,4% presentaban historia de tabaquismo.
Etiología de las bronquiectasias
| Etiología | n = 2.047 (100%) |
|---|---|
| Postinfecciosas | 613 (30) |
| TBC | 380 (18,6) |
| No TBC | 233 (11,4) |
| Idiopática | 496 (24,2) |
| Fibrosis quística | 255 (12,5) |
| Inmunodeficiencias primarias | 192 (9,4) |
| EPOC | 160 (7,8) |
| Asma | 110(5,4) |
| Discinesia ciliar | 60 (2,9) |
| Enfermedades sistémicas o del tejido conectivo | 29 (1,4) |
| Aspiración | 20 (0,9) |
| Reflujo gastroesofágico | 13 (0,6) |
| Inhalación de gases | 6 (0,3) |
| Inhalación de drogas | 4 (0,2) |
| ABPA | 18 (0,9) |
| Malformaciones congénitas | 14 (0,7) |
| Patología traqueobronquial | 11(0,5) |
| Síndrome Swyer-James | 3 (0,1) |
| Inmunodeficiencias secundarias | 11 (0,5) |
| VIH | 4 (0,2) |
| Postrasplante | 4 (0,2) |
| Neoplasias | 3 (0,1) |
| Déficit alfa 1 antitripsina | 10 (0,5) |
| Obstrucción bronquial | 6 (0,3) |
| Enfermedad inflamatoria intestinal | 5 (0,2) |
| Infarto pulmonar por TEP | 5 (0,2) |
| Síndrome de Young | 5 (0,2) |
| Síndrome de uñas amarillas | 4 (0,2) |
| Rinosinusitis purulenta | 4(0,2) |
| Panbronquiolitis | 2 (0,1) |
| Quiste hidatídico | 2 (0,1) |
| Otros | 2 (0,1) |
ABPA: aspergilosis broncopulmonar alérgica; EPOC: enfermedad pulmonar obstructiva crónica; TBC: tuberculosis; TEP: tromboembolismo pulmonar; VIH: virus de la inmunodeficiencia humana.
Características clínicas, espirométricas y microbiológicas de los pacientes con bronquiectasias no debidas a fibrosis quística
| Total | n = 1.792 |
|---|---|
| Datos clínicos | |
| Edad | 64,9±18,4 |
| < 50, n (%) | 377 (21) |
| 50-75, n (%) | 787 (43,9) |
| >75, n (%) | 628 (35) |
| Edad al diagnóstico | 50,4±20,8 |
| Mujer, n (%) | 983 (54,9) |
| IMC | 24,9±4,8 |
| < 20, n (%) | 217 (12,1) |
| 20-25, n (%) | 667 (37,2) |
| 25-30, n (%) | 645 (36) |
| ≥ 30, n (%) | 263 (14,7) |
| Fumadores/exfumadores, n (%) | 686 (38,3) |
| Sinusitis, n (%) | 428 (24,8) |
| Aspecto del esputo | |
| Mucoso, n (%) | 577 (38,4) |
| Mucopurulento, n (%) | 591 (39,3) |
| Purulento, n (%) | 334 (22,2) |
| Localización de las bronquiectasias | |
| Localizadas, n (%) | 500 (27,9) |
| Bilaterales, n (%) | 881 (49,2) |
| Difusas, n (%) | 408 (22,8) |
| Datos espirométricos | |
| FEV1% | 67,3±23,9 |
| FEV1% > 80%, n (%) | 599 (35,7) |
| FEV1% 50-80%, n (%) | 624 (37,2) |
| FEV1% < 50%, n (%) | 454 (27,1) |
| FVC% | 71,7±19,5 |
| FEV1/FVC% | 70,2±15,4 |
| Datos microbiológicos | |
| Infección bronquial crónica, n (%) | 623 (34,8%) |
| Infección bronquial crónica por Pseudomonas aeruginosa, n (%) | 362 (20,5%) |
| Infección bronquial crónica por otros microorganismos, n (%) | 239 (13,5) |
| Tratamiento con antibiótico inhalado, n (%) | 187 (11,3) |
IMC: índice de masa corporal; n: número; %: porcentaje.
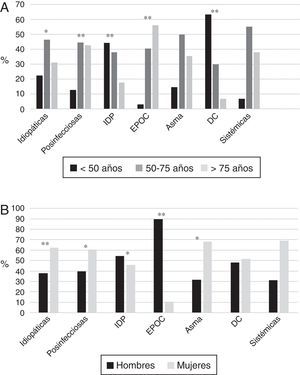
La etiología de las BQ se identificó en el 75,8% de los pacientes, siendo la causa conocida más frecuente la postinfecciosa (30%). Las frecuencias de las distintas causas se muestran en la tabla 2. En la tabla 4 se resumen las diferencias clínicas en función de la etiología. Los pacientes con EPOC presentaron la mayor media de edad (fig. 2A), mientras que los pacientes con BQ por DC fueron los más jóvenes. Predominaba el sexo femenino en pacientes con BQ idiopáticas, postinfecciosas, ETC y asma, y el masculino en los que tenían inmunodeficiencias primarias (IDP) y, fundamentalmente, EPOC (fig. 2B). Los pacientes con BQ por IDP y DC presentaron más rinosinusitis. Las debidas a DC, IDP y ETC fueron predominantemente bilaterales (tabla 5A).
Características clínicas según la etiología de las bronquiectasias
| Pacientes | Idiopáticas (n=496) | Postinfecciosas (n=613) | Inmunodeficiencias primarias (n=192) | EPOC (n=160) | Asma (n=110) | Discinesia ciliar (n=60) | Sistémicas (n=29) | p ANOVA |
|---|---|---|---|---|---|---|---|---|
| Edad (años) | 63,9±17,4 | 69,1±16,4 | 53,8±18,7 | 76,5±10,3 | 66,8±16,9 | 42,9±18,8 | 70±13,8 | < 0,001 |
| Edad al diagnóstico (años) | 49,3±19,2 | 53,6±19,7 | 39,9±19,9 | 65,7±10,9 | 56,2±16,9 | 22,1±18,1 | 58,5±15,2 | < 0,001 |
| Mujeres | 309 (62,3) | 370 (60,4) | 88 (45,8) | 17 (10,6) | 75 (68,2) | 31 (51,7) | 20 (69) | < 0,001 |
| Tabaquismo | 163 (32,9) | 208 (33,9) | 64 (33,3) | 154 (96,2) | 31 (28,4) | 14 (23,3) | 8 (27,6) | < 0,001 |
| IMC | 25,3±4,7 | 24,9±4,7 | 23,1±4,4 | 25,5±4,1 | 26,5±4,9 | 23,8±6,1 | 25,2±4,2 | < 0,001 |
| Rinosinusitis | 129 (26,7) | 100 (17) | 76 (42) | 11 (7,1) | 33 (31,1) | 43 (75,4) | 2 (7,1) | < 0,001 |
| FEV1% | 73,3±22,6 | 65,6±23,1 | 77,7±21,9 | 46,8±19 | 63,4±23,4 | 67,1±24,2 | 71,4±22,7 | < 0,001 |
| FEV1/FVC% | 72,8±14 | 69,6±14,8 | 77,9±14,4 | 56,5±15,1 | 66,4±13,5 | 73,2±14,7 | 70,8±14,3 | < 0,001 |
| Expectoración crónica | 246 (49,6) | 325 (53) | 70 (36,5) | 104 (65) | 53 (48,2) | 51 (85) | 13 (44,8) | < 0,001 |
| Hemoptisis | 24 (4,8) | 38 (6,2) | 2 (1) | 4 (2,5) | 1 (0,9) | 1 (1,7) | 0 (0) | < 0,001 |
| Infección bronquial crónica por algún MPP | 157 (31,7) | 216 (35,2) | 69 (35,9) | 54 (33,8) | 31 (28,2) | 41 (68,3) | 9 (31) | < 0,001 |
| Infección bronquial crónica por PA | 85 (17,2) | 140 (23) | 21 (11,8) | 39 (24,4) | 14 (12,7) | 27 (45) | 8 (27,6) | < 0,001 |
| Infección bronquial crónica por HI | 52 (10,6) | 62 (10,2) | 34 (19,1) | 13 (8,1) | 14 (12,7) | 14 (23,3) | 1 (3,4) | < 0,001 |
| ATB inhalado | 50 (11,1) | 54 (9,7) | 14 (7,4) | 21 (14,3) | 5 (4,8) | 21 (39,6) | 3 (10,3) | < 0,001 |
ATB: antibiótico; EPOC: enfermedad pulmonar obstructiva crónica; HI: Haemophilus influenzae; IMC: índice de masa corporal; MPP: microorganismo potencialmente patógeno; n: número; PA: Pseudomonas aeruginosa; %: porcentaje.
Los valores mayores y menores se resaltan en negrita.
(A) Edad según etiología. * p<0,05; **p<0,001. DC: discinesia ciliar; EPOC: enfermedad pulmonar obstructiva crónica; IDP: inmunodeficiencias primarias. Resultados expresados como porcentajes. (B) Sexo según etiología. * p<0,01; **p<0,001. DC: discinesia ciliar; EPOC: enfermedad pulmonar obstructiva crónica; IDP: inmunodeficiencias primarias. Resultados expresados como porcentajes
Localización de las bronquiectasias según la etiología
| Localizadas (n=459) | Bilaterales (n=829) | Difusas (n=370) | p | |
|---|---|---|---|---|
| Idiopáticas, n (%) | 121 (24,5) | 260 (52,6) | 113 (22,9) | ns |
| Postinfecciosas, n (%) | 221 (36,1) | 260 (42,4) | 132 (21,5) | < 0,001 |
| TBC, n (%) | 150 (39,5) | 154 (40,5) | 76 (20) | |
| No TBC, n (%) | 71 (30,5) | 106 (45,5) | 56 (24) | |
| Inmunodeficiencias primarias | 31 (16,1) | 112 (58,3) | 49 (25,5) | 0,001 |
| EPOC, n (%) | 40 (25) | 91 (56,9) | 29 (18,1) | ns |
| Asma, n (%) | 33 (30) | 62 (56,4) | 15 (13,6) | ns |
| Discinesia ciliar, n (%) | 10 (16,7) | 29 (48,3) | 21 (35) | 0,027 |
| Sistémicas, n (%) | 3 (10,3) | 15 (51,7) | 11 (37,9) | 0,040 |
EPOC: enfermedad pulmonar obstructiva crónica; ns: no significativo; TBC: tuberculosis.
Presentaban IBC el 34,8% de los pacientes con BQNFQ, siendo Pseudomonas aeruginosa (PA, 20,5%) y Haemophilus influenzae (HI, 11,8%) los microorganismos más frecuentes. Las diferentes etiologías presentaban distintos patrones microbiológicos (tablas 4 y 5B). Los pacientes con DC presentaron las mayores tasas de IBC por distintos microorganismos y los asmáticos, las menores. La IBC por PA fue más frecuente en las debidas a DC y EPOC y menos en IDP y asma.
Infección bronquial crónica por Pseudomonas aeruginosa (PA) según la etiología
| PA sí (n=334) | PA no (n=1.305) | p | |
|---|---|---|---|
| Idiopáticas n (%) | 85 (25,4) | 408 (31,3) | < 0,05 |
| Postinfecciosas n (%) | 140 (41,9) | 469 (35,9) | < 0,05 |
| Inmunodeficiencias primarias n (%) | 21 (6,3) | 157 (12) | < 0,01 |
| EPOC n (%) | 39 (11,7) | 121 (9,3) | ns |
| Asma n (%) | 14 (4,2) | 96 (7,4) | < 0,05 |
| Discinesia ciliar n (%) | 27 (8,1) | 33 (2,5) | < 0,001 |
| Sistémicas n (%) | 8 (2,4) | 21 (1,6) | ns |
EPOC: enfermedad pulmonar obstructiva crónica.
Del total de pacientes con BQNFQ, presentaban un FEV1>80% el 35,7%; FEV1% entre 50-80% un 37,2%, y FEV1%<50% un 27,1%. Los pacientes con EPOC presentaban la mayor alteración de la función pulmonar y los pacientes con inmunodeficiencias, la menor (tablas 4 y 6). En el modelo de regresión logística (tabla 7A) los factores de riesgo asociados a una peor función pulmonar fueron el sexo femenino, la mayor edad, un menor índice de masa corporal (IMC) y la presencia de IBC. Las etiologías con mayor riesgo de presentar peor función pulmonar eran las BQ postinfecciosas y las secundarias a EPOC y asma. Las BQ que se diagnosticaban a mayor edad presentaban mejor función pulmonar.
Función pulmonar según la etiología
| FEV1>80% n=557 | FEV1 50-80% n=577 | FEV1<50% n=417 | p | |
|---|---|---|---|---|
| Idiopáticas, n (%) | 212 (46,4) | 157 (34,4) | 88 (19,3) | < 0,001 |
| Postinfecciosas, n (%) | 171 (29,9) | 238 (41,7) | 162 (28,4) | 0,001 |
| Inmunodeficiencias primarias, n (%) | 102 (54,8) | 59 (31,7) | 25 (13,4) | < 0,001 |
| EPOC, n (%) | 8 (5,3) | 55(36,2) | 89 (58,6) | < 0,001 |
| Asma, n (%) | 32 (32) | 37 (37) | 31 (31) | ns |
| Discinesia ciliar, n (%) | 21 (36,2) | 20 (34,5) | 17 (29,3) | ns |
| Sistémicas, n (%) | 11 (40,7) | 11 (40,7) | 5 (18,5) | ns |
EPOC: enfermedad pulmonar obstructiva crónica; FEV1: flujo espiratorio forzado en el primer segundo; ns: no significativo.
Regresión logística. Características asociadas a peor función pulmonar
| β | p | OR | IC 95% inferior | IC 95% superior | |
|---|---|---|---|---|---|
| Sexo | |||||
| Hombre | < 0,001 | 1,00 | |||
| Mujer | 0,84 | 2,31 | 1,81 | 2,95 | |
| Edad | 0,03 | < 0,001 | 1,03 | 1,02 | 1,03 |
| Edad al diagnóstico | −0,028 | < 0,001 | 0,973 | 0,96 | 0,985 |
| IMC | |||||
| 20-25 | 0,021 | 1,00 | |||
| < 18,5 | 0,55 | 1,73 | 1,08 | 2,77 | |
| 18,5-20 | 0,80 | 2,22 | 1,29 | 3,82 | |
| 25-30 | 0,13 | 1,14 | 0,87 | 1,50 | |
| ≥ 30 | 0,09 | 1,09 | 0,76 | 1,56 | |
| Etiología | |||||
| Idiopáticas | < 0,001 | 1,00 | |||
| Postinfecciosas | 0,58 | 1,78 | 1,36 | 2,34 | |
| IDP | −0,33 | 0,72 | 0,50 | 1,05 | |
| EPOC | 2,11 | 8,22 | 3,86 | 17,52 | |
| Asma | 0,73 | 2,07 | 1,28 | 3,36 | |
| DC | 0,58 | 1,78 | 0,95 | 3,33 | |
| Sistémicas | 0,16 | 1,17 | 0,51 | 2,66 | |
| Infección bronquial crónica | |||||
| No | < 0,001 | 1,00 | |||
| Sí | 0,82 | 2,27 | 1,77 | 2,93 | |
DC: discinesia ciliar; EPOC: enfermedad pulmonar obstructiva crónica; IDP: inmunodeficiencias primarias; IMC: índice de masa corporal.
Variable dependiente: FEV1<80% vs FEV1≥80%
R cuadrado de Nagelkerke: 0,233.
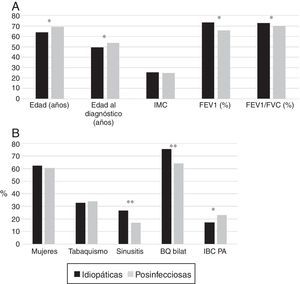
Los pacientes con BQ postinfecciosas eran mayores y se diagnosticaban más tarde. En aquellos con BQ idiopáticas predominaron las mujeres y la afectación bilateral; presentaron menor frecuencia de IBC por PA, mayor de rinosinusitis y mejor función pulmonar (figs. 3A y 3B).
(A) Comparación de las características de los pacientes con bronquiectasias idiopáticas frente a los que presentaban bronquiectasias postinfecciosas. * p<0,001. IMC: índice de masa corporal. Resultados expresados como medias. (B) Comparación de las características de los pacientes con bronquiectasias idiopáticas frente a los que presentaban BQ postinfecciosas. * p<0,05; **p<0,001. BQ bilat: bronquiectasias bilaterales y difusas; IBC PA: infección bronquial crónica por Pseudomonas aeruginosa. Resultados expresados como porcentajes.
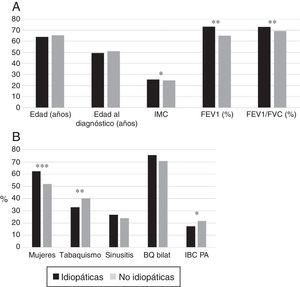
Las BQ idiopáticas eran más frecuentes en mujeres no fumadoras y se asociaban a mejor función pulmonar, mayor IMC y menor frecuencia de IBC por PA que las de causa conocida (figs. 4A y 4B). En el análisis de regresión logística (tabla 7B) las BQ idiopáticas se asociaron a un mayor IMC, mejor función pulmonar y al sexo femenino.
(A) Comparación de las características de los pacientes con BQ idiopáticas frente a los que presentaban bronquiectasias no fibrosis quística de causa conocida. n = 1.792. * p<0,05; **p<0,001. IMC: índice de masa corporal. Resultados expresados como medias. (B) Comparación de las características de los pacientes con bronquiectasias idiopáticas frente a los que presentaban bronquiectasias no fibrosis quística de causa conocida. n = 1792. * p<0,05; **p<0,01; ***p<0,001. BQ bilat: bronquiectasias bilaterales y difusas; IBC PA: infección bronquial crónica por Pseudomonas aeruginosa. Resultados expresados como porcentajes.
Regresión logística. Características asociadas a bronquiectasias idiopáticas
| β | OR | IC95% | p | |
|---|---|---|---|---|
| IMC | 0,026 | 1,026 | 1,003-1,049 | 0,026 |
| FEV1 | 0,014 | 1,014 | 1,009-1,019 | < 0,001 |
| Sexo (mujer) | 0,245 | 1,278 | 1,013-1,611 | 0,038 |
FEV1: flujo espiratorio forzado en el primer segundo; IMC: índice de masa corporal.
Variable dependiente: idiopáticas vs no idiopáticas.
Este estudio evaluó la etiología de las BQ (aplicando un protocolo homogéneo y extenso de pruebas diagnósticas) en la mayor muestra de pacientes con BQ publicada hasta ahora. Aunque no podemos establecer con certeza la prevalencia de las diferentes etiologías, al tratarse de un registro voluntario donde no estarían incluidos consecutivamente todos los pacientes posibles, la muestra es bastante representativa de los pacientes españoles con BQ, ya que participaron unidades de neumología de diferentes comunidades autónomas españolas.
La etiología de las BQ se identificó en una gran proporción de los pacientes incluidos en el RHEBQ-SEPAR (75,8%), ya que se recomendaba un amplio abanico de pruebas etiológicas12 y eran pacientes seguidos por neumólogos que suelen seguir las recomendaciones de la SEPAR. Las distintas cohortes publicadas han mostrado resultados dispares (26-90%) por las diferentes poblaciones evaluadas, los criterios para definir las etiologías, el estudio diagnóstico realizado y el lugar donde se controlaba al paciente1-11. Las BQ idiopáticas eran más frecuentes si los pacientes analizados procedían de consultas generales1,10,11,26 frente a los procedentes de unidades de neumología o específicas1,2,4,7,9,15,27, como es el caso de los pacientes incluidos en el RHEBQ-SEPAR. Gao et al.1, en la revisión que incluye los estudios publicados de todos los países, encuentran un 44,8% de BQ idiopáticas y, analizando solo los europeos, un 41,1%.
En nuestro estudio las causas conocidas más frecuentes fueron las postinfecciosas (30%), seguidas de FQ, IDP, EPOC, asma, DC y ETC, en la línea de otros estudios1,4,8,9,12,15,26,27. De los 35 estudios europeos revisados por Gao et al.1 (6.364 pacientes), de media, las postinfecciosas suponían el 31,2%; IDP: 5,3%; EPOC: 5,2%; ETC: 4%; ABPA: 2,8%; DC: 2,7%; asma: 7%, e inflamatoria intestinal: 1%. En España15-20, en un estudio cuyo objetivo fue construir y validar el sistema de puntuación FACED15, que incluyó 839 pacientes de 7 unidades específicas de BQ, en las que se seguía también el protocolo diagnóstico de la NSBQ12, el 37% fueron idiopáticas, el 29,3% postinfecciosas, el 8,3% inmunodeficiencias, el 3,5% EPOC, el 3,2% DC y el 2,1% ETC. Sin embargo, en un estudio estadounidense7 (106 pacientes) se identificaron los factores causales en más del 90% de los casos, siendo los más frecuentes los trastornos inmunitarios y las ETC, probablemente porque era un centro muy especializado y se realizó una evaluación inmunológica exhaustiva7. Por otro lado, el RHEBQ-SEPAR estaba implementado por neumólogos, y en nuestro medio patologías como las ETC, y en algunos casos las inmunodeficiencias y el asma atópico o la ABPA, son seguidas también por otros especialistas, lo que podría condicionar las menores tasas de algunas de estas patologías en nuestra serie.
En nuestra muestra, las infecciones siguen siendo la causa más frecuente de BQ, y de ellas, las secundarias a tuberculosis. Sin embargo, es posible que algunos de los casos de BQ postinfecciosas pudieran tener alguna alteración de la inmunidad o alteración genética no detectada28 que los hiciera más susceptibles a las infecciones, fundamentalmente en aquellos con rinosinusitis concomitante2,4. En la revisión sistemática1, en adultos, de las postinfecciosas, la tuberculosis fue también la etiología predominante y era más frecuente en Asia que en Europa1,6,10,11,29. En niños, las neumonías eran las principales causas30. En países en vías de desarrollo1,6,29 o en comunidades indígenas5,31 las infecciones tienen aun mayor prevalencia debido a las peores condiciones sociosanitarias.
La FQ suponía también un alto porcentaje, ya que el RHEBQ-SEPAR incluía todas las causas de BQ y cada vez son más los pacientes adultos con FQ seguidos por neumólogos en las unidades de FQ32, y la mayoría de ellas participaron en el registro.
Asimismo, la frecuencia de IDP también fue elevada (mayor que lo publicado en Europa1,9 aunque menor de lo encontrado en Estados Unidos)7, ya que se aconsejaba un amplio estudio para descartar o apoyar este diagnóstico12 antes de clasificar las BQ como idiopáticas.
En nuestra muestra, el 7,8% de los pacientes con BQ presentaron como causa la EPOC. Los estudios clásicos sobre etiología no incluían la EPOC2-4, pero los más recientes, tras la publicación de los estudios de Patel et al.33 y Martínez-García et al.34,35 que demostraron que más del 50% de los pacientes con EPOC moderada y grave presentaban BQ, la frecuencia descrita ha aumentado (11-15%)8,9,27,36. Como se esperaba, los pacientes con EPOC eran fundamentalmente varones, con historia de tabaquismo, presentaban mayor edad, mayor frecuencia de IBC por PA y peor función pulmonar.
Se encontraron diferencias clínicas en función de la etiología, con resultados similares a los publicados en otras series9,15,27. Los pacientes con DC presentaban las mayores tasas de IBC por distintos microorganismos y los asmáticos, las menores1,4,9. La DC y las IDP presentaban con más frecuencia rinosinusitis, en concordancia con otros estudios1,2.
En nuestra muestra solo el 27% de los pacientes presentaron un FEV1%<50% y en el análisis multivariante las etiologías más asociadas a una peor función pulmonar fueron las BQ postinfecciosas, por asma y, fundamentalmente, las secundarias a EPOC. Los pacientes con IDP y con BQ idiopáticas eran los que tenían mejor función pulmonar. Lonni et al.9 valoraron la relación entre los diferentes niveles de gravedad y las distintas etiologías de las BQ y no encontraron grandes diferencias, salvo por una mayor frecuencia de formas graves en las secundarias a EPOC y menor en las BQ idiopáticas, al igual que en nuestro estudio. La asociación entre EPOC y BQ condiciona un fenotipo clínico más grave y con peor pronóstico9,34-36, aunque se discute si es una relación de causalidad37 o una comorbilidad38.
Al comparar las BQ idiopáticas con las postinfecciosas, las idiopáticas se diagnosticaban antes, tenían más clínica de rinosinusitis, eran predominantemente bilaterales, tenían mejor función pulmonar y menor frecuencia de IBC por PA, similar a lo encontrado en estudios previos1,4. En las BQ postinfecciosas el retraso diagnóstico podría estar en relación con un tiempo variable entre la infección inicial causante de las BQ y la posterior sobreinfección que provocaría la aparición de nuevos síntomas4,8,12.
Al comparar las BQ idiopáticas con las BQNFQ de cualquier causa conocida, observamos que presentan un fenotipo especial, con menos tabaquismo, mayor IMC, mejor función pulmonar, menor frecuencia de IBC por PA y un claro predominio de mujeres, lo que confirma lo encontrado en las series publicadas en otras poblaciones con menor número de pacientes9,27. Recientemente se han publicado varios estudios36,39 para intentar definir fenotipos específicos en las BQ relacionados con el pronóstico, y que contemplan factores como la edad, las agudizaciones o las colonizaciones por microorganismos, pero en los que también influyen las distintas etiologías. Martínez-García et al.39 observaron que los fenotipos que se asocian a mejor pronóstico incluían un mayor número de pacientes con IDP, DC o BQ idiopáticas frente a los asociados a peor pronóstico, entre los que predominan los pacientes con EPOC. Aliberti et al.36 también encontraron que los pacientes con BQ idiopáticas presentaban con mayor frecuencia fenotipos que tienen menos IBC por PA y son menos graves, y que los fenotipos con EPOC tienen más frecuencia de IBC por PA y mayor gravedad, lo que apoya nuestros resultados.
LimitacionesAunque nuestro estudio tiene importantes puntos fuertes, como el incluir la mayor muestra de pacientes con BQ seguidos por neumólogos de diferentes comunidades autónomas españolas y a los que se les realizaba un protocolo homogéneo y extenso de pruebas diagnósticas para evaluar las causas, también presenta limitaciones. En primer lugar, no se puede establecer la prevalencia exacta de las distintas causas, ya que no todos los pacientes con BQ están incluidos, aunque consideramos que la población analizada era lo suficientemente representativa. Por otro lado, el análisis de los datos fue transversal, por lo que son necesarios estudios longitudinales que puedan confirmar la relación de la etiología con la clínica y la evolución de la enfermedad. Por último, no estaba recogido el grado de disnea, por lo que no pudimos calcular los índices pronósticos FACED15 ni BSI40 que hubieran dado una información más global de la gravedad.
ConclusionesEl presente estudio es el primer análisis del RHEBQ-SEPAR que ha explorado las causas de las BQ en la mayor muestra publicada hasta ahora. La etiología de las BQ se identificó en una gran proporción de los pacientes (75,8%), siendo las causas conocidas más frecuentes la postinfecciosa (30%), seguida de FQ, IDP, EPOC, asma, DC y ETC. Se pueden identificar diferentes fenotipos clínicos en relación con la etiología. Los pacientes con BQ idiopáticas presentaron una menor gravedad, mayor IMC, mejor función pulmonar, menor frecuencia de IBC por PA y un claro predominio de mujeres. Son necesarios estudios longitudinales que puedan confirmar la relación de la etiología con la clínica y la evolución de esta enfermedad.
AutoríaCasilda Olveira, Alicia Padilla y Miguel Ángel Martínez-García han contribuido a la concepción y diseño del estudio, a la adquisición, análisis e interpretación de los datos y a la redacción del artículo, siendo los garantes del manuscrito. El resto de los autores han contribuido a la adquisición de los datos y a su revisión crítica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosLos autores agradecen a Francisco Rivas (Departamento de Investigación, Agencia Sanitaria Costa del Sol, Marbella, Málaga) su contribución en el análisis estadístico de los datos.