El estudio basal del PLATINO, llevado a cabo entre 2003 y 2005 en 5ciudades latinoamericanas (São Paulo, Ciudad de México, Montevideo, Santiago, Caracas), mostró una prevalencia elevada de la enfermedad pulmonar obstructiva crónica (EPOC).
Métodos/diseñoSe llevó a cabo un estudio de seguimiento en 3 de los 5 centros (Montevideo, Santiago y São Paulo) después de un periodo de 5, 6 y 9años, respectivamente, con el objetivo de verificar la estabilidad del diagnóstico de EPOC a lo largo del tiempo, la evolución de la enfermedad en cuanto a supervivencia, morbilidad y función respiratoria, y análisis de los biomarcadores genéticos e inflamatorios en sangre. Se añadieron algunas preguntas adicionales al cuestionario original y se obtuvieron los certificados de defunción a partir de los registros oficiales nacionales.
ResultadosEl trabajo de campo se ha completado en los 3 centros. De las muestras originales de la fasei del PLATINO pudimos localizar y entrevistar al 85,6% en Montevideo, al 84,7% en Santiago y al 77,7% en São Paulo. Los individuos no localizados se caracterizaban por un mayor nivel de estudios en Brasil y era más probable que fueran fumadores actuales en Santiago y São Paulo que en Montevideo. La calidad global de las espirometrías fue ≥80% según los criterios de la American Thoracic Society. El número de muertes fue de 71 (Montevideo), 95 (Santiago) y 135 (São Paulo), y se obtuvieron los certificados de defunción a partir de los registros de mortalidad nacionales del 76,1, del 88,3 y del 91,8% de los casos en Montevideo, Santiago y São Paulo, respectivamente.
ConclusionesEste estudio muestra que es posible realizar estudios longitudinales de base poblacional en Latinoamérica, con tasas de seguimiento elevadas y una alta calidad de los datos de espirometría. La idoneidad de los registros de mortalidad nacionales varía en los distintos centros de Latinoamérica.
The PLATINO baseline study, conducted from 2003-2005 in five Latin American cities (São Paulo, Mexico City, Montevideo, Santiago, Caracas), showed a high prevalence of chronic obstructive pulmonary disease (COPD).
Methods/designA follow-up study was conducted in three out of the five centers (Montevideo, Santiago, and São Paulo) after a period of 5, 6 and 9years, respectively, aimed at verifying the stability of the COPD diagnosis over time, the evolution of the disease in terms of survival, morbidity and respiratory function, and the analyses of inflammatory and genetic biomarkers in the blood. Some questions were added to the original questionnaire and death certificates were obtained from the national official registries.
ResultsThe fieldwork has been concluded in the three centers. From the original samples in the PLATINO study phasei, we were able to locate and interview 85.6% of patients in Montevideo, 84.7% in Santiago and 77.7% in São Paulo. Individuals who could not be located had higher education levels in Brazil, and were more likely to be current smokers in Santiago and São Paulo than in Montevideo. The overall quality of spirometries was ≥80% according to American Thoracic Society criteria. The number of deaths was 71 (Montevideo), 95 (Santiago) and 135 (São Paulo), with death certificates obtained from the national mortality registries for 76.1%, 88.3% and 91.8% of cases in Montevideo, Santiago and São Paulo, respectively.
ConclusionsThis study shows that is possible to perform population-based longitudinal studies in Latin American with high follow-up rates and high-quality spirometry data. The adequacy of national mortality registries varies among centers in Latin America.
Los estudios sobre la prevalencia de la enfermedad pulmonar obstructiva crónica (EPOC) en Latinoamérica son escasos; el proyecto PLATINO fue un estudio multicéntrico llevado a cabo en 5 centros de Latinoamérica que llenó un importante vacío del conocimiento en esta área1.
El objetivo original del estudio PLATINO, puesto en marcha en 2002, fue describir la epidemiología de la EPOC en 5 importantes ciudades de Latinoamérica: São Paulo (Brasil), Santiago (Chile), Ciudad de México (México), Montevideo (Uruguay) y Caracas (Venezuela), en individuos adultos de 40años o más, puesto que las personas de menos de 40años tienen una prevalencia baja de EPOC2. Un objetivo secundario fue evaluar la prevalencia de las comorbilidades médicas indicadas por los propios individuos, que pueden darse con bastante frecuencia en la EPOC, como las enfermedades cardiovasculares y el cáncer de pulmón.
Estos centros son representativos de las diversas áreas geográficas distintas de Latinoamérica y corresponden al área metropolitana más amplia de cada uno de los países participantes. El estudio se llevó a cabo entre 2002 y 2004 a través de una iniciativa de la Asociación Latinoamericana del Tórax (ALAT).
El estudio basal del PLATINO puso de manifiesto una prevalencia elevada de la EPOC en Latinoamérica, aplicando los criterios de cocientes fijados (FEV1/FVC<70% post broncodilatador), y obtuvo unas cifras que no se conocían anteriormente para Latinoamérica3,4.
Algunos de los aspectos más relevantes del estudio basal del PLATINO fueron los siguientes: a)el hecho de que se tratara de un estudio de base poblacional y que la mayoría de los estudios de la EPOC existentes en la literatura se han efectuado en pacientes con EPOC seleccionados; b)el elevado porcentaje de respuesta en todos los centros, y c)la alta calidad de las espirometrías.
Se ha descrito de manera detallada la metodología del estudio en otra publicación5.
Sin embargo, fue un estudio transversal que constó de una visita en un único momento en el tiempo, y esto no nos permite analizar la temporalidad ni algunos parámetros de interés en la EPOC. En consecuencia, después de 5años se decidió que debía llevarse a cabo un seguimiento del estudio en algunos centros que habían participado en el proyecto original.
Se plantearon varias cuestiones relativas a las dificultades de seguimiento de las personas en Latinoamérica, como el elevado nivel de migración y movilidad, la falta de registros oficiales para localizar a los mismos individuos, la posibilidad de muerte en personas de 40años o más tras el estudio inicial, y la idoneidad de la información basada en las estadísticas poblacionales para los certificados de defunción. Otro posible problema importante fue el aumento de la violencia en Latinoamérica, que podría constituir una limitación para visitar los hogares en algunas áreas de las ciudades. Se obtuvo financiación para repetir el estudio en 3 de los 5 centros. Los centros se eligieron en función de las limitaciones antes citadas y del nivel de prevalencia de la EPOC observado en el estudio inicial.
La primera visita de seguimiento tuvo lugar en la ciudad de Montevideo (5años después de la inicial), dado que este centro fue el que presentó la prevalencia de EPOC más alta en el estudio basal del PLATINO (19,7%; IC del 95%: 17,2-22,1), es una ciudad pequeña y tiene un nivel de movilidad de las personas muy bajo. Como segundo centro para el seguimiento se eligió Santiago, ya que esta ciudad ocupó el segundo lugar en el orden de prevalencia de la EPOC (16,9%; IC del 95%: 14,7-19,1), tuvo la prevalencia más alta de tabaquismo en el estudio basal (38,6%) y se considera un lugar seguro en Latinoamérica. Por último, el seguimiento se realizó en un tercer centro (São Paulo), ya que la ciudad ocupó el tercer lugar en cuanto a prevalencia de EPOC (15,8%; IC del 95%: 13,5-18,1)4. El intervalo de tiempo transcurrido entre las 2 visitas fue diferente en cada uno de los centros, con valores de 5, 6 y 9años en Montevideo, Santiago, y São Paulo, respectivamente. La principal razón de las diferencias de tiempo entre las 2 fases del estudio fue la obtención de recursos para financiar el proyecto. Los objetivos generales del estudio de seguimiento fueron: a)evaluar la evolución natural de la EPOC en la misma muestra de individuos del proyecto PLATINO original; b)validar la fiabilidad del diagnóstico inicial de EPOC; c)describir la evolución natural de la EPOC en cuanto a supervivencia, morbilidad, evolución laboral, función respiratoria, síntomas respiratorios, exacerbaciones, estado general de salud, limitación de actividad física, tratamiento, hospitalización, absentismo laboral y nutrición, entre otros factores, y d)obtener muestras de sangre para el análisis de biomarcadores.
En este artículo se describen los siguientes aspectos: a)los métodos utilizados en un estudio longitudinal de base poblacional en Latinoamérica; b)los resultados preliminares, como las tasas de seguimiento, el control de calidad de las espirometrías, la información sobre las muertes ocurridas en el periodo; c)los procedimientos empleados para la obtención y conservación de las muestras de sangre, y d)las principales limitaciones para llevar a cabo este tipo de estudios en Latinoamérica.
MétodosEl diseño de la visita de seguimiento fue transversal y la población diana fue la misma que se había investigado y en la que se había realizado la espirometría; dado que completamos 2 visitas a lo largo del tiempo en la misma población, podemos afirmar que el diseño del estudio global es un diseño de estudio de cohorte.
Se contactó de nuevo con todos los individuos identificados en el censo y los hogares visitados en el estudio basal y se aplicaron los mismos procedimientos que en el estudio basal del PLATINO. Todos los adultos elegibles de la muestra inicial respondieron al cuestionario y se aplicaron los mismos métodos que antes5.
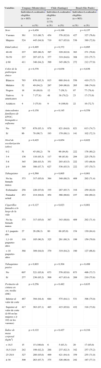
En la tabla 1 se indican las variables previas y las nuevas variables recogidas en las 2 fases del estudio PLATINO. Puede consultarse una información detallada sobre los cuestionarios en la página web del estudio PLATINO1.
Variables obtenidas en cada centro en la situación basal y en el seguimiento. Estudio PLATINO
| Variables | Montevideo (Uruguay) | Santiago (Chile) | São Paulo (Brasil) | |||
| Basal | Seguimiento | Basal | Seguimiento | Basal | Seguimiento | |
| Demográficas y socioeconómicas | X | X | X | X | X | X |
| Síntomas y enfermedades respiratorias | X | X | X | X | X | X |
| Tratamiento de la enfermedad y uso de medicación | X | X | X | X | X | X |
| Tabaquismo | X | X | X | X | X | X |
| Escala de Fagerstrom14 | – | X | – | X | – | X |
| Exposición ocupacional al polvo | X | X | X | X | X | X |
| Comorbilidades (enfermedades cardíacas, hipertensión, diabetes y cáncer de pulmón) | X | X | X | X | X | X |
| Tabaquismo pasivo | X | X | X | X | X | X |
| Calidad de vida (SF-12)13 | X | X | X | X | X | X |
| Impacto económico | X | X | X | X | X | X |
| Actividades en tiempo de ocio | X | X | X | X | X | X |
| Contaminación en el hogar | X | X | X | X | X | X |
| Actividad física33 | – | X | X | – | X | |
| Sueño e insomnio | X | X | X | X | – | X |
| Uso de oxígeno | X | X | X | X | X | X |
| Inventario de Beck (escala de depresión)16 | – | X | – | X | – | X |
| Antropometría | X | X | X | X | X | X |
| Presión arterial | – | – | – | X | – | – |
| Saturación de oxígeno | X | X | X | X | – | – |
| Espirometría | X | X | X | X | X | X |
Las muestras de sangre se extrajeron por primera vez en la segunda fase del estudio PLATINO; en consecuencia, en este caso se trata de datos transversales y no longitudinales. Estos análisis podrán usarse como información basal para futuros seguimientos. Después de contactar con los sujetos elegibles en cada uno de los hogares, los entrevistadores les preguntaron si aceptaban que se les extrajera una muestra de sangre; en los que lo aceptaron, se contactó con el laboratorio clínico, que se encargó de organizar el desplazamiento a cada domicilio y la extracción de las muestras de sangre. Las muestras se obtuvieron en ayunas (8h) y se determinaron biomarcadores genéticos y séricos6–8; el tiempo transcurrido entre la extracción de la sangre y la llegada al laboratorio fue en promedio de 3h (durante este periodo, las muestras se mantuvieron a 4°C). Se siguió el siguiente procedimiento para la extracción del ADN9: se obtuvo una muestra de 5ml de sangre venosa periférica, que se colocó en viales con EDTA y se transfirió a tubos cónicos de 15ml. Se añadió a la sangre venosa una solución de lisis eritrocitaria (9 a 10ml) (NH2Cl 114mM, NH4HCO3 1mM) y se incubó el tubo durante 30min a 4°C. A continuación se centrifugó el material y se recuperó la capa leucocitaria, que se conservó a –80°C. Se obtuvo el suero a partir de 15ml de sangre periférica recogida en viales con un contenido de acelerador de la coagulación y se congeló a –80°C para el análisis de biomarcadores en suero.
Según lo indicado en la literatura, algunos posibles biomarcadores a explorar en el futuro son los siguientes: quimioatrayentes (proteína inducida por interferón gamma10 [IP-10], quimioatrayente alfa de célulasT inducible con interferón [iTAC], eotaxina-2 [Eot2], factor inhibidor de progenitor mieloide-1 [MPIF 1], proteína quimiotáctica monocitaria1 [MCP1], proteína inflamatoria macrofágica 1a y 1b [MIP1a y MIP1b], interleucina-8 [IL-8], quimiocina regulada por timo y activación [TARC]), inflamación (interleucina-15 [IL-15], antagonista de receptor de interleucina-1 [IL-1ra], interleucina-17 [IL-17], factor de necrosis tumoral-alfa/receptor de TNF 1 [TNF-α/TNF R1], interferón gamma [IFNg], interleucina-12, subunidad p40 [IL_12P40], receptor de interleucina2 gamma [IL-2Rg], interleucina-6 [IL-6], interleucina-8 [IL-8]), destrucción y reparación (factor de crecimiento tumoral alfa [TGFa], factor de crecimiento endotelial vascular [VEGF], receptor de andrógenos [AR], factor neurotrófico de origen cerebral [BDNF], factor de crecimiento nervioso beta [bNGF], metaloproteinasa de matriz9 [MMP9], inhibidor de metaloproteinasas tisular [TIMP1]) nuevos marcadores (inhibidor del activador del plasminógeno-2 [PAI-II], hormona prolactina) y marcadores específicos pulmonares (desmosina, proteína surfactante pulmonar D [SPD], proteína secretora de células claras [CC-16] y quimiocina (motivo C-C) ligando-18 [CCL-18])10,11. Las muestras de sangre se mantendrán congeladas a –80°C en cada uno de los centros y se analizarán una vez se haya obtenido financiación para ello.
MortalidadDurante las visitas realizadas en cada hogar del estudio basal del PLATINO, se preguntó por la situación vital de los individuos que formaron la muestra original del estudio. Si alguna persona del hogar informaba al entrevistador de que el individuo o individuos del estudio original había(n) fallecido, se trasladaba la información a un miembro del equipo que se encargaba de obtener más información acerca de la muerte. Esta persona debía contactar con el registro oficial de defunciones del país y evaluar la información a partir de los certificados de defunción oficiales. Esto se hizo en cada uno de los 3 centros.
El protocolo original tuvo como objetivo obtener datos del hospital para los pacientes que fallecían durante la hospitalización; debido a razones logísticas, y también a la insuficiencia de la información del registro hospitalario observada en el primer lugar de estudio (Montevideo), esto no se llevó a cabo en los otros 2 lugares (Santiago y São Paulo).
La información sobre la muerte fue certificada en el registro oficial de mortalidad de cada centro y se verificaron los correspondientes certificados de defunción. En Uruguay, el registro no era electrónico y los certificados tuvieron que localizarse entre otros varios certificados de defunción. En Chile y en Brasil se dispuso de un registro electrónico y fue más fácil localizar los certificados de defunción.
Toda la información de los certificados se copió a una hoja de cálculo Excel, exactamente como estaba redactada en los certificados. Se copió el nombre del individuo, la fecha de nacimiento, la fecha de muerte, la causa básica de la muerte y todas las demás causas contribuyentes.
Después de finalizado el estudio de seguimiento en los 3 centros, designamos a un experto en registros de mortalidad (de Brasil) que revisó todos los certificados de defunción; este experto certificó la causa básica de la muerte basándose en la información de los certificados de defunción y ordenó las causas contribuyentes. La información sobre los certificados de defunción de Uruguay era imprecisa e insuficiente en mayor grado que en las otras dos ciudades; por ejemplo con bastante frecuencia, la causa de la muerte indicada en los certificados era «paro cardiorrespiratorio» o «muerte natural».
Tras una evaluación cuidadosa de los certificados de defunción de los 3 centros, la coordinación del estudio y el experto en registro de mortalidad decidieron que era imposible ordenar las causas de muerte de los datos de Uruguay. La única información obtenida de los certificados de defunción de Uruguay fue la causa básica de la muerte en los certificados que se consideró que contenían la información esencial para certificarla.
Control de calidad de cuestionarios, espirometría y antropometríaEn el estudio de seguimiento se adoptaron los mismos procedimientos de control de calidad descritos en el estudio basal del PLATINO; la información detallada de los procedimientos puede consultarse en otra publicación5.
CuestionarioEl cuestionario fue una combinación que incluía los apartados de los siguientes cuestionarios: ATS/DLD12 y ECRHSII; se añadió también el SF-1213 para evaluar el estado de salud global. Se incorporaron también algunas otras preguntas e instrumentos específicos al cuestionario original, como lo siguiente: preguntas sobre la nueva legislación anti-tabaquismo en todos los lugares y la escala Fagerstrom14; los otros 2instrumentos añadidos al cuestionario original fueron los siguientes: el cuestionario Baecke para medir la actividad física15 y el Beck Inventory Depression para medir la depresión16.
EspirometríaSe utilizó un espirómetro basado en el tiempo de tránsito de ultrasonidos, portátil y con batería (Easy-One de NDD™). El calibrado de los espirómetros se verificó diariamente, con una jeringa de 3l antes del uso de campo. Los espirómetros almacenaban los resultados de 400pruebas en un chip de memoria que se descargaba de forma regular. La evaluación inicial se llevó a cabo inmediatamente después de que un breve cuestionario estableciera si el individuo era apto para esta intervención (antecedentes en los últimos 3meses de cirugía torácica o abdominal, infarto de miocardio, cirugía ocular [o desprendimiento de retina], hospitalización por cualquier problema cardiaco, tratamiento actual para la tuberculosis, embarazo indicado por la propia mujer o frecuencia del pulso superior a 120 o inferior a 60latidos/min) y después de completado el examen antropométrico. A continuación, los participantes realizaron varios intentos hasta alcanzar 3 maniobras de ATS aceptables, con una FVC y FEV1 reproducibles hasta 150ml17. Luego se administró un broncodilatador (salbutamol 200μg) por inhalación, y se repitió la prueba 15min más tarde, con los mismos criterios. Todas las espirometrías se llevaron a cabo con el individuo sentado, con una pinza nasal y con una boquilla desechable18.
Medición de la alturaSe utilizó un estadiómetro portátil Seca® (precisión 0,1cm) para medir la altura. La técnica fue la recomendada por Lohman, Roche y Martorell19. Los participantes no llevaban los zapatos. Se les indicó que se colocaran de pie con los pies en contacto con la parte inferior del estadiómetro y que mantuvieran la cabeza erguida en el plano de Francfort mientras se verificaba la altura.
PesoSe utilizó una báscula electrónica Tanita® (precisión 200g). Se pesó a los participantes sin zapatos y con ropa ligera.
Perímetro de cinturaSe utilizó una cinta inextensible Fiberglass® (precisión 0,1cm). En primer lugar, los entrevistadores identificaron el punto medio entre la última costilla y la cresta ilíaca; a continuación, colocaron la cinta métrica horizontalmente alrededor de la cintura sobre el punto medio; la cinta no debía estar ni demasiado tensa ni demasiado laxa20.
Las determinaciones de altura, peso y perímetro de cintura se realizaron 2 veces en cada individuo y se utilizó el valor medio.
Consideraciones éticasSe obtuvo la aprobación ética por parte del comité ético de cada centro. El formulario de consentimiento aprobado por los comités éticos mencionaba la aplicación de un cuestionario, el uso de un broncodilatador en 2 momentos, la realización de una espirometría y la obtención de una muestra de sangre para un futuro análisis de biomarcadores genéticos e inflamatorios.
Tan solo se consideró elegibles a quienes aceptaron participar en el estudio y firmaron el consentimiento informado. Los individuos que no aceptaron participar en la investigación o que no firmaron el formulario de consentimiento fueron considerados pérdidas del estudio. Los resultados de las espirometrías se enviaron a todos los pacientes, y en los casos en los que había una EPOC o alguna anomalía de la espirometría, se ofreció a los participantes la posibilidad de acudir a una consulta médica en un centro clínico.
Procesamiento de los datosAntes de enviar los cuestionarios originales al centro de coordinación situado en Pelotas, en el sur de Brasil, se fotocopiaron todos los cuestionarios para conservarlos en el centro. En el centro de coordinación, todos los cuestionarios fueron examinados y las respuestas abiertas fueron codificadas con los mismos códigos que en el estudio basal. Los datos se introdujeron en el programa Epidata 3.121 y posteriormente se compararon las 2 entradas realizadas. Toda diferencia detectada entre las 2 series de datos fue verificada en el cuestionario original y se introdujeron las correcciones pertinentes; tras la depuración de los datos, se transfirieron a otro programa (STATA). Los resultados de espirometría fueron depurados y corregidos en Ciudad de México y enviados luego al centro de coordinación y vinculados con la base de datos del cuestionario22.
AnálisisLos análisis se realizarán con el empleo del programa STATA. Ello incluye los siguientes análisis descriptivos de las variables de resultados obtenidas en las 2 visitas del PLATINO. Se compararán, además, las muestras por lo que respecta a las variables demográficas, socioeconómicas, conductuales y nutricionales. El segundo conjunto de análisis incluirá el cálculo de la prevalencia de la EPOC en el seguimiento del PLATINO según la presencia de EPOC en el estudio basal del PLATINO, y según los diversos criterios de EPOC. En tercer lugar, analizaremos la mortalidad con modelos de Cox, ya que el tiempo hasta la muerte difiere en los 3 países. Todos los análisis tendrán en cuenta el procedimiento de muestreo agrupado23 e introducirán un ajuste respecto a la diferencia de tiempo según cada centro.
ResultadosEl trabajo de campo se llevó a cabo secuencialmente y, por tanto, tuvimos intervalos de tiempo entre las 2 visitas que fueron diferentes para cada centro. En la tabla 2 se indica la media de tiempo de seguimiento para cada centro; el de São Paulo fue el más prolongado. El número de muertes, rechazos y pérdidas fue mayor en São Paulo que en los otros 2 centros; no obstante, la tasa de respuesta global para las espirometrías fue casi la misma en los 3 centros, alcanzando un 95%. La tasa de respuesta global para la obtención de muestras de sangre fue del 75,3% en Montevideo, del 82,7% en Santiago y del 60% en São Paulo (tabla 2).
Muestras basales y de seguimiento según el centro. Estudio PLATINO
| Montevideo (Uruguay), n | Santiago (Chile), n | São Paulo (Brasil), n | |
| Tiempo hasta el seguimiento en años, media (DE) | 4,9 (0,1) | 6,5 (0,2) | 8,8 (0,1) |
| Tamaño muestral original en la situación basal | 943 | 1.208 | 1.000 |
| Espirometrías realizadas en la situación basal (pacientes elegibles para el seguimiento) | 885 | 1.173 | 963 |
| Individuos localizados | 872 | 1.118 | 943 |
| Muertes | 71 | 95 | 135 |
| Rechazos | 76 | 63 | 141 |
| Pérdidas | 35 | 62 | 54 |
| Individuos entrevistados | 687 | 898 | 613 |
| Espirometrías realizadas en el seguimiento | 683 | 858 | 596 |
| Tasas globales de respuesta a las entrevistas (%) | 85,6 | 84,7 | 77,7 |
| Tasas globales de respuesta incluidas las espirometrías (%) | 99,4 | 95,5 | 97,2 |
| Tasas globales de respuesta incluyendo las muestras de sangre (%) | 75,3 | 84,5 | 60,0 |
Las tasas de seguimiento según las características basales clave por países se indican en la tabla 3. En el periodo de 5-9años el porcentaje de seguimiento no varió en función del sexo, la edad, el color de la piel, los antecedentes familiares de bronquitis crónica, enfisema o EPOC, el tabaquismo pasivo, el perímetro de cintura o el índice de masa corporal (IMC). Los participantes con niveles de estudios inferiores tenían una mayor probabilidad de ser localizados en la ciudad de São Paulo, aunque no hubo diferencias en comparación con los otros lugares. Según la presencia de tabaquismo, hubo un porcentaje superior de seguimiento en los no fumadores en comparación con los fumadores (88,5% frente a 80,6%) en Santiago, y un porcentaje superior de individuos localizados en los exfumadores (82,0%) en São Paulo.
Tasas de seguimiento según las características basales clave por países. Estudio PLATINO
| Variables | Uruguay (Montevideo) | Chile (Santiago) | Brasil (São Paulo) | |||
| Individuos elegibles (n=885) | Localizados* | Individuos elegibles (n=1173) | Localizados* | Individuos elegibles (n=963) | Localizados* | |
| n | n (%) | n (%) | n (%) | n (%) | n (%) | |
| Sexo | p=0,458 | p=0,166 | p=0,157 | |||
| Varones | 361 | 313 (86,7) | 454 | 376 (82,8) | 427 | 327 (76,6) |
| Mujeres | 524 | 445 (84,9) | 719 | 617 (85,8) | 536 | 389 (72,6) |
| Edad (años) | p=0,495 | p=0,372 | p=0,095 | |||
| 40-49 | 237 | 205 (86,5) | 397 | 329 (82,9) | 383 | 271 (70,8) |
| 50-59 | 237 | 207 (87,3) | 377 | 319 (84,6) | 308 | 233 (75,7) |
| ≥60 | 411 | 346 (84,2) | 399 | 345 (86,5) | 272 | 212 (77,9) |
| Color de la piel/origen étnico | p=0,378 | p=0,038 | p=0,836 | |||
| Blancos | 793 | 676 (85,3) | 815 | 688 (84,4) | 556 | 410 (73,7) |
| Mulatos | 52 | 49 (94,2) | 287 | 249 (86,8) | 265 | 196 (74,0) |
| Negros | 18 | 16 (88,9) | 12 | 7 (58,3) | 97 | 77 (79,4) |
| Nativos americanos | 9 | 7 (77,8) | 48 | 38 (79,2) | 23 | 17 (73,9) |
| Asiáticos | 4 | 3 (75,0) | 9 | 9 (100,0) | 22 | 16 (72,7) |
| Antecedentes familiares de EPOC, bronquitis o enfisema | p=0,158 | p=0,145 | p=0,559 | |||
| No | 797 | 678 (85,1) | 978 | 821 (84,0) | 821 | 613 (74,7) |
| Sí | 86 | 78 (90,7) | 193 | 170 (88,1) | 141 | 102 (72,3) |
| Nivel de escolarización (años) | p=0,425 | p=0,854 | p=0,022 | |||
| 0-2 | 51 | 45 (88,2) | 78 | 66 (84,6) | 222 | 178 (80,2) |
| 3-4 | 136 | 116 (85,3) | 117 | 98 (83,8) | 294 | 225 (76,5) |
| 5-8 | 345 | 288 (83,5) | 351 | 293 (83,5) | 222 | 153 (68,9) |
| ≥9 | 349 | 306 (87,7) | 627 | 536 (85,5) | 222 | 157 (70,7) |
| Tabaquismo | p=0,560 | p=0,005 | p=0,001 | |||
| No ha fumado nunca | 373 | 317 (85,0) | 384 | 340 (88,5) | 409 | 292 (71,4) |
| Exfumador | 258 | 226 (87,6) | 335 | 287 (85,7) | 316 | 259 (82,0) |
| Fumador actual | 253 | 214 (84,6) | 454 | 366 (80,6) | 237 | 164 (69,2) |
| Cigarrillos fumados a lo largo de la vida | p=0,127 | p=0,023 | p<0,001 | |||
| No ha fumado nunca | 373 | 317 (85,0) | 387 | 343 (88,6) | 409 | 292 (71,4) |
| ≤ 1 paquete-año | 27 | 26 (96,3) | 80 | 68 (85,0) | 154 | 130 (84,4) |
| 1,1-10 paquetes-años | 116 | 105 (90,5) | 325 | 261 (80,3) | 199 | 159 (79,9) |
| > 10 paquetes-años | 368 | 309 (84,0) | 379 | 319 (84,2) | 190 | 127 (66,8) |
| Tabaquismo pasivo | p=0,803 | p=0,304 | p=0,499 | |||
| No | 607 | 521 (85,8) | 673 | 576 (85,6) | 673 | 496 (73,7) |
| Sí | 277 | 236 (85,2) | 500 | 417 (83,4) | 289 | 219 (75,8) |
| Perímetro de cintura en cm; media (DE) | p=0,256 | p=0,482 | p=0,635 | |||
| Inferior al valor de corte | 467 | 394 (84,4) | 684 | 575 (84,1) | 531 | 398 (75,0) |
| Superior al valor de corte (≥88 en las mujeres o ≥102 en los varones) | 417 | 363 (87,1) | 485 | 415 (85,6) | 432 | 318 (73,6) |
| Índice de masa corporal (kg/m2) | p=0,122 | p=0,427 | p=0,216 | |||
| <18,5 | 15 | 15 (100,0) | 6 | 5 (83,3) | 20 | 17 (85,0) |
| 18,5-24,9 | 242 | 199 (82,2) | 288 | 237 (82,3) | 342 | 257 (75,2) |
| 25-29,9 | 327 | 280 (85,6) | 499 | 421 (84,4) | 359 | 255 (71,0) |
| ≥30 | 300 | 263 (87,7) | 375 | 326 (86,9) | 242 | 187 (77,3) |
El número máximo de datos no disponibles fue de 9 para el color de la piel en Uruguay, 5 para el IMC en Chile y 11 para los paquetes-años en Brasil.
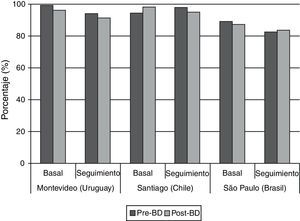
Por lo que respecta a la calidad global de los espirómetros en las 2 fases del estudio, el 80% o más de las pruebas alcanzaron los criterios de la American Thoracic Society (ATS) en todos los centros (fig. 1); puede observarse también que las espirometrías basales tuvieron una calidad superior a las de seguimiento (fig. 1).
Se obtuvieron los certificados de defunción del registro de mortalidad nacional de cada país, y con ello se localizaron el 76,1% de los certificados de defunción en Montevideo, el 88,3% en Santiago y el 84,5% en São Paulo.
DiscusiónQue nosotros sepamos, el estudio PLATINO es la primera investigación longitudinal de base poblacional que aborda la EPOC en Latinoamérica y será clave para aportar una información importante sobre la evolución natural de la enfermedad. Dado que su muestra es representativa de la población adulta de más de 40años de áreas urbanas de Latinoamérica, puede contribuir también a la evaluación de otros resultados, como la mortalidad global, el impacto de las políticas de salud púbica (en especial en cuanto al tabaquismo), las comorbilidades (cardiopatía, hipertensión, diabetes y cáncer de pulmón) así como el tratamiento de los pacientes con EPOC.
En la literatura hay varios estudios amplios importantes sobre la evolución natural de la EPOC y las tasas de mortalidad asociadas a ella. Sin embargo, la mayor parte de estas investigaciones no corresponden a estudios de base poblacional24–26. En España hay 2 estudios de base poblacional transversales (IBERPOC y EPI-SCAN) que han tenido como objetivo comparar las tendencias en la prevalencia de la EPOC27. Los autores observaron una disminución del 50,4% en la prevalencia de EPOC en un periodo de 10años. Los resultados de estos 2 estudios son muy relevantes, pero no pueden analizarse como un diseño de cohorte, puesto que se realizaron en 2 poblaciones diferentes.
El hecho de que nosotros pudiéramos trabajar con los mismos investigadores principales en los 3 centros y con algunos de los técnicos del estudio basal aseguró la calidad de los datos. Sin embargo, el estudio tiene algunas limitaciones que es preciso mencionar, como el elevado coste de los estudios de seguimiento, los problemas que comporta la obtención de muestras de sangre en el domicilio y la disponibilidad de estadísticas vitales suficientes en algunos países de Latinoamérica. Esos puntos se abordan a continuación.
Dado que la financiación se obtuvo de manera gradual, cada uno de los centros tuvo periodos de seguimiento diferentes. Así pues, todos los análisis futuros deberán tener en cuenta estos intervalos y los datos censurados se utilizarán para el análisis de la mortalidad28. Estas estrategias deberían reducir al mínimo el posible sesgo causado por el uso de visitas de seguimiento con intervalos diferentes.
Las muestras de sangre extraídas domiciliariamente requieren una gran cantidad de trabajo y tienen un coste elevado. Por razones de seguridad, se tomó la decisión de trabajar con técnicos de laboratorios clínicos bien conocidos en cada centro. Dada la necesidad de estar en ayunas y los retrasos en la llegada del personal de laboratorio a los hogares, en ocasiones los individuos que habían aceptado la extracción de una muestra de sangre finalmente la rechazaron. Aunque se proporcionó una información detallada sobre la dirección de los domicilios, no siempre fue fácil localizar el hogar correcto. Además, dadas las restricciones de tiempo establecidas entre la obtención y el procesamiento en el laboratorio (media de 3h en todos los centros), se programó el análisis de muestras de pocos individuos cada día. La queja principal de los participantes (sobre todo los ancianos) fue la relativa al periodo durante el que debían estar en ayunas. A pesar de estas dificultades, la tasa global de obtención de muestras de sangre fue razonablemente alta (alrededor del 70%). Se siguió estrictamente el mismo protocolo de obtención y procesamiento de las muestras en todos los centros29,30.
Este estudio tiene otras limitaciones que deben señalarse. Una de ellas es la evaluación de tendencias o la disminución de la función pulmonar. Disponemos de 2 estudios transversales realizados a lo largo del tiempo en la misma población; en consecuencia, el diseño es el de un estudio de cohorte. Sin embargo, para algunos de los parámetros de valoración, como la evolución natural de la enfermedad o la reducción de la función pulmonar a lo largo del tiempo, 2 puntos no son suficientes para evaluar tendencias temporales. Sí pueden establecer, en cambio, un patrón de los parámetros de resultados evaluados en el estudio. Nuestra intención es realizar un tercer seguimiento del estudio PLATINO en el futuro.
Otro punto que puede considerarse una limitación del estudio es la dosis del broncodilatador (200μg) que se administró a los participantes antes de la segunda espirometría; aunque las nuevas guías GOLD proponen una dosis de 400μg, pensamos que sería mejor para la comparación con el estudio basal del PLATINO utilizar la misma dosis de broncodilatador; de lo contrario, cualquier resultado futuro podría ser atribuible al aumento de dosis del broncodilatador.
Los datos de mortalidad fueron la limitación más importante del presente estudio. Esta información se extrajo de los certificados de defunción oficiales, y ello planteó algunos problemas. No fue posible encontrar los certificados para una parte de los individuos que, según las familias, habían fallecido (23,9% en Uruguay, 11,7% en Chile y 8,2% en Brasil). Además, un número considerable de los certificados de defunción no habían sido completados adecuadamente por los médicos, principalmente en Uruguay. Con objeto de mejorar la calidad de los datos de mortalidad, se tomó la decisión de que un experto en mortalidad recodificara los certificados de defunción y certificara la causa básica de la muerte31,32. Ese experto no conocía si los individuos fallecidos habían sido diagnosticados o no de EPOC. La calidad de la información de los certificados de defunción de Santiago y de São Paulo fue considerada claramente suficiente por el experto.
A pesar de estas limitaciones, alentamos a los investigadores de Latinoamérica a realizar estudios similares. Nuestro deber es mostrar a las autoridades sanitarias que las estadísticas vitales deben mejorarse en Latinoamérica para permitir la comparación con los datos de otras regiones. Además, la creación de laboratorios centrales, como los biobancos, optimizaría la dedicación de tiempo, los costes y la seguridad en la conservación del material biológico. Las encuestas de este tipo refuerzan la creación de capacidades en Latinoamérica y articulan los esfuerzos por alcanzar niveles superiores de conocimiento científico.
AutoríaA. M. B. Menezes fue la coordinadora general del estudio PLATINO, redactó la versión preliminar del artículo y revisó la versión final. M. M. de Oca revisó también el manuscrito. A. Muiño, M. V. Lopez-Varela, G. Valdivia, C. Lisboa y J. R. Jardim fueron los coordinadores locales del estudio PLATINO. R. Perez-Padilla se encargó del control de calidad de las espirometrías. F. C. Wehrmeister realizó el análisis estadístico. Todos los autores leyeron y aprobaron el manuscrito final.
FinanciaciónEl estudio fue financiado por la Asociación Latinoamericana de Tórax (ALAT), Boehringer Ingelheim Pharma GmbH & Co. KG, GlaxoSmithKline y Novartis.
Conflicto de interesesLos autores no declaran ningún conflicto de intereses respecto a este artículo.
Agradecemos a la Asociación Latinoamericana del Tórax (ALAT) su apoyo al estudio PLATINO y a Boehringer Ingelheim GmbH, Glaxo Smith Kline y Novartis la financiación del estudio.
Maria Márquez, Maria Blanco, Fernanda Rosa, Aquiles Camelier, Francisco Franco, Dolores Moreno y Julio Pertuzé.