Los resultados que respaldan el uso y la efectividad de los dispositivos de presión espiratoria positiva en pacientes con enfermedad pulmonar obstructiva (EPOC) continúan siendo objeto de controversia. Hemos evaluado la hipótesis de que la adición de la TPEP o la IPPB a un tratamiento farmacológico estándar pueda aportar un beneficio clínico adicional respecto al tratamiento farmacológico solo en los pacientes con EPOC grave.
MétodosUn total de 45 pacientes fueron asignados aleatoriamente a los 3 grupos siguientes: un grupo fue tratado con IPPB, otro fue tratado con TPEP y un tercer grupo recibió únicamente tratamiento farmacológico (grupo de control).
Las variables de valoración principales fueron la puntuación de la escala o cuestionario relativo a la disnea (escala del MRC); la de disnea, tos y esputo (BCSS); y la de calidad de vida (test de evaluación de la EPOC) (CAT). Las variables de valoración secundarias fueron las pruebas de la función respiratoria, la gasometría arterial y los análisis hematológicos.
ResultadosTanto los pacientes del grupo de IPPB como los del grupo de TPEP mostraron una mejoría significativa en 2 de las 3 evaluaciones (MRC y CAT) en comparación con el grupo de control. Sin embargo, en el análisis de comparación de los grupos para las mismas variables en el grupo de IPPB frente al grupo de TPEP observamos una mejoría significativa en el grupo de IPPB (p≤0,05 para la escala del MRC y p≤0,01 para el CAT).
La diferencia de efecto de las 2 técnicas se pone de manifiesto en los resultados de las pruebas de la función pulmonar: la IPPB aumenta los valores de FVC, FEV1 y MIP; esto refleja su capacidad de aumentar el volumen pulmonar. Por su parte, la TPEP aumenta la FVC y el FEV1 (en menor medida que la IPPB), pero eleva la MEP, mientras que reduce la capacidad pulmonar total y el volumen residual.
ConclusionesLas 2 técnicas (IPPB y TPEP) mejoran significativamente la disnea, los instrumentos de valoración de la calidad de vida y la función pulmonar en los pacientes con una EPOC grave. La IPPB mostró una mayor efectividad en la mejora de los instrumentos de evaluación de la disnea y la calidad de vida (MRC y CAT) en comparación con la TPEP.
Results supporting the use and the effectiveness of positive expiratory, pressure devices in chronic obstructive pulmonary disease (COPD) patients are still controversial, We have tested the hypothesis that adding TPEP or IPPB to standard pharmacological therapy may provide additional clinical benefit over, pharmacological therapy only in patients with severe COPD.
MethodsFourty-five patients were randomized in three groups: a group was treated; with IPPB,a group was treated with TPEP and a group with pharmacological; therapy alone (control group).
Primary outcome measures included the measurement of scale or, questionnaire concerning dyspnea (MRC scale),dyspnea,cough, and, sputum (BCSS) and quality of life (COPD assessment test) (CAT). Secondary, outcome measures were respiratory function testing,arterial blood gas,analysis,and hematological examinations.
ResultsBoth patients in the IPPB group and in the TPEP group showed a significant, improvement in two of three tests (MRC,CAT) compared to the control, group.However,in the group comparison analysis for, the same variables between IPPB group and TPEP group we observed a, significant improvement in the IPPB group (P≤.05 for MRC and P≤.01 for, CAT).
The difference of action of the two techniques are evident in the results of, pulmonary function testing: IPPB increases FVC, FEV1, and MIP; this reflects, its capacity to increase lung volume. Also TPEP increases FVC and FEV1 (less, than IPPB), but increases MEP, while decreasing total lung capacity and, residual volume.
ConclusionsThe two techniques (IPPB and TPEP) improves significantly dyspnea; quality of; life tools and lung function in patients with severe COPD. IPPB demonstrated a greater effectiveness to improve dyspnea and quality of life tools (MRC, CAT) than TPEP.
Los métodos de fisioterapia respiratoria con el empleo de técnicas de respiración asistidas manualmente se consideran el patrón de referencia para los pacientes con enfermedades pulmonares obstructivas crónicas que tienen un reflejo tusígeno normal1. Además, la presión espiratoria positiva aplicada con dispositivos de manejo manual se considera una técnica válida para abordar la secreción de las vías aéreas y potenciar la expectoración2. Se han utilizado varios dispositivos para producir una presión espiratoria positiva, como la mascarilla de presión espiratoria positiva (PEP)3 o la botella de PEP4 y el sistema de tratamiento con presión espiratoria positiva vibratoria5,6. Sin embargo, los resultados que respaldan el uso y la efectividad de estos instrumentos se fundamentan en una evidencia clínica escasa. Recientemente, se ha introducido una nueva modalidad de aplicación de un nivel bajo de presión espiratoria positiva durante la respiración espontánea que se denomina presión espiratoria positiva temporal7. La respiración con presión positiva intermitente (IPPB) se utiliza en la práctica clínica principalmente para mejorar el volumen pulmonar y para reducir el trabajo de la respiración8. Hemos evaluado la hipótesis de que la adición de la presión espiratoria positiva temporal (TPEP) o IPPB al tratamiento farmacológico estándar pueda aportar un beneficio clínico adicional en los pacientes con una enfermedad pulmonar obstructiva crónica (EPOC) grave o muy grave (evaluación combinada de los grupos C y D)9.
MétodosSeleccionamos prospectivamente un total de 53 pacientes de edades comprendidas entre 40 y 80 años con EPOC grave o muy grave (FEV1<50%) (evaluación combinada de los grupos C y D) ingresados en el Hospital de día de la Unidad de Medicina Respiratoria del Hospital de Sestri Levante entre junio de 2012 y noviembre de 2012. Todos los pacientes se encontraban en un estado clínico estable (sin ninguna exacerbación aguda durante al menos 2 semanas en el momento de la inclusión en el estudio, incluida la ausencia de cambios en la medicación). El diagnóstico y gravedad de la EPOC se confirmaron con el empleo de las guías GOLD9. Se realizaron pruebas de la función pulmonar mediante una pletismografía corporal computarizada (VMAX 20 PFT Sensor Medics, Yorba Linda, CA, EE. UU.), aplicando normas internacionales10. Se analizaron los siguientes parámetros: capacidad vital forzada (FVC), volumen espiratorio forzado en el primer segundo (FEV1), volumen de espiración forzada en un segundo/capacidad vital (FEV1/FVC%), capacidad pulmonar total (TLC), volumen residual (RV) y difusión pulmonar de monóxido de carbono (DLCO). La fuerza de la musculatura inspiratoria se evalúo mediante la determinación de la presión bucal inspiratoria máxima (MIP) en el RV. La fuerza de la musculatura inspiratoria se midió también con la presión bucal espiratoria máxima (MEP) en la TLC. Se utilizó el mejor de los valores obtenidos en un mínimo de 3 intentos. Todas las determinaciones se realizaron en posición erguida7. Se excluyó a los pacientes con antecedentes de asma, arritmias cardiacas graves, cáncer o traqueostomía y a los que se consideró que no podían realizar maniobras de espiración forzada o utilizar un dispositivo de TPEP o respiración con IPPB. Tan solo se incluyó a los pacientes que dieron su consentimiento informado. Se consideró que los pacientes habían abandonado el estudio cuando se produjeron signos de una nueva exacerbación.
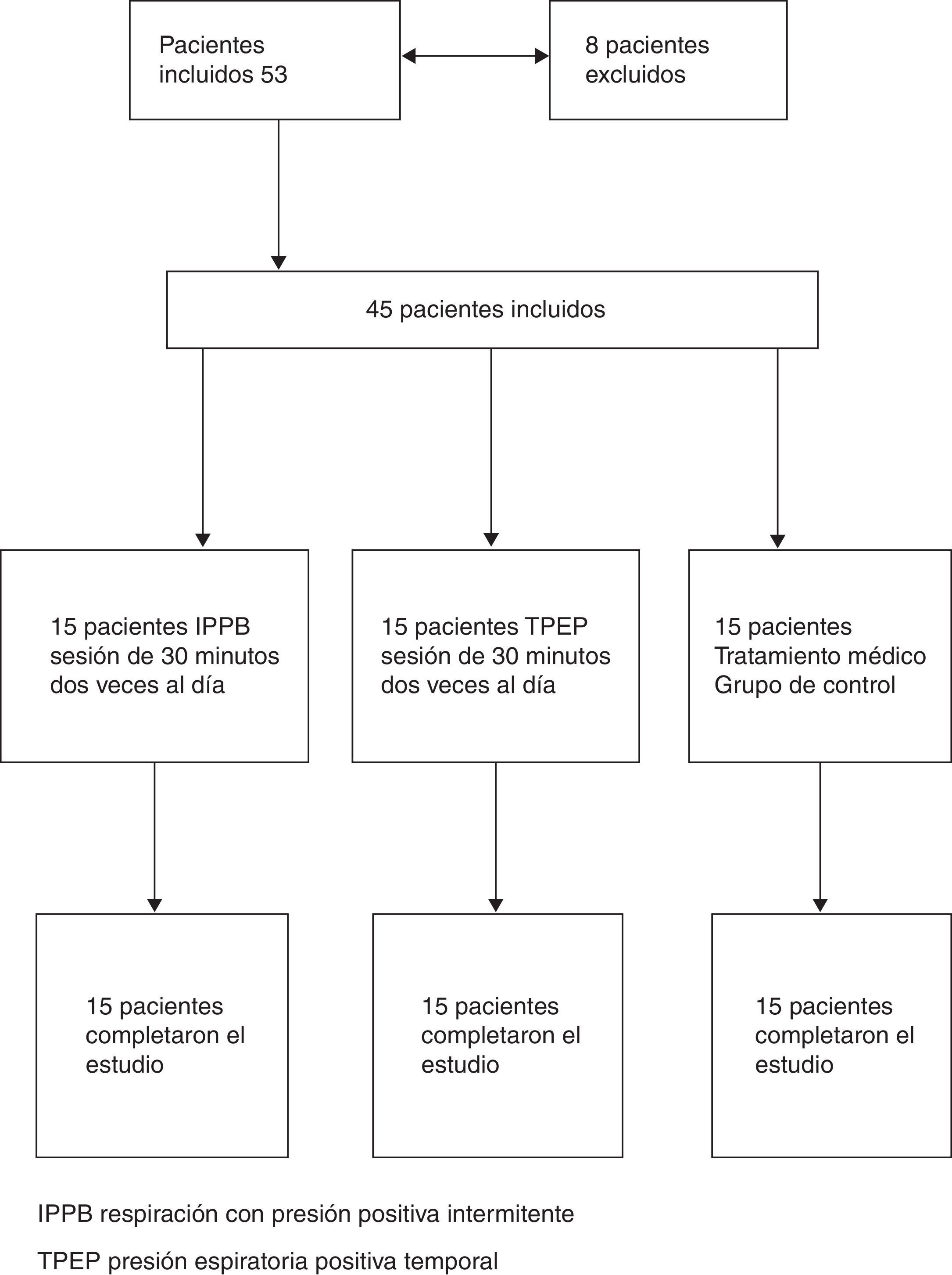
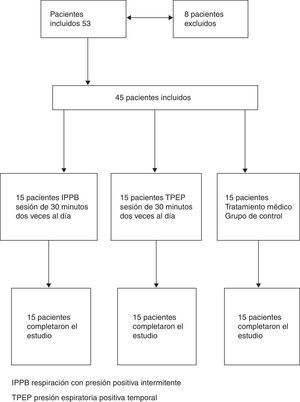
ProtocoloEl estudio fue un ensayo ciego simple y aleatorizado. El plan de asignación aleatoria fue generado por un estadístico que no participó en el estudio, mediante el empleo de un generador de permutaciones aleatorias online, disponible en: http://www.randomization.com. Se proporcionó la asignación aleatoria a los médicos que seleccionaban a los pacientes, mediante el empleo de sobres sellados. Los pacientes y los investigadores que llevaron a cabo el análisis de los datos del estudio no conocían las asignaciones de tratamiento de los pacientes. Un total de 45 de los 53 pacientes incluidos fueron considerados aptos para el estudio (8 fueron excluidos: 7 a causa de la incapacidad de realizar una maniobra de espiración forzada y uno por antecedentes de asma bronquial coexistente). Todos los pacientes estaban recibiendo tratamiento inhalatorio con un agonista β2 más corticosteroide (28 con salmeterol más fluticasona, 17 con formoterol más budesonida) y bromuro de tiotropio. Cinco pacientes tenían una insuficiencia respiratoria crónica tratada con oxigenoterapia. Los pacientes incluidos en la asignación aleatoria se dividieron en 3 grupos (15 pacientes en cada grupo): un grupo fue tratado con IPPB, otro grupo fue tratado con TPEP y un tercer grupo recibió tan solo el tratamiento farmacológico (grupo de control) (fig. 1 [diagrama de flujo]).
Tras la asignación aleatoria un fisioterapeuta enseñó a todos los pacientes elegibles para el estudio el uso de la presión espiratoria positiva temporal (TPEP) o la respiración con presión positiva intermitente (IPPB) como aclimatación en una sesión de formación de 2h en el laboratorio pulmonar, antes de la inclusión definitiva en el protocolo del estudio. El dispositivo de TPEP (UNIKO Medical Products Research, Legnano, Italia) aplicaba una presión positiva fija (1cm H2O, es decir, 0,0977 KPa) tan solo en la fase espiratoria. Este aumento de la presión baja se creó mediante un flujo pulsátil de una frecuencia de aproximadamente 42Hz7. El tratamiento de TPEP se aplicó con una boquilla específica para ello.
El dispositivo de IPPB (ALFA 200C, Air Liquide) aplicaba una presión inspiratoria que aumentaba gradualmente hasta el valor máximo tolerado (hasta 40cm H2O). La frecuencia respiratoria, el flujo inspiratorio (de 20 a 60l/min) y el desencadenante teleinspiratorio se establecieron de manera que optimizaran la comodidad del paciente. El tratamiento de IPPB se aplicó con una boquilla específica para ello. Ambos tratamientos se aplicaron en sesiones de 30min de duración 2 veces al día (por la mañana y a última hora de la tarde). La duración de cada tratamiento fue de 15días y el tratamiento se aplicó 5días por semana. El estudio se llevó a cabo cumpliendo las normas de la declaración de Helsinki y fue aprobado por el Comité de Ética de ASL 4 Chiavarese, Chiavari, Italia; todos los pacientes dieron su consentimiento informado por escrito antes del inicio del estudio. El estudio se registró como Chi CTR-TRC-12002178 en la siguiente dirección electrónica: www.chictr.org.
Evaluaciones y parámetros de valoraciónEn el momento de la inclusión se registraron las características antropométricas y fisiológicas de los pacientes. Las variables de valoración principales fueron las escalas de disnea, tos y esputo, así como las evaluaciones de las actividades de la vida diaria. Las variables de valoración secundarias fueron las pruebas de la función respiratoria (FVC, FEV1, FEV1/FVC%, TLC, RV, DLCO, MIP, MEP), la gasometría arterial (paO2, paCO2, pH), y los análisis hematológicos (recuento leucocitario y eritrocitario, proteína C reactiva, γ-globulinas). La disnea, tos y esputo y las actividades de la vida diaria se midieron con la escala de disnea, tos y esputo (Breathlessness, Cough, and Sputum Scale [BCSS])11, el test de evaluación de la EPOC (COPD Assessment Test [CAT])12,13 y la escala de disnea del Medical Research Council (MRC). Los volúmenes estáticos y dinámicos se expresaron como porcentaje de los valores esperados. La presión máxima inspiratoria y espiratoria (MIP/MEP) se expresaron en valores absolutos (kPa). Se registraron diariamente los resultados de BCSS y CAT con objeto de evaluar las variaciones diarias de la disnea y la sensación percibida de impedimento bronquial y de registrar otros parámetros de valoración del estudio.
Análisis estadísticoLos datos clínicos se expresaron en forma de recuento, porcentaje (%) y media (±desviación estándar [DE]). Inicialmente calculamos la diferencia entre cada grupo de tratamiento y el grupo de control. La evaluación de la diferencia entre los 2 tratamientos (IPPB y TPEP) y el grupo de control se realizó con el empleo de un análisis univariado (covarianza). Luego, se analizó la diferencia entre los 2 tratamientos (IPPB y TPEP) con un análisis de covarianza; se consideró estadísticamente significativo un valor de p≤0,05. El análisis de los datos se realizó con el programa R-Project versión 2.13.2.
ResultadosParticipantesLos 45 pacientes incluidos completaron el estudio. Veintiséis de ellos eran varones (9 en el grupo de TPEP, 9 en el grupo de IPPB y 8 en el grupo de control) y 19 mujeres (6 en el grupo de TPEP, 6 en el grupo de IPPB y 7 en el grupo de control). La media de edad fue de 73±6 en el grupo de TPEP, 70±9 en el grupo de IPPB y 70±6 en el grupo de control.
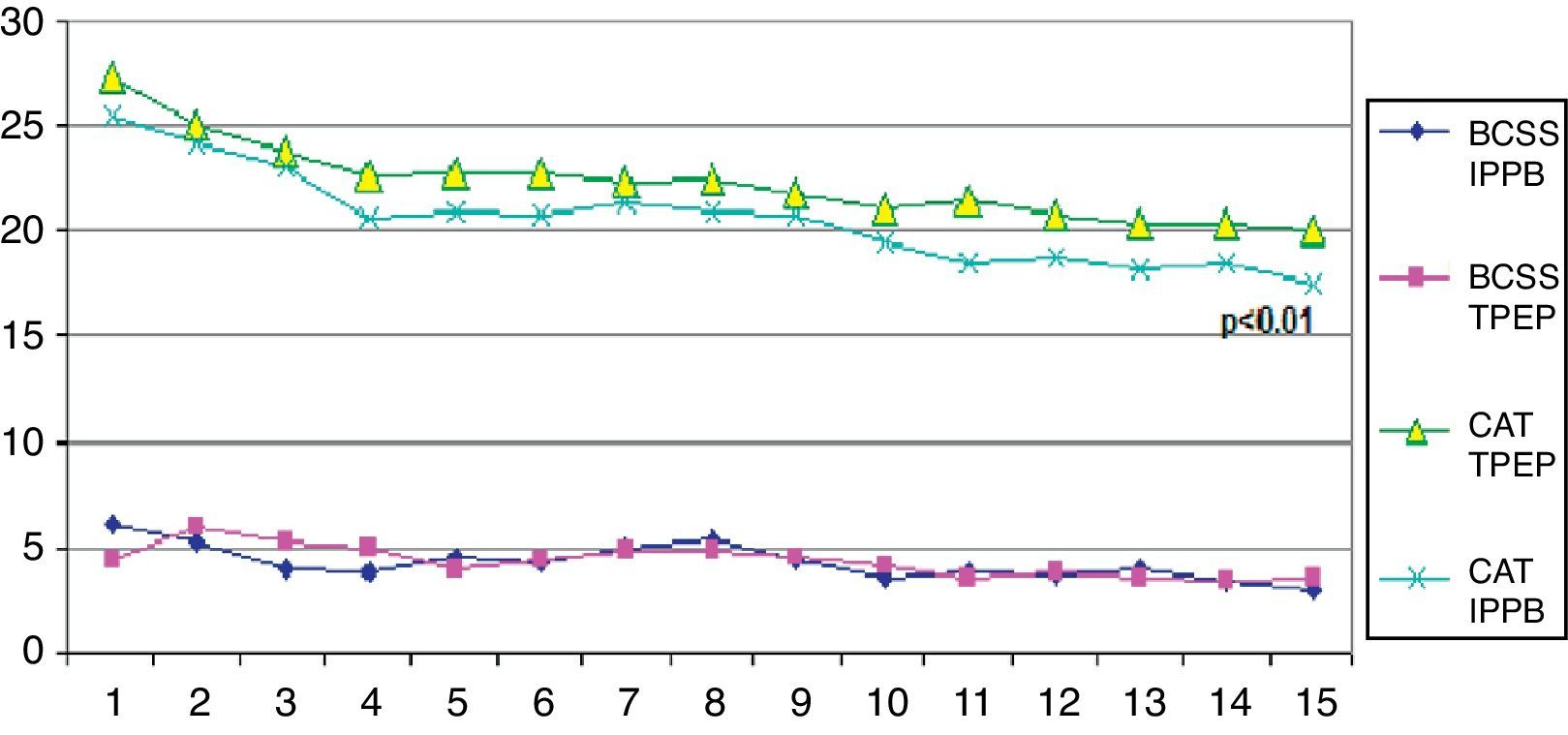
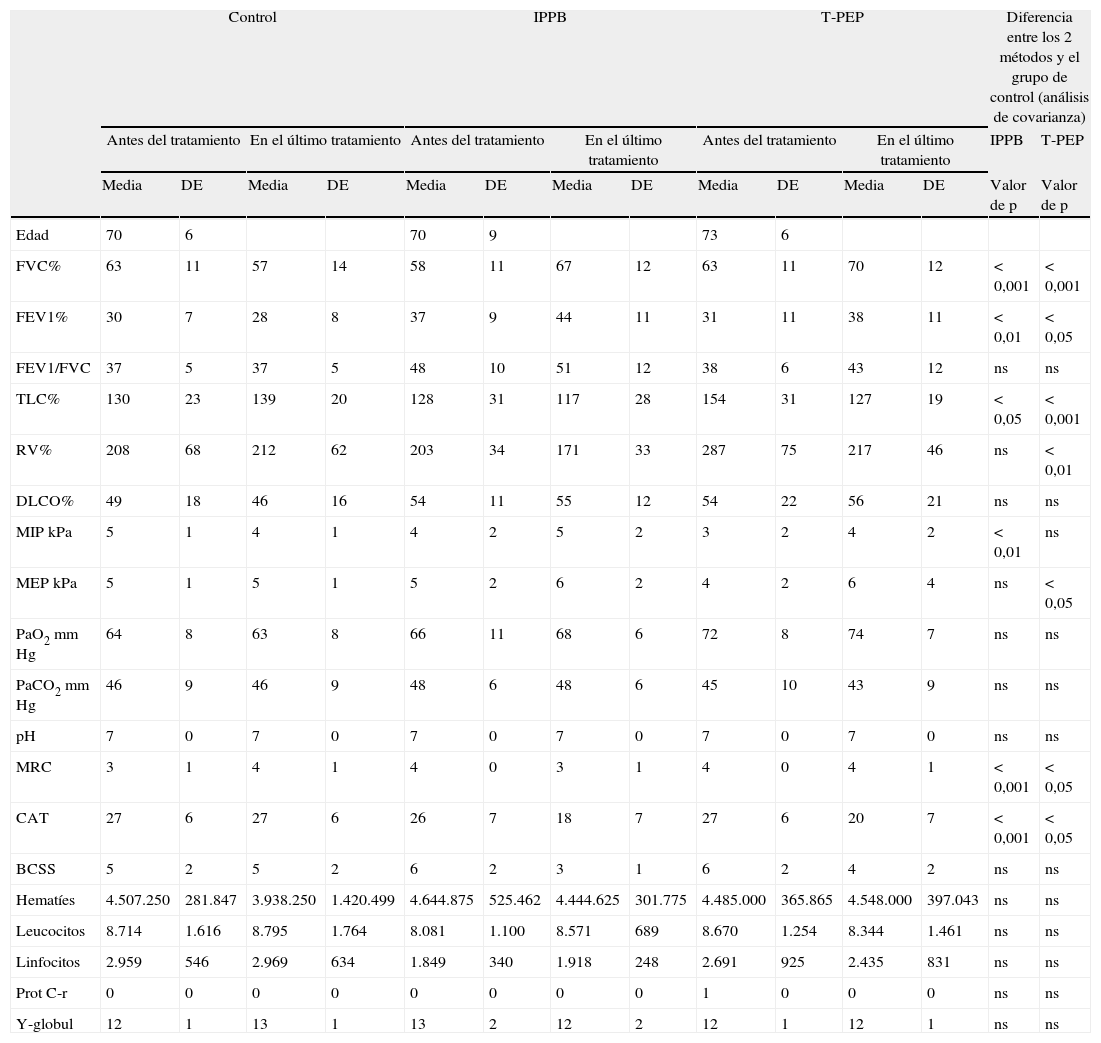
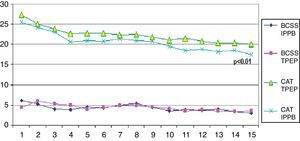
Variables de valoración principalesTanto los pacientes del grupo de IPPB como los del grupo de TPEP presentaron una mejoría significativa en la evaluación de la disnea (MRC) o la calidad de vida (CAT) en comparación con grupo de control (tabla 1). Sin embargo, en el análisis de comparación de los grupos para las mismas variables, en el grupo de IPPB frente al grupo de TPEP observamos una mejoría significativa en el grupo de IPPB (p≤0,05 para la escala del MRC y p≤0,01 para el CAT) (tabla 2). En la figura 2 se muestra la tendencia diaria de los resultados de CAT y BCSS durante el periodo de estudio.
Cambios de los volúmenes pulmonares, intercambio de gases, escalas de disnea y calidad de vida y fuerza muscular y parámetros bioquímicos antes y después del tratamiento en los 3 grupos
| Control | IPPB | T-PEP | Diferencia entre los 2 métodos y el grupo de control (análisis de covarianza) | |||||||||||
| Antes del tratamiento | En el último tratamiento | Antes del tratamiento | En el último tratamiento | Antes del tratamiento | En el último tratamiento | IPPB | T-PEP | |||||||
| Media | DE | Media | DE | Media | DE | Media | DE | Media | DE | Media | DE | Valor de p | Valor de p | |
| Edad | 70 | 6 | 70 | 9 | 73 | 6 | ||||||||
| FVC% | 63 | 11 | 57 | 14 | 58 | 11 | 67 | 12 | 63 | 11 | 70 | 12 | <0,001 | <0,001 |
| FEV1% | 30 | 7 | 28 | 8 | 37 | 9 | 44 | 11 | 31 | 11 | 38 | 11 | <0,01 | <0,05 |
| FEV1/FVC | 37 | 5 | 37 | 5 | 48 | 10 | 51 | 12 | 38 | 6 | 43 | 12 | ns | ns |
| TLC% | 130 | 23 | 139 | 20 | 128 | 31 | 117 | 28 | 154 | 31 | 127 | 19 | <0,05 | <0,001 |
| RV% | 208 | 68 | 212 | 62 | 203 | 34 | 171 | 33 | 287 | 75 | 217 | 46 | ns | <0,01 |
| DLCO% | 49 | 18 | 46 | 16 | 54 | 11 | 55 | 12 | 54 | 22 | 56 | 21 | ns | ns |
| MIP kPa | 5 | 1 | 4 | 1 | 4 | 2 | 5 | 2 | 3 | 2 | 4 | 2 | <0,01 | ns |
| MEP kPa | 5 | 1 | 5 | 1 | 5 | 2 | 6 | 2 | 4 | 2 | 6 | 4 | ns | <0,05 |
| PaO2mm Hg | 64 | 8 | 63 | 8 | 66 | 11 | 68 | 6 | 72 | 8 | 74 | 7 | ns | ns |
| PaCO2mm Hg | 46 | 9 | 46 | 9 | 48 | 6 | 48 | 6 | 45 | 10 | 43 | 9 | ns | ns |
| pH | 7 | 0 | 7 | 0 | 7 | 0 | 7 | 0 | 7 | 0 | 7 | 0 | ns | ns |
| MRC | 3 | 1 | 4 | 1 | 4 | 0 | 3 | 1 | 4 | 0 | 4 | 1 | <0,001 | <0,05 |
| CAT | 27 | 6 | 27 | 6 | 26 | 7 | 18 | 7 | 27 | 6 | 20 | 7 | <0,001 | <0,05 |
| BCSS | 5 | 2 | 5 | 2 | 6 | 2 | 3 | 1 | 6 | 2 | 4 | 2 | ns | ns |
| Hematíes | 4.507.250 | 281.847 | 3.938.250 | 1.420.499 | 4.644.875 | 525.462 | 4.444.625 | 301.775 | 4.485.000 | 365.865 | 4.548.000 | 397.043 | ns | ns |
| Leucocitos | 8.714 | 1.616 | 8.795 | 1.764 | 8.081 | 1.100 | 8.571 | 689 | 8.670 | 1.254 | 8.344 | 1.461 | ns | ns |
| Linfocitos | 2.959 | 546 | 2.969 | 634 | 1.849 | 340 | 1.918 | 248 | 2.691 | 925 | 2.435 | 831 | ns | ns |
| Prot C-r | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | ns | ns |
| Y-globul | 12 | 1 | 13 | 1 | 13 | 2 | 12 | 2 | 12 | 1 | 12 | 1 | ns | ns |
BCSS: puntuación de dificultad respiratoria, tos y esputo; CAT test de evaluación de la EPOC; DLCO: difusión pulmonar de monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; y-glob: gammaglobulinas; IPPB: respiración con presión positiva intermitente; MEP presión inspiratoria máxima; MIP: presión inspiratoria máxima; MRC: escala del Medical Research Council; ns: no significativo; PaCO2: presión arterial de dióxido de carbono; PaO2: presión arterial de oxígeno; Prot C-r: proteína C reactiva; RV: volumen residual; TLC capacidad pulmonar total; T-PEP: presión espiratoria positiva temporal.
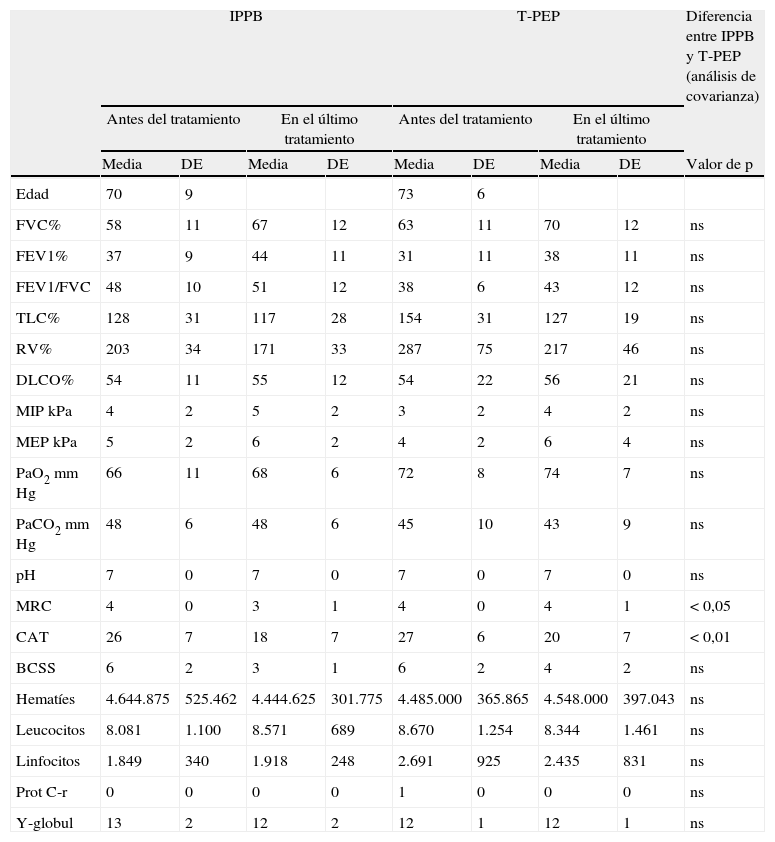
Cambios en los volúmenes pulmonares, intercambio de gases, escalas de disnea y calidad de vida, y fuerza muscular y parámetros bioquímicos antes y después del tratamiento en los grupos de IPPB y TPEP
| IPPB | T-PEP | Diferencia entre IPPB y T-PEP (análisis de covarianza) | |||||||
| Antes del tratamiento | En el último tratamiento | Antes del tratamiento | En el último tratamiento | ||||||
| Media | DE | Media | DE | Media | DE | Media | DE | Valor de p | |
| Edad | 70 | 9 | 73 | 6 | |||||
| FVC% | 58 | 11 | 67 | 12 | 63 | 11 | 70 | 12 | ns |
| FEV1% | 37 | 9 | 44 | 11 | 31 | 11 | 38 | 11 | ns |
| FEV1/FVC | 48 | 10 | 51 | 12 | 38 | 6 | 43 | 12 | ns |
| TLC% | 128 | 31 | 117 | 28 | 154 | 31 | 127 | 19 | ns |
| RV% | 203 | 34 | 171 | 33 | 287 | 75 | 217 | 46 | ns |
| DLCO% | 54 | 11 | 55 | 12 | 54 | 22 | 56 | 21 | ns |
| MIP kPa | 4 | 2 | 5 | 2 | 3 | 2 | 4 | 2 | ns |
| MEP kPa | 5 | 2 | 6 | 2 | 4 | 2 | 6 | 4 | ns |
| PaO2mm Hg | 66 | 11 | 68 | 6 | 72 | 8 | 74 | 7 | ns |
| PaCO2mm Hg | 48 | 6 | 48 | 6 | 45 | 10 | 43 | 9 | ns |
| pH | 7 | 0 | 7 | 0 | 7 | 0 | 7 | 0 | ns |
| MRC | 4 | 0 | 3 | 1 | 4 | 0 | 4 | 1 | <0,05 |
| CAT | 26 | 7 | 18 | 7 | 27 | 6 | 20 | 7 | <0,01 |
| BCSS | 6 | 2 | 3 | 1 | 6 | 2 | 4 | 2 | ns |
| Hematíes | 4.644.875 | 525.462 | 4.444.625 | 301.775 | 4.485.000 | 365.865 | 4.548.000 | 397.043 | ns |
| Leucocitos | 8.081 | 1.100 | 8.571 | 689 | 8.670 | 1.254 | 8.344 | 1.461 | ns |
| Linfocitos | 1.849 | 340 | 1.918 | 248 | 2.691 | 925 | 2.435 | 831 | ns |
| Prot C-r | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | ns |
| Y-globul | 13 | 2 | 12 | 2 | 12 | 1 | 12 | 1 | ns |
BCSS: puntuación de dificultad respiratoria, tos y esputo; CAT test de evaluación de la EPOC; DLCO: difusión pulmonar de monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; y-glob: gammaglobulinas; IPPB: respiración con presión positiva intermitente; MEP presión inspiratoria máxima; MIP: presión inspiratoria máxima; MRC: escala del Medical Research Council; ns: no significativo; PaCO2: presión arterial de dióxido de carbono; PaO2: presión arterial de oxígeno; Prot C-r: proteína C reactiva; RV: volumen residual; TLC capacidad pulmonar total; T-PEP: presión espiratoria positiva temporal.
No se observaron cambios significativos en los análisis de laboratorio de parámetros bioquímicos. No se identificaron tampoco cambios significativos en la gasometría arterial. Tal como se muestra en la tabla 1 hubo un aumento significativo al final del tratamiento en los valores de FVC, FEV1 y MIP, y una disminución de la TLC en el grupo de IPPB en comparación con el grupo de control. Los valores de FVC, FEV1 y MEP aumentaron significativamente y la TLC y el RV se redujeron en el grupo de TPEP en comparación con el grupo de control (tabla 1). No se observaron diferencias en el análisis de comparación de los grupos de IPPB y TPEP (tabla 2).
DiscusiónRecientemente se ha introducido una nueva modalidad de aplicación mecánica de un nivel bajo de presión espiratoria positiva en la boca durante la respiración espontánea, denominada presión espiratoria positiva temporal, para los pacientes con EPOC. Esta técnica produce un aumento de 1cmH2O en la presión de las vías aéreas a lo largo del ciclo respiratorio hasta inmediatamente antes de la espiración. El nivel de presión aplicada con la presión espiratoria positiva temporal es considerablemente inferior al nivel utilizado normalmente ([5-15cmH2O] con los dispositivos anteriores). La IPPB es un dispositivo terapéutico establecido en varios campos de la rehabilitación respiratoria14. Utiliza un respirador mecánico para aportar una presión controlada de un gas con objeto de facilitar la ventilación o expansión de los pulmones, con lo que produce un aumento del volumen corriente. La IPPB puede incluir una ventilación de presión o tiempo limitados, así como una ventilación con ciclos de presión, tiempo o flujo. Los aparatos de IPPB se emplean también para la administración de los fármacos en aerosol15. La IPPB continúa siendo una técnica empleada para la ventilación mecánica de corta duración o intermitente destinada a aumentar la expansión pulmonar, administrar medicación aerosolizada y/o facilitar la ventilación16. Se han publicado pocos estudios sobre el uso de la IPPB en pacientes con EPOC: uno de los realizados hace más tiempo puso de manifiesto una escasa ventaja de su uso en el tratamiento con aerosol17. Un segundo estudio no mostró ventaja alguna de la adición de IPPB a la fisioterapia respiratoria tradicional18. El siguiente, un estudio multicéntrico, que comparó el tratamiento de IPPB con el tratamiento mediante un nebulizador compresor en 985 pacientes ambulatorios, no observó ventaja alguna de la IPPB con respecto al uso de un nebulizador compresor19. Desde finales de la década de 1980 el uso de la IPPB se fue abandonando progresivamente por varias razones que fueron resaltadas por Duffy y Furley20. Los dispositivos se continuaron utilizando en pacientes con enfermedades pulmonares restrictivas (por ejemplo enfermedades neuromusculares). Más recientemente se han publicado 2 estudios en los que se ha observado que la IPPB aumenta los parámetros funcionales respiratorios (capacidad vital, capacidad pulmonar total, capacidad residual funcional, así como presión inspiratoria y espiratoria máximas) junto con la ventilación global en pacientes con enfermedades neuromusculares21,22. El uso de la presión espiratoria positiva para mejorar el volumen pulmonar está bien documentado en la literatura; los fisioterapeutas utilizan este instrumento en los pacientes con volúmenes pulmonares bajos para mejorar la ventilación y el intercambio gaseoso. La IPPB se utiliza en la práctica clínica principalmente para mejorar el volumen pulmonar y para reducir el trabajo de la respiración8.
Los resultados preliminares ponen de manifiesto que una presión espiratoria ≤1cmH2O aplicada durante una fracción de la fase espiratoria puede mejorar la distribución de la ventilación alveolar7. Tan solo se ha publicado un estudio relativo a la TPEP, y este artículo puso de relieve su eficacia para mejorar los volúmenes pulmonares y acelerar la eliminación del impedimento bronquial después de un tratamiento a corto plazo (10 días)7.
El estudio consideró diferentes variables de valoración principales (fracción de oxígeno inspiratorio-PaO2/FiO2), y variables de valoración secundarias como los parámetros de la función pulmonar y las variaciones diarias en la producción, densidad y purulencia del esputo y el impedimento bronquial evaluado con una escala analógica visual. En el análisis de grupos del cambio pre-post para la misma variable tan solo la capacidad inspiratoria aumentó de manera más significativa, y se redujo la purulencia del esputo en el grupo tratado con TPEP. La metodología (la TPEP se añadió a las técnicas de respiración asistida manualmente tradicionales), los parámetros de valoración y los resultados dificultan la comparación de nuestro estudio con los anteriores: el aumento de la capacidad inspiratoria (IC) puede sugerir una reducción de la hiperinsuflación pulmonar, como observamos en nuestros pacientes (una reducción significativa de la TLC y el RV). En otro estudio la TPEP se utilizó durante 30min 2 veces al día a lo largo de un periodo de tiempo breve (5 días) como preparación para la cirugía mayor abdominal23. Identificamos, además, un estudio controlado no aleatorizado (publicado en italiano) (en el que se utilizaron como grupo control las determinaciones de pacientes previos) que mostró una mejora de la paO2 y los parámetros de la función pulmonar después del uso de TPEP durante 28 días24. La IPPB se utilizó ampliamente en pacientes postoperados en los que mejora el volumen pulmonar y potencia la efectividad de la tos25. En pacientes con una tetraplejia de instauración aguda, aumenta el volumen corriente y la capacidad vital forzada, permitiendo la insuflación y ventilación pulmonar, con lo que reduce la elasticidad de la pared torácica y del pulmón21. Aparte de la IPPB como instrumento para la administración de aerosoles en el árbol bronquial, no hay ningún estudio que confirme la utilidad de la IPPB en pacientes con EPOC. Una de las razones es que el uso de la IPPB requiere un alto nivel de destreza del operador en la manipulación apropiada de los ajustes utilizados17. De hecho, el dispositivo más reciente de IPPB (Alfa 200C, Air Liquide) (fig. 3) actúa de manera similar a un respirador de 2 niveles (BIPAP), pero continúa siendo un dispositivo de fisioterapia respiratoria. Los ajustes son más fáciles de realizar y el dispositivo puede emplearse con una boquilla o con una mascarilla.
Nuestro estudio es el primero en el que se consideran tan solo pacientes con EPOC y, en este sentido, podría considerarse un estudio piloto (en el estudio previo se incluyó también a pacientes con bronquiectasias)7. Este es el primer ensayo clínico que verifica la efectividad de la IPPB en pacientes con EPOC grave e intenta confirmar la efectividad de la TPEP. La diferencia de efecto de las 2 técnicas se pone de manifiesto en los resultados de las pruebas de la función pulmonar: la IPPB aumenta los valores de FVC, FEV1 y MIP; esto refleja su capacidad de aumentar el volumen pulmonar y mejorar la efectividad de la tos8,21,22, pero no redujo la capacidad pulmonar total y el volumen residual. Por su parte, la TPEP aumenta la FVC y el FEV1 (en menor medida que la IPPB), pero eleva la MEP, mientras que reduce la TLC y el RV. Esta última observación es importante, ya que podría explicar funcionalmente el mecanismo de acción sugerido de la TPEP en los bronquiolos pequeños al producir una mejora de la distribución de la ventilación alveolar obtenida con tan solo 1cmH2O a lo largo del ciclo respiratorio23.
LimitacionesAunque presenta algunos resultados nuevos e interesantes en relación con el uso de las 2 técnicas de presión espiratoria positiva, y se llevó a cabo en una población estrictamente seleccionada y en un número limitado de pacientes con un diseño controlado y aleatorizado, somos conscientes de algunas limitaciones de nuestro estudio y de la potencia estadística limitada de nuestras muestras.
No estudiamos parámetros de valoración funcionales más complejos (por ejemplo la prueba de la marcha de 6min) para verificar si las mejoras registradas en la función pulmonar y la calidad de vida podían relacionarse con un mejor estado general en relación con las actividades diarias.
ConclusionesLas 2 técnicas (IPPB y TPEP) mejoran significativamente la disnea, los instrumentos de valoración de la calidad de vida y la función pulmonar en los pacientes con una EPOC grave. La IPPB mostró una mayor efectividad en la mejora de los instrumentos de evaluación de la disnea (MRC) y la calidad de vida (CAT) en comparación con la TPEP.
Conflicto de interesesEste estudio se llevó a cabo de manera independiente de los fabricantes, y los autores no tienen ningún conflicto de intereses que declarar.
Los autores agradecen a la Dra. Maura Ferrari-Bravo la ayuda en el análisis estadístico y al Dr. Cornelius Barlascini su inestimable colaboración en la corrección y revisión del manuscrito.