Es probable que la disfunción de los músculos respiratorios, principalmente del diafragma, constituya una pieza clave dentro de los mecanismos fisiopatológicos que conducen a la dificultad del destete de la ventilación mecánica. La limitada movilidad del paciente crítico —y en especial del diafragma— cuando se requiere soporte prolongado con ventilación mecánica favorece el inicio temprano de la disfunción muscular respiratoria, la cual puede originarse también o hacerse mayor en presencia de factores frecuentes en el paciente críticamente enfermo, tales como sepsis, desnutrición, edad avanzada, duración y modo ventilatorio, uso de algunos medicamentos como glucocorticoides y bloqueadores neuromusculares. En esta revisión haremos énfasis en este origen multicausal, en el que la alteración del metabolismo de las proteínas es un mecanismo común involucrado, de acuerdo con los hallazgos reportados en diferentes modelos. El entendimiento de esta multicausalidad integrada por un mismo mecanismo fisiopatológico podría favorecer el manejo y la monitorización de los pacientes sometidos a ventilación mecánica.
Respiratory muscle dysfunction, particularly of the diaphragm, may play a key role in the pathophysiological mechanisms that lead to difficulty in weaning patients from mechanical ventilation. The limited mobility of critically ill patients, and of the diaphragm in particular when prolonged mechanical ventilation support is required, promotes the early onset of respiratory muscle dysfunction, but this can also be caused or exacerbated by other factors that are common in these patients, such as sepsis, malnutrition, advanced age, duration and type of ventilation, and use of certain medications, such as steroids and neuromuscular blocking agents. In this review we will study in depth this multicausal origin, in which a common mechanism is altered protein metabolism, according to the findings reported in various models. The understanding of this multicausality produced by the same pathophysiological mechanism could facilitate the management and monitoring of patients undergoing mechanical ventilation.
La ventilación mecánica (VM) es una de las medidas de soporte vital avanzado más comúnmente utilizada en las unidades de cuidados intensivos (UCI) y forma parte del manejo estándar de la insuficiencia respiratoria aguda. Sin embargo, a pesar de sus bondades, la VM puede causar complicaciones directas a nivel pulmonar y sistémico1 que conducen a la prolongación de la estancia hospitalaria, con incremento de los costos y con mayor mortalidad y disminución de la calidad de vida2. Resulta entonces crítico tratar de acortar el periodo de VM con el que es soportado un paciente críticamente enfermo, mediante la juiciosa evaluación diaria por parte del clínico; se calcula que cerca del 40% del tiempo total de VM en la UCI es requerido para llevar a cabo el retiro del soporte respiratorio3. Algunos estudios descriptivos han demostrado que el 69% de los pacientes es de fácil destete, mientras que el 15% requiere VM prolongada (VMP), con estancias hospitalarias superiores a 10días4.
La dificultad en el destete de la VM constituye un problema muy importante, pues incrementa complicaciones tales como infecciones nosocomiales y/o trauma de la vía aérea, entre otras. Esta situación, además de llevar a un deterioro significativo de la calidad de vida, genera un consumo de hasta el 40% de los recursos de la UCI2,5. Es probable que la disfunción de los músculos respiratorios, principalmente del diafragma, sea una pieza clave dentro de los mecanismos fisiopatológicos de la dificultad del destete de la VM6. La movilidad del diafragma disminuye cuando se utiliza VM, y esto favorece el inicio temprano de su disfunción2,3, la cual se potencia en la medida que se suman otros factores, tales como edad avanzada, larga duración de VM, modo ventilatorio controlado, alteraciones nutricionales, sepsis y uso de algunos medicamentos como glucocorticoides y bloqueadores neuromusculares (BNM)7. Cada vez se conocen mejor los mecanismos fisiopatológicos que permiten relacionar estos factores con la disfunción muscular respiratoria8, y esta, a su vez, con la dificultad para retirar la VM.
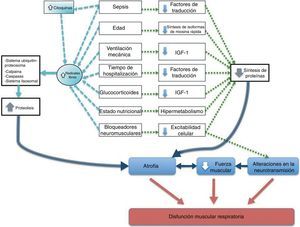
En este trabajo queremos hacer énfasis en 2aspectos. Uno de ellos es que los factores principalmente asociados a la disfunción muscular respiratoria se presentan con una alta prevalencia y por lo tanto simultaneidad importante en los pacientes con VM. El otro aspecto es que la fisiopatología de estos factores tiene como mecanismo común la proteólisis y/o la disminución de la síntesis de las proteínas musculares, lo cual ha sido además evidenciado histológicamente como atrofia9.
Factores asociados con la disfunción muscular respiratoriaEdadEn un estudio multicéntrico prospectivo que incluyó pacientes ventilados mecánicamente en las unidades de cuidados intensivos de 20países de América y Europa10 y en otro realizado en Latinoamérica11, encontraron que la edad promedio fue de 57años, y en los pacientes que se encontraban en VMP fue de 72años. Habitualmente en humanos, la fuerza, la masa y la estructura del músculo esquelético cambian con la edad. A los 70años se presenta una reducción de la masa muscular de entre el 20 y el 30%, y esto genera una disminución de la fuerza periférica entre el 20 y el 40%12. La disminución de la masa periférica representa la caída del número y del tamaño de las fibras, principalmente de las rápidas13. Estos cambios con la edad en los músculos respiratorios y en la musculatura periférica pueden ser diferentes, puesto que la actividad respiratoria es continua, mientras que la de los músculos periféricos no. A pesar de que la información en humanos es limitada, la disfunción de los músculos respiratorios relacionada con la edad ha sido demostrada mediante la disminución de la fuerza de estos, con la caída de 0,8 a 2,7cm de agua/año de la presión inspiratoria máxima (PIM) en edades entre 65 y 85años14 y la caída de un 25% de la presión transdiafragmática en adultos entre 65 a 75años15. Un mecanismo que explica estos cambios es el efecto acumulativo de los radicales activos de oxígeno, que puede desencadenar procesos proteolíticos16. Se ha sugerido también que al progresar la edad, hay una remodelación de las fibras musculares en la que las fibras rápidas de miosina son sustituidas por isoformas de tipo lento12.
Duración y modo de la ventilación mecánicaTeniendo en cuenta la evolución de los pacientes que ingresan en la UCI, se ha reportado que el 30% ha requerido soporte con VM cuya duración media fue de 5 a 8días y el modo más utilizado fue el asisto-controlado (60%)10,11. De los pacientes con VM, el 30% presentó dificultad al destete y una fracción importante se quedó en lo que fue definido como VMP. Parece ser que, además de la duración de la VM, el modo ventilatorio es determinante también en la aparición de la disfunción muscular diafragmática17. Esta fue descrita por primera vez en 1994 por Le Bourdelles et al.18, quienes sometieron ratas a VM y demostraron que después de 48h de soporte se reducía la fuerza muscular máxima por unidad de área de sección transversal. La atrofia diafragmática ha recibido una creciente atención en los últimos años9. Varios estudios realizados en diferentes especies animales han demostrado que son suficientes 12-18h de VM para que esta atrofia se produzca de forma significativa en las fibras lentas y rápidas de este músculo17. Esta atrofia precede la aparición de la observada en el sistema locomotor, comúnmente descrita en animales de experimentación tras 96h de VM8. Resultados similares a estos estudios fueron confirmados en humanos tras 18 a 69h de VM9, en los que se demostró atrofia diafragmática después de comparar biopsias de este músculo entre sujetos con muerte cerebral (previamente sometidos a VM controlada) y sujetos controles sometidos a cirugía torácica. Como hallazgo importante, se observó disminución del área de sección transversal tanto de fibras tipo i como tipo ii en los sujetos ventilados durante más de 48h. Algunos estudios en animales revelan que la inmovilidad producida por la VM controlada provoca además una disminución de las fibras en los músculos esqueléticos locomotores, un trastorno miofibrilar en el diafragma y, además, alteraciones en la estructura de la línea Z en ambos19.
El mecanismo mayormente asociado a la atrofia diafragmática en modelos animales20 y en humanos sometidos a VM es el incremento de la proteólisis9,21. En animales, además, se ha evidenciado disminución de la síntesis proteica18,20. En recientes investigaciones se ha identificado la participación de la calpaína, la caspasa-3, el sistema lisosomal y el sistema ubiquitina-proteosoma, en la proteólisis diafragmática8. Actualmente la investigación se dirige hacia la exploración de las vías de transducción de estos mecanismos, con el fin de encontrar fármacos o intervenciones terapéuticas que las desvíen hacia la prevención de la atrofia y disfunción muscular respiratoria. En este sentido se han propuesto alternativas como la disminución del tiempo en los modos controlados de VM, la estimulación eléctrica diafragmática transcutánea y la movilización temprana de los pacientes22, así como de fármacos con efectos antioxidantes.
Estado nutricional y metabólicoEntre el 30 y el 60% de los pacientes de la UCI tienen o tendrán algún grado de desnutrición, debido a las alteraciones metabólicas que conducen a un mayor gasto energético y también a un déficit de nutrientes secundario a la disminución de la absorción o a la disponibilidad de estos durante la enfermedad crítica23. Hay un estado hipermetabólico que se produce por un incremento de hormonas catabólicas (glucagón, adrenalina y cortisol) como de citoquinas24, pero también, por la inhibición de hormonas anabólicas como la insulina y la testosterona. La permanencia en este estado induce la disminución tanto de la masa y de la fuerza muscular como de la respuesta inmune24. El desequilibrio hormonal ha sido asociado con la aparición frecuente de hiperglucemia, que aunque es una condición adaptativa a la enfermedad crítica, se ha establecido como un factor pronóstico negativo a corto, medio y largo plazo25. La hiperglucemia favorece el almacenamiento de los lípidos en forma de triglicéridos y lipoproteínas de baja densidad26. La capacidad disminuida en la utilización de estos sustratos como fuentes de energía conduce a una marcada proteólisis y, por lo tanto, a la disminución de la masa muscular, al incremento de las infecciones severas, al fallo orgánico múltiple y a la muerte, sobre todo en pacientes críticos quirúrgicos27. El peso del diafragma de rata en estado de desnutrición cae más que el de los músculos de las extremidades, por atrofia y remodelación de las fibras rápidas28. Por otro lado, la hiperglucemia produce estrés oxidativo, que ha sido asociado a la pérdida y a la atrofia de las fibras nerviosas, alterando la neurotransmisión muscular.
ComorbilidadesLos pacientes críticamente enfermos que se encuentran sometidos a VM pueden presentar diferentes comorbilidades, y las más prevalentes son sepsis, diabetes mellitus, hipertensión e infarto agudo de miocardio. También pueden presentarse complicaciones como barotrauma, sepsis, síndrome de dificultad respiratoria en el adulto (SDRA), neumonía asociada a VM, shock cardiogénico y polineuropatía del paciente crítico10. Varias de estas enfermedades pueden sumar sus efectos en el desarrollo de la disfunción muscular respiratoria a través de mecanismos mediados por alteraciones en el metabolismo de las proteínas. Por ejemplo, tanto en modelo animal como en humanos, el síndrome de respuesta inflamatoria sistémica de la sepsis induce al incremento de las citoquinas proinflamatorias (TNF-α, IL-6, IL-1) y al de los radicales libres29, los cuales favorecen también una mayor actividad de las vías proteolíticas30 mencionadas anteriormente en otros factores. De la síntesis de proteínas en el músculo esquelético de ratas se ha reportado que otros mediadores inflamatorios inducidos por sepsis, como la IL-1β, disminuye la fosforilación del factor eIF4G, lo cual altera el inicio de la traducción de proteínas sarcoplásmicas como miofibrilares en los músculos de contracción rápida31. Otros mecanismos diferentes a cambios en la regulación del metabolismo proteico se han propuesto en la sepsis, mecanismos que están asociados con alteraciones de la excitabilidad celular, la homeostasis del calcio30 y la fosforilación oxidativa mitocondrial del músculo.
Tratamientos farmacológicosGlucocorticoidesLos glucocorticoides (GC) en el paciente crítico se usan en la sepsis, en la lesión pulmonar aguda (SDRA) y en el shock vasodilatador refractario32. Altas dosis han sido asociadas a trastornos neuromusculares que producen disfunción muscular periférica y respiratoria. En pacientes con VM se observó que los GC retrasan el destete de VM y aumentan la necesidad de traqueostomía32.
En humanos y en animales, la disfunción muscular respiratoria y periférica por GC también se produce por inhibición del anabolismo y por el efecto catabólico de las proteínas33. Mediante el efecto anti-anabólico de los GC, la síntesis proteica se inhibe por distintos mecanismos. Uno de ellos es la inhibición del transporte de los aminoácidos dentro del músculo, lo cual limita la síntesis de proteínas; otro mecanismo propuesto es la inhibición de la acción estimuladora de la insulina y del factor de crecimiento insulínico (IGF-1) sobre la fosforilación de la proteína de unión (eIF4) y la proteincinasa ribosomal S6, 2factores claves en la traducción del ARNm33. Por último, los GC inhiben la miogénesis a través de la baja regulación de la miogenina, un factor de transcripción necesario para la diferenciación de células satélite en fibras musculares34. La estimulación del IGF-1 o de los bloqueadores de miostatina constituyen algunos de los más promisorios alcances terapéuticos para prevenir la atrofia muscular causada por GC. La acción catabólica de los GC es mediada por los sistemas proteolíticos celulares ubiquitin-proteosoma, lisosomal y el de calpaínas35, que afectan principalmente las proteínas miofibrilares. En la atrofia muscular se ha observado que mediadores intracelulares como FOXO, GSK3b, C/EBPb, p300, REDD1 y ATF4 forman parte no solo de la acción catabólica sino de la acción inhibitoria del anabolismo de los GC35.
Bloqueadores neuromuscularesEs conocido que con los BNM se tiene el objetivo de mejorar la sincronía de los pacientes en VM y mantener los parámetros ventilatorios altos (PEEP>10cmH2O, FIO2>80%) en aquellos que lo necesiten. Los BNM se dividen en despolarizantes y no-despolarizantes. En un estudio con diafragma de rata en el que se comparó el efecto de estos, se encontró que los BNM no despolarizantes tenían mayor potencia36. En humanos se ha reportado que los BNM no despolarizantes no producen debilidad adquirida en la UCI al compararlos con placebo37. Sin embargo, en algunos artículos se reporta la presencia de complicaciones respiratorias (desaturación prolongada, SatO2<90%) que requieren reintubación38.
El uso prolongado de dosis altas de los BMN concomitante con esteroides y en presencia de una inmovilización prolongada favorece la debilidad muscular en el paciente crítico y en algunos casos la miopatía aguda necrosante39. En esta miopatía hay debilidad generalizada, que afecta la musculatura periférica y la respiratoria, es de recuperación lenta y deja secuelas. En pacientes críticos con sepsis o en fallo orgánico múltiple la farmacocinética de los BNM está alterada debido a cambios en la función orgánica, la perfusión y la relación entre los fluidos del espacio intra y extracelular40. Por estos hallazgos, se ha recomendado la administración de BNM que no alteren la función renal o hepática y en dosis intermitente.
Síntesis de la disfunción muscular respiratoria en el paciente crítico con ventilación mecánicaEn el esquema de la figura 1 se presentan los factores que contribuyen a la disfunción muscular respiratoria del paciente crítico con VM. Se pueden observar los mecanismos involucrados en la proteólisis y/o la disminución de la síntesis proteica correspondiente a cada factor.
ConclusiónLa disfunción muscular respiratoria en el paciente críticamente enfermo sometido a VM, a pesar de tener un origen multicausal, puede tener como mecanismos subyacentes la proteólisis y/o la disminución de síntesis proteica principalmente, y en algunos casos la perturbación de la neurotransmisión. Esta disfunción favorece la dificultad del destete, la VMP y la morbimortalidad del paciente crítico.
Aunque el objetivo de esta revisión fue hacer énfasis en la disfunción muscular respiratoria, su multicausalidad y los mecanismos asociados afectan también de una u otra manera la musculatura periférica.
RecomendacionesEl tratamiento temprano e integrado de las múltiples causas asociadas a la disfunción muscular respiratoria podría disminuir la estancia hospitalaria y la morbimortalidad asociada, así como la presencia y la gravedad de las secuelas neuromusculares que pueden llegar a ser irreversibles.
Es importante promover la investigación en la cuantificación y la regulación del metabolismo proteico alterado en las condiciones de estos pacientes, para así lograr contrarrestar esta tendencia metabólica, a través de una prescripción de tratamientos y dietas más cercana a las condiciones reales del paciente crítico con VM.
FinanciaciónConvocatoria Universidad del Valle del año 2010.
Convenio macroFundación Valle del Lili y Universidad del Valle.
Conflicto de interesesNo hay conflicto de intereses ni institucional ni con individuos.
La ejecución de esta revisión fue posible con el apoyo institucional de la Universidad del Valle y la Fundación Valle del Lili (FVL) de Cali-Colombia. De la mismo forma se resalta la colaboración de la doctora Mónica P. Vargas, MD, Anestesióloga de la Unidad de Cuidado Intensivo de la FVL.