La ecografía torácica es útil en la valoración de enfermedades del parénquima pulmonar periférico, pleura, pared torácica, diafragma y mediastino, y también es de gran utilidad como guía en procedimientos intervencionistas diagnósticos y terapéuticos. Sus principales ventajas radican en la ausencia de radiaciones ionizantes, la capacidad de explorar en tiempo real y la posibilidad de realizar la exploración en la cabecera del paciente. En este artículo se revisan sus principales indicaciones y limitaciones, así como su semiología básica.
Chest ultrasonography is a useful tool for assessing disease activity in the peripheral lung parenchyma, pleura, chest wall, diaphragm, and mediastinum. Ultrasound imaging also provides highly useful guidance in invasive diagnostic and therapeutic procedures. The main advantages of this imaging technology are the absence of ionizing radiation and the possibility of real-time bedside applications. The chief indications and limitations of chest ultrasonography and the principal sonographic signs are reviewed.
Actualmente ya se ha demostrado la utilidad de la ecografía en múltiples afecciones y localizaciones del organismo, puesto que presenta una serie de ventajas sobre el resto de técnicas radiológicas1. Entre ellas destacan la ausencia de radiaciones ionizantes, la posibilidad de realizar la exploración en la cabecera del paciente, su valoración en tiempo real y la accesibilidad de los equipos2. Estas características son de especial utilidad en las personas más susceptibles a los efectos adversos de la radiación, como los niños3,4 y las embarazadas, o en pacientes de difícil movilización, como los ingresados en unidades de cuidados intensivos5–7. La portabilidad de los ecógrafos permite el estudio de pacientes de forma extrahospitalaria por parte de equipos de urgencias8.
Los últimos avances técnicos, como la utilización de armónicos tisulares9, junto con las mejoras en la ecografía Doppler y la aplicación de nuevos contrastes ecográficos10, han permitido que esta técnica tenga un papel importante en el diagnóstico y manejo de pacientes en múltiples subespecialidades, como la radiología abdominal, de la mama y del aparato locomotor. En las enfermedades torácicas, la ecografía ha tenido un papel secundario o, en gran parte de las enfermedades, prácticamente nulo. Esto se debe a que un 99% de los ultrasonidos que se emiten por el transductor ecográfico son repelidos en la interfase entre pleura y pulmón, debido a la gran diferencia de impedancia acústica entre los tejidos blandos y el aire11 y a la gran atenuación que sufren los ultrasonidos en su propagación a través de un medio aéreo. No obstante, numerosas publicaciones demuestran su utilidad en enfermedades torácicas no cardiológicas. La intención de esta revisión es dar a conocer qué enfermedades pueden beneficiarse del uso de la ecografía, para lo cual se revisan las aplicaciones de la técnica según el compartimiento torácico afectado: pleura, pulmón, pared torácica, mediastino y diafragma.
PleuraEs en la enfermedad pleural donde tradicionalmente la ecografía torácica ha tenido mayor difusión12, en especial en el diagnóstico y la punción del derrame pleural, si bien en múltiples centros se ha empleado exclusivamente como guía para la toracocentesis.
El grosor de la pleura normal es de 0,2–0,4mm. Estas medidas están por debajo de la resolución de los aparatos de ecografía. Así pues, ambas hojas pleurales aparecen en la ecografía como una línea hiperecogénica única que se mueve con la respiración (deslizamiento pulmonar o lung sliding).
Derrame pleuralLa ecografía es más precisa (sensibilidad del 100% y especificidad del 99,7%) que la radiografía convencional para detectar derrames pleurales, ya que puede visualizar a partir de 5ml de líquido13, mientras que para su visualización en la radiografía posteroanterior de tórax se necesitan 150ml, y hasta 525ml en la proyección anteroposterior en decúbito supino14.
En un estudio de Lichtenstein et al15 en pacientes con síndrome de distrés respiratorio agudo, en el que se usaba la tomografía computarizada (TC) como técnica de referencia, la ecografía mostró mayor capacidad de detección de líquido pleural (93%) que la auscultación (63%) y la radiografía en proyección anteroposterior en decúbito supino (47%).
El volumen del derrame pleural puede calcularse mediante diversas ecuaciones basadas en la medición del grosor lateral de la columna de líquido, la altura del fluido subpulmonar y el grosor del recubrimiento del pulmón16,17. El método más sencillo consiste en multiplicar el grosor de la columna lateral de líquido (en mm) por un factor empírico de 90, con lo que se obtiene el volumen de derrame pleural en mililitros (r=0,68). La estimación del volumen del derrame pleural es más precisa mediante ecografía que en radiografías17.
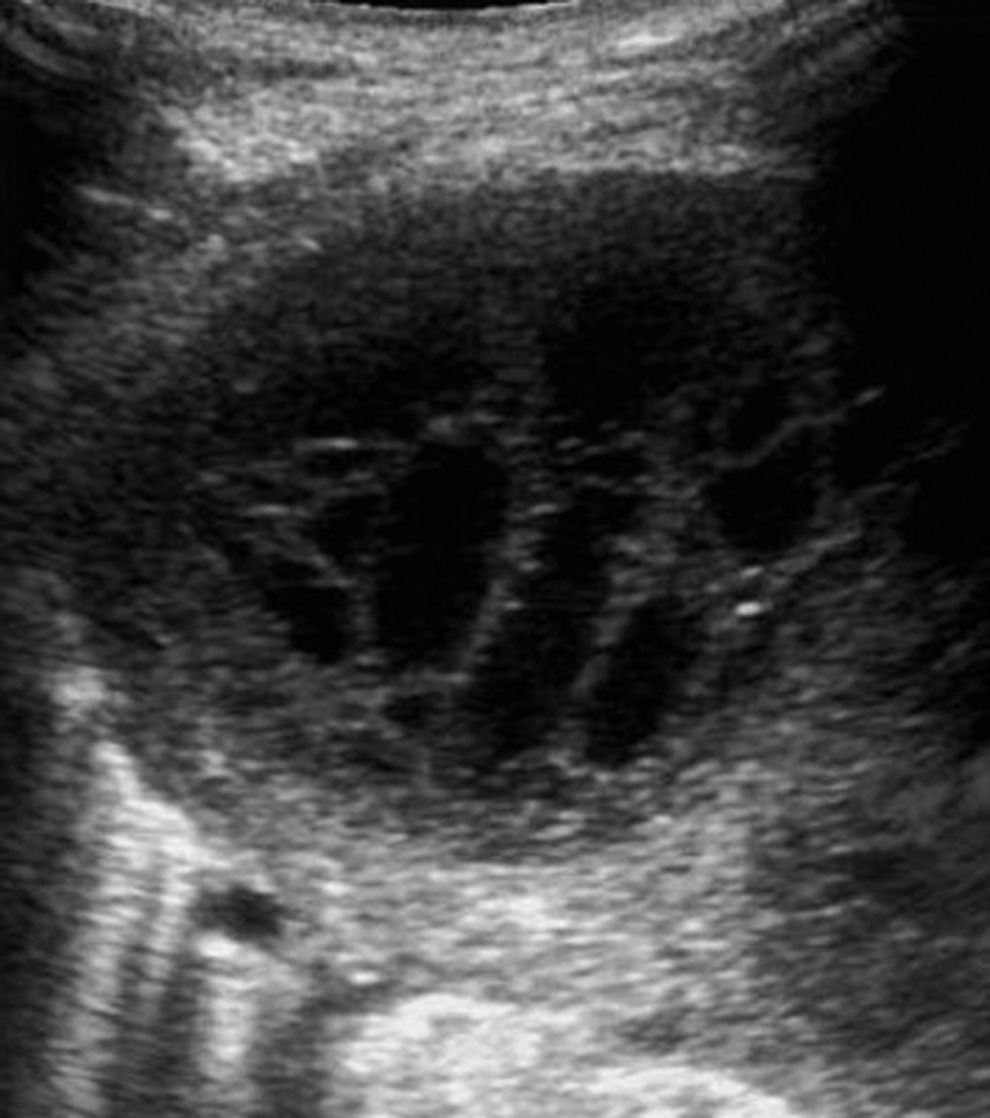
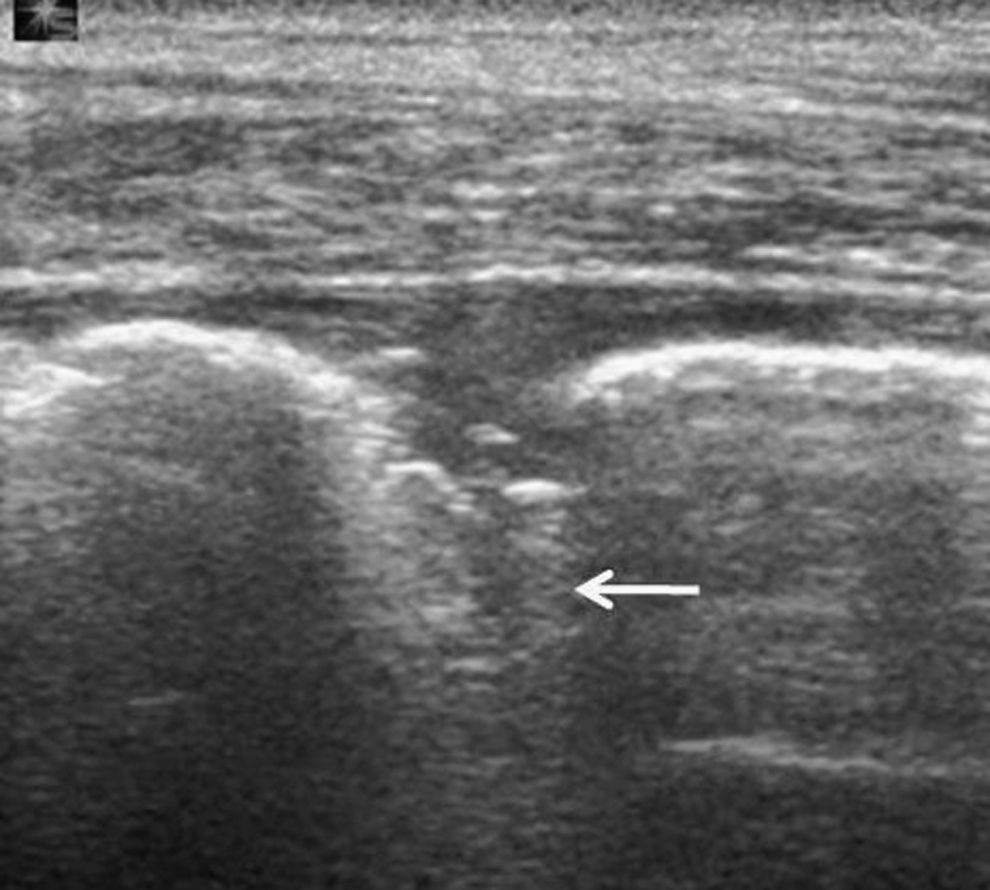
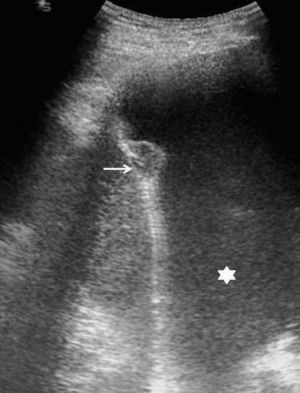
El aspecto ecográfico de un derrame pleural depende de su naturaleza, causa y cronicidad. Por sus características ecográficas los derrames pueden dividirse según presenten ecos internos, septos (gruesos o finos y móviles) y/o nodularidad pleural, o sean totalmente anecogénicos. Se ha demostrado que la ecografía es más sensible que la TC para demostrar la existencia de septos (fig. 1) en el interior de un derrame pleural4,18. La presencia de ecos, septos o nódulos permite catalogarlo de exudado19. La ausencia de estos hallazgos, es decir, el hecho de que se trate de un líquido anecogénico, no permite determinar que sea un trasudado, dado que los exudados se pueden presentar de esta manera19.
La ecografía es igualmente útil para diferenciar un pequeño derrame pleural de una lesión pleural sólida20 o de una atelectasia.
También se puede distinguir entre derrame pleural de escasa cuantía y engrosamiento pleural20. Para ello es útil el signo del color líquido (fluid color sign)21, que está presente en el derrame y no en los engrosamientos pleurales. Consiste en la presencia de señal Doppler-color en el interior de un pequeño derrame pleural, como consecuencia de la transmisión de los movimientos respiratorios o cardíacos.
Entre los signos que indican malignidad destacan la presencia de nodulaciones pleurales, que son las únicas específicas de malignidad, y el signo del remolino (swirling pattern)22. Este último, que consiste en el movimiento de los ecos internos en forma de espiral, se encuentra con frecuencia en pacientes con derrame neoplásico, si bien no es patognomónico22. Las nodulaciones pleurales se encuentran con mayor frecuencia en pleura periférica y diafragmática.
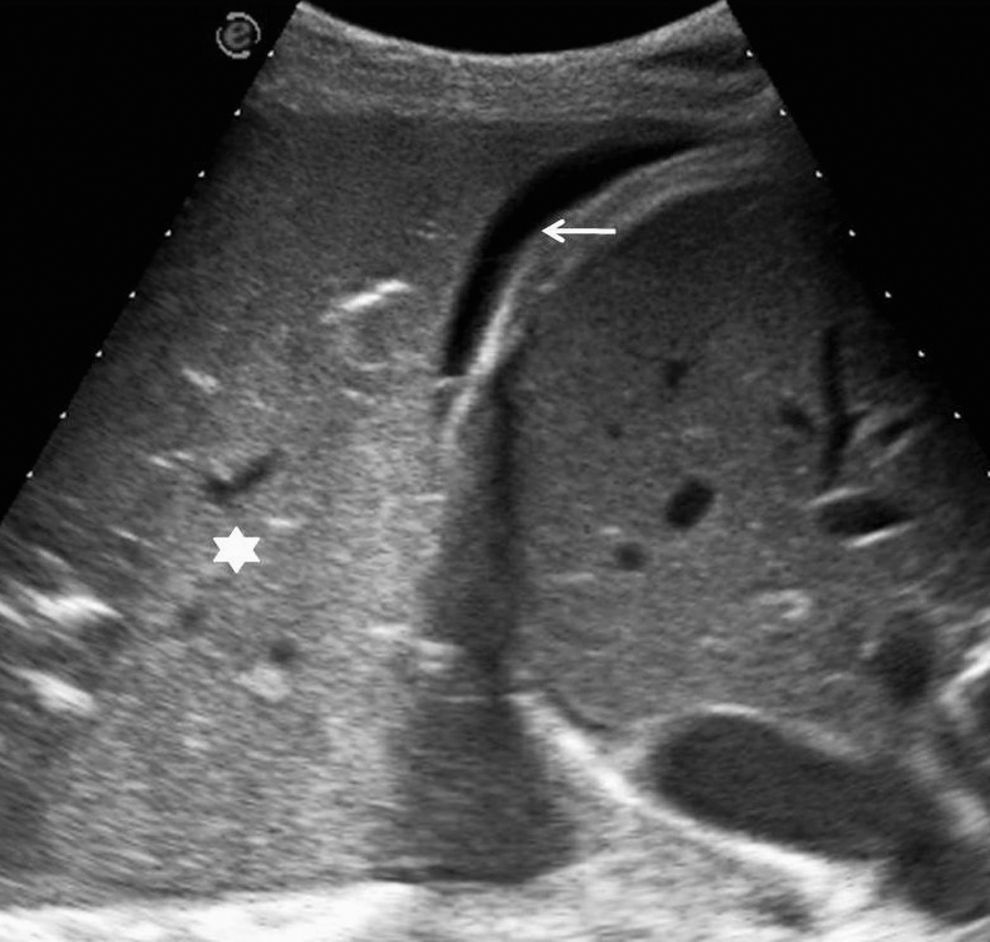
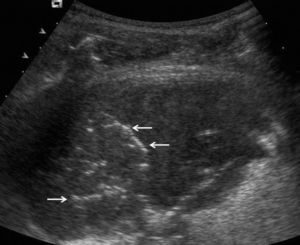
En pacientes de difícil movilización, como los ingresados en unidades de cuidados intensivos, la ecografía también es útil para determinar si las alteraciones visibles en la radiografía anteroposterior en decúbito supino corresponden a derrame pleural o a consolidaciones parenquimatosas (fig. 2). Además, como se comenta más adelante, también permite la obtención de líquido pleural de forma rápida y segura.
Engrosamientos pleuralesLos engrosamientos pleurales pueden ser secundarios a una pleuritis o corresponder a placas pleurales. La pleuritis se manifiesta como una interrupción de la línea pleural con engrosamiento irregular de la pleura visceral. Esta anomalía es prácticamente imperceptible en la radiografía y fácil de identificar mediante ecografía23. Por su parte, las placas pleurales relacionadas con la exposición al asbesto se manifiestan como engrosamientos hipoecogénicos, con amplia sombra acústica posterior si están calcificados20.
Masas pleuralesLas neoplasias pleurales benignas (lipoma, schwannoma, condroma, tumor fibroso localizado benigno) son poco frecuentes y sólo representan el 5% de los tumores pleurales24,25. En la ecografía aparecen bien delimitadas y moderadamente ecogénicas. En ocasiones pueden acompañarse de discreto derrame pleural. Estas características no permiten diferenciarlas entre sí, pero sí de las lesiones malignas.
Las masas malignas de la pleura incluyen el mesotelioma, el linfoma y las metástasis. Ecográficamente el mesotelioma se manifiesta como un engrosamiento irregular, a veces nodular, asociado a importante derrame pleural26. No obstante, la TC sigue siendo la técnica de elección en la estadificación del mesotelioma pleural26, a pesar de que haya publicaciones que muestran resultados correctos con la ecografía27.
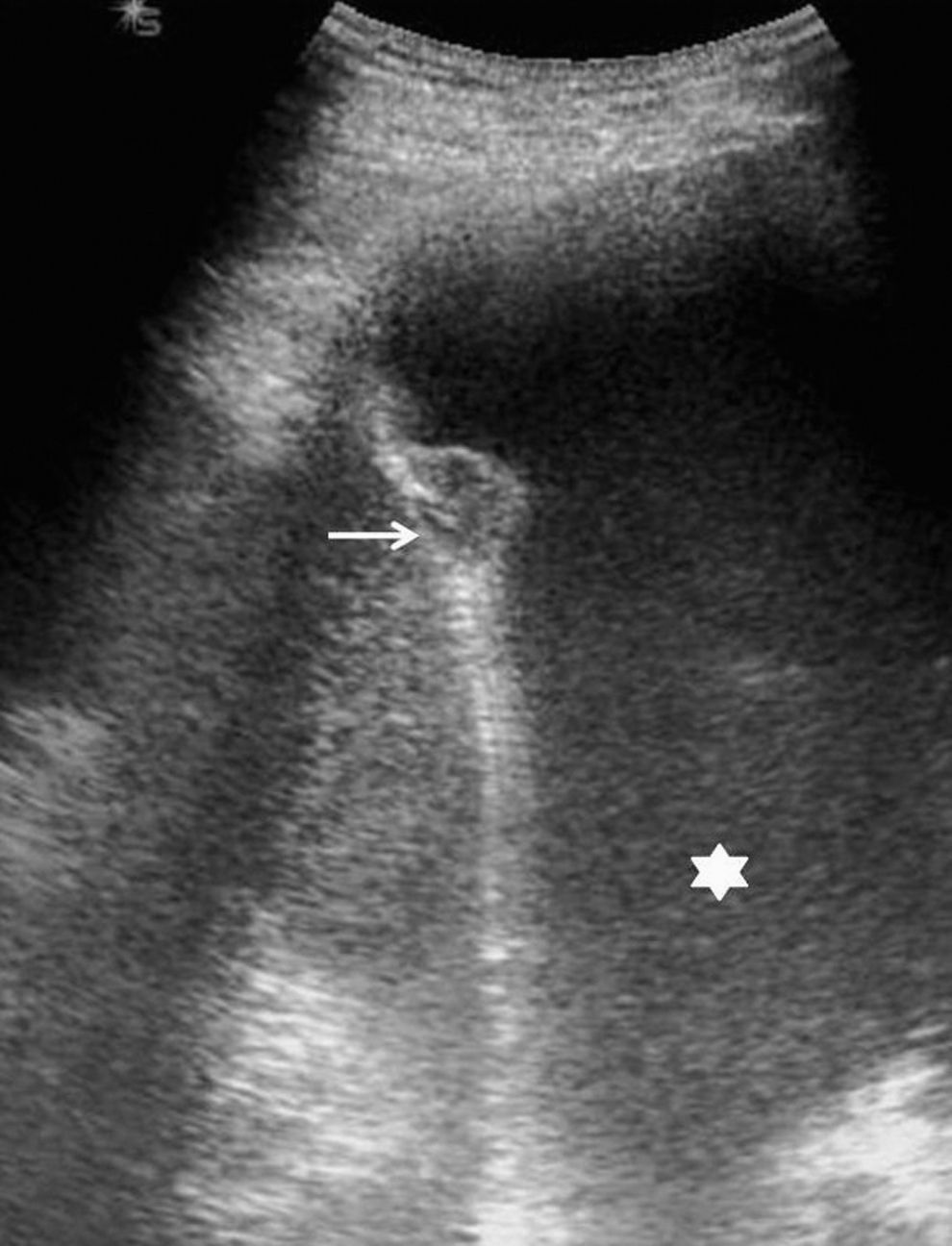
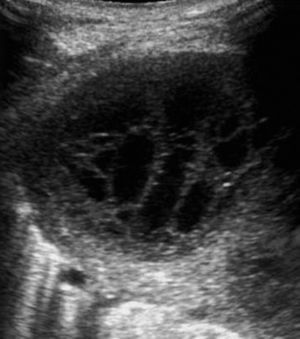
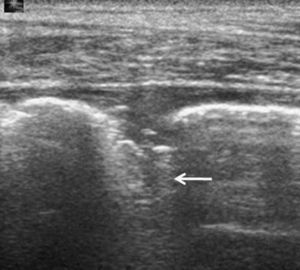
Las metástasis, fundamentalmente de adenocarcinoma, son los tumores malignos más frecuentes de la pleura20. Por lo general se acompañan de derrame pleural que, al actuar como ventana acústica, permite una mejor valoración ecográfica del componente sólido. La manifestación ecográfica más característica es en forma de nódulos de tamaño superior a 5mm en la pleura parietal, aunque en ocasiones puede haberlos en la visceral7. La región más afectada es la pleura diafragmática20 (fig. 3), y la ecografía también permite objetivar la extensión a la pared torácica.
NeumotóraxLa técnica de referencia en el diagnóstico del neumotórax es la TC28, pero su alto coste, su disponibilidad y, sobre todo, el uso de radiaciones ionizantes no permiten que sea la técnica de elección. En la práctica diaria, ante la sospecha de neumotórax se utiliza para su diagnóstico la radiografía posteroanterior en inspiración; tradicionalmente se ha acompañado de su equivalente en espiración, si bien se ha demostrado que esta proyección no cambia el manejo de estos pacientes ni aumenta la capacidad de detección29–31. La ecografía permite una detección rápida del neumotórax; su uso está especialmente indicado en gestantes y pacientes en edad pediátrica (ambos con mayor susceptibilidad a la radiación), así como en pacientes con traumatismos o ingresados en unidades de cuidados intensivos (que son los grupos con mayor dificultad para la movilización), y permite su cuantificación para el posterior manejo de estos pacientes32.
La ausencia de artefactos de cola de cometa33 y de deslizamiento pulmonar34,35 —este último signo tanto en escala de grises como con Doppler-color—, la existencia de reverberaciones lineales posteriores33 y la imagen de punto de pulmón (lung point)36 permiten el diagnóstico de neumotórax. El signo del punto de pulmón permite, además, predecir la necesidad de drenaje del neumotórax: cuando su localización es lateral, un 90% de los pacientes necesita drenaje, frente al 8% de los casos en que la localización es anterior32. Los primeros estudios publicados se realizaron en pacientes con traumatismos37,38 o con ventilación mecánica32, aunque los mejores resultados se han obtenido en las series de pacientes a quienes se practica una punción transtorácica, con unos valores de sensibilidad superiores a los de la radiografía convencional y cercanos a los de la TC39,40. Sin embargo, hay falsos positivos, como los descritos en pacientes con enfermedad pulmonar obstructiva crónica (EPOC)41, que presentan una disminución del movimiento pulmonar probablemente condicionada por la hiperinsuflación, si bien esta hipótesis aún no ha sido demostrada. Los pacientes con antecedentes de pleurodesis, afectación pleural por exposición al asbesto o distrés respiratorio agudo también pueden presentar abolición del movimiento pulmonar33. Otra posible limitación de la técnica se encuentra en los pacientes con traumatismo que presenten enfisema subcutáneo, ya que, como se ha mencionado anteriormente, los ultrasonidos sufren una gran atenuación en su propagación por medio aéreo.
El hidroneumotórax también puede diagnosticarse con ecografía torácica, mediante el signo de la cortina (curtain sign), que consiste en la presencia de artefactos de reverberación en el interior del derrame, lo que traduce la existencia de aire pleural34.
PulmónLa ecografía permite estudiar las enfermedades del parénquima pulmonar que afecten a la periferia del pulmón42. Las que la respeten no podrán evaluarse con esta técnica, ya que la práctica totalidad de los ultrasonidos se reflejan en la superficie pleural por la gran diferencia de impedancia acústica.
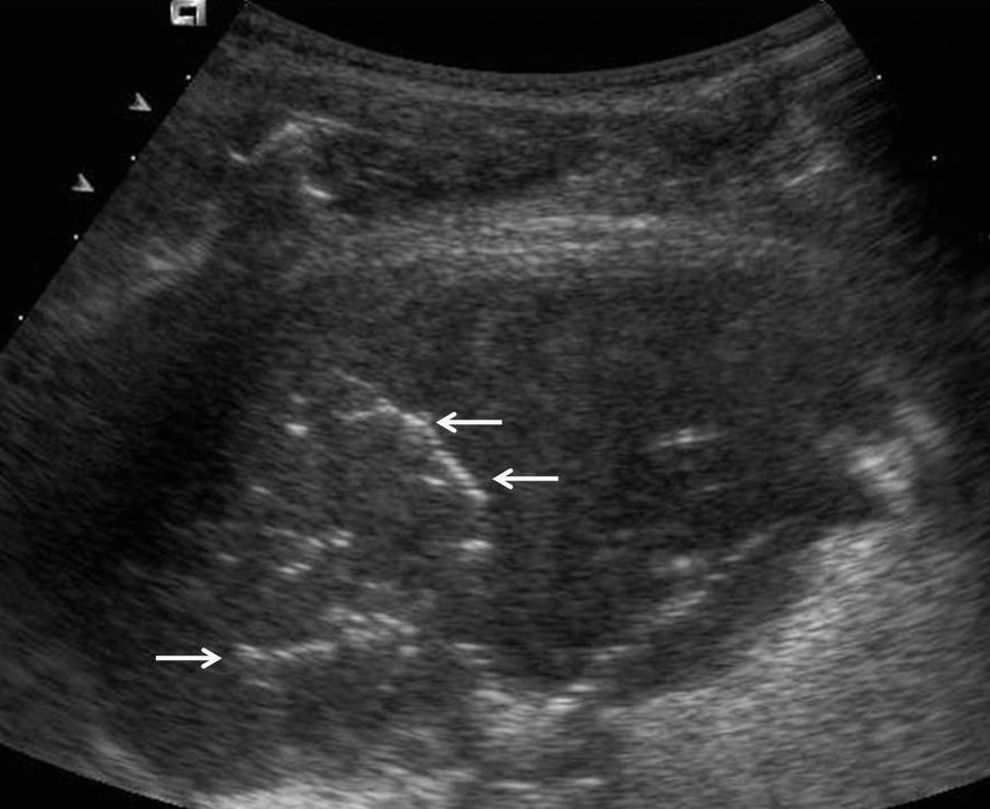
NeumoníaEn fases iniciales el pulmón se muestra difusamente ecogénico, con un aspecto ecográfico similar al del hígado, con márgenes irregulares43,44 y, a menudo, imágenes lineales ramificadas hiperecogénicas en su interior, que corresponden a broncograma aéreo45,46 (fig. 4). En fases más avanzadas, y tras tratamiento antibiótico, las consolidaciones neumónicas muestran múltiples imágenes aéreas en su interior que traducen curación del parénquima pulmonar con progresiva aireación.
Otro signo, también visible en la TC, que pueden presentar las consolidaciones neumónicas es el del broncograma líquido46, que consiste en imágenes lineales anecogénicas en el interior del parénquima. Este signo, si bien no es patognomónico, debe orientar hacia una obstrucción central como causa de la consolidación47. La ecografía puede igualmente ser de utilidad en estos casos, ya que en ocasiones es capaz de distinguir entre el proceso neoplásico central y el pulmón periférico consolidado.
La ecografía es más sensible que la radiografía convencional12,43, e incluso que la TC48, en la valoración de necrosis y abscesificación de las neumonías. En la ecografía Doppler-color se pueden identificar zonas hipoecogénicas que traducen hipoperfusión49. Los abscesos se visualizan como imágenes nodulares u ovaladas con márgenes bien o mal definidos y un contenido que puede ser totalmente anecogénico o contener ecos y septos internos43,50,51.
La importancia de la ecografía en la valoración de la neumonía radica en la detección de derrame pleural paraneumónico y de abscesos intrapulmonares, en la aspiración de las consolidaciones con objeto de obtener muestras para cultivo y en el control de pacientes especialmente susceptibles a la radiación, como los niños49 y las embarazadas.
NeoplasiaÚnicamente pueden evaluarse mediante ecografía las neoplasias que presenten contacto pleural. La ecogenicidad de las lesiones pulmonares periféricas no permite su clasificación en benignas o malignas, aunque los tumores pulmonares se manifiestan como masas predominantemente hipoecogénicas47. Sin embargo, hay otros criterios ecográficos que contribuyen a esa diferenciación: contorno de la superficie pulmonar, límites con el pulmón ventilado, destrucción de la arquitectura normal, desplazamiento vascular, neovascularización, invasión de estructuras adyacentes y diferenciación entre una lesión central y la atelectasia obstructiva subsecuente47.
En ocasiones las neoplasias presentan una superficie pleuropulmonar de contornos irregulares, hecho que no se produce en los procesos inflamatorios, y esto se identifica muy bien cuando hay derrame pleural.
Normalmente los márgenes de las neoplasias son definidos y, en ocasiones, pueden mostrar digitaciones hacia el pulmón adyacente.
La ecografía es más sensible (76,9–100%) que la TC (68–69,2%) para la evaluación de la invasión de la pared torácica52,53. Estudios recientes que la han comparado con la TC helicoidal y la resonancia magnética de 1,5 teslas demuestran su mayor sensibilidad para detectar invasión de pleura y pared torácica11,54. Las neoplasias que invaden la pleura parietal y la pared torácica muestran una pérdida del deslizamiento pulmonar normal durante la respiración20.
Las neoplasias provocan destrucción de la arquitectura normal del pulmón, con desplazamiento de bronquios y vasos. Estos vasos pueden verse retorcidos y con cambios en sus diámetros47.
La exploración con Doppler-color es útil para determinar la naturaleza benigna o maligna de una lesión pulmonar periférica y demostrar la existencia de neovascularización mediante los índices de resistencia. Así pues, un índice de resistencia medio (± desviación estándar) de 0,52±0,13 (sensibilidad del 100% y especificidad del 95%) y un índice de pulsatilidad de 1,43±0,13 (sensibilidad del 97% y especificidad del 95%) orientan sobre la malignidad de una masa pulmonar23.
Las metástasis hematógenas, por su distribución normalmente periférica, también se pueden visualizar mediante ecografía, en forma de nódulos ecogénicos subpleurales. La ecografía es una técnica limitada en el estudio de las metástasis pulmonares, ya que las que no están en contacto con la pleura periférica no son detectables.
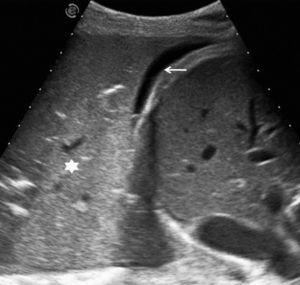
Embolia e infarto pulmonaresLas áreas de infarto pulmonar pueden identificarse en la ecografía como lesiones hipoecogénicas de morfología triangular con base periférica55,56, que puede protruir sobre la superficie pleural (fig. 5). En fases iniciales sus límites son mal definidos, pero con el tiempo se delimitan mejor; también pueden visualizarse un bronquiolo en disposición central, como una imagen hiperecogénica lineal, y el vaso aferente congestivo55–58. En los infartos en fase inicial no se evidencia broncograma aéreo59, lo que permite distinguirlos de las consolidaciones de origen infeccioso, que normalmente sí lo presentan.
En cuanto a la embolia pulmonar, aunque algunos estudios han demostrado buenos resultados en su detección, con sensibilidad del 74–98% y especificidad del 60–95%55–59, la TC con multidetectores no sólo permite visualizar las áreas de infarto, sino que además valora la existencia de defectos de repleción en el interior de las arterias pulmonares hasta en aquéllas subsegmentarias, con una sensibilidad del 85–90%60 y un valor predictivo negativo del 96–99%61. Por ello el actual potencial de la ecografía en esta enfermedad se limita a los pacientes que por problemas de movilización no son tributarios de que se les realice una TC con multidetectores 62,63.
AtelectasiaUn problema importante en radiología es distinguir entre atelectasia obstructiva y atelectasia pasiva por derrame pleural. Algunos signos radiológicos, como la S de Golden, permiten el diagnóstico de atelectasia obstructiva por neoplasia central, pero estos signos son poco frecuentes. Se ha descrito una serie de hallazgos ecográficos que permiten esa diferenciación.
En las atelectasias pasivas se pueden evidenciar: moderado derrame pleural, consolidación del parénquima pulmonar de morfología triangular, márgenes irregulares con el parénquima aireado y reventilación parcial durante la inspiración o después de la toracocentesis.
En las atelectasias obstructivas la ecografía muestra: escaso derrame pleural, consolidación hipoecogénica del parénquima, lesiones focales (por licuefacción, formación de abscesos o metástasis), broncograma líquido, lesión central obstructiva y ausencia de reventilación durante la inspiración.
La distinción entre atelectasia y tumor central puede llegar a establecerse mediante ecografía en un 50% de los casos64.
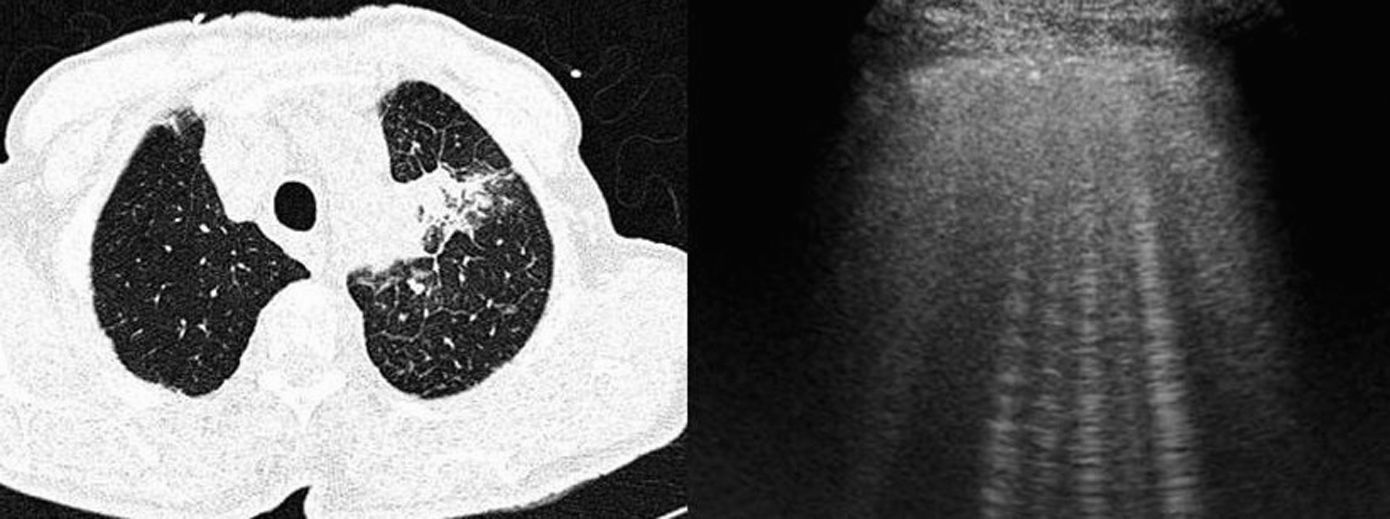
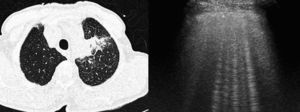
Enfermedades que cursan con afectación de los septos interlobulillaresHay múltiples procesos patológicos que cursan con afectación de los septos interlobulillares, cuya localización periférica en el pulmón los hace fácilmente valorables por ecografía, y que se han descrito como artefactos en cola de cometa12,65. Estos artefactos son visibles en condiciones normales66, pero en determinadas enfermedades que cursan con afectación de los septos interlobulillares se visualiza un aumento del número de artefactos en cola de cometa en la superficie pleural67 (fig. 6). Por el contrario, en pacientes con EPOC se ha descrito un número menor de estos artefactos.
Tomografía computarizada de tórax (izqda.): neoplasia pulmonar en el lóbulo superior izquierdo, con engrosamiento de septos interlobulillares, indicativo de linfangitis carcinomatosa. Ecografía torácica (dcha.): múltiples artefactos de cola de cometa que traducen el engrosamiento de los septos interlobulillares.
En las unidades de cuidados intensivos este hallazgo es útil para distinguir a los pacientes con EPOC de aquéllos con insuficiencia cardíaca5,68–70, con una sensibilidad del 100% y una especificidad del 92% para la detección de edema pulmonar68. Incluso se ha descrito la relación existente entre el número de artefactos en cola de cometa y el grado de insuficiencia cardíaca71,72, lo que permite el seguimiento de estos pacientes73.
Pared torácicaMasasLa ecografía es sensible, pero muy inespecífica, para la detección de masas en la pared torácica4. Por lo tanto, su papel en el estudio de estas masas queda relegado a la detección49, siendo otras técnicas más especificas, como la resonancia magnética, las que deben dar un diagnóstico más preciso.
AdenopatíasLa ecografía es muy útil en la detección y caracterización de adenopatías, especialmente en la axila y fosa supraclavicular11. En cuanto a la caracterización de dichas adenopatías, permite distinguir ganglios reactivos de aquellos que presentan infiltración neoplásica74. Las adenopatías reactivas son ovaladas o triangulares y conservan el hilio de grasa, que incluso puede estar aumentado7. Las adenopatías malignas son redondas, hipoecogénicas y no conservan el hilio de grasa7. Cuando presentan irregularidades en sus márgenes, se debe sospechar diseminación extracapsular. Las adenopatías con infiltración por linfoma son redondas e hipoecogénicas, aunque de contornos bien definidos.
Costillas y esternónLa ecografía es útil en la detección de fracturas costales y esternón, y es más sensible que la radiografía convencional7,75. La aparición del fenómeno de la chimenea (chimney phenomenon) permite diagnosticar las fracturas en que no existe desplazamiento de los bordes. Este fenómeno consiste en la presencia de reverberaciones posteriores en el punto de fractura. La ecografía permite, además, diagnosticar complicaciones asociadas, ya sean leves, como los hematomas perióseos y desplazamiento de fragmentos76, o complejas, como hemotórax y neumotórax.
La ecografía permite asimismo la detección de metástasis costales, al demostrar la existencia de lesiones hipoecogénicas que sustituyen a la hiperecogenicidad normal de la cortical ósea76. No obstante, no es útil en la determinación de la afectación metastásica costal, al ser una exploración costosa y de larga duración77, por lo que su papel es el de guía para el intervencionismo sobre estas lesiones78.
DiafragmaLa exploración ecográfica del diafragma es dificultosa y, en condiciones normales, se realiza a través del abdomen79. Por este motivo el diafragma izquierdo es más difícil de valorar, ya que el estómago, que contiene aire, impide la transmisión del haz de ultrasonidos4.
Los defectos del diafragma, ya sean congénitos, traumáticos o por hernias, son de difícil evaluación ecográfica. Su visualización se ve favorecida cuando se asocian a derrame pleural, ya que el líquido actúa de ventana acústica.
La exploración ecográfica en tiempo real permite la visualización del movimiento del diafragma y su cuantificación. La parálisis frénica y el movimiento paradójico del diafragma son fácilmente observables mediante ecografía4,80, lo que evita la utilización de radiaciones ionizantes en pruebas como la escopia.
MediastinoEl mayor desarrollo de la ecografía mediastínica se ha producido en el ámbito de la cardiología, que no se trata en este artículo. Sin embargo, mediante abordajes supraesternal81 y paraesternal82 se puede acceder a determinadas áreas del mediastino, en especial al compartimiento anterior y a la ventana aortopulmonar47,83.
Aproximadamente el 75% de las masas del mediastino se encuentran en los compartimientos anterior y medio. Estos espacios son accesibles mediante ecografía, hecho que permite estudiar dichas masas mediastínicas y valorar la infiltración de vasos o la naturaleza quística de estas lesiones84.
Para la valoración de las adenopatías mediastínicas se han obtenido mejores resultados con la ecografía que con la radiología convencional85. La sensibilidad global de la ecografía para el estudio de adenopatías mediastínicas es del 62%, y asciende hasta el 72% si se consideran las regiones accesibles86.
La ecografía mediastínica tiene desventajas respecto a la TC y la resonancia magnética, como la incapacidad de visualizar todo el mediastino y la escasa especificidad en el estudio de masas mediastínicas no quísticas.
Las alteraciones del pericardio como derrames, infiltración tumoral o hemopericardio son fácilmente asequibles mediante ecografía87.
Contraste ecográficoLa existencia de un aporte arterial doble al pulmón hace que este órgano pueda evaluarse mediante ecografía con contraste88. El uso de contrastes ecográficos aumenta la especificidad de la técnica sobre la base de 2 parámetros: tiempo de captación y extensión de la captación. Con esta técnica se pueden confirmar los diagnósticos de pleuritis y embolia pulmonar periférica, caracterizar las consolidaciones secundarias a atelectasia, neumonía o tumor, y asistir en procedimientos intervencionistas88.
Intervencionismo con guía ecográficaToracocentesisLa ecografía es una técnica segura, rápida y eficaz de guía para la obtención de líquido pleural89–91, y permite obtener mejores resultados que los conseguidos por clínicos expertos92. En manos experimentadas, la punción con guía ecográfica presenta un 2–3% de complicaciones, número similar al de la guía por TC26. La toracocentesis con guía ecográfica es por ello una técnica segura, y puede realizarse en pacientes con ventilación mecánica93,94.
En el estudio del derrame pleural metastásico, la posibilidad de dirigir la punción hacia eventuales componentes pleurales sólidos, en ocasiones de muy pequeño tamaño, aumenta la tasa de diagnóstico obtenido exclusivamente con la aspiración de líquido95.
Drenaje pleuralLas técnicas de drenaje pleural pueden aplicarse mediante guía ecográfica, lo que permite colocar tubos de menor calibre con una mayor precisión. Estos procedimientos se han mostrado útiles en derrames paraneumónicos96,97, empiemas, derrames malignos y neumotórax. Con estos catéteres la tasa de complicaciones es menor que con los mayores23. La tasa de éxito en drenajes pleurales por derrames paraneumónicos oscila entre el 72 y el 88%23.
Biopsia pleuralLa ecografía también es útil en la obtención de muestras histológicas de lesiones pleurales, con una tasa de éxito del 80%98. En un estudio comparativo entre biopsia con guía ecográfica y la tradicional biopsia con aguja de Abrams sin guía, se demostraron mayores sensibilidad (70–86%) y especificidad (100%) para diagnósticos de malignidad y tuberculosis con la biopsia con guía ecográfica23,99. Con esta técnica también se han obtenido buenos resultados en el diagnóstico del mesotelioma maligno, con una sensibilidad del 61,5%, una especificidad del 100% y una precisión del 82,8%100, valores cercanos a los obtenidos mediante toracoscopia101.
Cáncer de pulmónLas neoplasias pulmonares que se encuentran en la periferia del pulmón y presentan contacto pleural son susceptibles de punción con guía ecográfica44, con una sensibilidad del 97% y una precisión del 98%. Se puede realizar la punción en nódulos a partir de 1 cm102,103, ya que la ecografía permite ver en tiempo real la punta de la aguja y confirmar su localización intralesional.
La ecografía también es útil en la punción de lesiones tumorales con necrosis central, ya que permite dirigir la aguja hacia las zonas sólidas, lo que aumenta la sensibilidad de la prueba.
En los tumores de Pancoast la punción guiada por TC se ve limitada por la localización de las lesiones. En estos casos el abordaje ecográfico en tiempo real permite accesos complejos (p. ej. supraclaviculares), al tiempo que la realización previa de una ecografía Doppler-color permite evitar la punción de las estructuras vasculares subclavias; con ello se consiguen tasas de éxito del 83%23.
En general, la punción de lesiones pulmonares periféricas mediante guía ecográfica es una técnica segura, con una tasa de complicaciones del 1–2% —las más frecuentes son el neumotórax y la hemoptisis—, la mayoría autolimitadas. Al igual que otras técnicas diagnósticas, permite detectar la aparición de neumotórax durante el procedimiento; si se produce antes de haber conseguido puncionar la lesión, la atenuación del sonido que produce la aparición de aire en la pleura impedirá la visualización de la lesión104, que se deberá abordar con otra técnica.
Neumonía y absceso pulmonarEn pacientes inmunocomprometidos puede ser de interés conocer el agente causal de la neumonía. En estos casos es de utilidad la punción ecoguiada, ya que permite evitar los grandes vasos intrapulmonares con la aplicación del Doppler-color44.
También se pueden puncionar para realizar un diagnóstico microbiológico los abscesos pulmonares, que se pueden drenar percutáneamente con guía ecográfica105, aunque algunos autores prefieren la guía mediante TC23.
MediastinoLa ecografía sirve de guía en la obtención de muestras citológicas o histológicas de adenopatías106 o masas localizadas en el mediastino anterior o superior107. Se puede usar un abordaje supraesternal108 o paraesternal109 y, al igual que en otras localizaciones, la exploración con Doppler-color permite evitar la punción de vasos mediastínicos.
ConclusionesLa ecografía es una herramienta útil en el diagnóstico y manejo de múltiples enfermedades torácicas. Es una exploración rápida, inocua —al no usar radiaciones ionizantes— y de bajo coste, que no requiere la movilización del paciente. Es superior a otras técnicas (radiografía, TC) en determinadas afecciones, y en otras aporta información complementaria.
Es una técnica aparentemente compleja, pero tras el entrenamiento y aprendizaje de los diferentes patrones ecográficos constituye una herramienta valiosa para el estudio de las enfermedades torácicas. Está en manos de neumólogos y radiólogos avanzar conjuntamente en el conocimiento de esta técnica e integrarla de forma progresiva en la práctica clínica diaria.