En los últimos años la llamada «medicina personalizada o de precisión» ha irrumpido con fuerza en el manejo de las enfermedades, entre ellas las respiratorias. La posibilidad de implantar esta forma de trabajar pasa indefectiblemente por el hallazgo y validación de biomarcadores biológicos que se relacionen bien con el diagnóstico, tratamiento o pronóstico de los pacientes respiratorios. En este sentido, la mayoría de enfermedades respiratorias o grupo de las mismas ya cuentan con biomarcadores biológicos de mayor o menor fiabilidad, y se están realizando un gran número de estudios en busca de nuevos de estos indicadores. El objetivo de la presente revisión es poner al día al lector y analizar la literatura científica existente sobre la existencia y validez diagnóstica, terapéutica o pronóstica de los biomarcadores biológicos más importantes en la actualidad en las principales enfermedades respiratorias, así como sobre los retos futuros en este sentido.
In recent years, personalized or precision medicine has made effective inroads into the management of diseases, including respiratory diseases. The route to implementing this approach must invariably start with the identification and validation of biological biomarkers that are closely related to the diagnosis, treatment, and prognosis of respiratory patients. In this respect, biological biomarkers of greater or lesser reliability have been identified for most respiratory diseases and disease classes, and a large number of studies are being conducted in the search for new indicators. The aim of this review is to update the reader and to analyze the existing scientific literature on the existence and diagnostic, therapeutic, and prognostic validity of the most important biological biomarkers in the main respiratory diseases, and to identify future challenges in this area.
Definidos como una característica medible que constituye un indicador de un proceso biológico normal o patogénico, o de la respuesta a una exposición o intervención1,2, los biomarcadores han adquirido un importante papel en el ámbito de la salud respiratoria como elemento clave para desarrollar un abordaje clínico que permita tratar a pacientes y no a enfermedades3. Para ello, requieren tener una alta especificidad para la enfermedad o evento que se pretende evaluar, ser fáciles de medir, tener un bajo coste, un buen rendimiento discriminativo y mayor rentabilidad que los indicadores utilizados en la práctica clínica convencional4,5.
En general, los biomarcadores se clasifican en función de su campo de aplicación o de su naturaleza4,5. Según el primer criterio, se diferencian biomarcadores diagnósticos, de monitorización, farmacodinámicos o de respuesta, predictivos, pronósticos, de seguridad, y de riesgo o susceptibilidad4.
Aunque las pruebas de imagen o la función pulmonar pueden proporcionar biomarcadores contrastados en el ámbito respiratorio, el desarrollo de los procedimientos «ómicos» constituyen su principal fuente. Así, se diferencian biomarcadores genómicos, transcriptómicos, proteómicos, metabolómicos y epigenéticos6–9. No obstante, también será necesario considerar biomarcadores digitales captados desde distintos dispositivos electrónicos10, que proporcionan información continua y durante periodos prácticamente indefinidos de medidas complejas relacionadas con la salud respiratoria.
Debido a la creciente expansión de este campo y a la progresiva importancia que están adquiriendo en el manejo de las enfermedades respiratorias, esta revisión tiene por objetivo evaluar críticamente las características, condiciones y aplicabilidad de los principales biomarcadores disponibles actualmente para el abordaje de pacientes con enfermedades respiratorias.
Biomarcadores en la enfermedad pulmonar obstructiva crónicaLa enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad heterogénea y responsable de una elevada carga de morbimortalidad11. Como enfermedad heterogénea, la predicción del pronóstico y la respuesta al tratamiento es difícil con base en datos exclusivamente clínicos o funcionales. Por ello, la búsqueda de biomarcadores aplicados a su diagnóstico, pronóstico y tratamiento ha sido uno de los campos de investigación y desarrollo más importantes en el que se han producido avances más relevantes en las últimas décadas.
En fase estable se conoce que los biomarcadores asociados a las vías inflamatorias dependientes de la interleucina (IL)-6, como la proteína C reactiva (PCR) y el fibrinógeno, se asocian con un incremento del riesgo de muerte por EPOC12, además de definir un patrón de mayor riesgo de exacerbaciones moderadas y graves13. Otros biomarcadores como el club cell protein 16 (CC16) y el soluble receptor for advanced glycation end products (sRAGE) han sido estudiados en diferentes cohortes, demostrando su asociación con la caída de la función pulmonar y con la progresión del enfisema, aunque de una magnitud pequeña14–16.
Los niveles en sangre de miR-320c, que inhiben la expresión de SERPINA1 en células hepáticas, están asociados con la presencia de enfermedad pulmonar en pacientes con diferentes niveles de Alfa1 antitripsina17. Asimismo, se ha demostrado que los pacientes con EPOC muestran una disminución en la expresión de SOD3 y de fibulina-5 en el intersticio pulmonar, y aquellos con enfisema tienen mayores niveles de miR-7 metilado18,19.
Probablemente el aspecto más interesante es el recuento de eosinófilos en sangre periférica como biomarcador de respuesta al tratamiento con corticoides inhalados (CI). La presencia de eosinófilos por encima de 300 células/mm3 define a los pacientes que más se benefician de incluir un CI en su tratamiento en términos de reducción de exacerbaciones. Este aspecto ha sido extensamente estudiado en muestras poblacionales y provenientes de ensayos clínicos20–26 y es un primer paso en la medicina de precisión en la EPOC27,28.
Biomarcadores en asmaEl asma también es un síndrome heterogéneo29 con un espectro fenoendotípico amplio en el que hay muchos mediadores implicados. De la misma forma que ocurre en la EPOC, esta variabilidad complica la obtención de un único biomarcador que ayude a predecir la gravedad, la evolución y la respuesta al tratamiento.
Los mediadores inflamatorios del asma pueden ser medidos en diferentes muestras corporales, incluidos el tracto respiratorio superior e inferior, la saliva, la orina y la sangre periférica30, si bien cada tipo de muestra presenta sus propias ventajas y limitaciones (tabla 1)31.
Ventajas y limitaciones de los diferentes métodos de muestreo de biomarcadores en asma
| Método | Biomarcador | Punto de corte | Ventajas | Limitaciones |
|---|---|---|---|---|
| Broncoscopia:- Biopsia- Lavado bronco-alveolar (BAL)- Cepillado bronquial | - Eosinófilos- Neutrófilos- Contaje total de células inflamatorias- Citoquinas- Falta de marcadores y mediadores- Remodelado de la vía aérea | Falta de puntos de corte claros | Lectura semi-directa | - Invasiva- Requiere personal experto- No es factible en enfermedades muy gravescon función pulmonar comprometida- Posible sesgo del sitio de la toma de muestras- Dilución (BAL) |
| Esputo inducido | - Eosinófilos- Neutrófilos- Contaje total de células inflamatorias- Citoquinas- Marcadores de activación de células- Falta de mediadores | En general, el corte de ≥3% se utiliza para indicar eosinofilia en esputo, y ≥61% para indicar neutrofilia en el esputo. Sin embargo, basado en el tratamiento adaptado a los eosinófilos del esputo se han establecido varios puntos de corte de eosinófilos, que van desde el 2 hasta el 8% | - Lectura semidirecta- Múltiples biomarcadores- Lectura reproducible- Método adecuado para el fenotipado de la enfermedad y seguimiento en centros especializados | -Semi-invasivo-Muestras analizables disponibles en aprox. 80-90% de los sujetos-Se necesita un protocolo adaptado para enfermedad grave con compromiso de la función pulmonar (contraindicado si FEV1<1L y/o con patología cardiovascular concomitante)- Procedimiento técnicamente complejo y lento, restringido a centros especializados |
| Sangre periférica | - Eosinófilos- Marcadores de activación celular- IgE (total / específica)- Citocinas y mediadores | Varios puntos de corte para los eosinófilos, que van principalmente de 150 a 500células/μL | Fácil de extraer | - Semi-invasivo- Lectura indirecta- Alta variabilidad diurna intraindividual- Los eosinófilos sanguíneos no reflejan adecuadamente la eosinofilia de las vías respiratorias durante el tratamiento con corticoides sistémicos |
| Aire espirado | - FeNO- Compuestos orgánicos volátiles (COVs) | Bajo:FeNO<25 ppb (≥12 años), <20 (<12 años), FeNO alto>50 (≥12 años), <35(<12 años) | - No invasivo- Método simple que permite repetir mediciones- Método adecuado para fenotipado y seguimiento- Lectura directa | - Varios factores alteran los niveles de FeNO- Falta de métodos estandarizados para recopilación y análisis de COVs |
| Condensado de aire espirado | - pH- Marcadores de estrés oxidativo- Leucotrienos- Citoquinas | No hay puntos de corte claros.Algunos estudios muestras que pH ≤7,20 se relaciona con asma mal controlada | - No invasivo- Permitemediciones seriadas | - Se necesita laboratorio especializado- Costoso- Resultados variables debido a cuestiones técnicas- Requiere un mayor desarrollo y validación |
Tomada y modificada de Diamant Z, et al31.
En la última década, se han identificado distintos mecanismos moleculares que se relacionan con los fenotipos clínicos del asma. Fundamentalmente se han descrito biomarcadores relacionados con el asma T232. Los eosinófilos en esputo son probablemente el biomarcador mejor caracterizado y más útil hasta ahora en asma T2. La técnica del esputo inducido es menos invasiva que la broncoscopia y permite muestras reproducibles de la inflamación de las vías respiratorias centrales, pero requiere mucho tiempo y una infraestructura considerable33. La utilidad de otros biomarcadores estudiados como la inmunoglobulina E (IgE), los eosinófilos en sangre, la medición de la fracción exhalada de óxido nítrico (FENO) o la periostina son biomarcadores aún controvertidos34,35. Así, aunque la eosinofilia sérica no siempre se correlaciona con la eosinofilia en esputo36, sí ha demostrado tener valor pronóstico de respuesta a los biológicos anti-IL5-IL-5Rα530, y diversos estudios parecen sustentar su utilidad como predictor de exacerbaciones37,38. También parece consolidarse la relación entre los niveles séricos de vitamina D con el control del asma y la incidencia de exacerbaciones39. La IgE sérica se utiliza para decidir la dosis de omalizumab, pero no existe relación entre la respuesta al tratamiento y los niveles de IgE40. La FENO se relaciona con la inflamación eosinofílica de la vía aérea, que puede ayudar al diagnóstico del asma41 y podría identificar a los respondedores a dupilumab42.
Otros marcadores identificables en suero como el CD26, asociado a las células T, o el CD14, asociado a los monocitos, proteínas del sistema Insulin-like Growth Factors, o factores identificables en el condensado exhalado como el ADN mitocondrial o nuclear, parecen prometedores para establecer fenoendotipos de asma, ya que parecen capaces de diferenciar asma alérgica de no alérgica, y se han asociado con la gravedad del asma y con el remodelado bronquial43–47.
Por separado, estos mediadores no tienen las cualidades del biomarcador ideal, por lo que probablemente el uso de paneles combinados podría mejorar la identificación de endotipos de asma.
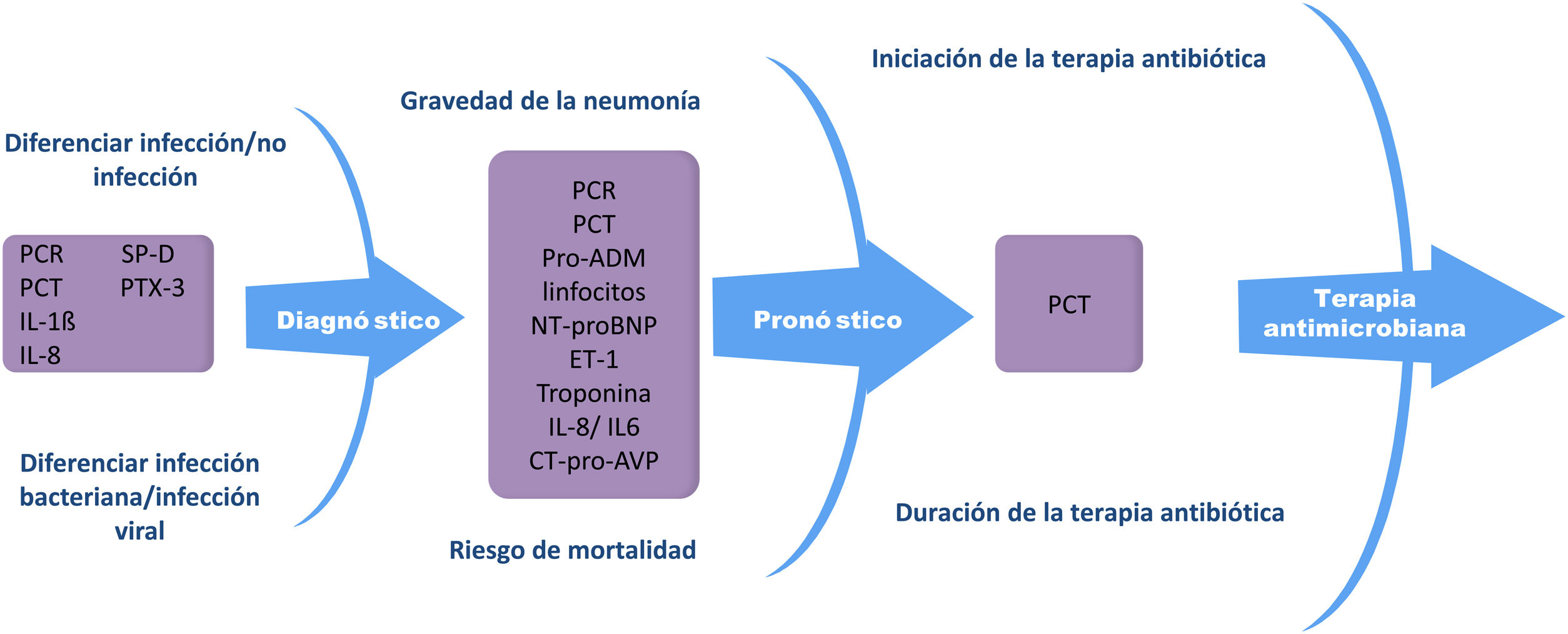
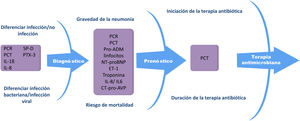
Biomarcadores en neumoníaLos biomarcadores tanto en la neumonía adquirida en la comunidad como en la nosocomial pueden ser utilizados tanto en el diagnóstico48 como en el tratamiento, dado que ayudan a la diferenciación entre una infección bacteriana o una viral49-56; en la identificacion y estratificación de pacientes con neumonía grave57-62; en la identificación de complicaciones neumónicas63,64, y el inicio y finalización del tratamiento antibiótico53,65-69 (fig. 1). Los biomarcadores aportan información relevante sobre la respuesta del huesped a la infección, así como sobre la actividad patogénica dentro del huesped, todo lo cual puede servir como información relevante junto con los parámetros clínicos en la toma de decisiones.
Biomarcadores en la neumonía
PCR: proteína C- reactiva; PCT: procalcitonina; SP-D: proteína del surfactante D; PTX-3: pentraxina3; pro-ADM: pro-adrenomedulina; NT-proBNP: N-terminal péptido natriurético tipo B; ET-1: endotelina-1; CT-pro-AVP: porción C-terminal de pro-arginina-vasopresina.
La procalcitonina (PCT) y la PCR siguen siendo los dos biomarcadores más comunmente utilizados en la neumonía52,67,70-72. En los últimos años, otros biomarcadores como la proadrenomodulina (pro-ADM)73,74, interleukina-6 (IL-6)75–77, interleukina-8 (IL-8), N-terminal péptido natriurético tipo B (NT-proBNP)61,78,79, porción C terminal de pro-arginina-vasopresina (CT-pro-AVP)80, pentraxina 3 (PTX-3)81,82, factor de crecimiento fibroblástico-21 (FGF-21)83, amiloide A sérico (SAA)78 y la proteína del surfactante D (SP-D)84 han sido evaluados, aunque aún son necesarios nuevos estudios para determinar su valor en la neumonía. La princial limitación para la implementación de los biomarcadores en la práctica clínica es la variabilidad de sus niveles, dado que pueden verse influenciados por diferentes factores como el estado inmunológico, la terapia inmunomoduladora, el propio patógeno, la gravedad de la enfermedad y el tiempo de medida del biomarcador con respecto al momento en el que se produce la infección85. Existe un elevado nivel de evidencia que sugiere que biomarcadores como PCR y PCT deben de ser considerados como una herramienta de ayuda en la toma de decisiones, y que su valor aumenta cuando son utilizados junto con los parámetros clínicos y los sistemas de puntuación de gravedad86–89. A pesar de que siguen existiendo muchos retos pendientes para el futuro en la investigación de los biomarcadores, estos pueden mejorar sustancialmente el manejo de los pacientes con neumonía.
Biomarcadores en bronquiectasias y fibrosis quísticaLa fibrosis quística y las bronquiectasias son enfermedades que se caracterizan por una elevada heterogeneidad y complejidad, tanto clínica como biológica, debido a que distintos mecanismos fisiopatológicos intervienen en su gravedad y pronóstico. Por ello, es de gran importancia disponer de biomarcadores que identifiquen fenotipos clínicos y endotipos moleculares de estos pacientes, con la intención de poder administrar tratamientos personalizados y dirigidos90,91.
Durante años, el biomarcador más utilizado y más asequible en la práctica clínica de estos pacientes ha sido la coloración del esputo. Este refleja la inflamación pulmonar, principalmente neutrofílica, y se ha utilizado como marcador de mal pronóstico92. Hoy en día, sin embargo, y gracias a un gran avance en la investigación, se han publicado múltiples estudios con el fin de encontrar biomarcadores cuantificables en sangre y pulmón con un papel diagnóstico, pronóstico o incluso terapéutico (tabla 2).
Principales biomarcadores en bronquiectasias y fibrosis quística y método de detección
| Categoría | Biomarcadores | Método de detección |
|---|---|---|
| Proteasas | Neutrófilo elastasa | ELISA, ELISA semicuantitativo neutrophil elastase airway test stick – NEATstik |
| Metaloproteasas | ELISA | |
| Mucinas | MUC5AC y MUC5AB | ELISA, cromatografía |
| Proteínas y péptidos antimicrobianos | LL-37, SLPI, Lactoferrina, Lisozima | ELISA |
| Microbiología | Carga bacteriana pulmonar | Cultivo microbiológico (semicuantitativo), qPCR (cuantitativo) |
| Disbiosis pulmonar | Microbioma (16s ARN) | |
| Inflamación sistémica | Glóbulos blancos, neutrófilos, plaquetas y velocidad de sedimentación globular | Hemograma, citometría de flujo |
| PCR, TNF-α | ELISA |
ELISA: ensayo por inmunoabsorción ligado a enzimas; qPCR: reacción en cadena de polimerasa cuantitativa; SLPI: inhibidor de proteasas leucocitarias; PCR: Proteina C Reactiva; TNF-α: factor de necrosis tumoral alpha.
Las proteasas pulmonares han sido los biomarcadores más estudiados en ambas enfermedades, por su papel clave en el mantenimiento de la inflamación y del daño pulmonar en estos pacientes93. Entre ellos, destaca la neutrófilo elastasa, que ha demostrado ser un potente marcador de pronóstico y gravedad, así como una buena diana terapéutica en pacientes con bronquiectasias94,95. Es importante señalar que los biomarcadores estudiados no solo derivan de la respuesta del huésped frente a la inflamación o la infección bronquial que muchas veces asocian, sino que también pueden actuar como biomarcadores algunas características de la infección como son la carga bacteriana y la disbiosis pulmonar, que se han asociado también a gravedad y respuesta al tratamiento96,97.
Finalmente, cabe destacar que, aunque la respuesta inflamatoria en estos pacientes tiene un claro predominio a nivel pulmonar, diversos biomarcadores sanguíneos como la PCR o el TNF-α han demostrado también su relación con el pronóstico de la enfermedad98, y su estudio puede ser de gran utilidad, ya que facilitan mucho su aplicación en la práctica clínica habitual.
Biomarcadores en fibrosis pulmonar idiopática y otras enfermedades pulmonares intersticialesLos estudios sobre el descubrimiento de nuevos biomarcadores en la fibrosis pulmonar idiopática y otras enfermedades pulmonares intersticiales han sido los predominantes en las investigaciones realizadas sobre este grupo de enfermedades en la última década99-103. Actualmente, los únicos biomarcadores recomendados en la práctica clínica son las pruebas de función pulmonar (LFT), los hallazgos radiológicos en tomografía computarizada de tórax de alta resolución (HRCT) o el análisis histológico104,105. El mayor reto para el futuro en este sentido se basa en encontrar biomarcadores biológicos que ayuden en el diagnóstico y pronóstico de estas enfermedades, dado que el curso de las mismas es muy variable, y en ocasiones supone una gran dificultad poder llegar a un diagnóstico de certeza sin la utilizacdión de pruebas invasivas106. Además, no hay que olvidar, que están apareciendo en el mercado nuevas opciones terapéuticas para la IPF107, por lo que el desarrollo de biomarcadores que ayuden a evaluar la respuesta a estos tratamientos será de enorme importancia108,109.
Están siendo exploradas cuatro áreas de investigación basadas en la patogénesis de la fibrosis pulmonar: disfunción/daño epitelial, expresión de la matriz extracelular, regulación del sistema inmune y genético. En la tabla 3 se observan los biomarcadores más importantes investigados en el área de las enfermedades pulmonares intersticiales. Actualmente, ninguno de estos prometedores biomarcadores han probado tener un valor diagnóstico significativo, dado que no son capaces de diferenciar entre las diferentes enfermedades intersticiales pulmonares, ni presentan tampoco mayor valor pronóstico que las LFT, pero es posible que exista un brillante devenir para estos biomarcadores en futuros estudios, y que finalmente se pueda encontrar el valor de estas moléculas en el diagnóstico de las enfermedades pulmonares intersticiales.
Principales biomarcadores serológicos en fibrosis pulmonar idiopática y otras enfermedades pulmonares intersticiales
| Biomarcadores de fibrosis pulmonar | |||
|---|---|---|---|
| Daño epitelial | Matriz extracelular | Sistema inmune | Genética |
| KL6, SP-A, SP-D, CC16, YKL40 | MMP1, MMP7, LOXL2 | CCL18, IL-6, Osteopontina | Polimorfismos MUC5B, alteraciones telómeros |
KL6: Krebs von den Lungen-6; SP-A: proteína del surfactante A; SP-D: proteína del surfactante D; CCL16: ligando de quimioquina 16; YKL40: proteína quitinasa-3-similar-1; MMP-1: matriz metaloproteinasa 1; MMP-7: matriz metaloproteinasa 7; LOXL2: lisil oxidasa-homólogo 2; CCL18: ligando de quimioquina 18; IL-6: interleucina 6; MUC5B: mucina 5B.
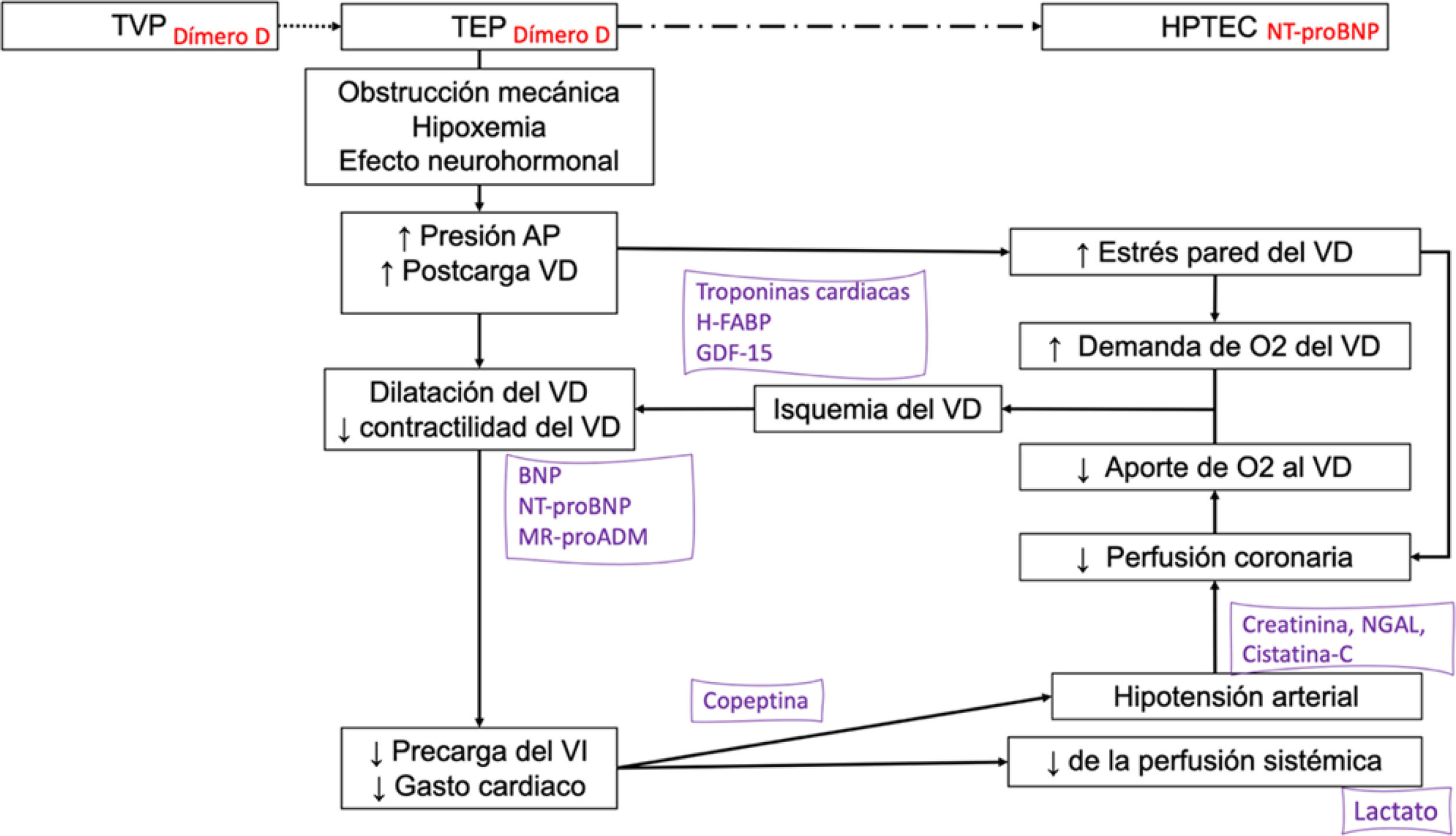
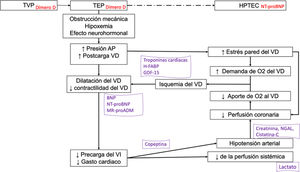
En la tromboembolia de pulmón (TEP), los biomarcadores sanguíneos permiten optimizar su manejo diagnóstico-terapéutico (fig. 2).
Biomarcadores en la fisiopatogenia de la tromboembolia pulmonar aguda. Los biomarcadores son posicionados en el esquema de acuerdo con el mecanismo fisiopatológico que expresan y según la utilidad diagnóstica (en rojo) o pronóstica (en morado).
AP: arteria pulmonar; BNP: péptido natriurético tipo B; H-FABP: proteína ligadora de ácidos grasos cardiacos; GDF-15: factor de diferenciación de crecimiento 15; HPTEC: hipertensión pulmonar tromboembólica crónica; LMR: relación linfocito-monocito; MR-proADM: región media de la proadrenomedulina; NGAL: lipocalina asociada con la gelatinasa de neutrófilos; NLR: relación neutrófilo-linfocito; NT-proBNP: fragmento amino-terminal del proBNP; O2: oxígeno; PLR: relación plaqueta-linfocito; pO2: presión arterial de oxígeno; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda; VD: ventrículo derecho; VI: ventrículo izquierdo.
El dímero D tiene utilidad diagnóstica en la TEP por su alto valor predictivo negativo, que permite excluir el diagnóstico en pacientes con probabilidad clínica baja o moderada de TEP, o TEP clínicamente improbable110–114. Además, en el seguimiento, los niveles elevados de dímero D se asocian a un mayor riesgo de recurrencia trombótica tras suspender la anticoagulación115–117. También resultó de utilidad para excluir TEP en pacientes con neumonía por COVID-19, aunque con puntos de corte de dímero D diferentes a los utilizados en la práctica clínica habitual con pacientes sin infección por SARS-CoV-2118.
Diversos biomarcadores sanguíneos presentan utilidad pronóstica, y combinados con parámetros clínicos y de imagen permiten estratificar el riesgo110,112. Los efectos deletéreos de la TEP sobre el ventrículo derecho (VD) son determinantes en el pronóstico durante la fase aguda. Entre los marcadores de daño miocárdico destacan las troponinas cardiacas y la proteína ligadora de ácidos grasos cardiacos (H-FABP)119–122. Los principales biomarcadores sanguíneos de disfunción VD son el péptido natriurético tipo B (BNP) y su fragmento amino-terminal (nT-proBNP). Estos biomarcadores cardiacos son particularmente útiles por su capacidad para excluir una evolución precoz desfavorable123,124. La adición de otros biomarcadores pronósticos, como la copeptina125, el lactato126, la creatinina sérica127, el sodio plasmático128, la cistatina C y la lipocalina asociada con la gelatinasa de neutrófilos129, podrían ayudar a predecir mejor el pronóstico de pacientes con TEP aguda. Algunos parámetros analíticos rutinarios se han asociado a un mayor riesgo de neoplasia maligna oculta al diagnóstico de la TEP, incluyendo la presencia de anemia, el recuento elevado de plaquetas y leucocitos, y los niveles de dímero D superiores a 4.000 ng/mL130–133.
Finalmente, otros biomarcadores sanguíneos en investigación podrían resultar útiles en la TEP: determinados marcadores inflamatorios (IL-6)134 y relaciones neutrófilo-linfocito, plaqueta-linfocito135 y linfocito-monocito136, el factor de diferenciación de crecimiento 15 (GDF-15)137, la región media de la proadrenomedulina138, determinados micro-ARNs circulantes139–141 y el microbioma142.
Biomarcadores en hipertensión pulmonarEl pronóstico en la hipertensión arterial pulmonar (HAP) viene determinado por la interacción fisiopatológica entre el ritmo de progresión de los cambios obstructivos en la microcirculación pulmonar y la respuesta adaptativa del ventrículo derecho (VD). Los mecanismos fisiopatológicos de la HAP incluyen: la vasoconstricción, la proliferación del músculo liso, la inflamación, la apoptosis endotelial, la proliferación endotelial resistente a la apoptosis, la fibrosis, la trombosis in situ y, finalmente, lesiones plexiformes, que son una proliferación de células endoteliales que parecen tener un origen monoclonal143,144.
Cada vez se ha descrito un mayor número de biomarcadores de la HAP que puedan ser de utilidad para establecer el pronóstico como marcadores de disfunción y lesión miocárdica, inflamación, disfunción y proliferación vascular, coagulación y actividad plaquetaria, hipoxia y daño tisular145–150 (tabla 4).
Utilidad de algunos biomarcadores en el diagnóstico, tratamiento y seguimiento de los pacientes con hipertensión pulmonar
| 1. Identificar población de pacientes en riesgo de hipertensión arterial pulmonar (PE Esclerosis Sistémica): NT-proBNP, UA, PIM-147. |
| 2. Progresión de la enfermedad y respuesta al tratamiento: BNP, NT-proBNP, ET-1, Ang-2, ADM, PaCO2. |
| 3. Identificar pacientes en insuficiencia cardiaca derecha: BNP, NT-proBNP, TnI, OPN. |
| 4. Pronóstico en HAP: BNP, NT-proBNP, TnT, IL-6, IL-8, IL-10, IL-12p70, PCR, OPN, ADMA, vWF, PaCO2, UA, función renal, Na, copeptina, bilirubina. |
ADM: adrenomedulina; ADMA: dimetilarginna asimétrica. Ang: angiopoietina; ANP: péptido natriurético atrial; BNP: péptido natriurético cerebral; BUN: nitrógeno de urea en sangre; CRP: proteína C reactiva; CysC: cystatin C; ET-1: endotelina 1; GDF-15: factor de diferenciación del crecimiento 15; H-FABP: heart-type fatty binding protein; IL: interleukin; MiRNA: microRNA; MPV: volumen plaquetario medio; Na: sodio; NT-proBNP: N-terminal propeptido natriurético cerebral; OPN: osteopontin; PIM-1: provirus integration site for Moloney murine leukemia virus; PLC: contaje de plaquetas; TnI: troponina I; TnT: troponina T; UA: acido úrico; VSMCs: vascular smooth muscle cells; vWF: Factor von Willebrand.
El cáncer de pulmón (CP) es la causa más frecuente de mortalidad por cáncer151. Se han identificado diversos biomarcardores, desde algunos fácilmente disponibles como la albúmina sérica o el recuento plaquetario152,153, hasta otros de obtención más compleja como mutaciones genéticas o el estudio del microbioma de la vía aérea154–156.
En los pacientes con CP no microcítico con lesiones genéticas específicas, la terapia dirigida adecuadamente mejora los resultados del tratamiento, en comparación con la quimioterapia estándar. Resulta relevante determinar alteraciones moleculares diana del receptor de factores de crecimiento epidérmico (EGFR), linfoma quinasa anaplásico (ALK), proto-oncogen 1 (ROS 1), proto-oncogen B-Raf (BRAF), receptor de tirosin kinasa (NTRK) y puntos de control inmunitario programados de muerte celular-1 (PD-1) y/o muerte celular programada-1 ligando (PD-L1), así como carga mutacional tumoral157,158. El número de biomarcadores de tratamiento está aumentando, por lo que en las formas avanzadas no solo se incluyen aquellos asociados con medicamentos aprobados, sino también con otros fármacos en investigación. Hemos de tener en cuenta que existen datos procedentes de next generation sequencing (NGS), en los que se pueden apreciar cambios y nuevos biomarcadores con implicaciones terapéuticas y pronósticas. Además, cada vez existen más avances en la aplicación de biomarcadores en combinación con modelos clínicos en la selección de los pacientes susceptibles de entrar en un programa de cribado y en el manejo de los nódulos pulmonares incidentales. Existen resultados prometedores con varios biomarcadores explorados en sangre y otros fluidos159–167. Varios paneles de biomarcadores multianalíticos están disponibles y han mostrado rendimiento en la clasificación de nódulos pulmonares indeterminados164–167. Sin embargo, estos paneles deben utilizarse en un contexto clínico adecuado y precisan una validación más amplia.
Biomarcadores en el derrame pleuralEl análisis del líquido pleural (LP) permite orientar el diagnóstico etiológico del derrame pleural (DP) de forma rápida e incruenta al estudiar los diferentes biomarcadores. En el caso de la insuficiencia cardiaca, el NT-proBNP168 en LP presenta una alta sensibilidad a la hora de establecer la causa, sobre todo en aquellas situaciones en las que no se cumplen los criterios de Light. En lo que se refiere a los derrames pleurales infecciosos, no existe un biomarcador tan eficaz como el pH o la glucosa que nos permita tomar decisiones en el manejo del derrame pleural paraneumónico (DPPN)169. En DP secundario a tuberculosis, se han estudiado multitud de biomarcadores, pero la adenosindeaminasa (ADA)170 continúa siendo el más sensible para distinguir el derrame pleural tuberculoso (DPTB) cuando sus niveles son mayores a 35 UI/L. En el caso del derrame pleural maligno (DPM) han sido muchos los biomarcadores estudiados, aunque hasta la fecha es necesario el estudio citohistológico para confirmar la etiología maligna del DP. Algunos de estos biomarcadores nos permiten clasificar inicialmente la etiología del DP, siendo la calprotectina171 el más eficaz para distinguirlo de los DP benignos. Otros marcadores tumorales validados en plasma, como el CEA o CA15.3, nos permiten orientar el origen del DPM. Un caso particular lo constituyen los nuevos biomarcadores moleculares, que permiten definir dianas terapéuticas e individualizar el tratamiento del CP; estos son, por ejemplo, el EGFR, PDL1, ROS1 o ALK172. Su determinación en LP resulta ser igualmente eficaz que en tejido tumoral, evitando así la realización de técnicas invasivas.
Biomarcadores en apnea del sueñoLa apnea obstructiva del sueño (AOS) es un trastorno respiratorio caracterizado por la oclusión total o parcial de la vía aérea durante el sueño, que provoca fragmentación del mismo, cambios en la presión intratorácica y episodios de hipoxia-reoxigenación. Estos eventos ocurren de forma repetida durante el sueño e inducen la activación de mecanismos intermedios que se relacionan con consecuencias fisiopatológicas de la AOS, tales como activación simpática, disfunción endotelial, hipercoagulabilidad, estrés oxidativo, inflamación y desregulación metabólica. Se ha estimado que entre un 35 y 40% de la variabilidad en la manifestación de esta enfermedad es atribuible a factores genéticos173. Se ha postulado que variantes genéticas asociadas con la estructura craneofacial, la distribución de la grasa corporal y el control neuronal de los músculos de las vías respiratorias superiores, contribuirían en la manifestación de distintos fenotipos de la AOS.
Numerosos estudios han explorado la utilidad de distintos biomarcadores para el diagnóstico y pronóstico de la AOS. En adultos, el análisis combinado de la hemoglobina glicosilada (HbA1c), la PCR y la eritropoyetina (EPO) ha mostrado su utilidad para el screening de la AOS174. Además, IL-6 e IL-10 detectados en muestras de sangre han demostrado ser biomarcadores robustos para el diagnóstico de esta enfermedad175. Asimismo, los micro-ARNs han surgido recientemente como candidatos potenciales a biomarcadores para el diagnóstico176,177 y predicción de respuesta al tratamiento con CPAP en pacientes con hipertensión resistente y AOS178. En población infantil, la combinación de calicreína-1, uromodulina, urocortina-3 y orosomucoide-1 evaluadas en muestras de orina demostró una precisión diagnóstica excelente179. También, el análisis de neurotransmisores en orina demostró su utilidad como biomarcadores para el diagnóstico de la AOS180.
Se han identificado biomarcadores relacionados con los procesos fisiopatológicos de la AOS, principalmente aquellos asociados a activación simpática (catecolaminas)180, disfunción endotelial (óxido nítrico y moléculas de adhesión tales como proteínas de adhesión celular vascular y de adhesión intercelular181,182, hipercoagulabilidad183,184, estrés oxidativo (ROS, isoprostano185, malondialdehído)186, inflamación187 (HIF-1α, NF-κß, IL-6 y TNF-α) y desregulación metabólica. Recientemente, se ha sugerido que la AOS se asocia con una mayor prevalencia, incidencia y mortalidad del cáncer. Así, la AOS se relaciona con niveles circulantes elevados de VCAM-1, que podrían indicar su contribución a la tumorogénesis a través de la adhesión basada en integrinas188. También se ha informado del papel del PD-L1 soluble como potencial biomarcador de agresividad y metástasis en pacientes con melanoma cutáneo y AOS189.
Biomarcadores en enfermedades sistémicas con repercusión pulomonarLa enfermedad pulmonar intersticial difusa (EPID) es una de las principales causas de morbimortalidad en las enfermedades autoinmunes sistémicas (EAS). Dentro de este grupo es especialmente frecuente en la artritis reumatoide (AR), la esclerosis sistémica (ES) y en las miopatías190.
Los autoanticuerpos séricos son actualmente los únicos biomarcadores disponibles en la práctica clínica para el diagnóstico y la clasificación de las EAS191. Los anticuerpos anti-Scl-70 / antitopoisomerasa I, anti U3-RNP y anti Th/To pueden identificar a aquellos pacientes con riesgo de desarrollar ES-EPID192.
En la AR, la edad avanzada, género masculino, antecedentes de tabaquismo y seropositividad al factor reumatoide (FR) o del anticuerpo del péptido citrulinado cíclico (ACPA) son factores de riesgo para EPID. También otros anticuerpos contra proteínas carbamiladas y anticuerpos contra las peptidil arginina deaminasas (anti-PAD)193.
La silicosis también se ha relacionado con una mayor incidencia de enfermedades reumatológicas autoinmunes sistémicas194.
Entre las miopatías se pueden detectar varios anticuerpos con mayor predisposición a desarrollar EPID. Es el caso de ARN sintetasas de transferencia antiaminoacilo (antisintetasas) y anti-CADM-140 (MDA5/IFIH1). En los pacientes antisintetasa positivo, la EPID se manifiesta de forma subaguda y es especialmente agresiva en el caso de la miopatía MDA5195.
En los últimos años se han producido avances en la búsqueda de otros biomarcadores diferentes a los autoanticuerpos como proteínas secretadas por las células epiteliales alveolares, las citocinas inflamatorias y las quimiocinas. IL-6, IL-8, IL-10, CCL2, CXCL10, CX3CL1, factor de crecimiento de fibroblastos 2 (FGF-2) y factor de crecimiento endotelial vascular, KL-6 y SP-D se han asociado a presencia o progresión de la EPID en diferentes EAS196,197 (tabla 5)
Posibles biomarcadores séricos relacionados con la progresión de EPID asociada a enfermedades sistémicas
| Enfermedad sistémica | Biomarcadores |
|---|---|
| Esclerosis sístémica | - Anti - topoisomerasa - 1 Ab (Scl - 70)- Anti - U11 / U12 RNP Ab- Patrón de tinción de Ab nucleolar antinuclear (indica anti-Th / To, U3 RNP)- Proteína C-reactiva- IL-6 e IL-10- CCL2 (MCP - 1), CXCL4, CCL18- KL-6- SP-D |
| Artritis reumatoide | - Factor reumatoide- ACPA, anti-PAD y anti-carbamilados- HLA-DRB1- MMP-7- KL6- PARC- SP-D- Proteína inducible por interferón-γ 10 (IP-10 CXCL10) |
| Dermato/polimiositis | - ARN sintetasas de transferencia anti-aminoacilo (anti-sintetasas)- Anti-CADM-140 (MDA5 / IFIH1)- Ferritina- PCR- KL6 |
| Síndrome sjögren | - Anticuerpos anti-Ro 52/SS-A- KL6- Proteína angiopoyentina 2 (Angptl2) |
| Lupus eritematoso sistémico | - Antígenos nucleares extraíbles (ENA) |
IL-6: interleukina 6; IL-10: interleukina 10; CCL: ligando de quimioquina; MCP1: proteína quimioatrayente de monocitos 1; CXCL4: ligando de quimiocina 4; KL6: Krebs von den Lungen-6; SP-D: proteína del surfactante D; ACPA: anticuerpos anti-citrulina; PAD: peptidil arginina deaminasa; MMP-7: matrix metaloproteinasa 7; PARC: quimiocina pulmonar y regulada por activación; IFIH1: interferón inducido con helicasa C Dominio 1 (Interferon Induced With Helicase C Domain 1); CADM: dermatomiosis amiopática (clinically amyopathic dermatomyositis); MDA5: proteína 5 asociada a diferenciación de melanoma; ARN: ácido ribonucleico; PCR: proteína C reactiva.
La práctica de una medicina de precisión que consiga un tratamiento personalizado pasa, sin lugar a dudas, por el descubrimiento de marcadores, especialmente biológicos. Estos marcadores deben ser idealmente fáciles de implementar en la práctica clínica, fáciles de interpretar, baratos, sensibles y específicos para una determinada enfermedad (en este caso del ámbito neumológico), y que cumplan una función diagnóstica, pronóstica y/o de identificación de respuesta al tratamiento. Aunque la evolución científica en el descubrimiento de estos biomarcadores es muy dispar, según la enfermedad pulmonar de la que se trate, en los últimos años este tema ha despertado un interés importante, lo que hace presagiar que en un futuro no muy lejano seremos capaces de encontrar algunos de estos biomarcadores biológicos que nos ayudarán a encontrar homogeneidad en la heterogeneidad que hoy aún gobierna en gran parte de las enfermedades del sistema respiratorio.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores del presente manuscrito declaran no tener ningún conflicto de interés relativo al mismo.