La evidencia disponible sobre la rentabilidad diagnóstica y la seguridad de la criobiopsia pleural (CB) está basada en una serie de estudios que presentan casuísticas limitadas y diferentes diseños. Un análisis agrupado de los mismos podría mejorarla y aportar una visión global de esta novedosa técnica.
MetodologíaRevisión sistemática y metaanálisis de los estudios publicados en los que se incluían resultados sobre rendimiento y seguridad diagnóstica de la CB pleural comparados con la realizada con pinzas flexibles convencionales. Se evaluó la heterogeneidad del análisis determinando el índice I2 y la calidad de los estudios mediante la herramienta QUADAS-2.
ResultadosPara la evaluación final se incluyeron 7 trabajos con 356 pacientes. En el 55,6% el derrame pleural fue de etiología maligna, 61,1% de ellos cáncer de pulmón. La rentabilidad diagnóstica de la CB pleural fue del 95% (IC 95% 92-97) frente al 91% (IC 95% 87-94) con las pinzas flexibles convencionales (p=0,019). Se describió sangrado leve en el 67% (IC 95% 62-72) de las CB frente al 85% (IC 95% 79-90) de las realizadas con pinzas flexibles convencionales (p<0,001). El tamaño de las muestras de CB fue superior y el porcentaje de artefactos menor. No fue posible realizar un análisis agrupado en la evaluación de la detección de alteraciones moleculares. La heterogeneidad observada fue moderada-alta, aunque la calidad de los estudios fue aceptable.
ConclusionesLa CB pleural es una técnica segura y con elevada rentabilidad para el diagnóstico etiológico del derrame pleural, obteniéndose muestras de mayor tamaño con menos artefactos. Son necesarios más estudios sobre determinaciones moleculares.
Current evidence on the diagnostic yield and safety of pleural cryobiopsy (CB) is based on a series of heterogeneous studies with limited cohorts. A pooled analysis of these studies could improve the evidence and contribute to a better understanding of this new technique.
MethodologyWe performed a systematic review and meta-analysis of published studies that included data on the yield and diagnostic safety of pleural CB compared with procedures performed using conventional flexible forceps. The heterogeneity of the analysis was evaluated by determining the I2 index, while study quality was measured with the QUADAS-2 tool.
ResultsSeven studies involving 356 patients were used for the final evaluation. In 55.6%, the etiology of the pleural effusion was malignant, 61.1% of which were lung cancer. The diagnostic yield of pleural CB was 95% (95% CI 92-97) vs. 91% (95% CI 87-94) with conventional flexible forceps (P=.019). Mild bleeding was reported in 67% of CB procedures (95% CI 62-72) compared with 85% of conventional flexible forceps procedures (95% CI 79-90) (P<.001). CB specimens were larger, and fewer artifacts were detected. A pooled analysis of the detection of molecular changes could not be performed. Heterogeneity was moderate to high, although the quality of the studies was acceptable.
ConclusionsPleural CB is a safe technique with a high yield for etiological diagnosis of pleural effusion, and larger specimens with fewer artifacts are obtained. Molecular determinations should be investigated in more depth.
La toracoscopia médica (TM), también denominada pleuroscopia o toracoscopia con anestesia local, es una técnica mínimamente invasiva que permite examinar el espacio pleural y realizar biopsias dirigidas de la pleura parietal1–3. Es considerada la técnica de elección en el diagnóstico del derrame pleural (DP) con criterios de exudado de etiología incierta4,5. En una revisión publicada en 2010 que incluyó múltiples series de casos, la TM con biopsia pleural mediante pinzas convencionales tenía una sensibilidad del 92,6% para el diagnóstico de DP maligno3. La TM puede ser realizada con toracoscopio rígido o pleuroscopio semirrígido1–3. El resultado de los principales estudios que comparan la rentabilidad diagnóstica entre TM rígida y semirrígida han demostrado que no existen diferencias significativas entre ambas técnicas6–8. Sin embargo, cuando la toracoscopia se hace con el pleuroscopio semirrígido deben hacerse entre 6-8 biopsias debido a su menor tamaño1–3. Actualmente es una técnica en expansión que se considera segura, dado que el porcentaje de complicaciones graves es menor del 5%1,3,9,10. Sin embargo, sobre todo en la afectación neoplásica pleural, la eficacia diagnóstica y la seguridad descrita no han sido uniformes en todos los estudios3,9,10, lo que, añadido a que cada vez es necesario disponer de muestras histológicas de mayor tamaño para la caracterización molecular de los tumores11, ha potenciado el desarrollo de nuevas técnicas de biopsia pleural como es el caso de la criobiopsia (CB). Inicialmente, la CB fue descrita como una técnica endoscópica de elevada rentabilidad diagnóstica y segura para el diagnóstico de tumores endobronquiales y más recientemente en el estudio de la enfermedad pulmonar intersticial12,13. En el estudio del DP, su validez y seguridad han sido publicadas por varios grupos, aunque estos estudios presentan casuísticas limitadas y diferentes diseños14, lo que al menos de forma individual limita su evidencia científica. De hecho, estas nuevas técnicas de biopsia pleural no se incluyen en las guías de práctica clínica4,5.
En este contexto, creemos que parece oportuno revisar la evidencia disponible sobre este tema realizando un análisis sistemático agrupado de la literatura publicada sobre la rentabilidad diagnóstica y la seguridad de la CB de la pleura parietal en el diagnóstico del DP frente a la biopsia mediante pinza flexible convencional (PFC), y evaluar algunos aspectos como la implantación de esta novedosa técnica diagnóstica en la práctica clínica habitual. Con estos objetivos se llevó a cabo el presente estudio.
MétodosSe realizó una revisión sistemática y un posterior metaanálisis de la evidencia existente desde enero de 2010 hasta mayo de 2019 siguiendo las recomendaciones de la declaración PRISMA para revisiones y metaanálisis. Se realizó una búsqueda bibliográfica en las bases de datos electrónicas PubMed (MEDLINE), Embase, The Cochrane Library, Web of Science y TheClinicalTrials.gov en relación con la CB pleural durante la TM. Los términos utilizados en la búsqueda fueron: «semi-rigid pleuroscopy», «rigid thoracoscopy», «medical thoracoscopy», «cryobiopsy», «pleural effusion», «cryoprobe biopsy». Se realizó también una búsqueda manual para evitar la pérdida de estudios o revisiones no seleccionadas de forma electrónica. Se incluyeron en la búsqueda metaanálisis y revisiones sistemáticas, estudios aleatorizados, de cohortes, de casos y controles y series de casos en los que se describía en sus resultados la rentabilidad de la CB pleural en el estudio del DP durante la TM. Se excluyeron aquellos estudios con menos de 10 pacientes o casos clínicos aislados. La búsqueda no se limitó a ningún idioma.
La revisión sistemática se complementó con el análisis de las referencias bibliográficas de los estudios incluidos y las principales guías de práctica clínica.
Dos autores (MBR y CMR) seleccionaron de forma independiente los resúmenes para determinar su elegibilidad y excluyeron los estudios que no cumplían con los criterios de inclusión. Las discrepancias fueron resueltas mediante la discusión con un tercer autor (AFV). Los estudios elegibles se obtuvieron en formato completo y fueron revisados de forma independiente por los 2 autores (MBR y CMR).
La información relevante de cada uno de los estudios se recogió mediante tablas de evidencia.
Las principales variables analizadas fueron la rentabilidad diagnóstica de las muestras de pleura parietal obtenidas mediante criosonda frente a las obtenidas con PFC. La rentabilidad fue calculada dividiendo el número de sujetos en quienes las biopsias mostraban hallazgos histológicos definitivos (incluyendo pleuritis inespecífica) por el diagnóstico final del paciente. Como variable principal se registraron también las complicaciones, como el grado de sangrado de la CB y la PFC o de dolor debido al procedimiento. Se consideró sangrado leve aquel autolimitado, moderado cuando era necesario el uso de fármacos vasoactivos de forma tópica (adrenalina) y grave cuando requería intervención con electrocauterio o argón plasma1,3.
Como variables secundarias se definieron el tamaño medio de las CB (en mm), el grado de profundidad de la muestra obtenida y el grado de artefactos de las muestras definidos por el nivel de aplastamiento que afectaba a más del 25% de su área o la interpretabilidad, así como el grado de integridad14.
Con respecto al procedimiento, se analizó el tiempo de congelación de la criosonda (en segundos) y la duración de la prueba.
Como variable secundaria se analizó también la rentabilidad en el diagnóstico molecular de la CB en el DP maligno por cáncer de pulmón.
De forma general se describieron además las características clinicoepidemiológicas de los pacientes (edad, sexo) y la etiología específica del DP benigno y maligno.
La calidad de los estudios fue valorada siguiendo los niveles de evidencia y grados de recomendación descritos en las guías científicas15 y para la redacción de este manuscrito se comprobaron 27 ítems de la declaración PRISMA para revisiones sistemáticas y metaanálisis16. Además, se realizó un resumen de los resultados de la evaluación QUADAS-2 de todos los estudios que fueron incluidos en esta revisión sistemática y metaanálisis.
Se estimaron las proporciones y los intervalos de confianza al 95% (IC 95%) de la rentabilidad diagnóstica y de las complicaciones, concretamente del sangrado, de la criosonda y de la PFC de cada uno de los estudios y de forma conjunta. Esta información se mostró mediante forest plots elaborados con la librería «meta» del software estadístico R 3.4.2. La heterogeneidad entre los resultados de los estudios se evaluó mediante la prueba estadística Q de Cochran y el estadístico I2. Se consideró que existía heterogeneidad significativa si I2 era>50% y/o p<0,1.
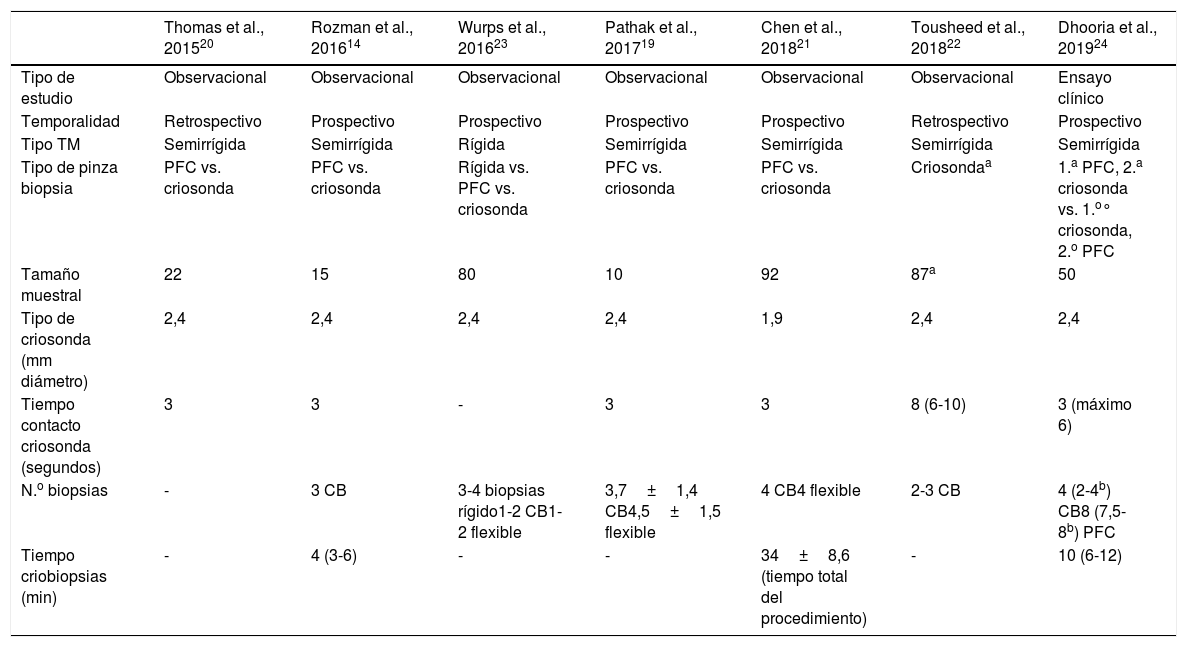
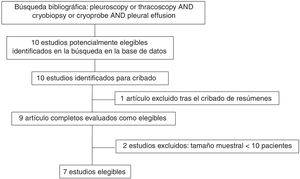
ResultadosDescripción general de los estudios revisadosObtuvimos 10 estudios potencialmente elegibles e identificados para cribado. Un artículo fue excluido tras la lectura del resumen y 9 fueron leídos a texto completo. Después de revisar detenidamente el texto completo, 2 estudios fueron excluidos por incluir menos de 10 pacientes17,18, por lo que finalmente se incluyeron 7 trabajos en el análisis agrupado14,19–24. La figura 1 muestra el diagrama de flujo del trabajo y la tabla 1, las características generales y los aspectos del procedimiento de los estudios. Cuatro fueron observacionales prospectivos14,19,21,23, 2 observacionales retrospectivos20,22 y solo uno de ellos fue un ensayo clínico controlado y aleatorizado24 (tabla 1). Todos fueron realizados en un único centro. No se encontraron revisiones sistemáticas o metaanálisis sobre el tema.
Diseño del estudio y características de la toracoscopia médica con criosonda
| Thomas et al., 201520 | Rozman et al., 201614 | Wurps et al., 201623 | Pathak et al., 201719 | Chen et al., 201821 | Tousheed et al., 201822 | Dhooria et al., 201924 | |
|---|---|---|---|---|---|---|---|
| Tipo de estudio | Observacional | Observacional | Observacional | Observacional | Observacional | Observacional | Ensayo clínico |
| Temporalidad | Retrospectivo | Prospectivo | Prospectivo | Prospectivo | Prospectivo | Retrospectivo | Prospectivo |
| Tipo TM | Semirrígida | Semirrígida | Rígida | Semirrígida | Semirrígida | Semirrígida | Semirrígida |
| Tipo de pinza biopsia | PFC vs. criosonda | PFC vs. criosonda | Rígida vs. PFC vs. criosonda | PFC vs. criosonda | PFC vs. criosonda | Criosondaa | 1.a PFC, 2.a criosonda vs. 1.o° criosonda, 2.o PFC |
| Tamaño muestral | 22 | 15 | 80 | 10 | 92 | 87a | 50 |
| Tipo de criosonda (mm diámetro) | 2,4 | 2,4 | 2,4 | 2,4 | 1,9 | 2,4 | 2,4 |
| Tiempo contacto criosonda (segundos) | 3 | 3 | - | 3 | 3 | 8 (6-10) | 3 (máximo 6) |
| N.o biopsias | - | 3 CB | 3-4 biopsias rígido1-2 CB1-2 flexible | 3,7±1,4 CB4,5±1,5 flexible | 4 CB4 flexible | 2-3 CB | 4 (2-4b) CB8 (7,5-8b) PFC |
| Tiempo criobiopsias (min) | - | 4 (3-6) | - | - | 34±8,6 (tiempo total del procedimiento) | - | 10 (6-12) |
CB: criobiopsia; PFC: pinza flexible convencional; TM: toracoscopia médica.
En todos ellos la TM fue realizada en una sala de técnicas con anestesia local y sedación leve-moderada por el neumólogo intervencionista. En el caso de las pleuroscopias semirrígidas se utilizó el pleuroscopio semirrígido Olympus LTF-160 (Olympus, Tokio, Japón), con un canal de trabajo de 2,8mm de diámetro interno. Solo en un estudio se utilizó un toracoscopio rígido de 11mm (Storz, Tuttlingen, Alemania)23. Las CB se hicieron en zonas seleccionadas de la pleura parietal de cada paciente sospechosas de malignidad que fueron obtenidas con una criosonda flexible de 2,4mm (Erbokryo CA, Erbe, Alemania). Solo un estudio utilizó una sonda de 1,9mm21. La punta de la criosonda se colocaba sobre la zona de la pleura parietal a biopsiar, activándose a −89̊C, un mínimo de 3s hasta un máximo de 10 (tabla 1). El número de CB osciló desde un mínimo de 2 a un máximo de 4 (tabla 1). No fue posible estimar la duración de las TM, ya que la mayoría de los estudios incluidos no describían el tiempo medio del procedimiento.
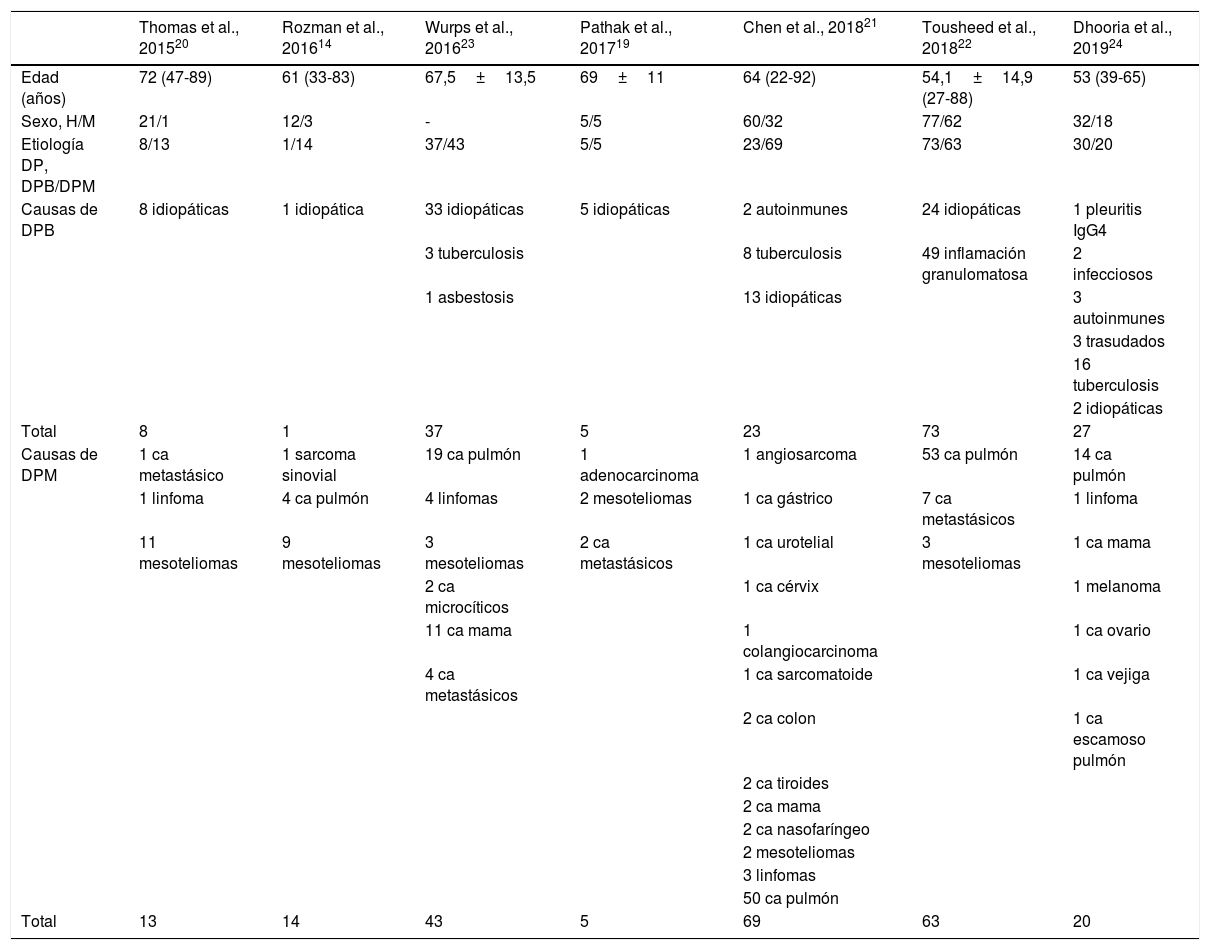
En la tabla 2 se resumen las características clinicoepidemiológicas y la etiología del DP de los sujetos incluidos en los estudios. La mayoría fueron hombres, 207 (75%), todos adultos, con un rango de edad de 22 a 92 años. En total se incluyeron 408 pacientes, realizándose CB a 356.
Características clinicoepidemiológicas de todos los pacientes incluidos en los estudios de esta revisión
| Thomas et al., 201520 | Rozman et al., 201614 | Wurps et al., 201623 | Pathak et al., 201719 | Chen et al., 201821 | Tousheed et al., 201822 | Dhooria et al., 201924 | |
|---|---|---|---|---|---|---|---|
| Edad (años) | 72 (47-89) | 61 (33-83) | 67,5±13,5 | 69±11 | 64 (22-92) | 54,1±14,9 (27-88) | 53 (39-65) |
| Sexo, H/M | 21/1 | 12/3 | - | 5/5 | 60/32 | 77/62 | 32/18 |
| Etiología DP, DPB/DPM | 8/13 | 1/14 | 37/43 | 5/5 | 23/69 | 73/63 | 30/20 |
| Causas de DPB | 8 idiopáticas | 1 idiopática | 33 idiopáticas | 5 idiopáticas | 2 autoinmunes | 24 idiopáticas | 1 pleuritis IgG4 |
| 3 tuberculosis | 8 tuberculosis | 49 inflamación granulomatosa | 2 infecciosos | ||||
| 1 asbestosis | 13 idiopáticas | 3 autoinmunes | |||||
| 3 trasudados | |||||||
| 16 tuberculosis | |||||||
| 2 idiopáticas | |||||||
| Total | 8 | 1 | 37 | 5 | 23 | 73 | 27 |
| Causas de DPM | 1 ca metastásico | 1 sarcoma sinovial | 19 ca pulmón | 1 adenocarcinoma | 1 angiosarcoma | 53 ca pulmón | 14 ca pulmón |
| 1 linfoma | 4 ca pulmón | 4 linfomas | 2 mesoteliomas | 1 ca gástrico | 7 ca metastásicos | 1 linfoma | |
| 11 mesoteliomas | 9 mesoteliomas | 3 mesoteliomas | 2 ca metastásicos | 1 ca urotelial | 3 mesoteliomas | 1 ca mama | |
| 2 ca microcíticos | 1 ca cérvix | 1 melanoma | |||||
| 11 ca mama | 1 colangiocarcinoma | 1 ca ovario | |||||
| 4 ca metastásicos | 1 ca sarcomatoide | 1 ca vejiga | |||||
| 2 ca colon | 1 ca escamoso pulmón | ||||||
| 2 ca tiroides | |||||||
| 2 ca mama | |||||||
| 2 ca nasofaríngeo | |||||||
| 2 mesoteliomas | |||||||
| 3 linfomas | |||||||
| 50 ca pulmón | |||||||
| Total | 13 | 14 | 43 | 5 | 69 | 63 | 20 |
ca: carcinoma; DPB: derrame pleural benigno; DPM: derrame pleural maligno; H: hombre; M: mujer.
Los datos se expresan como mediana (rango) o media±desviación típica.
La causa más frecuente del DP fue el DP maligno, con un total de 227 (55,6%) casos, de los cuales 141 (61,1%) fueron DP por cáncer de pulmón no microcítico (tabla 2).
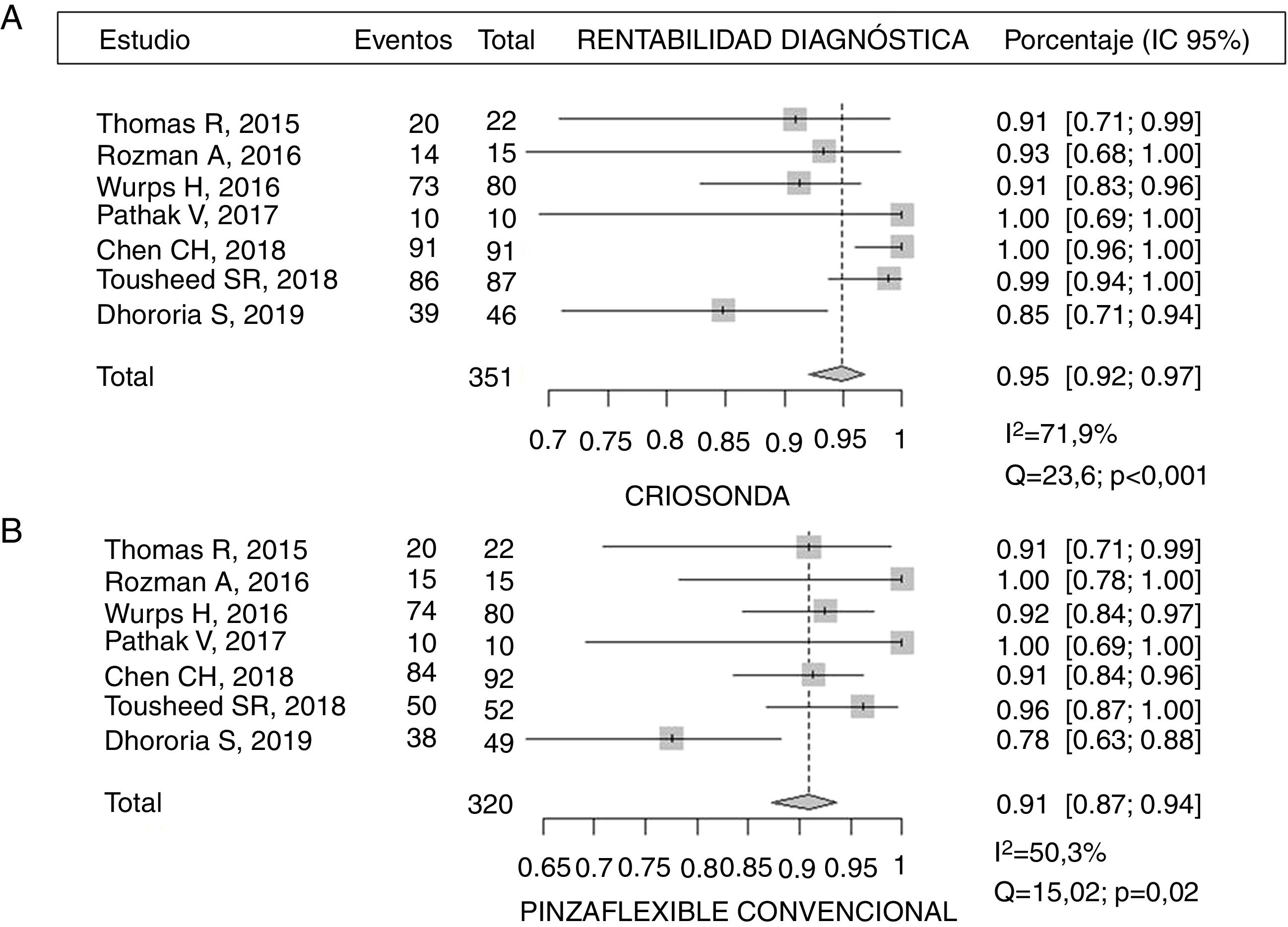
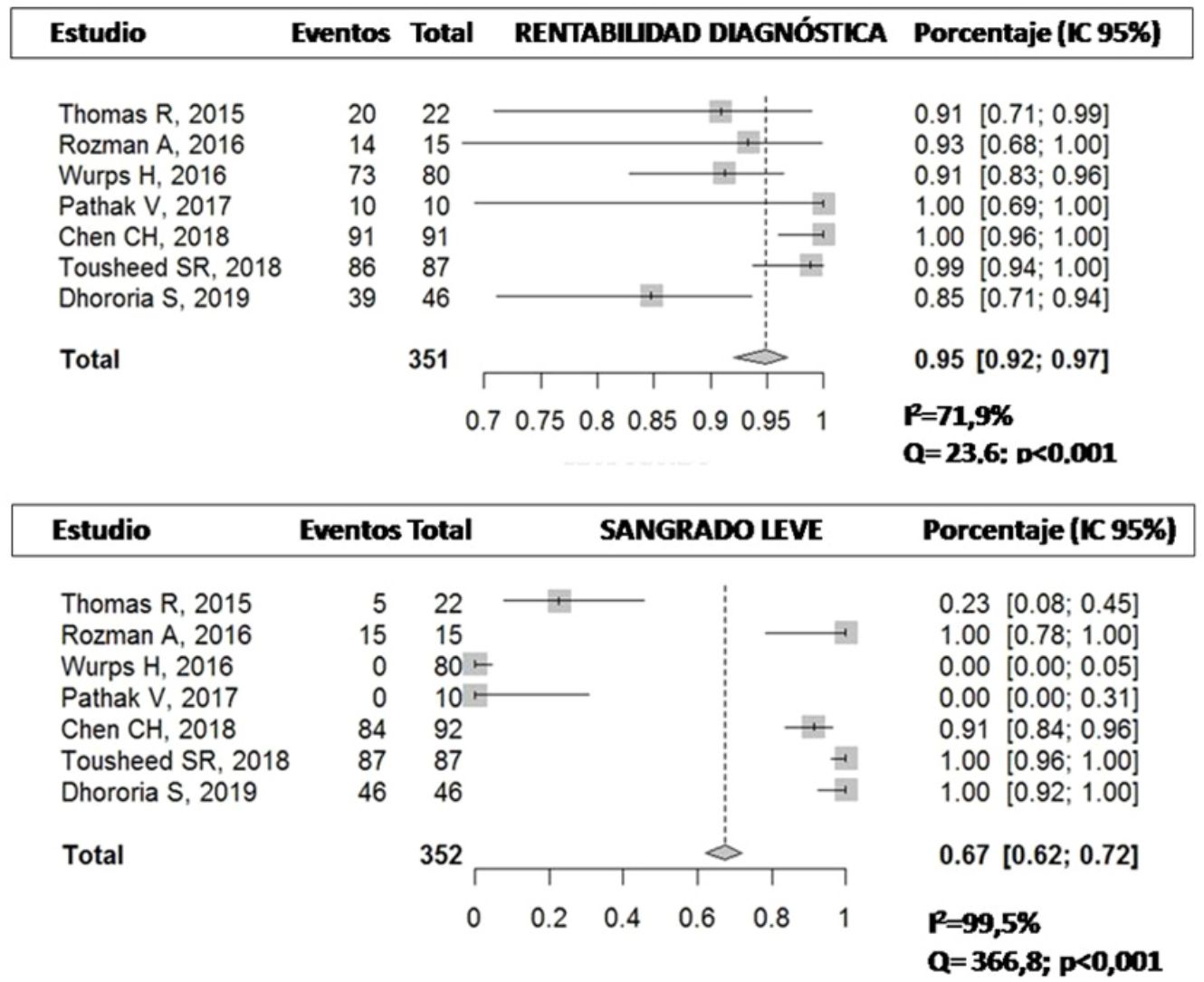
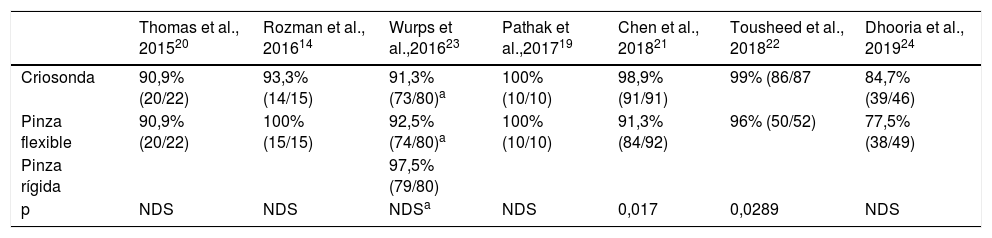
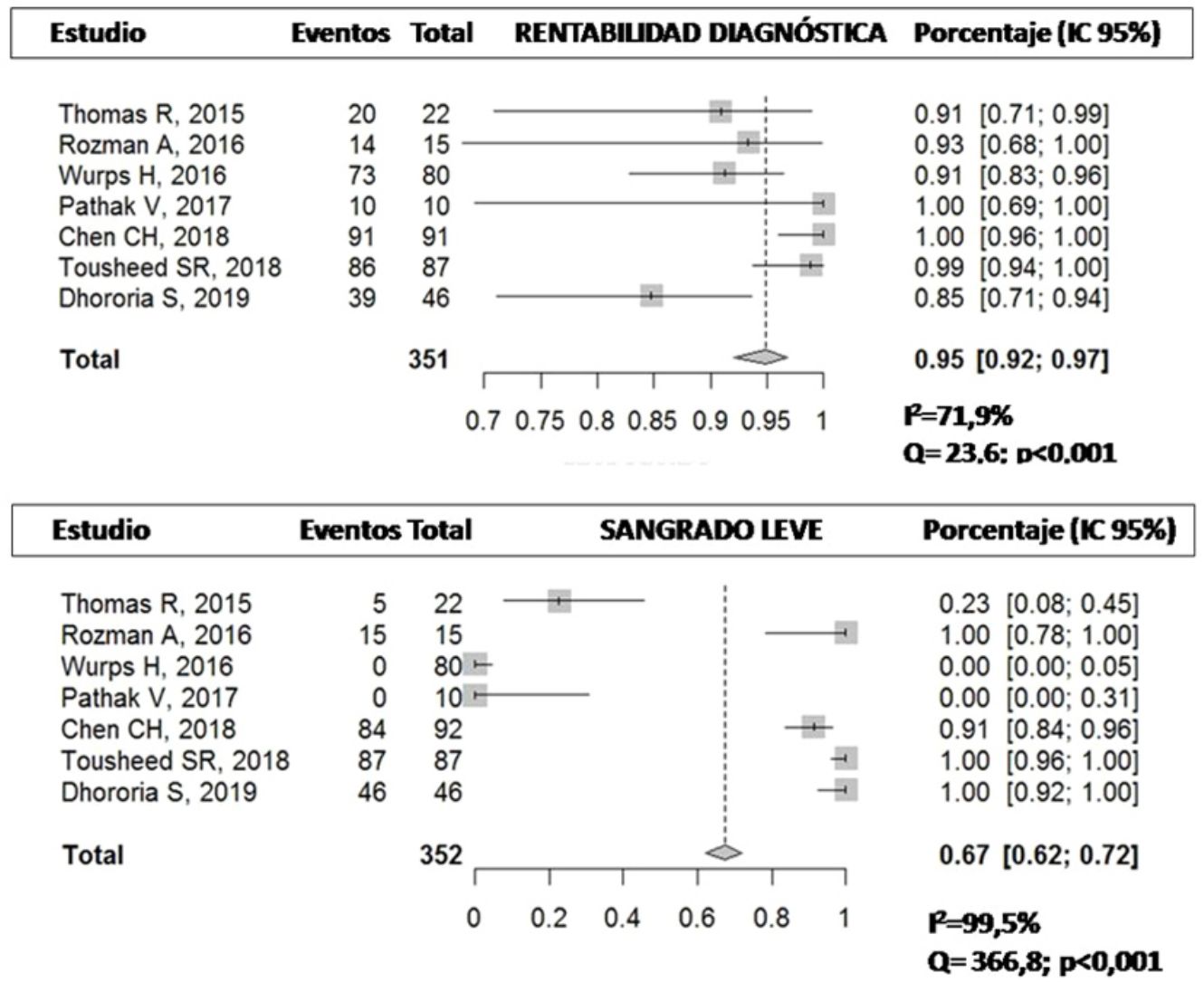
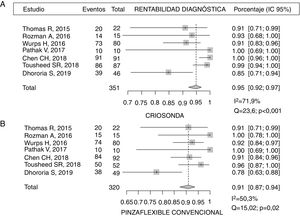
Rentabilidad diagnósticaEn la tabla 3 se representa la rentabilidad diagnóstica de las diferentes muestras obtenidas por criosonda y PFC. Se describe también la rentabilidad diagnóstica de la pinza rígida en el único estudio que utilizó un toracoscopio rígido23. Chen et al.21 describieron una rentabilidad de la CB de casi un 99% frente al 91% de la PFC (p=0,017). Resultados similares fueron descritos por Tousheed et al.22, 99 frente a 96% (p=0,02), respectivamente, aunque en este último trabajo se compararon los resultados de la CB con una seria histórica de TM con PFC22. La rentabilidad diagnóstica de la CB pleural obtenida en este análisis agrupado fue del 95% (IC 95% 92-97) frente al 91% de la PFC (IC 95% 87-94), con diferencias estadísticamente significativas (p=0,019), pero con una heterogeneidad moderada-alta en los resultados, debido al bajo tamaño muestral de los mismos (fig. 2). Con respecto a uno de los objetivos secundarios del metaanálisis, solo 2 de los estudios analizaron la capacidad de establecer una caracterización molecular del cáncer de pulmón no microcítico en las CB14,22. En el primero, que incluyó 14 casos de DP maligno (4 adenocarcinomas de pulmón), se pudo realizar un análisis de las mutaciones del gen EGFR en todas las muestras14. En el segundo estudio, que incluyó 139 pacientes, a 87 de los cuales se les realizó CB, en 29 el diagnóstico fue de cáncer de pulmón no microcítico, siendo también todas las muestras válidas para este estudio molecular22, aunque en ninguno de estos trabajos se analizó la rentabilidad de la PFC para el análisis de ADN en las muestras de tumor.
Rentabilidad diagnóstica de la criobiopsia pleural frente a la biopsia con pinza convencional de la pleura parietal
| Thomas et al., 201520 | Rozman et al., 201614 | Wurps et al.,201623 | Pathak et al.,201719 | Chen et al., 201821 | Tousheed et al., 201822 | Dhooria et al., 201924 | |
|---|---|---|---|---|---|---|---|
| Criosonda | 90,9% (20/22) | 93,3% (14/15) | 91,3% (73/80)a | 100% (10/10) | 98,9% (91/91) | 99% (86/87 | 84,7% (39/46) |
| Pinza flexible | 90,9% (20/22) | 100% (15/15) | 92,5% (74/80)a | 100% (10/10) | 91,3% (84/92) | 96% (50/52) | 77,5% (38/49) |
| Pinza rígida | 97,5% (79/80) | ||||||
| p | NDS | NDS | NDSa | NDS | 0,017 | 0,0289 | NDS |
NDS: no diferencias significativas.
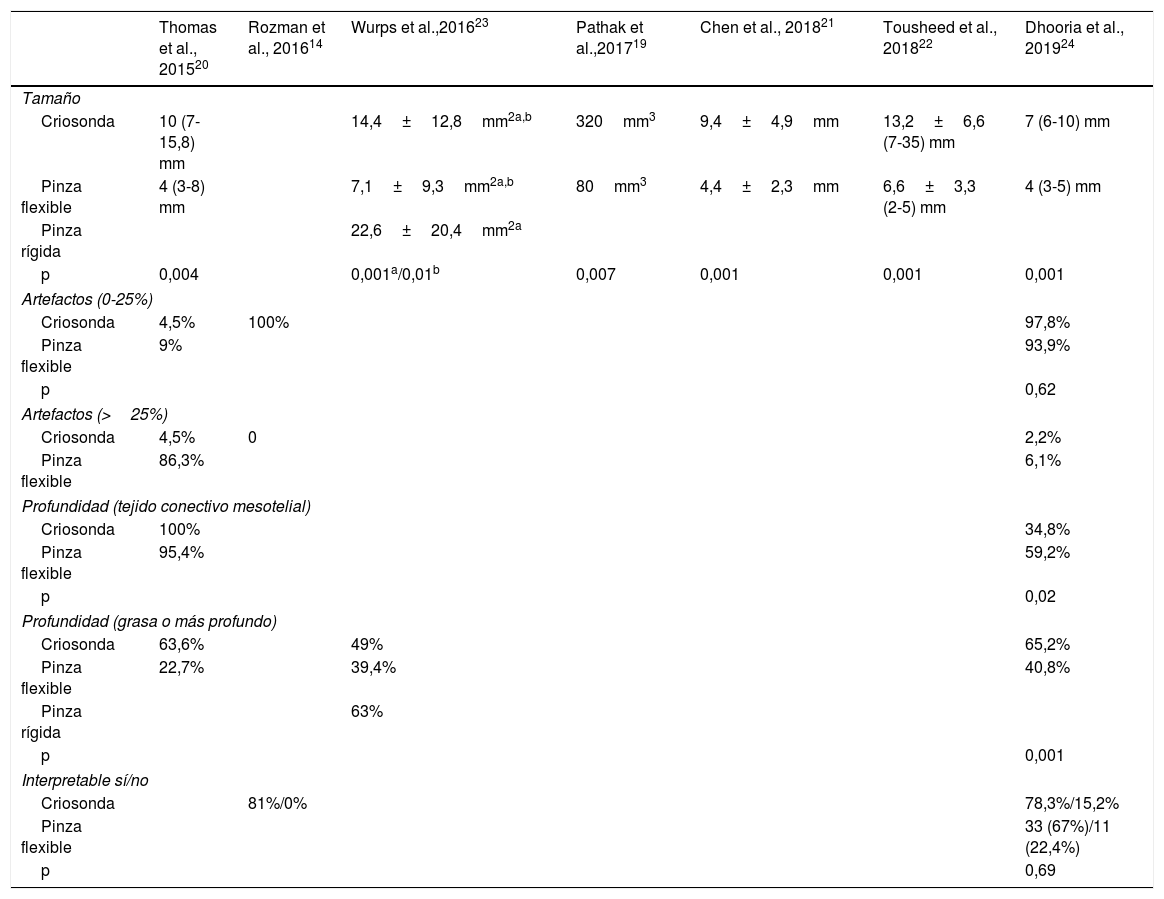
En la tabla 4 se describe el tamaño medio de las CB (en mm o mm2), el grado de profundidad de las muestras obtenidas y de artefactos. El tamaño de las CB fue de 7 a 35mm, siendo significativamente mayor cuando se comparó con el tamaño de la PFC de forma independiente en 6 de los 7 estudios que lo describieron entre sus resultados19–24.
Características de las muestras obtenidas en función del tipo de pinza utilizada: criosonda vs. pinza convencional
| Thomas et al., 201520 | Rozman et al., 201614 | Wurps et al.,201623 | Pathak et al.,201719 | Chen et al., 201821 | Tousheed et al., 201822 | Dhooria et al., 201924 | |
|---|---|---|---|---|---|---|---|
| Tamaño | |||||||
| Criosonda | 10 (7-15,8) mm | 14,4±12,8mm2a,b | 320mm3 | 9,4±4,9mm | 13,2±6,6 (7-35) mm | 7 (6-10) mm | |
| Pinza flexible | 4 (3-8) mm | 7,1±9,3mm2a,b | 80mm3 | 4,4±2,3mm | 6,6±3,3 (2-5) mm | 4 (3-5) mm | |
| Pinza rígida | 22,6±20,4mm2a | ||||||
| p | 0,004 | 0,001a/0,01b | 0,007 | 0,001 | 0,001 | 0,001 | |
| Artefactos (0-25%) | |||||||
| Criosonda | 4,5% | 100% | 97,8% | ||||
| Pinza flexible | 9% | 93,9% | |||||
| p | 0,62 | ||||||
| Artefactos (>25%) | |||||||
| Criosonda | 4,5% | 0 | 2,2% | ||||
| Pinza flexible | 86,3% | 6,1% | |||||
| Profundidad (tejido conectivo mesotelial) | |||||||
| Criosonda | 100% | 34,8% | |||||
| Pinza flexible | 95,4% | 59,2% | |||||
| p | 0,02 | ||||||
| Profundidad (grasa o más profundo) | |||||||
| Criosonda | 63,6% | 49% | 65,2% | ||||
| Pinza flexible | 22,7% | 39,4% | 40,8% | ||||
| Pinza rígida | 63% | ||||||
| p | 0,001 | ||||||
| Interpretable sí/no | |||||||
| Criosonda | 81%/0% | 78,3%/15,2% | |||||
| Pinza flexible | 33 (67%)/11 (22,4%) | ||||||
| p | 0,69 | ||||||
El porcentaje de artefactos que afectaban a más del 25% de la muestra de CB osciló entre 0 y 4,5%, siendo menor que el de la PFC en los 3 estudios en los que se analizó14,20,24. Algo similar de describió en la profundidad de las muestras obtenidas con ambas técnicas20,23,24. La profundidad del tejido definido como presencia de grasa o tejido muscular, aspecto especialmente relevante para determinar la invasión del tumor, fue mayor en las biopsias obtenidas con criosonda, llegando al 65% de todas las muestras frente al 40% de la PFC, en función de la serie24.
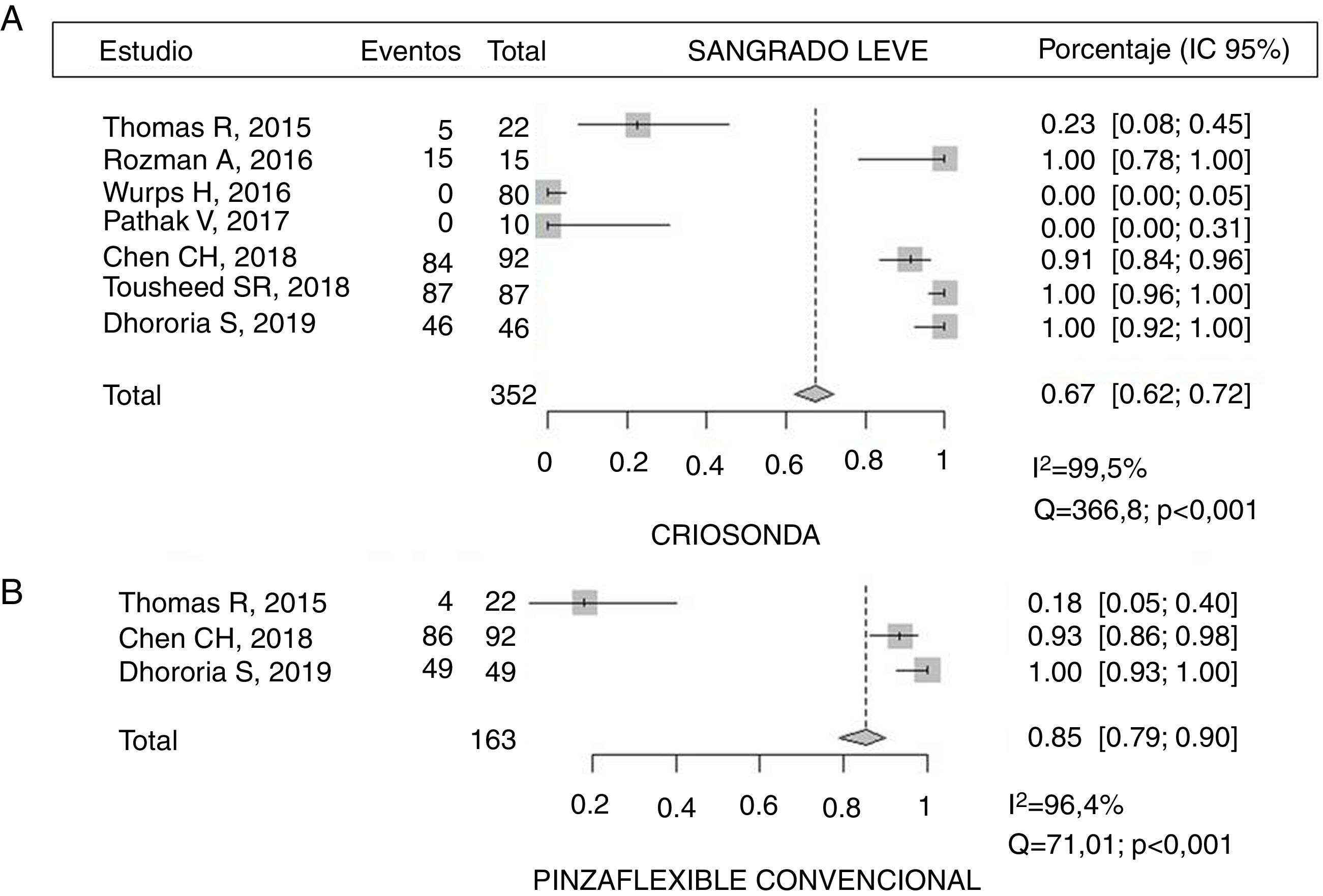
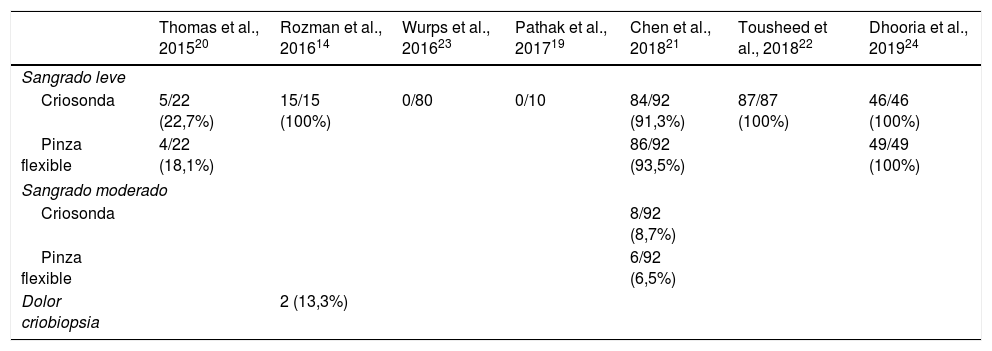
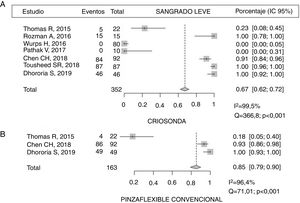
ComplicacionesEl 67% (IC 95% 62-72) de los pacientes sometidos a CB presentaron sangrado leve frente al 85% (IC 95% 79-90) de aquellos en los que se obtuvo la muestra con PFC14,20–22,24, con diferencias estadísticamente significativas (p<0,001), pero con una importante variabilidad de los resultados en los estudios al calcularse un I2 elevado (fig. 3). El sangrado moderado se describió en un 8,7% (8/92) y un 6,5% (6/92), respectivamente21. En 2 de los estudios no se describió ningún caso de sangrado con la CB21,23 (tabla 5). Solo en un estudio se describe un dolor agudo durante la realización de las CB, siendo el porcentaje menor del 14%14.
Complicaciones derivadas de las biopsias con criosonda
| Thomas et al., 201520 | Rozman et al., 201614 | Wurps et al., 201623 | Pathak et al., 201719 | Chen et al., 201821 | Tousheed et al., 201822 | Dhooria et al., 201924 | |
|---|---|---|---|---|---|---|---|
| Sangrado leve | |||||||
| Criosonda | 5/22 (22,7%) | 15/15 (100%) | 0/80 | 0/10 | 84/92 (91,3%) | 87/87 (100%) | 46/46 (100%) |
| Pinza flexible | 4/22 (18,1%) | 86/92 (93,5%) | 49/49 (100%) | ||||
| Sangrado moderado | |||||||
| Criosonda | 8/92 (8,7%) | ||||||
| Pinza flexible | 6/92 (6,5%) | ||||||
| Dolor criobiopsia | 2 (13,3%) | ||||||
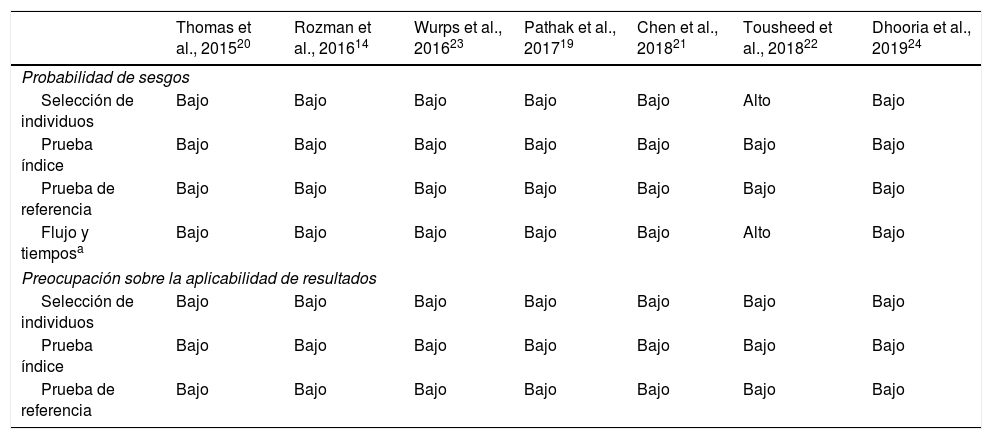
Realizamos una valoración de la calidad de los estudios incluidos en una revisión sistemática mediante la herramienta QUADAS-2 (tabla 6). Con respecto a los 4 dominios clave para evaluar la posibilidad de sesgos, en la mayoría de los estudios el riesgo de sesgo fue juzgado como bajo. Únicamente en un estudio retrospectivo, que incluyó como grupo control una serie histórica de TM con PFC, fue considerado alto22.
Resultados de la calidad de los estudios mediante la herramienta QUADAS-2
| Thomas et al., 201520 | Rozman et al., 201614 | Wurps et al., 201623 | Pathak et al., 201719 | Chen et al., 201821 | Tousheed et al., 201822 | Dhooria et al., 201924 | |
|---|---|---|---|---|---|---|---|
| Probabilidad de sesgos | |||||||
| Selección de individuos | Bajo | Bajo | Bajo | Bajo | Bajo | Alto | Bajo |
| Prueba índice | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| Prueba de referencia | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| Flujo y tiemposa | Bajo | Bajo | Bajo | Bajo | Bajo | Alto | Bajo |
| Preocupación sobre la aplicabilidad de resultados | |||||||
| Selección de individuos | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| Prueba índice | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| Prueba de referencia | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
Sin embargo, debemos destacar que en nuestra evaluación no encontramos preocupaciones acerca de la aplicabilidad de los resultados.
DiscusiónLa presente revisión sistemática y metaanálisis evalúa la eficacia y seguridad de la CB pleural frente a las técnicas de biopsia con PFC realizadas durante la TM para el estudio del DP. Aunque encontramos una elevada variabilidad, hay un aceptable nivel de calidad. La CB demuestra que es una técnica segura y con una rentabilidad global del 95% para establecer la etiología del DP. Las muestras pleurales obtenidas con criosonda son más grandes que las conseguidas con PFC, más profundas y de mejor calidad para su interpretabilidad, al tener menos artefactos. Sin embargo, no existen datos suficientes para poder obtener unas conclusiones firmes sobre una posible ventaja en la caracterización molecular de las muestras obtenidas en pacientes con DP debido a un cáncer de pulmón.
En alguno de los estudios se describieron dificultades especiales para la realización de CB en pacientes que presentaban una superficie pleural muy consistente14,24, por lo que es muy posible que la apariencia macroscópica y la consistencia de los implantes metastásicos sea importante cara a la elección de esta técnica de biopsia frente a las convencionales.
Una limitación de la TM semirrígida es el pequeño tamaño de las muestras, por lo que muchos expertos recomiendan realizar entre 6 y 10 biopsias1–3. Como describimos en este análisis agrupado, las muestras obtenidas por CB de la pleura parietal son significativamente más grandes que las obtenidas con la PFC14,19,20,22–24. Esto podría ser especialmente importante en el diagnóstico del DP maligno, ya que es necesaria una muestra de gran tamaño para realizar no solo estudios morfológicos, sino de inmunohistoquímica y moleculares, pero también para diferenciar DP metastásicos de diferentes órganos o hematológicos del mesotelioma pleural. En un estudio muy reciente, no incluido en el presente trabajo ya que incluye únicamente 5 casos con mesotelioma pleural, se describe que el tamaño de la muestras obtenidas con criosonda era 3 veces superior al de las PFC, la profundidad necesaria para establecer el diagnóstico de mesotelioma era alcanzada en 4 casos utilizando la CB frente a un caso de PFC, y el porcentaje de artefactos era significativamente menor para la CB con respecto a la PFC (9 frente a 35%, p<0,001)18. La CB conseguía establecer el diagnóstico de mesotelioma con éxito en todos los casos, mientras que la PFC solo lo lograba en un caso18. A pesar de estos resultados, parecen necesarios más estudios para determinar la técnica de biopsia óptima para el diagnóstico de mesotelioma pleural.
Con el desarrollo de las nuevas terapias dirigidas, incluyendo la inmunoterapia para el tratamiento del cáncer de pulmón no microcítico, existe un incremento en la demanda de muestras de tumor de mejor calidad11. En un pequeño estudio descriptivo realizado por nuestro grupo sobre el rendimiento diagnóstico de la TM semirrígida para la caracterización molecular del DP maligno por cáncer de pulmón no microcítico, se realizaron pruebas moleculares en 14 adenocarcinomas, obteniéndose material suficiente y adecuado para determinar el estado de mutación de EGFR en el 100% y en el 90% para la translocación de ALK25. Solo en 2 estudios de este metaanálisis se analizan las muestras de la criosonda para la detección de la mutación del gen EGFR, siendo posible en todas las muestras de tumor analizadas. Dada la importancia creciente y el desarrollo de las terapias dirigidas, al identificarse nuevas alteraciones moleculares o mutaciones conductoras se hace necesario desarrollar nuevos estudios encaminados a establecer la indicación de la criosonda de la pleura parietal como una nueva técnica de biopsia que permita optimizar la muestra y así poder identificar el mayor número de alteraciones moleculares posible26,27.
La metodología de esta revisión ha sido rigurosa, con doble cribado independiente de resúmenes, revisión de artículos, extracción de datos y evaluación de la calidad de los estudios. El proceso riguroso y basado en la evidencia científica utilizado en la construcción de la herramienta QUADAS-2 permitió facilitar la evaluación del riesgo de sesgo, su calificación y las preocupaciones sobre la aplicabilidad. Por lo tanto, los autores consideran que el resultado de esta revisión es un resumen fiable de la bibliografía existente. Sin embargo, la revisión tiene limitaciones. Los estudios incluidos fueron la mayoría observacionales y existe un destacable porcentaje de heterogeneidad en los principales objetivos estudiados.
Recientemente, ha sido publicada una revisión sistemática que describe resultados similares28. No obstante, una limitación de esta revisión es que no se incluyó entre los estudios seleccionados el único ensayo clínico controlado y aleatorizado publicado hasta el momento24.
Los resultados del presente metaanálisis demuestran que la CB de la pleura parietal durante la TM es un procedimiento seguro y con una elevada rentabilidad diagnóstica para el DP. La obtención de muestras de mayor tamaño, mayor calidad y con menos artefactos permitiría acortar el tiempo del procedimiento, ya que son necesarias menos biopsias que cuando se usa la PFC y la obtención de tejido de mayor tamaño podría ayudar a disminuir el número de pruebas y evitar repetir procedimientos. Si tenemos en cuenta que hoy en día el tejido se considera el material estándar para establecer el diagnóstico del cáncer de pulmón no microcítico y que existe una continua búsqueda de nuevos marcadores moleculares, siendo el factor limitante más significativo la cantidad de tumor disponible, la CB pleural podría ser considera la mejor opción para establecer el diagnóstico morfológico, inmunohistoquímico y molecular en este grupo de pacientes, aunque este es un aspecto que requeriría una mayor evidencia científica, más homogénea y de mayor calidad.
Además, una limitación de la técnica es que no está estandarizada. El tipo de sonda y el tiempo de congelación varían entre centros y todos los estudios se han realizado en un único hospital. Son necesarios estudios multicéntricos con una metodología rigurosa para evaluar el uso rutinario de esta nueva técnica como herramienta durante la TM y su aplicación en la práctica clínica habitual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.