Se ha demostrado que la teofilina mejora la función respiratoria y la oxigenación en pacientes con enfermedad pulmonar obstructiva crónica (EPOC). Sin embargo, no está suficientemente evaluado el impacto de la teofilina sobre la mortalidad de los pacientes con EPOC.
MétodoDos investigadores buscaron de forma independiente artículos elegibles en 4 bases de datos. Los artículos seleccionados para el presente metaanálisis debían ser artículos de investigación originales que proporcionaran el cociente de riesgos instantáneos (HR) de la mortalidad por cualquier causa en pacientes con EPOC tratados con teofilina. Se permitió incluir tanto ensayos controlados aleatorizados como estudios observacionales. Después de confirmar que la heterogeneidad no era significativa (I2<50%), para estimar el cociente de riesgos instantáneos del metaanálisis se empleó un modelo fijo con un método de varianza inversa genérica.
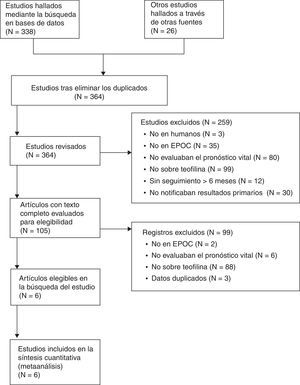
ResultadosSe seleccionaron 364 artículos potencialmente elegibles. De los 364 artículos, 259 fueron excluidos basándose en el título y el resumen, y 99 fueron excluidos después de considerar sus textos completos. Finalmente, nuestro análisis incluyó 6 estudios observacionales y ningún ensayo controlado aleatorizado. Un estudio estaba realizado con 2 cohortes. El número de pacientes en cada cohorte varió de 47 a 46.403. La heterogeneidad (I2=42%, p=0,11) y el sesgo de publicación (r=0,21, p=0,662 en la prueba de Begg) no fueron significativos. El metaanálisis del modelo fijo arrojó un cociente de riesgos instantáneos combinado de mortalidad por cualquier causa con teofilina de 1,07 (intervalo de confianza del 95%: 1,2-1,13, p=0,003).
ConclusiónEl presente metaanálisis de 7 cohortes observacionales sugiere que la teofilina aumenta ligeramente la mortalidad por cualquier causa de los pacientes con EPOC.
Theophylline has been shown to improve respiratory function and oxygenation in patients with chronic obstruction pulmonary disease (COPD). However, the impact of theophylline on mortality in COPD patients has not been not sufficiently evaluated.
MethodTwo investigators independently searched for eligible articles in 4 databases. The eligibility criterion for this meta-analysis was an original research article that provided a hazard ratio for theophylline for all-cause mortality of COPD patients. Both randomized controlled trials and observational studies were accepted. After we confirmed no substantial heterogeneity (I2<50%), the fixed-model method with generic inverse variance was used for meta-analysis to estimate the pooled hazard ratio.
ResultsWe screened 364 potentially eligible articles. Of the 364 articles, 259 were excluded on the basis of title and abstract, and 99 were excluded after examination of the full text. Our final analysis included 6 observational studies and no randomized controlled trials. One study reported 2 cohorts. The number of patients in each cohort ranged from 47 to 46,403. Heterogeneity (I2=42%, P=.11) and publication bias (Begg's test r=0.21, P=.662) were not substantial. Fixed-model meta-analysis yielded a pooled hazard ratio for theophylline for all-cause death of 1.07 (95% confidence interval: 1.02-1.13, P=.003).
ConclusionThis meta-analysis of 7 observational cohorts suggests that theophylline slightly increases all-cause death in COPD patients.
La enfermedad pulmonar obstructiva crónica (EPOC), actualmente la cuarta causa de muerte en todo el mundo, es una enfermedad sistémica cuya principal característica es la limitación crónica del flujo aéreo. Por lo tanto, es comprensible que los medicamentos broncodilatadores, como la teofilina, los antagonistas muscarínicos de acción prolongada (LAMA) y los beta-agonistas de acción prolongada (LABA) se utilicen como medicamentos esenciales para el tratamiento de enfermos con EPOC estable1. Entre estas 3 subclases de broncodilatadores, los LAMA y los LABA han demostrado ser seguros y eficaces en repetidas ocasiones, tanto en ensayos controlados aleatorizados (ECA) como en estudios observacionales a gran escala1-7. Por ello, los LAMA y los LABA se consideran en la actualidad medicamentos de primera línea para la EPOC estable1. Por otra parte, la eficacia de la teofilina se ha demostrado en muchos estudios observacionales y en ECA de un tamaño relativamente pequeño8-18. En general, estos estudios han indicado que la teofilina mejora los resultados de las pruebas de función respiratoria y las gasometrías, y que la teofilina puede afectar al riesgo de exacerbaciones y de efectos colaterales. Aunque a los médicos normalmente les interesa el pronóstico vital del paciente, la variable principal de resultado en los estudios no era la muerte, sino otras variables alternativas como la oxigenación o la función respiratoria, ya que no observamos un número suficiente de muertes durante el período de seguimiento. Sin embargo, estos marcadores indirectos no siempre reflejan la mortalidad de las enfermedades respiratorias con obstrucción del flujo aéreo. Por ejemplo, los beta-agonistas de acción corta mejoran la obstrucción del flujo aéreo, la disnea y la calidad de vida de los pacientes con asma bronquial, pero el uso regular de beta-agonistas de acción corta aumenta el número de muertes por asma bronquial19,20. Por lo tanto, el impacto de la teofilina sobre la mortalidad de los pacientes con EPOC es todavía una cuestión importante que se debe investigar.
Algunos estudios observacionales han explorado el impacto del tratamiento con teofilina sobre la tasa de muerte de pacientes con EPOC21-26. Sin embargo, existe una considerable variabilidad entre los resultados de estos estudios. La asociación entre la teofilina y el riesgo de mortalidad sigue siendo una cuestión importante para todos los clínicos, ya que la teofilina es un broncodilatador de uso habitual que se ha empleado durante décadas1,27. Por consiguiente, el objetivo de la presente revisión sistemática y metaanálisis es evaluar el impacto de la teofilina sobre la mortalidad por todas las causas en pacientes con EPOC.
MétodosBúsqueda del estudioDada la naturaleza del estudio y el anonimato de los pacientes, no fue necesaria la aprobación del comité de revisión institucional ni la obtención del consentimiento informado de los pacientes.
El criterio de selección para este metaanálisis fue que los trabajos fueran artículos de investigación original que proporcionasen el cociente de riesgos instantáneos (HR) de mortalidad por cualquier causa en pacientes con EPOC tratados con teofilina. Se admitieron tanto ensayos controlados aleatorizados (ECA) como estudios observacionales. Para los estudios observacionales, se prefirió el HR ajustado al no ajustado. La duración del seguimiento debía ser superior a 6meses. Se eliminaron las duplicaciones de datos.
Dos investigadores buscaron de forma independiente artículos elegibles en las bases de datos MEDLINE, Web of Science, EMBASE y Cochrane a partir de enero de 2014. La fórmula de búsqueda en MEDLINE fue ((«COPD»[title] OR «chronic obstructive pulmonary disease»[title] OR «chronic obstructive airway disease»[title] OR «emphysema»[title] OR «chronic bronchitis»[title] OR «chronic airflow obstruction»[title]) OR ((«COPD» OR «chronic obstructive pulmonary disease» OR «chronic obstructive airway disease» OR «emphysema» OR «chronic bronchitis» OR «chronic airflow obstruction») AND («theophylline» OR «xanthine» OR «theophyllines» OR «xanthines» OR «aminophylline» OR «diprophylline» OR «proxyphylline» OR «diprophylline»))) AND («mortality» OR «prognosis» OR «death» OR «mortalities» OR «prognoses» OR «deaths») AND («hazard ratio» OR «HR» OR «hazard ratios»).
La calidad de los estudios elegibles se evaluó mediante una escala que comprendía 4 subescalas, con un máximo de 2 puntos para cada subescala28. Las subescalas fueron definición de ingreso en la cohorte, definición de la exposición, resultados y evaluación de factores de confusión. Las puntuaciones oscilaron de 0 a 8, donde la puntuación más alta significó mejor calidad28.
EstadísticaSe extrajeron los HR de la mortalidad por todas las causas de cada estudio. El HR y su correspondiente intervalo de confianza del 95% (IC) debían estar claramente mostrados en el texto, una tabla o una figura en cada uno de los artículos originales. Además, se extrajeron los datos relativos al número de pacientes, la administración concomitante de beta-estimulantes y anticolinérgicos y las covariables ajustadas para el modelo de Cox.
En el metaanálisis se empleó un modelo fijo con el método de la varianza inversa genérica para estimar el valor combinado, después de confirmar que la heterogeneidad no era significativa (I2<50%)29-31. La heterogeneidad de los estudios originales, se evaluó con: a)la prueba de chi-cuadrado con una zona de rechazo de p=0,1, y b)la prueba estadística de I2, donde I2=0% indica ausencia de heterogeneidad, I2=25% indica leve heterogeneidad, I2=50% indica heterogeneidad moderada; I2=75% indica una fuerte heterogeneidad30,31. El sesgo de publicación se evaluó con un gráfico en embudo y con la prueba de Begg, usando la prueba de correlación de rangos de Spearman con una zona de rechazo de p=0,132. Todos los análisis se realizaron utilizando los programas informáticos Excel Toukei 2012 (SSRI, Tokio, Japón) y Review Manager versión 5.3 (Colaboración Cochrane, Oxford, Reino Unido).
ResultadosBúsqueda del estudioSe seleccionaron 364 artículos potencialmente elegibles. De los 364 artículos, 259 fueron excluidos basándose en el título y el resumen, y 99 fueron excluidos después de considerar sus textos completos. Lee había publicado 4 artículos que analizaban datos solapados que informaban del riesgo de muerte por régimen de tratamiento mediante el HR25,33-35. De estos, se incluyó un artículo centrado en el impacto de la teofilina sobre la mortalidad25, y los otros se excluyeron33-35 debido a duplicidades en los datos. Finalmente, nuestro análisis incluyó 6 estudios (fig. 1)21-26. Los 6 habían sido publicados entre 2003 y 2011. Macie había dividido los casos de EPOC en 2 grupos: un grupo de pacientes de menos de 65años de edad y otro de pacientes de 65años o mayores24. Lee había notificado algunos HR de muerte por cualquier causa en pacientes tratados con teofilina25. Uno de los HR se había calculado mediante un análisis de exposición temporal variable, en el que los pacientes habían sido tratados con diferentes medicamentos. Todos los demás HR del estudio de Lee se habían calculado con pautas terapéuticas específicas. Al considerar que esto suponía un uso duplicado de los datos en los cálculos, adoptamos el HR del análisis de exposición temporal variable del estudio de Lee.
El metaanálisis principal incluyó 7 cohortes. El número de pacientes en cada cohorte osciló de 47 a 46.403, lo que nos llevó a incluir a un total de 60.692 pacientes con EPOC (tabla 1). El nivel de calidad de estudio de Lee fue de 6 sobre 8. Las puntuaciones de calidad de los otros estudios incluidos fueron 7 sobre 8. Estas puntuaciones indicaron que la calidad de estos estudios observacionales era, en general, buena (tabla 1). Las covariables ajustadas en el modelo de Cox se resumen también en la tabla 1. Ningún estudio proporcionó datos sucintos relativos a dosis o concentraciones plasmáticas de teofilina.
Resumen de los estudios originales incluidos en el metaanálisis
| Estudio | Diseño | CE | Pacientes | Seguimiento | Covariables ajustadas para el modelo de Cox | Cociente de riesgos instantáneos (IC 95%) | |||
|---|---|---|---|---|---|---|---|---|---|
| Inclusión, definición | n | Beta-agonistas inhalados | Anticolinérgicos inhalados | ||||||
| Fan (2003)21 | Prospectivo | 7 | Ambulatorios con corticosteroides inhalados. ICD-9 | 8.052 | 88,0% (SABA) | 72,8% (no especificado) | 544 días | Medicación pulmonar, edad, hospitalización, visitas previas por EPOC, comorbilidad, distancia al hospital | 1,00 (0,84-1,20) |
| Nizet (2005)22 | Prospectivo | 7 | Hipercápnicos, ATS | 47 | No disponible | No disponible | 3,8 años | Edad, sexo, comorbilidad, diuréticos | 1,10 (0,40-3,10) |
| Gudmundsson (2006)23 | Prospectivo | 7 | Postexacerbación | 416 | 39,6% (LABA) | 35,1% (ipratropio) | 2 años | Edad, sexo, centro, tabaquismo, FEV1, hospitalización previa, SGRQ, comorbilidad, medicación pulmonar, oxigenoterapia de larga duración | 0,9 (0,48-1,30) |
| Maciea (2006)24 | Retrospectivo | 7 | Postingreso, ICD-9 | 365 días | Covariables seleccionadas | ||||
| <65 años; | 965; | 54,9% (no especificado); | 30,6% (Ipratropio); | 1,41 (0,60-3,34); | |||||
| ≥65 años | 4.022 | 61,2% (no especificado) | 44,7% (ipratropio) | 1,40 (1,10-1.79) | |||||
| Lee (2009)25 | Retrospectivo | 6 | Veteranos, ICD-9 | 7.840 | 48,2% (LABA) | 88,2% (ipratropio) | 2,5 años | Propensión inicial a recibir teofilina, exacerbación, edad | 1,23 (1,09-1,39) |
| Gershon (2011)26 | Retrospectivo | 7 | Poblacional | 46.403 | 38,4% (LABA) | 61,6% (LAMA) | 5,5 años | Edad, sexo, residente de un centro de pacientes crónicos, ingresos, domicilio, duración de la EPOC, espirometría previa, visitas al médico, visitas al especialista, vacunación antigripal, cirugía de reducción de volumen pulmonar, medicamentos para la EPOC, medicación coronaria, enfermedades concomitantes, hospitalización/visita a urgencias reciente | 1,01 (0,93-1,10) |
ATS: American Thoracic Society; CE: calidad del estudio, siendo 8 la mejor puntuación; ICD-9: Clasificación Internacional de las Enfermedades, 9.ª revisión; LABA: beta-agonistas de acción prolongada; LAMA: antagonistas muscarínicos de acción prolongada; Prospectivo: estudio de cohortes prospectivo; Retrospectivo: estudio de cohortes retrospectivo; SABA: beta-agonistas de acción corta; SGRQ: puntuación total del cuestionario respiratorio St. George.
Macie dividió los casos en 2 grupos: un grupo de pacientes de menos de 65años y otro de pacientes de 65años o mayores.
Los porcentajes de pacientes que recibieron otros broncodilatadores tales como beta-agonistas y anticolinérgicos se muestran en la tabla 1. No se observó asociación específica entre el HR de muerte por cualquier causa de los estudios y la prescripción de estos broncodilatadores (tabla 1).
MetaanálisisCada una de las 7 cohortes presentó un HR de 0,79 a 1,41, lo que sugiere una débil o moderada heterogeneidad intrascendente (I2=42%, p=0,11). El modelo fijo de metaanálisis arrojó un HR combinado de muerte por todas las causas con teofilina de 1,07 (IC95%: 1,2-1,13, p=0,003) (fig. 2). Ni el gráfico en embudo ni la prueba de Begg (r=0,21; p=0,662) sugirieron la existencia de un sesgo de publicación (fig. 3).
Se realizó una revisión sistemática y un metaanálisis de estudios observacionales para evaluar el impacto de la teofilina sobre la mortalidad en los pacientes con EPOC. El modelo fijo del metaanálisis arrojó un HR combinado de muerte por todas las causas con teofilina de 1,07 (IC95%: 1,02-1,13, p=0,003) (fig. 2), lo que sugiere que la teofilina podría asociarse a un ligero aumento de la mortalidad por todas las causas en personas con EPOC.
En la EPOC, el tratamiento farmacológico se utiliza para reducir los síntomas, la frecuencia de las exacerbaciones y los fallecimientos. Hasta la fecha, pocos fármacos han demostrado de forma suficiente ser capaces de modificar el deterioro a largo plazo de la función pulmonar1. Los broncodilatadores, por lo general, aumentan el volumen espiratorio forzado por segundo mediante la alteración del tono de la musculatura lisa de las vías aéreas. Entre los broncodilatadores, la teofilina es menos eficaz y es peor tolerada que los LAMA y los LABA y no se recomienda como medicación de primera elección. La toxicidad es dependiente de la dosis y el margen terapéutico es bajo. El mayor efecto terapéutico se produce solo cuando se emplea a dosis próximas a dosis tóxicas1. Además, teóricamente, la teofilina causa efectos sistémicos con más facilidad que los LAMA y los LABA, si se administra sistemáticamente1.
Los efectos terapéuticos de la teofilina todavía son controvertidos. Actúa como un inhibidor no selectivo de la fosfodiesterasa, pero también tiene acciones no broncodilatadoras. Es decir, produce mejoría en la función de los músculos inspiratorios y tiene efecto antiinflamatorio. Zhou realizó un estudio aleatorizado, doble ciego, de grupos paralelos y controlado con placebo con 110 participantes. Este estudio evaluó el efecto terapéutico del tratamiento a dosis bajas (100mg 2veces al día)36. Esta dosis baja de teofilina no se consideró una dosis broncodilatadora, sino antiinflamatoria37. En el estudio, a pesar de que la teofilina a dosis bajas no mejoró la función pulmonar post-broncodilatador, los sujetos tratados con teofilina mostraron mejor calidad de vida y menor frecuencia de exacerbaciones y de hospitalización36. Considerando el reciente consenso en cuanto a la relación entre las exacerbaciones y la mortalidad, las dosis bajas de teofilina podrían contribuir a configurar una nueva estrategia de tratamiento.
Se deben tener en cuenta las limitaciones del presente estudio. Este metaanálisis incluyó a un número reducido de cohortes. Además, todos los estudios que contribuyeron al metaanálisis fueron estudios observacionales, no ECA. Sin embargo, en los últimos tiempos se ha generalizado la aceptación de los metaanálisis realizados a partir de estudios no ECA38. Otra limitación es que ningún artículo original proporcionó datos suficientes sobre dosis y concentraciones plasmáticas de teofilina. Pese a ello, creemos que el resultado de este análisis es digno de confianza, dado que las cohortes observacionales incluidas no mostraron heterogeneidad ni sesgo de publicación.
Para concluir, las directrices actuales que dan apoyo al uso crónico de la teofilina en los casos de EPOC se basan en unos pocos estudios centrados en las pruebas de función respiratoria y el análisis de gases en sangre8,9. Ningún ECA ha evaluado el impacto de la teofilina sobre la mortalidad por todas las causas. Este metaanálisis, que incluye 7cohortes observacionales, sugiere que la teofilina aumenta ligeramente la tasa de muerte por cualquier causa de los pacientes con EPOC, con un HR combinado de muerte por cualquier causa en pacientes que reciben teofilina de 1,07 (IC95%: 1,02-1,13). Estos resultados deberían tenerse en cuenta a la hora de decidir el uso de teofilina en algunos pacientes con EPOC.
FinanciaciónEl estudio no contó con apoyo alguno en forma de donaciones, regalos, equipo y/o medicación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.