Los beneficios clínicos del tratamiento complementario con corticoides de la neumonía por Pneumocystis jirovecii (P. jirovecii) en pacientes no infectados por el virus de la inmunodeficiencia humana (VIH) no se han evaluado mediante metanálisis.
MétodosRealizamos una revisión sistemática de los estudios publicados que describen los efectos del tratamiento complementario con corticoides sobre la evolución de pacientes con neumonía por P. jirovecii no infectados por VIH. Dos investigadores hicieron búsquedas independientes de artículos elegibles escritos en inglés en las bases de datos PubMed y Cochrane. Se efectuó un metanálisis con un modelo de efectos aleatorios para determinar la mortalidad como variable principal, y la necesidad de intubación o ventilación mecánica como variable secundaria.
ResultadosSiete estudios observacionales resultaron elegibles. En ellos el tratamiento complementario con corticoides no afectó a la mortalidad en los pacientes no infectados por VIH (odss ratio [OR] 1,26; IC 95% 0,60–2,67) y no tuvo ningún efecto beneficioso para los pacientes con hipoxemia intensa (PaO2<70mmHg) (OR 0,90; IC 95% 0,44–1,83). No se observó ningún efecto significativo sobre la variable secundaria (OR 1,34; IC 95% 0,44–4,11).
ConclusionesAunque los estudios eran observacionales, el metanálisis mostró que el tratamiento complementario con corticoides no mejoraba la evolución de los pacientes con neumonía por P. jirovecii no infectados por VIH. Estos resultados justifican la realización de un ensayo controlado aleatorizado.
The clinical benefits of adjunctive corticosteroids for Pneumocystis jirovecii (P. jirovecii) pneumonia in patients not infected with the human immunodeficiency virus (HIV) has not been evaluated by meta-analysis.
MethodsWe conducted a systematic review of published studies describing the effects of adjunctive corticosteroids on outcome in non-HIV P. jirovecii pneumonia patients. Two investigators independently searched the PubMed and Cochrane databases for eligible articles written in English. A meta-analysis was performed using a random-effects model for measuring mortality as the primary outcome, and the need for intubation or mechanical ventilation as the secondary outcome.
ResultsSeven observational studies were eligible. In these studies, adjunctive corticosteroids did not affect mortality in non-HIV patients (odds ratio [OR] 1.26; 95% CI 0.60-2.67) and there was no beneficial effect in patients with severe hypoxemia (PaO2<70mmHg) (OR 0.90; 95% CI 0.44-1.83). No significant effect on the secondary outcome was observed (OR 1.34; 95% CI 0.44-4.11).
ConclusionsAlthough the studies were observational, meta-analysis showed that adjunctive corticosteroids did not improve the outcome of P. jirovecii pneumonia in non-HIV patients. The results warrant a randomized controlled trial.
La neumonía por Pneumocystis jirovecii (P. jirovecii) –NPJ– es una infección oportunista potencialmente mortal que afecta a sujetos inmunodeprimidos1. La función de los linfocitos T CD4+ en la respuesta al antígeno y la producción de interferón gamma para la defensa del huésped frente al P. jirovecii es fundamental2. Los linfocitos T CD4+ están especialmente suprimidos si hay infección avanzada por el virus de la inmunodeficiencia humana (VIH). Sin embargo, en el entorno clínico suelen observarse otras causas de inmunosupresión, como son el uso continuado de corticoides, las neoplasias malignas hematológicas, los tumores de órganos sólidos o los trasplantes de órganos3,4. Por lo tanto, a pesar de que la NPJ es más frecuente en pacientes con VIH, esta patología no se debe ignorar en pacientes no infectados por este virus, en particular si se trata de pacientes inmunodeprimidos.
Existen diferencias en la epidemiología y la presentación clínica de la NPJ en los pacientes infectados y los no infectados por VIH. En los no infectados, la NPJ aparece a edades más tardías, el recuento de neutrófilos es más alto y la densidad de P. jirovecii en el lavado broncoalveolar más baja, en comparación con los pacientes con VIH5. Además, el inicio de la insuficiencia respiratoria es abrupto en estos pacientes, mientras que en pacientes con VIH es más lento1. En general, debido a una variedad de patologías médicas subyacentes, la evolución de la NPJ es menos favorable en los pacientes no infectados por VIH que en los infectados por este virus2.
La estrategia terapéutica de la NPJ se ha estudiado mucho, especialmente en pacientes con VIH. El tratamiento habitual suele ser sulfametoxazol-trimetoprim6 y, sobre la base de ensayos controlados aleatorizados efectuados en los años 907, a los pacientes con NPJ y VIH que presentan una hipoxemia sustancial se les prescribe tratamiento complementario con corticoides. Un metanálisis y una revisión sistemática recientes han demostrado que el tratamiento complementario con corticoides tiene un efecto beneficioso sobre la mortalidad de los pacientes con hipoxemia (presión parcial de oxígeno arterial >70mmHg o gradiente alvéolo-arterial <35mmHg con aire ambiental)8.
Por otra parte, no está claro el valor de los corticoides complementarios en pacientes no infectados por VIH con NPJ. Los estudios observacionales publicados no han demostrado que tengan un efecto decisivo sobre la evolución y, hasta la fecha, no se han llevado a cabo estudios controlados aleatorizados. Esto podría deberse a la gran variedad de enfermedades y fisiopatologías subyacentes, y a la relativa rareza de NPJ en pacientes no infectados por VIH. No obstante, dadas las diferencias observadas en la fisiopatología de la NPJ entre los pacientes infectados o no por VIH, es posible que exista algún factor que afecte el curso clínico con el uso de corticoides complementarios.
Hemos efectuado una revisión sistemática y un metanálisis de los estudios observacionales publicados que abordan el uso de tratamiento complementario con corticoides en pacientes con NPJ no infectados por VIH.
MétodosBúsqueda de estudiosDos investigadores (YF y TM) realizaron búsquedas independientes en la literatura de artículos elegibles publicados entre 1949 y junio de 2015, para lo que revisaron de forma sistemática las bases de datos PubMed y Cochrane. Las búsquedas se efectuaron con términos libres, términos MeSH y combinaciones de los términos «Pneumocystis», «pneumonia, Pneumocystis [MeSH]», «Pneumocystis infections [MeSH]», «Pneumocystis carinii [MeSH]», «Pneumocystis jirovecii [MeSH]», «PCP», «PJP», AND «non-HIV», «non-AIDS», «non-HIV-infected», «HIV-uninfected», «AIDS uninfected», «HIV-negative», AND «steroids», «corticosteroids», «hydroxycorticosteroids», «glucocorticoids», «prednisolone», «hydroxycortisone», e «hydrocortisone», restringidos al idioma inglés.
Criterios de selección y medidas de resultadosEl metanálisis incluyó los estudios que cumplían los criterios de selección. 1) Diseño de los estudios: ensayos controlados aleatorizados y estudios observacionales; 2) población: pacientes no infectados por VIH con NPJ; 3) intervención: administración de tratamiento complementario con corticoides; 4) intervención comparativa: sin administración de corticoides complementarios o sin incremento del uso de corticoides, según la definición de cada estudio; 5) variables de resultados: mortalidad como variable principal y porcentaje de intubación (o necesidad de ventilación mecánica) como variable secundaria. En los estudios que identificaban a los pacientes con hipoxemia también se analizó la mortalidad de los casos de pacientes no infectados por VIH que presentaban NPJ e hipoxemia grave (PaO2<70mmHg). Se excluyeron los artículos que no definían la presencia o ausencia del VIH en la población del estudio o en los que no constaban datos exactos para su evaluación.
Análisis estadísticoEl metanálisis se llevó a cabo de acuerdo con las recomendaciones PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analysis)9 y MOOSE (Meta-analysis Of Observational Studies in Epidemilogy)10. Para el análisis de los datos se utilizaron los programas informáticos Review Manager (RevMan) 5.3.5 (Cochrane Collaboration, Copenhague) y la versión 3.2.3 del programa R (R Foundation for Statistical Computing, Viena, Austria), que ofrecen paquetes estadísticos de código abierto para metanálisis. Para la agregación de datos se utilizó un modelo de efectos aleatorios y en el resumen se utilizaron odss ratio (OR). La heterogeneidad de los estudios originales se evaluó mediante el estadístico I2. En todos los análisis, los niveles de significación fueron bilaterales y los valores de p < 0,05 se consideraron significativos. El sesgo de publicación se examinó mediante un gráfico de embudo.
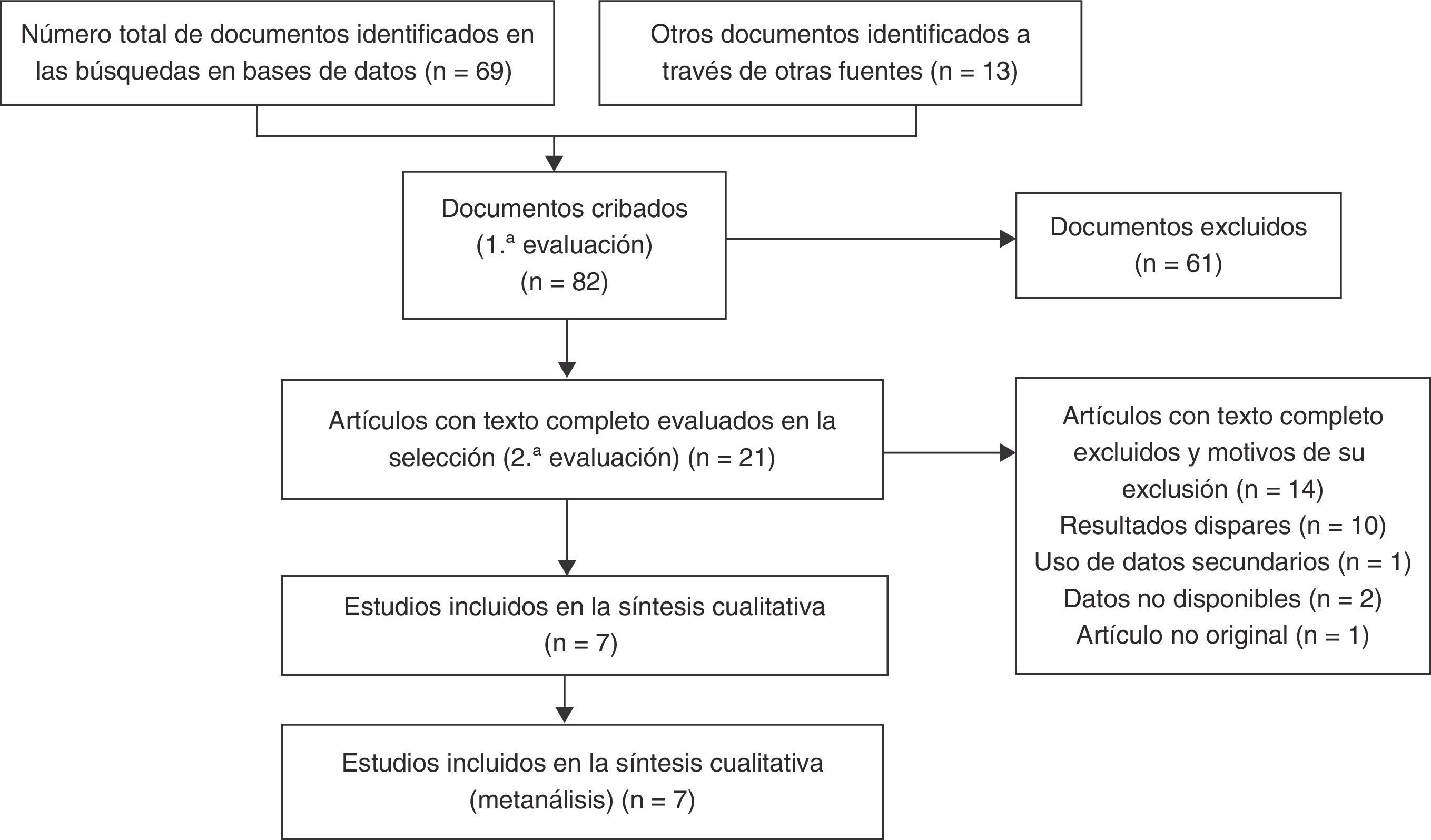
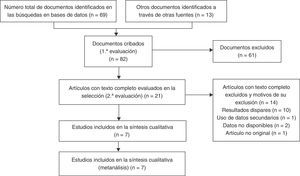
ResultadosResultados de la búsqueda y características de los estudiosA partir de las búsquedas sistemáticas efectuadas de acuerdo a las recomendaciones PRISMA y de un debate entre los dos revisores, se recabaron siete estudios observacionales11–17 (fig. 1). Los revisores llegaron a un acuerdo completo respecto a las búsquedas y los datos extraídos. La síntesis cualitativa incluyó siete de los 82 estudios examinados.
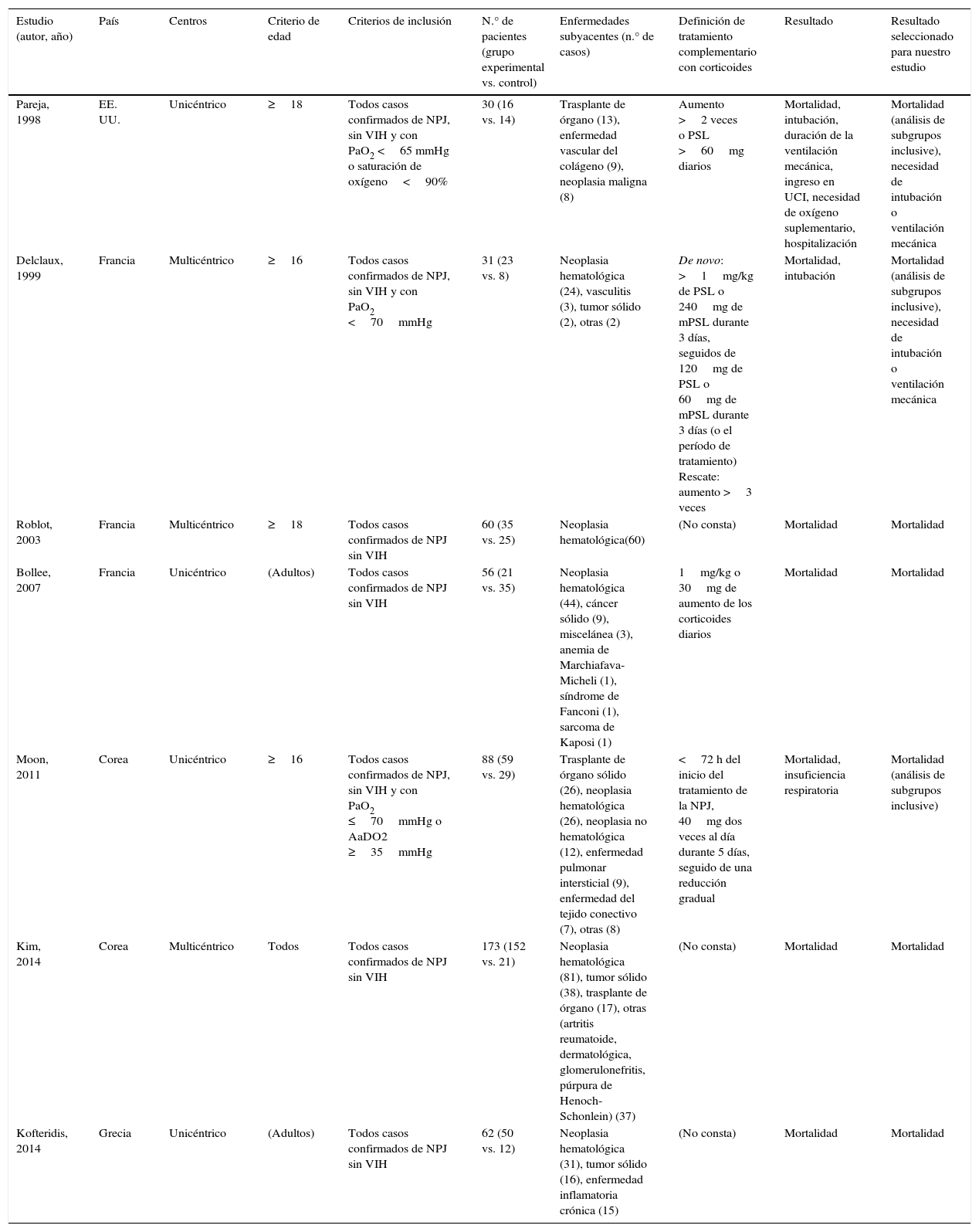
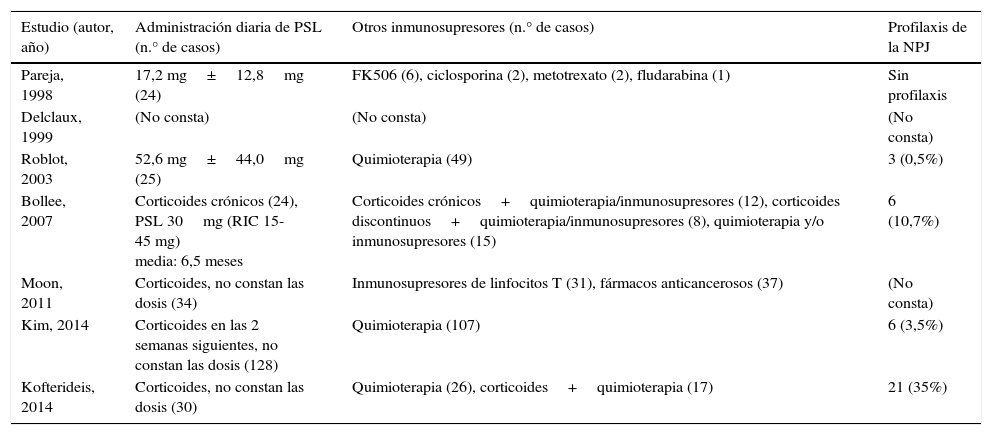
En la tabla 1 se muestran las características de los estudios seleccionados. No hubo ningún ensayo controlado aleatorizado, siendo todos los estudios observacionales y retrospectivos. Se observó una gran variedad de enfermedades subyacentes que habían causado la inmunosupresión de los pacientes, aunque con frecuencia fueron neoplasias malignas, en concreto hematológicas. Otros antecedentes de los pacientes se describen en la tabla 2. Entre el 38,6 y el 80,0% de los pacientes recibían corticoides, y en muchos casos los pacientes recibían otros inmunosupresores en el momento del diagnóstico de la NPJ. Cabe destacar que los pacientes no infectados por VIH recibían profilaxis para el P. jirovecii con menor frecuencia.
Características de los estudios observacionales incluidos
| Estudio (autor, año) | País | Centros | Criterio de edad | Criterios de inclusión | N.° de pacientes (grupo experimental vs. control) | Enfermedades subyacentes (n.° de casos) | Definición de tratamiento complementario con corticoides | Resultado | Resultado seleccionado para nuestro estudio |
|---|---|---|---|---|---|---|---|---|---|
| Pareja, 1998 | EE. UU. | Unicéntrico | ≥18 | Todos casos confirmados de NPJ, sin VIH y con PaO2 <65 mmHg o saturación de oxígeno<90% | 30 (16 vs. 14) | Trasplante de órgano (13), enfermedad vascular del colágeno (9), neoplasia maligna (8) | Aumento >2 veces o PSL >60mg diarios | Mortalidad, intubación, duración de la ventilación mecánica, ingreso en UCI, necesidad de oxígeno suplementario, hospitalización | Mortalidad (análisis de subgrupos inclusive), necesidad de intubación o ventilación mecánica |
| Delclaux, 1999 | Francia | Multicéntrico | ≥16 | Todos casos confirmados de NPJ, sin VIH y con PaO2 <70mmHg | 31 (23 vs. 8) | Neoplasia hematológica (24), vasculitis (3), tumor sólido (2), otras (2) | De novo: >1mg/kg de PSL o 240mg de mPSL durante 3 días, seguidos de 120mg de PSL o 60mg de mPSL durante 3 días (o el período de tratamiento) Rescate: aumento >3 veces | Mortalidad, intubación | Mortalidad (análisis de subgrupos inclusive), necesidad de intubación o ventilación mecánica |
| Roblot, 2003 | Francia | Multicéntrico | ≥18 | Todos casos confirmados de NPJ sin VIH | 60 (35 vs. 25) | Neoplasia hematológica(60) | (No consta) | Mortalidad | Mortalidad |
| Bollee, 2007 | Francia | Unicéntrico | (Adultos) | Todos casos confirmados de NPJ sin VIH | 56 (21 vs. 35) | Neoplasia hematológica (44), cáncer sólido (9), miscelánea (3), anemia de Marchiafava-Micheli (1), síndrome de Fanconi (1), sarcoma de Kaposi (1) | 1mg/kg o 30mg de aumento de los corticoides diarios | Mortalidad | Mortalidad |
| Moon, 2011 | Corea | Unicéntrico | ≥16 | Todos casos confirmados de NPJ, sin VIH y con PaO2 ≤70mmHg o AaDO2 ≥35mmHg | 88 (59 vs. 29) | Trasplante de órgano sólido (26), neoplasia hematológica (26), neoplasia no hematológica (12), enfermedad pulmonar intersticial (9), enfermedad del tejido conectivo (7), otras (8) | <72 h del inicio del tratamiento de la NPJ, 40mg dos veces al día durante 5 días, seguido de una reducción gradual | Mortalidad, insuficiencia respiratoria | Mortalidad (análisis de subgrupos inclusive) |
| Kim, 2014 | Corea | Multicéntrico | Todos | Todos casos confirmados de NPJ sin VIH | 173 (152 vs. 21) | Neoplasia hematológica (81), tumor sólido (38), trasplante de órgano (17), otras (artritis reumatoide, dermatológica, glomerulonefritis, púrpura de Henoch-Schonlein) (37) | (No consta) | Mortalidad | Mortalidad |
| Kofteridis, 2014 | Grecia | Unicéntrico | (Adultos) | Todos casos confirmados de NPJ sin VIH | 62 (50 vs. 12) | Neoplasia hematológica (31), tumor sólido (16), enfermedad inflamatoria crónica (15) | (No consta) | Mortalidad | Mortalidad |
mPSL: metilprednisolona; NPJ: neumonía por Pneumocystis jirovecii; PSL: prednisolona.
Perfiles de tratamiento de los pacientes de los estudios
| Estudio (autor, año) | Administración diaria de PSL (n.° de casos) | Otros inmunosupresores (n.° de casos) | Profilaxis de la NPJ |
|---|---|---|---|
| Pareja, 1998 | 17,2 mg±12,8mg (24) | FK506 (6), ciclosporina (2), metotrexato (2), fludarabina (1) | Sin profilaxis |
| Delclaux, 1999 | (No consta) | (No consta) | (No consta) |
| Roblot, 2003 | 52,6 mg±44,0mg (25) | Quimioterapia (49) | 3 (0,5%) |
| Bollee, 2007 | Corticoides crónicos (24), PSL 30mg (RIC 15-45 mg) media: 6,5 meses | Corticoides crónicos+quimioterapia/inmunosupresores (12), corticoides discontinuos+quimioterapia/inmunosupresores (8), quimioterapia y/o inmunosupresores (15) | 6 (10,7%) |
| Moon, 2011 | Corticoides, no constan las dosis (34) | Inmunosupresores de linfocitos T (31), fármacos anticancerosos (37) | (No consta) |
| Kim, 2014 | Corticoides en las 2 semanas siguientes, no constan las dosis (128) | Quimioterapia (107) | 6 (3,5%) |
| Kofterideis, 2014 | Corticoides, no constan las dosis (30) | Quimioterapia (26), corticoides+quimioterapia (17) | 21 (35%) |
NPJ: neumonía por Pneumocystis jirovecii; PSL: prednisolona; RIC: rango intercuartil.
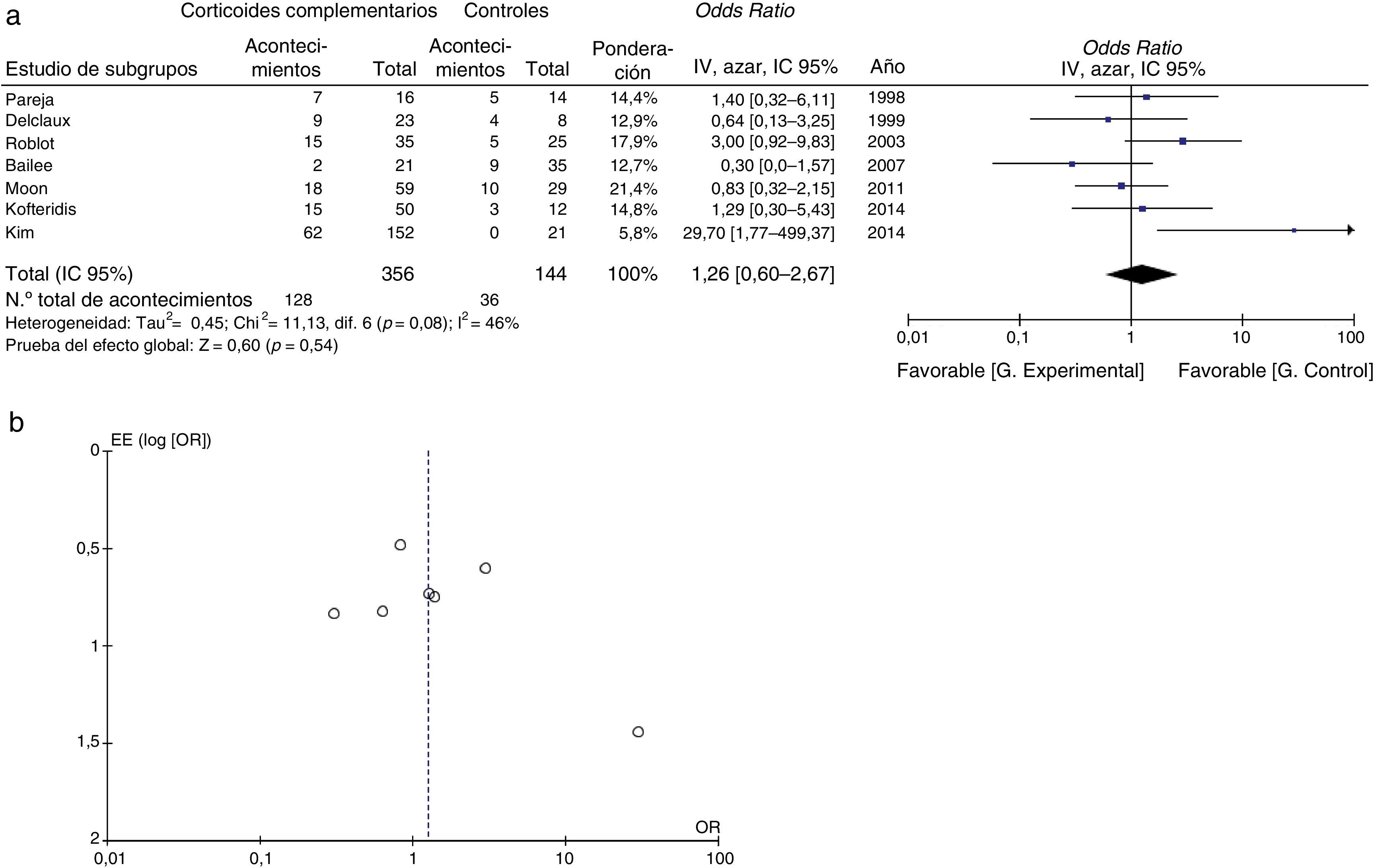
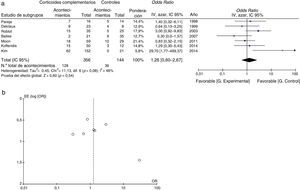
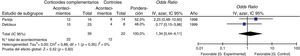
Todos los estudios aportaban datos de mortalidad. A partir de los resultados de los siete estudios observacionales se estimó que la OR combinada de la mortalidad de los pacientes que recibían tratamiento complementario con corticoides era de 1,26 (intervalo de confianza del 95% [IC 95%], 0,60–2,67, p=0,54, I2=46%, p para heterogeneidad=0,08), un resultado que no demuestra la eficacia del uso de corticoides complementarios en los pacientes no infectados por VIH (fig. 2a). Se observaron algunos resultados conflictivos y la heterogeneidad fue moderada. En la figura 2b se presenta un gráfico de embudo de la OR de la mortalidad. La ligera asimetría observada entre los estudios, que no alcanzó significación estadística (prueba de Egger, p=0,230), indica un posible sesgo de publicación.
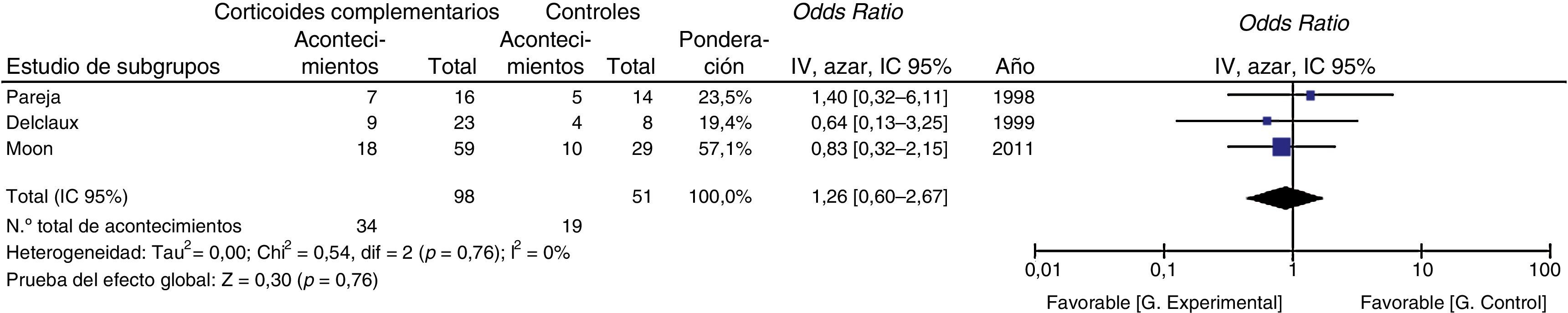
En el análisis de subgrupos, el hecho de recibir corticoides complementarios no redujo la mortalidad de los pacientes no infectados por VIH con NPJ e hipoxemia significativa (PaO2<70mmHg) (fig. 3).
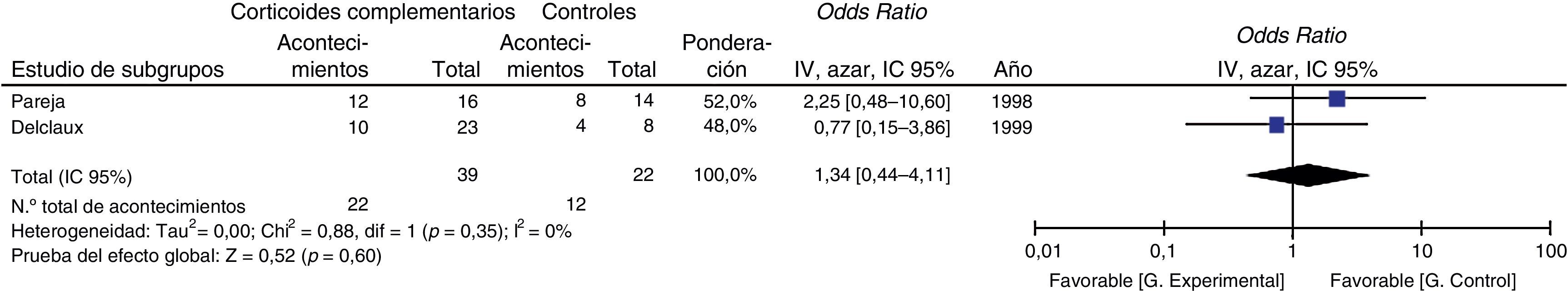
Variable secundariaLa necesidad de intubación o ventilación mecánica se evaluó en dos estudios, cuya OR combinada fue de 1,34 [IC 95% 0,44–4,11, p=0,60, I2=0%, p para heterogeneidad=0,35] (fig. 4).
DiscusiónEste metanálisis no aportó ninguna prueba de efectos beneficiosos sobre la mortalidad del tratamiento complementario con corticoides de los pacientes con NPJ y VIH negativo. Tampoco se hallaron diferencias estadísticamente significativas en la mortalidad de los pacientes con NPJ e hipoxemia (PaO2 <70mmHg) no infectados por VIH frente a los infectados por VIH8. El tratamiento tampoco indicó tener ningún efecto sobre la necesidad de intubación o ventilación mecánica, que informes anteriores consideraban que son factores de pronóstico de la evolución clínica18,19.
A pesar de que en un ensayo controlado aleatorizado8 se observó que con la administración de corticoides a pacientes infectados por VIH con NPJ e hipoxemia sustancial se reducía de manera significativa el riesgo relativo de muerte, en ningún estudio observacional publicado de pacientes no infectados por VIH se han logrado mostrar diferencias en la mortalidad. Además, los resultados de Delclaux12, Bollee14 y Moon15 demuestran que el tratamiento complementario con corticoides podría tener un ligero efecto beneficioso sobre la mortalidad, mientras que en el estudio de Kim16 (que es el que se realizó en una muestra más grande de pacientes) se observó un efecto negativo de los corticoides. Estos resultados sugieren que las diferencias en la fisiopatología contribuyen a la disparidad observada entre los pacientes con NPJ infectados por VIH y los no infectados por este virus.
En pacientes con VIH e hipoxemia intensa, los corticoides se usan de forma simultánea con el tratamiento de la infección por Pneumocystis para atenuar la excesiva inflamación transitoria que se asocia con la muerte inducida por fármacos para erradicar P. jiroveciii6, lo que puede mejorar la evolución clínica. La carga de P. jirovecii en los pulmones de los pacientes infectados por VIH con NPJ suele ser alta5. Una posible explicación de la falta de efecto sobre la mortalidad de los pacientes con NPJ no infectados por VIH podría ser que la baja carga microbiana pulmonar que presentan estos pacientes limita los beneficios potenciales del tratamiento12.
Por otro lado, la administración de corticoides constituye un factor de riesgo importante de NPJ20, especialmente en caso de administración crónica a pacientes no infectados por VIH3. El uso previo de corticoides puede alterar la respuesta a ese tratamiento complementario. Es decir, los efectos antiinflamatorios de los corticoides no son suficientemente potentes en los pacientes con NPJ que ya han recibido fármacos de esta clase. De hecho, en un informe ya se había mostrado una tendencia hacia mayor mortalidad de los pacientes no infectados por VIH con NPJ y que tomaban corticoides previamente21.
Otros resultados de esta revisión también son destacables. En primer lugar, la tasa de mortalidad del conjunto de los pacientes sin VIH y con NPJ fue del 32,8%, una tasa superior a la comunicada en pacientes con VIH y NPJ1. Es posible que estos resultados dependan más de los antecedentes médicos de los pacientes que de la gravedad de la NPJ o de la fisiopatología del P. jirovecii. No obstante, es necesario hacer un diagnóstico precoz y comenzar el tratamiento de inmediato, pues su retraso ha sido identificado como un factor de pronóstico de la NPJ22.
En segundo lugar, la profilaxis del P. jirovecii fue infrecuente en todos los estudios. Un reciente metanálisis sobre la prevención de la NPJ en pacientes inmunodeprimidos y no infectados por VIH23 indicó que la necesidad de profilaxis con fármacos anti-Pneumocystis es mayor. Por consiguiente, debido a la elevada tasa de mortalidad de la NPJ, es necesario enfatizar la profilaxis de los pacientes que reciben tratamiento crónico con corticoides u otros fármacos inmunosupresores.
Esta revisión sistemática tuvo algunas limitaciones que debemos mencionar. En primer lugar, a pesar de que el sesgo de publicación de este metanálisis no alcanzó la significación estadística, podría contener un sesgo de confusión, debido al carácter observacional y retrospectivo de todos los estudios incluidos y al desconocimiento de los efectos reales sobre la mortalidad. También es posible que los pacientes graves reciban corticoides complementarios con mayor frecuencia, lo que podría dar lugar a una infraestimación de sus efectos. Sin embargo, efectuar un ensayo controlado aleatorizado puede ser difícil, debido a que pocos pacientes no infectados por VIH desarrollan NPJ y a que muchos médicos incluyen los corticoides complementarios en el tratamiento de referencia de la NPJ, independientemente de la presencia o ausencia de VIH. Desde este punto de vista, en nuestro metanálisis se observa una marcada tendencia entre los pacientes no infectados por VIH y con NPJ. En segundo lugar, se observó heterogeneidad entre los estudios. Los pacientes no infectados por VIH con NPJ constituyen un grupo heterogéneo, lo que dificulta la realización de un análisis estratificado de subgrupos. La falta de coherencia en las características de los pacientes no infectados por VIH podría dificultar que se alcance significación estadística. Además, no hubo uniformidad en las definiciones del tratamiento complementario con corticoides en los estudios incluidos, y el uso de dosis insuficientes de corticoides podrían afectar a los resultados clínicos.
ConclusionesA pesar de que los estudios incluidos fueron puramente observacionales, en este metanálisis se demostró que los corticoides adyuvantes no mejoran los resultados de la NPJ en pacientes no infectados por VIH. Aun así, estos resultados deben confirmarse mediante un ensayo controlado aleatorizado.
Autoría/colaboradoresYuji Fujikura: búsqueda en la literatura, recogida de datos, análisis de los datos, preparación del manuscrito.
Toshie Manabe: búsqueda en la literatura, recogida de datos, análisis de los datos, revisión del manuscrito.
Akihiko Kawana: revisión del manuscrito.
Shigeru Kohno: diseño del estudio, revisión del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este metanálisis y revisión sistemática se llevó a cabo en paralelo con la redacción de las Orientaciones prácticas para la neumonía de la Sociedad Respiratoria Japonesa. Expresamos nuestro agradecimiento a todos los miembros del comité.