La disnea es una experiencia sensorial compleja, multidimensional y muy personal cuyo origen y mecanismos todavía se están investigando. La disnea de esfuerzo es uno de los síntomas más frecuentes de los pacientes que padecen enfermedades cardiopulmonares y un motivo habitual que les impulsa a buscar atención médica. El síntoma progresa de forma implacable a medida que la enfermedad avanza y conduce al paciente a evitar la actividad, con la consecuente atrofia de la musculatura periférica y pérdida de calidad de vida. La disnea guarda una estrecha relación con la calidad de vida, la (in)tolerancia al ejercicio y el pronóstico de diversas patologías, que incluyen la enfermedad pulmonar obstructiva crónica, la insuficiencia cardíaca, la enfermedad pulmonar intersticial y la hipertensión pulmonar, por lo que es un objetivo terapéutico importante.
El manejo y tratamiento eficaces de la disnea suponen un importante desafío para los cuidadores, y las opciones terapéuticas que pretenden revertir la causa subyacente solo han sido satisfactorias hasta cierto punto. En esta «revisión» intentaremos desvelar los mecanismos fisiológicos de la disnea de esfuerzo y traducirlos o aplicarlos a una amplia gama clínica de patologías cardiorrespiratorias.
Dyspnoea is a complex, highly personalized and multidimensional sensory experience, and its underlying cause and mechanisms are still being investigated. Exertional dyspnoea is one of the most frequently encountered symptoms of patients with cardiopulmonary diseases, and is a common reason for seeking medical help. As the symptom usually progresses with the underlying disease, it can lead to an avoidance of physical activity, peripheral muscle deconditioning and decreased quality of life. Dyspnoea is closely associated with quality of life, exercise (in)tolerance and prognosis in various conditions, including chronic obstructive pulmonary disease, heart failure, interstitial lung disease and pulmonary hypertension, and is therefore an important therapeutic target.
Effective management and treatment of dyspnoea is an important challenge for caregivers, and therapeutic options that attempt to reverse its underlying cause have been only partially successful This “review” will attempt to shed light on the physiological mechanisms underlying dyspnoea during exercise and to translate/apply them to a broad clinical spectrum of cardio-respiratory disorders.
Es necesario documentar y evaluar minuciosamente la disnea por, al menos, las siguientes razones: a)la disnea de esfuerzo suele ser uno de los problemas más precoces y molestos por los que los pacientes que padecen enfermedades cardíacas o pulmonares buscan atención médica; b)suele progresar a medida que la enfermedad avanza y a menudo conduce a un círculo vicioso caracterizado por la evitación de la actividad física, con la consecuente atrofia muscular y pérdida de calidad de vida; c)afecta a hasta la mitad de los pacientes con enfermedades crónicas; d)la disnea guarda una estrecha relación con la calidad de vida, la (in)tolerancia al ejercicio y el pronóstico de diversas patologías, incluida la enfermedad pulmonar obstructiva crónica (EPOC), en la que es un factor predictivo de mortalidad más preciso que el volumen espiratorio forzado en un segundo (VEF1) y, en pacientes con enfermedad cardíaca sometidos a una prueba de esfuerzo, la disnea predice mejor la mortalidad que la presencia de angina, y e)es un factor que condiciona el cumplimiento de los programas de entrenamiento físico en varias poblaciones, incluidos los pacientes con EPOC.
El manejo y tratamiento efectivos de la disnea es un importante desafío para los cuidadores, y las opciones terapéuticas que pretenden revertir la causa subyacente solo han sido satisfactorias hasta cierto punto1-7.
Tanto la American Thoracic Society8 como la European Respiratory Society1 han subrayado el carácter multidimensional de la disnea, que comprende 3 dimensiones básicas: 1)la dimensión sensoperceptiva; 2)el sufrimiento afectivo (o emocional), y 3)el impacto de los síntomas.
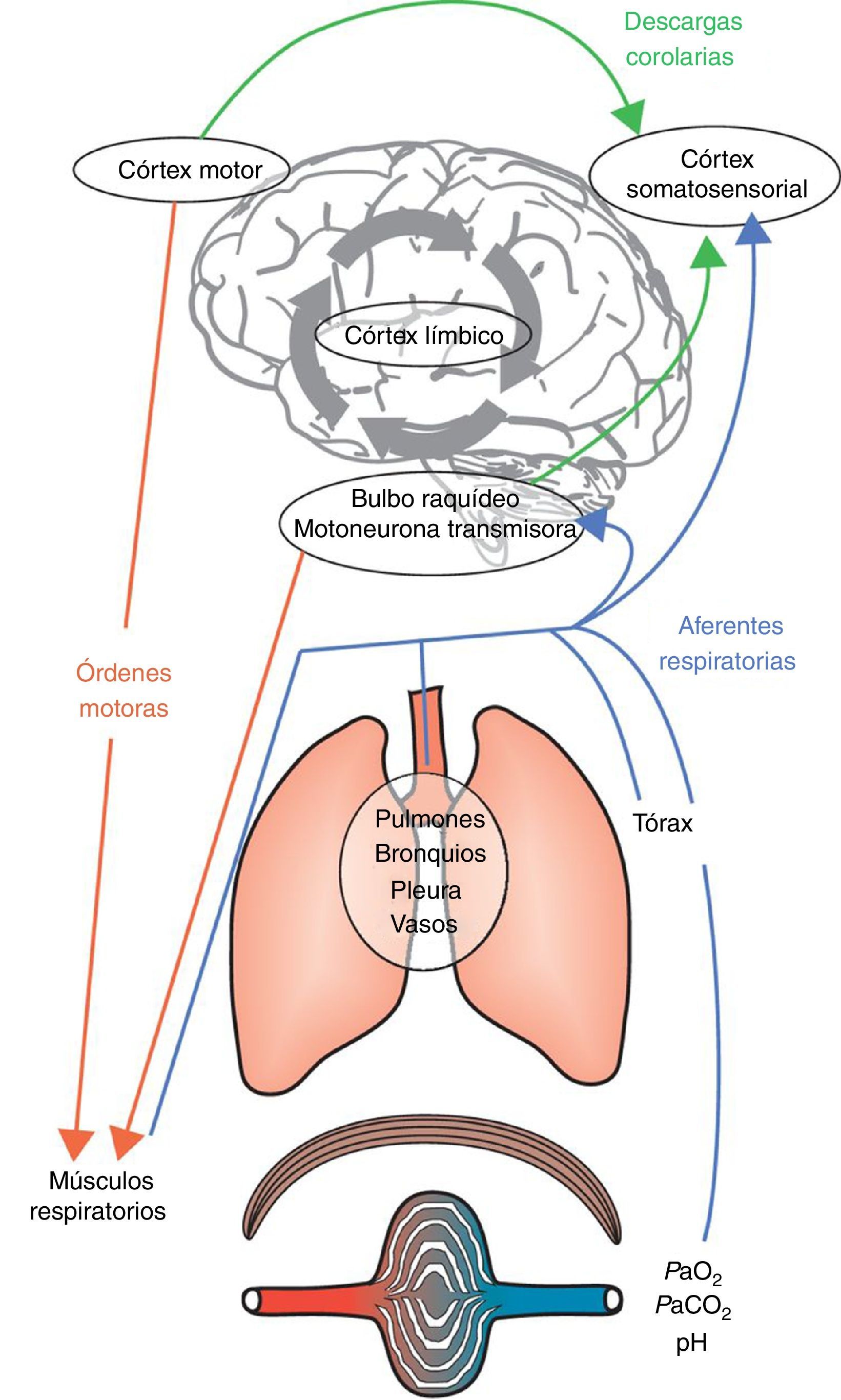
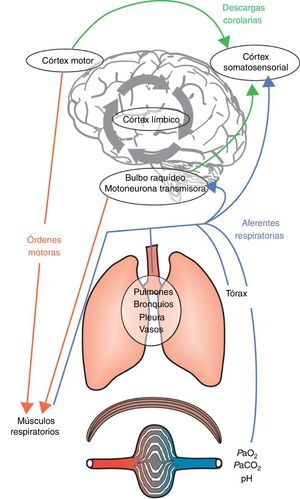
La disnea es una experiencia sensorial compleja y muy personal cuyos orígenes y mecanismos todavía no se conocen bien. El síntoma se manifiesta cuando existe una percepción consciente de disociación entre lo que el cerebro espera (a través de la «descarga corolaria», es decir, una copia de la actividad motora descendente a las áreas perceptivas) y la información que recibe del aparato respiratorio, la musculatura respiratoria, los quimiorreceptores periféricos y el aparato locomotor8. No todas las sensaciones respiratorias conscientes se etiquetan de «disnea», puesto que el cerebro es capaz de «filtrar» la mayoría de las informaciones respiratorias aferentes y solo permite que algunas de ellas alcancen el nivel consciente1. Este mecanismo de filtrado sensorial permite que el cerebro se distancie de información sensorial irrelevante. Los seres humanos están dotados de la capacidad voluntaria de percibir la «respiración» en cualquier momento. Por otro lado, si la respiración requiere atención inmediata, es imposible ignorarla, y esta sensación es la que normalmente se denomina disnea. Este «proceso de apertura» tiene una función instrumental y permite supervisar funciones biológicas y fisiológicas esenciales y adoptar la conducta adecuada. La apertura neural a información aferente respiratoria en el córtex cerebral desencadena la percepción cognitiva de estar respirando y una respuesta emocional o afectiva1. Se puede resumir que la disnea puede ser consecuencia de dos mecanismos interrelacionados: 1)un mecanismo discriminativo que identifica información aferente relevante relativa a alteraciones respiratorias y la conduce a la consciencia (componentes sensoriales: intensidad y calidad), y 2)un mecanismo afectivo que etiqueta estas sensaciones como desagradables o peligrosas (fig. 1).
Mecanismos integrantes de la etiología de la disnea. La acción de respirar es consecuencia de órdenes motoras del bulbo raquídeo y del córtex motor. Estas órdenes son integradas a nivel medular y transmitidas a los efectores musculares del aparato respiratorio. La activación subsiguiente de los músculos respiratorios produce una retroalimentación aferente, que se transmite a las fuentes de las órdenes motoras y al córtex somatosensorial. En este punto, la comparación entre la descarga corolaria y la retroalimentación aferente resultante pueden producir un desajuste y la disnea aparecerá cuando los efectos negativos desde el córtex límbico sean atribuidos a este desajuste sensorial, lo que también está influenciado y modulado por la memoria y el entorno predominante.Adaptado con permiso a partir de Laviolette y Laveneziana1.
La disnea se puede cuantificar («intensidad»). La disnea de esfuerzo se puede definir como «la percepción de malestar respiratorio que aparece con niveles de actividad que normalmente no causan este tipo de malestar». La intensidad de la disnea se puede determinar evaluando el nivel de actividad necesario para que se desencadene1.
Así, la disnea se puede evaluar durante una actividad física, como una prueba de esfuerzo cardiopulmonar (PECP)1,8. Para ello se puede utilizar la escala de 10 puntos de Borg, que permite calificar sensaciones respiratorias específicas (p.ej., dificultad inspiratoria, esfuerzo de la respiración, dificultad espiratoria, falta de aire, etc.) o más generales (p.ej., dificultad respiratoria, falta de aliento). Aunque no tan popular, la escala visual analógica (EVA) es otro instrumento de medición de la disnea con validez probada durante la PECP. La EVA y la escala de Borg han demostrado proporcionar puntuaciones similares durante la PECP y ser escalas fiables y reproducibles en sujetos sanos y en pacientes con enfermedades respiratorias crónicas que se someten a una PECP9. La ventaja de utilizar la escala de Borg o la EVA en pacientes individuales es la posibilidad de comparar de manera fiable la «intensidad de la disnea de esfuerzo» con un mismo nivel de actividad física (ritmo de actividad, consumo de oxígeno o ventilación estandarizados durante la PECP) entre sujetos, y evaluar la respuesta a una intervención terapéutica9. En algunos estudios se ha demostrado la estrecha correlación que existe entre la intensidad del esfuerzo respiratorio (determinado mediante la presión esofágica corriente en relación a la máxima) y la intensidad de la disnea (determinada mediante la escala de Borg) durante una PECP, y la asociación de las intervenciones farmacológicas capaces de reducir la magnitud (y la duración) del esfuerzo respiratorio con la reducción de la intensidad de la disnea1,9.
¿Se pueden evaluar conjuntamente la calidad y la cantidad de disnea?La naturaleza y la intensidad de la disnea se pueden evaluar conjuntamente durante una PECP. Algunos estudios han demostrado que los pacientes con EPOC y los pacientes con asma leve estable son capaces de percibir cambios dinámicos en su mecánica respiratoria durante el ejercicio. Una vez se ha alcanzado un volumen de reserva inspiratoria (VRI) crítico (0,3-0,5l de la capacidad pulmonar total [CPT]), la expansión del volumen corriente se restringe, la intensidad de la disnea aumenta de forma abrupta y se produce una transición en la elección del descriptor cualitativo principal, de inspiración laboriosa/con esfuerzo a difícil/insatisfactoria1. La relevancia clínica de este fenómeno radica en que, al evaluar la calidad de la disnea al final de una tanda de ejercicios, se puede comprobar si este ha alcanzado un VRI crítico (inspiración difícil/insatisfactoria) o no (laboriosa/con esfuerzo)1. La PECP permite entender los mecanismos que subyacen a la disnea durante el ejercicio (disnea de esfuerzo) y también puede ayudar al médico a identificar otros mecanismos causantes de mayor intensidad de la disnea que podrían ser «independientes» o «no directamente relacionados» con el determinante fisiopatológico principal/obvio de la enfermedad analizada.
Componentes afectivos y emocionalesLas sensaciones respiratorias incluyen componentes afectivos que se pueden modular con y/o variar de forma independiente de las dimensiones sensoriales de la disnea. A este respecto, tanto el dolor como la disnea comparten aspectos multidimensionales similares1,8. En sujetos sanos que respiran frente a cargas inspiratorias, la percepción de malestar de las sensaciones respiratorias aumenta más que la percepción de intensidad, lo que indica que las dimensiones sensorial y afectiva de la disnea se pueden diferenciar de manera similar a lo que ocurre en la percepción del dolor10. Por otro lado, la avidez de aire se asocia más a menudo a una sensación de malestar y a un componente emocional negativo que el trabajo/esfuerzo.
Se han diseñado escalas que evalúan el malestar respiratorio incorporando calificaciones de intensidad y descriptores afectivos y emocionales, tales como el Perfil multidimensional de disnea11-13 o la escala Disnea-12, que han sido validados en sujetos sanos y en pacientes con enfermedades respiratorias crónicas14-17.
Impacto de los síntomas o carga sintomáticaEl componente de impacto de los síntomas/carga sintomática valora el efecto de la disnea o dificultad respiratoria sobre la capacidad funcional, el empleo (discapacidad), la calidad de vida o el estado de salud1,8. Las mediciones comprenden: a)una puntuación unidimensional de discapacidad o limitación de la actividad (p.ej., la escala MRC); b)mediciones unidimensionales o multidimensionales de la capacidad funcional, y c)escalas multidimensionales de calidad de vida/estado de salud. Entre los cuestionarios se incluyen: el Índice de disnea inicial-Índice de disnea de transición (BDI-TDI), el Cuestionario respiratorio crónico y el Cuestionario respiratorio St. George1,8.
De la fisiología en la salud…La disnea puede percibirse como una sensación de esfuerzo respiratorioCuando la ventilación se incrementa de forma voluntaria, el córtex motor potencia la señal motora de salida a la musculatura respiratoria y, a través de interneuronas corticales, transmite una copia (descarga corolaria central) al córtex sensorial/de asociación, al que informa del esfuerzo voluntario para incrementar la ventilación18. También es probable que la sensación de esfuerzo respiratorio surja de la activación simultánea del córtex sensorial y la contracción muscular: distintos receptores musculares proporcionan al sistema nervioso central información relativa a la fuerza y la tensión, y es posible que dicha información receptorial subyazca a la sensación de esfuerzo18. Con fines clínicos, la magnitud percibida del esfuerzo respiratorio se expresa mediante la razón entre la presión esofágica corriente (Pes) y la capacidad de la musculatura respiratoria para generar una presión máxima (PI,max)18. En sujetos sanos, el esfuerzo respiratorio voluntario es proporcional al desplazamiento de la pared torácica (es decir, el cambio del volumen corriente [VT] expresado como porcentaje de la capacidad vital [CV]) a través de la información propioceptiva aferente concurrente transmitida por los nervios vago, glosofaríngeo, raquídeos y frénico que controlan el desplazamiento, y procesada e integrada en el córtex sensorial. El resultado es un acoplamiento neuromecánico armónico que evita el malestar o dificultad respiratoria1,8,18.
La disnea puede percibirse como una sensación de avidez de aireEn determinadas circunstancias clínicas o experimentales, la relación entre la disnea y el esfuerzo es menos evidente. Si un sujeto normal reduce la ventilación hasta un nivel inferior al dictado por la pulsión química (CO2), la disnea aumenta sin el correspondiente aumento de los índices del esfuerzo respiratorio1,8,18. De manera similar, en condiciones experimentales y clínicas en las que los receptores de tensión periféricos están inhibidos, el córtex sensorial no recibe información sobre la respuesta ventilatoria18. En estas circunstancias la disnea se percibe como una sensación de avidez de aire cuya intensidad depende del desajuste que exista entre la pulsión ventilatoria generada por el estímulo químico y la inhibición continuada de los sensores mecánicos pulmonares que señalan el nivel de ventilación1,8,18. A su vez, la disnea puede aparecer y variar cualitativamente cuando la información aferente periférica se modifica y el rendimiento motor inspiratorio se incrementa o se estabiliza1,8,18.
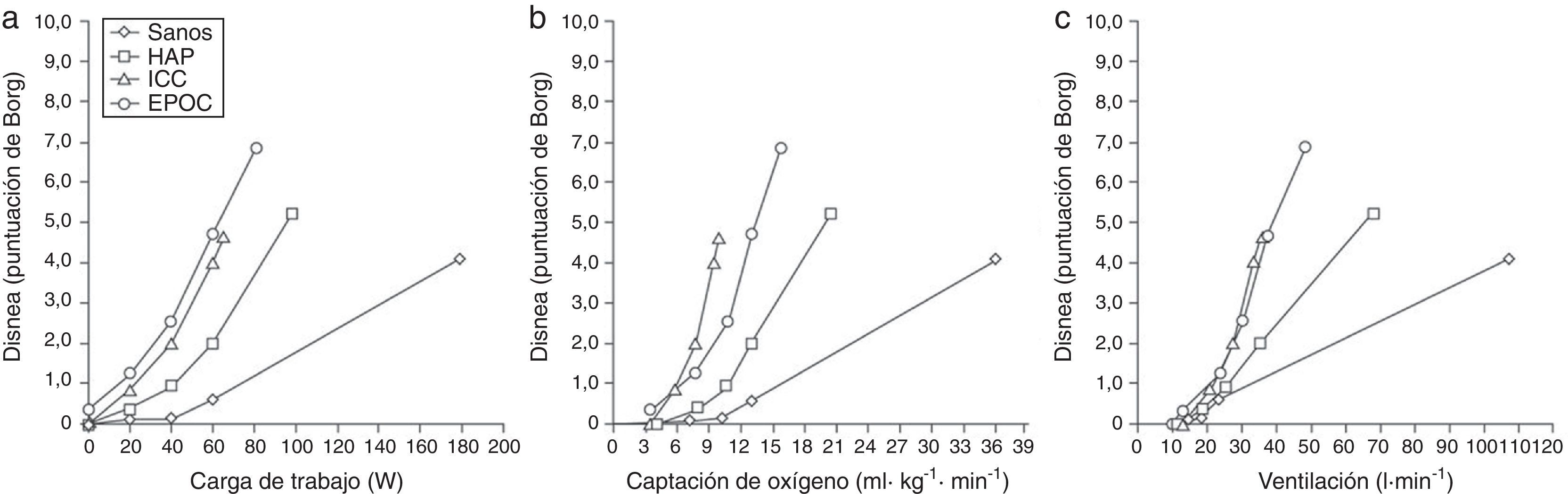
Disnea de esfuerzo en sujetos sanos no deportistasDurante el ejercicio, la respiración se adapta a las demandas muscular y cardiovascular. En sujetos sanos no deportistas la reserva del aparato respiratorio normalmente está conservada y el ejercicio está limitado por el hecho de alcanzar la capacidad máxima del aparato cardiovascular o del aparato locomotor. Por consiguiente, la fatiga muscular suele ser la causa principal del cese del ejercicio en sujetos sanos. Una excepción destacable son los atletas de alto nivel, que pueden notar una limitación respiratoria durante el ejercicio causada por el rendimiento cardiovascular o muscular excepcional1. En sujetos sanos, el aumento de la disnea es proporcional a la ventilación por minuto, que depende del esfuerzo contráctil respiratorio. Este esfuerzo se determina mediante la razón entre el cambio en la presión esofágica corriente en relación a la presión máxima (véase más arriba). En su nivel máximo de esfuerzo limitado por los síntomas, los adultos jóvenes sanos en general califican la intensidad de la disnea de «moderada» o «intensa» (fig. 2), y la describen como una sensación intensificada de esfuerzo, «trabajo» o «pesadez» respiratorios1.
Se muestra la intensidad de la disnea de esfuerzo (puntuada mediante la escala de Borg) en respuesta a un incremento de la carga de trabajo (izquierda), el consumo de oxígeno (centro) y la ventilación por minuto (derecha) en un sujeto sano, un paciente con EPOC, un paciente con insuficiencia cardíaca crónica (ICC) y un paciente con hipertensión arterial pulmonar (HAP). Datos obtenidos en el laboratorio de los autores, en París, Francia.Adaptado con permiso a partir de Laviolette y Laveneziana1.
En esta población, dichas sensaciones no suelen asociarse con una respuesta emocional negativa, porque representan la respuesta ventilatoria esperada a un esfuerzo intenso1. Si la actividad mecánica del aparato respiratorio es adecuada para el nivel de pulsión motora respiratoria central imperante, el aumento de la intensidad de la disnea es directamente proporcional al nivel de pulsión respiratoria neural y se describe como una sensación intensificada de esfuerzo, trabajo o pesadez respiratorios1,8.
…a las consecuencias clínicas en las patologías cardiorrespiratoriasLos pacientes con enfermedades respiratorias y cardiovasculares muestran limitaciones respiratorias durante el ejercicio más a menudo, aunque la fatiga de la musculatura de las extremidades también puede contribuir a limitar el ejercicio. En comparación con sujetos de control de la misma edad, los pacientes con enfermedades cardiorrespiratorias muestran mayor grado de disnea con determinados niveles de carga de trabajo, consumo de oxígeno y ventilación por minuto (fig. 2). En los capítulos siguientes examinaremos los mecanismos que originan dichas diferencias.
Enfermedad pulmonar obstructiva crónicaDurante la actividad física, los pacientes con EPOC suelen seleccionar 2 grupos de descriptores cualitativos de la disnea19-22. Es habitual que los pacientes con EPOC seleccionen el grupo de descriptores que aluden a un incremento del trabajo/esfuerzo respiratorio («respirar requiere más esfuerzo o es más laborioso»). La sensación de mayor trabajo/esfuerzo guarda relación con el incremento de la pulsión motora a la musculatura respiratoria y de la pulsión neural central (debida a la quimioestimulación) como consecuencia de la progresiva alteración metabólica y de la ventilación/perfusión que se observa durante el ejercicio. Así, el mayor trabajo/esfuerzo percibido durante la actividad física refleja, en parte, la mayor demanda ventilatoria requerida para una tarea dada, en comparación con los sujetos sanos. Además, el esfuerzo de la musculatura contráctil aumenta con cualquier grado de ventilación debido a: 1)el aumento agudo de la carga mecánica intrínseca (elástica/umbral), y 2)la debilidad de la musculatura funcional respiratoria. Estas alteraciones respiratorias mecánicas/musculares están, en parte, relacionadas con el reposo y la hiperinsuflación dinámica durante el ejercicio, y pueden conducir a disminución de la PI,max o a mayor incremento de la Pes como porcentaje de la PI,max. Debido a estos efectos, para generar una fuerza determinada se requiere mayor pulsión neural o activación eléctrica de la musculatura respiratoria. Asimismo, debido a la activación del sistema límbico, la descarga corolaria puede ser percibida como anómala, lo que evoca sensación de angustia.
El segundo grupo de descriptores alude a la inspiración insatisfactoria. Las consecuencias fisiológicas negativas de las anomalías estructurales (bronquitis crónica y enfisema), es decir, la limitación del flujo espiratorio y la hiperinsuflación dinámica, causan disnea23. Respirar con un volumen pulmonar elevado produce graves consecuencias mecánicas y sensoriales. La hiperinsuflación pulmonar dinámica fuerza la necesidad de acomodar el volumen corriente (VT) al VRI, que se reduce progresivamente, y los tramos superiores no lineales de la relación presión-volumen del aparato respiratorio. En esta situación, los músculos inspiratorios pueden estar sometidos a una carga elástica sustancial. A medida que la hiperinsuflación pulmonar progresa, los músculos inspiratorios deben vencer el retroceso interno combinado del pulmón y la pared torácica al inicio de la inspiración, antes de que comience el flujo inspiratorio. La hiperinsuflación pulmonar dinámica acorta la longitud operativa de los músculos inspiratorios, lo que afecta a su capacidad de generar presión. La combinación de una carga demasiado elástica y resistiva produce debilidad muscular funcional, y el trabajo de los músculos inspiratorios para mantener la respiración corriente aumenta de forma abrupta. La consecuencia final es que la razón entre la presión esofágica (expresada en porcentaje de la presión inspiratoria máxima) y el VT (expresado en porcentaje de la CPT o de la CV) aumentan de forma considerable. Una de las principales consecuencias de la hiperinsuflación es la restricción que se impone a la expansión del VT: el desplazamiento torácico se reduce (la respuesta del VT en relación a la CPT o CV disminuye o incluso alcanza una meseta discernible) a pesar del flujo motor casi máximo que generan los músculos respiratorios. Esta disociación neuromecánica o neuroventilatoria causada por la hiperinsuflación dinámica es uno de los principales factores que contribuyen a la disnea de los pacientes con EPOC1,19-24.
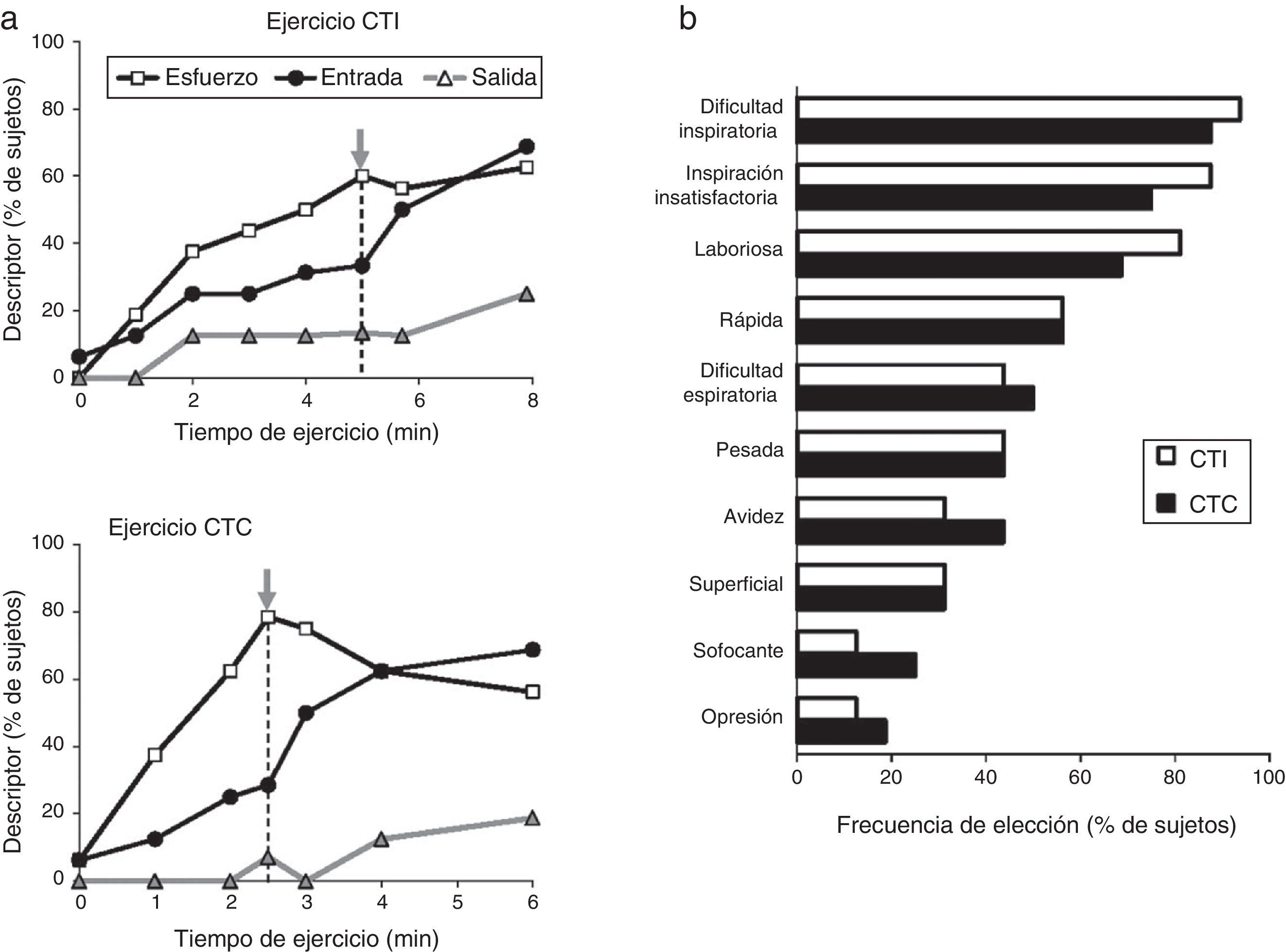
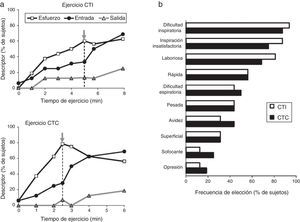
En efecto, la actividad física del paciente se caracteriza por un desajuste creciente entre el aumento de la estimulación neural central a la musculatura respiratoria y la disminución de la respuesta mecánica y/o muscular (desplazamiento de la pared torácica). Se ha propuesto que este desajuste, denominado disociación neuroventilatoria, constituye, al menos en parte, la base neurofisiológica de la sensación de inspiración insatisfactoria. En la práctica clínica, la pendiente que define la disociación neuroventilatoria (es decir, esfuerzo vs. desplazamiento) es más pronunciada y está desplazada hacia arriba en los pacientes, en comparación con los sujetos sanos. Con cualquier carga respiratoria, una pendiente más pronunciada producirá una disnea de mayor intensidad. En particular, los pacientes que durante el ejercicio experimentan una disnea intolerable, debido a que la expansión del VT está restringida (por los efectos de la hiperinsuflación pulmonar dinámica o de una capacidad inspiratoria en reposo ya reducida de forma crítica)23. Como ya se ha mencionado, este umbral de disnea parece estar situado en un VRI próximo a 0,5l23. Una vez se ha alcanzado este VRI crítico, la expansión ulterior del VT es muy difícil, la razón esfuerzo-desplazamiento del volumen (Pes/PI,max: VT/VC) aumenta de forma abrupta y la intensidad de la disnea aumenta de forma pronunciada hasta niveles intolerables19-22, independientemente del protocolo de la prueba de esfuerzo (ejercicio incremental o constante)19. Además, la consecución de limitaciones críticas en la expansión del VT también marcó el punto de transición en la elección del descriptor cualitativo dominante de «trabajo y esfuerzo» a «inspiración insatisfactoria»19 (fig. 3). En pacientes con EPOC, la intensidad y la calidad de la disnea evolucionan por separado y están muy influenciadas por limitaciones mecánicas en la expansión del VT durante el ejercicio19,20. Estos datos respaldan la importancia crucial de la restricción mecánica en el origen de la disnea de los pacientes con EPOC24.
A)Frecuencia de elección de los 3 descriptores evaluados durante un ejercicio con una carga de trabajo incremental (CTI) o constante (CTC): mayor trabajo y esfuerzo (esfuerzo), inspiración insatisfactoria (IN) y espiración insatisfactoria (ES). La flecha gris indica el inicio del punto de inflexión de la razón volumen corriente-ventilación durante el ejercicio. B)Frecuencia de elección de los descriptores de disnea obtenidos en el cuestionario al final del ejercicio.Adaptado con permiso a partir de Laveneziana et al.19.
Los pacientes que padecen trastornos neuromusculares (TNM) muestran una descarga neuromotora elevada que se percibe como un mayor esfuerzo muscular respiratorio y es probable que sea el principal mecanismo de la disnea que se observa en los TNM25. A pesar de ello, la significativa relación positiva entre el aumento de la disnea por unidad de incremento de ventilación y la elasticidad dinámica afecta al acoplamiento entre el esfuerzo respiratorio y el desplazamiento25.
Enfermedad pulmonar intersticialAl igual que en la EPOC, la mecánica dinámica respiratoria restrictiva limita la capacidad de los pacientes con enfermedad pulmonar intersticial (EPI) para incrementar la ventilación en respuesta a una mayor demanda metabólica o un trabajo físico26. Uno de los rasgos característicos de la EPI es la reducción de la distensibilidad y los volúmenes pulmonares. Ello tiene 2 consecuencias importantes: 1)los músculos inspiratorios deben generar mayor rendimiento motor y trabajo, y 2)la frecuente reducción de la CPT y el VRI en reposo, en comparación con los sujetos sanos. Por consiguiente, la expansión del VT está restringida al inicio del ejercicio «desde arriba» (reflejando las reducciones de la CPT y VRI), lo que fuerza un patrón de respiración rápida, superficial y menos efectiva. Las diferencias en la mecánica de la dinámica ventilatoria, que en algunos pacientes incluye una posible limitación del flujo espiratorio, contribuyen a las diferencias en la percepción cualitativa de los pacientes con EPI, es decir, dificultad inspiratoria/inspiración insatisfactoria y respiración superficial rápida18,26. Debido al incremento de la elasticidad dinámica y la pulsión respiratoria eferente, la base neurofisiológica de la dificultad inspiratoria/inspiración insatisfactoria puede radicar en la percepción consciente de una disociación entre la mayor pulsión para respirar (y el aumento del esfuerzo respiratorio concurrente, es decir, Pes/PI,max) y la respuesta mecánica limitada del aparato respiratorio (VT/VC), es decir, la incapacidad para expandir el VT de forma proporcional a la mayor pulsión a respirar26. A su vez, también se ha propuesto la posibilidad de que la intensidad de la disnea de esfuerzo en las EPI esté más relacionada con limitaciones mecánicas de la expansión del volumen que con los propios índices de esfuerzo inspiratorio26.
Insuficiencia cardíaca crónicaEl mensaje clave que los estudios de intervención terapéutica en pacientes con insuficiencia cardíaca (IC) crónica han aportado es que el alivio de la disnea de esfuerzo se asocia de forma sistemática con una reducción de la demanda ventilatoria excesiva (secundaria a una reducción de la pulsión neural central), una mejoría de la mecánica respiratoria y de la función muscular y, en consecuencia, un mejor acoplamiento neuromecánico del aparato respiratorio durante el ejercicio18. Se ha comunicado que el soporte de presión redujo la pendiente presión pleural inspiratoria corriente-tiempo sin afectar las calificaciones submáximas de disnea, pero permitió a los pacientes practicar ejercicio algunos minutos más sin que experimentaran un aumento significativo de la disnea27. Laveneziana et al.28 demostraron que la electroestimulación biventricular se asociaba con una mejoría de la intensidad de la disnea con determinados niveles de VE y de consumo de oxígeno (V’O2). Las pendientes disnea/VE disminuyeron sistemáticamente en ∼50% durante el ejercicio en respuesta a la electroestimulación cardíaca activa. La mejoría de la disnea durante la electroestimulación activa (en comparación con la modalidad de electroestimulación inactiva) se asoció con: 1)una necesidad ventilatoria reducida, probablemente debida a: a)un retraso de la acidosis metabólica secundaria a un mejor aporte o utilización del oxígeno, o ambos (como sugirió el aumento sistemático del umbral anaeróbico), y b)una mejoría de la relación ventilación-perfusión como consecuencia de la mejoría de la capacidad para reducir un espacio muerto fisiológico mayor durante el ejercicio debido a la mejor perfusión pulmonar (como sugirieron las mejorías de la pendiente y las razones VE/VCO2), y 2)una mejoría de los volúmenes pulmonares operativos dinámicos (debida a una hiperinsuflación dinámica reducida [reflejada por la mayor capacidad inspiratoria durante el ejercicio], la mejoría de la función muscular respiratoria, o ambas), y una mejoría de la capacidad de expansión del VT durante el ejercicio28. Los datos disponibles sugieren que la mayor demanda ventilatoria, la mecánica de la dinámica ventilatoria anormal y la disfunción de la musculatura respiratoria son instrumentales en el origen de la disnea de esfuerzo de los pacientes con insuficiencia cardíaca grave27,28.
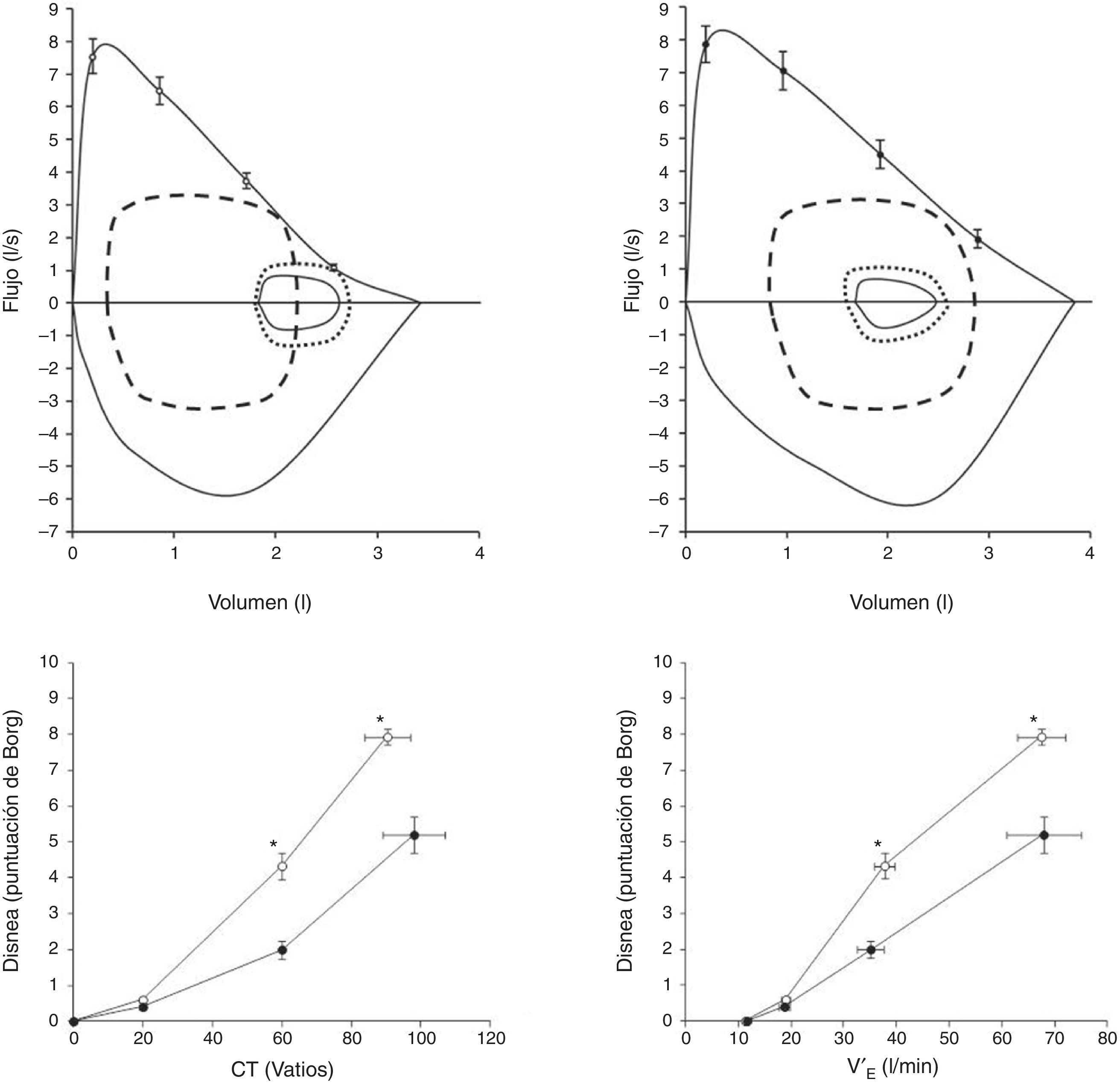
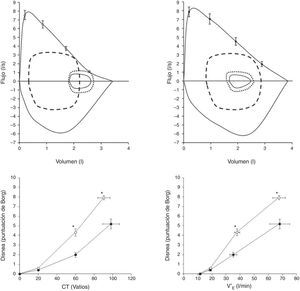
Hipertensión arterial pulmonarLa disnea de esfuerzo es, con diferencia, el síntoma predominante en los pacientes con hipertensión arterial pulmonar (HAP)29-31. Avances recientes en HAP han demostrado claramente que los flujos espiratorios del intervalo operativo corriente se encuentran reducidos en algunos pacientes con HAP (hasta un 60%), lo que podría promover la hiperinsuflación pulmonar dinámica inducida por el ejercicio (fig. 4)29.
Paneles superiores: se muestran las curvas de flujo-volumen máxima y a volumen corriente (líneas continuas) en pacientes con hipertensión arterial pulmonar (HAP), con hiperinsuflación (HAP-H; n=15, edad 40±11años; panel superior izquierdo) y sin hiperinsuflación (HAP-NH; n=10, edad 35±13años; panel superior derecho). Se presentan las curvas de flujo-volumen a volumen corriente en reposo, al inicio del ejercicio (línea de puntos) y en el momento de esfuerzo máximo (línea discontinua). En el panel de la izquierda se observa un descenso de la capacidad inspiratoria que confirma la hiperinsuflación dinámica.
Paneles inferiores: se muestra la intensidad de la disnea de esfuerzo (puntuada mediante la escala de Borg) en respuesta a una carga de trabajo incremental (panel izquierdo) (CT; panel inferior izquierdo) y la ventilación por minuto (V′E; panel inferior derecho) durante un ejercicio de pedaleo progresivo en pacientes con HAP-H (círculos abiertos) y pacientes con HAP-NH (círculos rellenos). Se presentan los valores medios±EE de los datos en reposo, a 20W, a 60W y durante el esfuerzo máximo.
*: p<0,05, HAP-H vs. HAP-NH.
Adaptado con permiso a partir de Laveneziana et al.29.
Laveneziana et al.29 fueron los primeros que examinaron el efecto de las posibles restricciones mecánicas críticas inducidas por la hiperinsuflación pulmonar dinámica sobre la intensidad de la disnea en pacientes jóvenes con HAP idiopática o hereditaria, no fumadores y sometidos a una PECP con esfuerzo progresivo y sintomatología limitada. Demostraron que hasta en un 60% de los pacientes con HAP se dan flujos espiratorios reducidos a bajos volúmenes pulmonares a pesar de un cciente VEF1/CV preservado. Al superponer un mayor desajuste ventilación/perfusión a la anomalía preexistente de la función de las vías aéreas, los síntomas molestos durante el esfuerzo aumentaron. A pesar del probable carácter multifactorial de la disnea de estos pacientes, estos resultados claramente indican que se debe considerar el aumento de la demanda ventilatoria y la anomalía en la mecánica ventilatoria dinámica de los pacientes con HAP29, en ausencia de una disfunción de la musculatura respiratoria31 o de cambios en la CPT29.
ObesidadSe cree que el aumento en la pulsión neural respiratoria es la que justifica similarmente el aumento de la disnea en sujetos obesos y delgados32. No obstante, otros mecanismos subyacentes pueden afectar la disnea en los sujetos obesos. Al aplicar la corrección correspondiente a la mayor cantidad de masa magra33, el rendimiento del ejercicio es menor en los sujetos obesos, en comparación con los sujetos sanos de peso normal, pero normal al expresarlo en porcentaje del peso corporal ideal previsto en aquellos sujetos con el mismo grado de hiperinsuflación que el de los sujetos obesos con «deflación», alcanzando ambos grupos puntuaciones de disnea similares34. En los sujetos «hiperinsufladores» la hiperinsuflación dinámica y la disminución del VRI aumentan la carga de la musculatura respiratoria, la pulsión respiratoria y la percepción de malestar respiratorio34. En contraste, en reposo, los «deflatores» muestran una relación negativa entre el volumen pulmonar al final de la espiración (VPFE, o EELV por sus siglas en inglés) y la respuesta respiratoria perceptual durante el ejercicio: a menor VPFE, mayor puntuación de Borg34. Un bajo VPFE en reposo tiene 3 consecuencias importantes durante el ejercicio que están relacionadas: 1)la disminución del volumen de reserva espiratoria; 2)la compresión dinámica de las vías aéreas, y 3)cambios en la presión transmural de las vías aéreas que producen una compresión dinámica de estas. Por consiguiente, una alteración de la pulsión central a la musculatura respiratoria en respuesta a la actividad aferente de los receptores mecánicos de las vías aéreas superiores también puede contribuir a la desagradable sensación respiratoria que padecen los sujetos obesos.
AsmaEn diferentes condiciones, que van desde la broncoconstricción inducida hasta el ejercicio físico, los pacientes asmáticos mencionan 3 descriptores cualitativos de la disnea predominantes: 1)la opresión torácica; 2)el mayor trabajo/esfuerzo («respirar requiere más trabajo o esfuerzo»), y 3)la inspiración insatisfactoria/no recompensada («no puedo tomar aire suficiente»)35-37. Se ha descrito la relación que existe entre factores sensoriales y mecánicos durante la prueba de la provocación con metacolina37-39, una prueba que permite evaluar la intensidad36,40,41 y la calidad36,38,42 de la disnea en una amplia gama de respuestas broncoconstrictoras, que van desde la broncoconstricción menor a la hiperinsuflación pulmonar grave36,37. Se ha propuesto que la hiperinsuflación pulmonar está relacionada con factores mecánicos, tales como la carga o la actividad de la musculatura respiratoria inducida por la hiperinsuflación37,43 que, en pacientes asmáticos, tiene una influencia sobre la percepción de la disnea durante la broncoconstricción aguda37,44 y el ejercicio35. También se ha probado que los descriptores de la disnea son un suplemento útil para la calificación global de la intensidad de la disnea durante el control de la respuesta al tratamiento broncodilatador en el broncoespasmo agudo45.
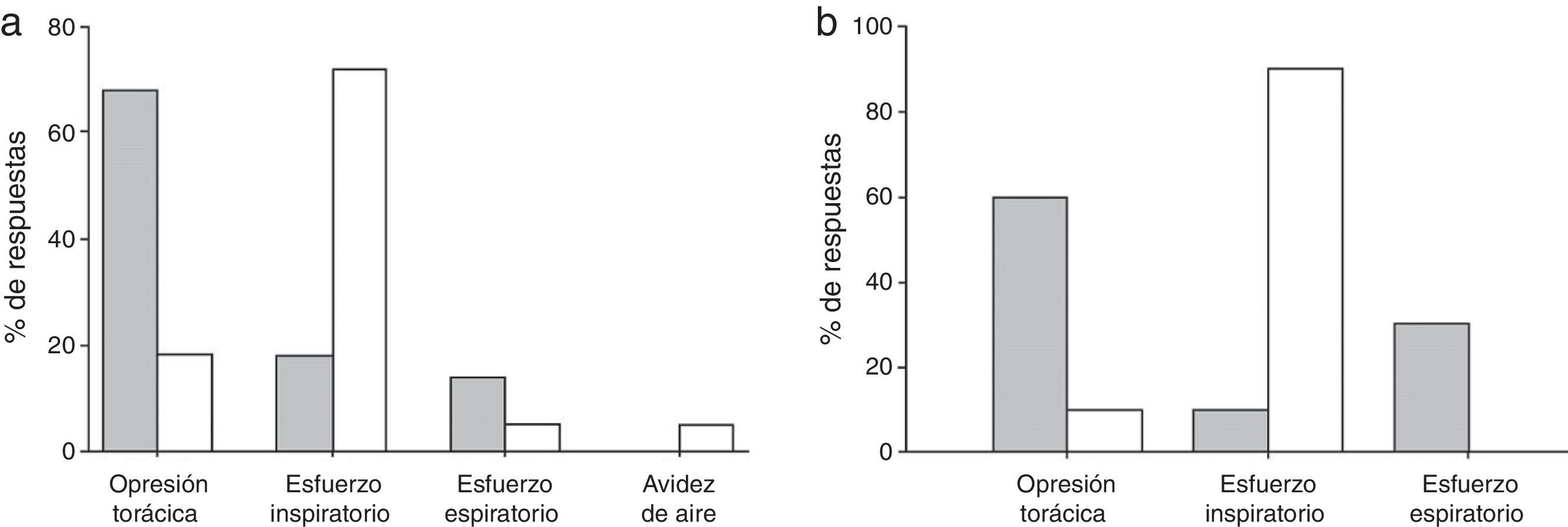
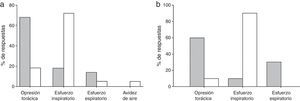
Los muchos descriptores que caracterizan el asma bronquial indican que es posible que los mecanismos que subyacen a la disnea sean diversos en esta población de pacientes, lo que sugiere la posibilidad de distinguir las diferentes causas de disnea en estos pacientes42. Basándose en los efectos contrapuestos de la obstrucción de las vías aéreas y la hiperinsuflación pulmonar dinámica en el lenguaje de la disnea durante la prueba de provocación37,38, y que un aumento en los volúmenes pulmonares no parece contribuir de forma crucial a la limitación del ejercicio y la intensidad de la disnea en sesiones de ejercicio de corta duración46, Laveneziana et al.36 plantearon la hipótesis de que los pacientes asmáticos pueden elegir diferentes descriptores, independientemente de la intensidad de la disnea durante las sesiones con ciclos de ejercicio de corta duración y la prueba de provocación con metacolina (fig. 5A). La obstrucción de las vías aéreas y la hiperinsuflación pulmonar dinámica, determinadas a partir de la reducción de la IC, mostraron mayor correlación con la disnea durante la prueba de provocación con metacolina35. La opresión torácica fue el descriptor notificado con mayor frecuencia (68%) durante la inhalación de metacolina36. El descriptor notificado con mayor frecuencia durante la prueba fue la opresión torácica36. En el ejercicio de pedaleo de corta duración, VE fue el factor mejor relacionado con la disnea, aunque el trabajo/esfuerzo fue el descriptor notificado con mayor frecuencia36. La capacidad inspiratoria disminuyó durante el ejercicio en 8 pacientes. Es interesante observar que el grado de hiperinsuflación dinámica de estos 8 pacientes durante la prueba de provocación con metacolina fue similar, pero sus descripciones de la disnea fueron diferentes entre las 2 pruebas (fig. 5B)36.
Elección de los descriptores de disnea tras la prueba de provocación con metacolina (columnas grises) y tras la prueba de esfuerzo cardiopulmonar (columnas blancas) (panel A). En el panel B se muestra la misma información limitada a los sujetos con un grado de hiperinsuflación similar al final de las pruebas.Adaptado con permiso a partir de Laveneziana et al.36.
Más recientemente, Laveneziana et al.35 han argumentado que la limitación del flujo espiratorio en reposo y durante el ejercicio podría haber explicado la disminución significativa de la IC (es decir, hiperinsuflación pulmonar dinámica) observada en pacientes con asma leve estable sometidos a un ejercicio de pedaleo de alta intensidad y con una carga de trabajo constante. Observaron una fuerte correlación entre la extensión de la limitación del flujo espiratorio y la reducción de la IC durante el ejercicio35. Sin embargo, la falta de determinaciones derivadas de la presión esofágica no permitió a los autores descartar la contribución de otros factores mecánicos en la etiología de la hiperinsuflación pulmonar dinámica.
En este mismo estudio se evaluó la descripción cualitativa de la disnea35. Los resultados mostraron que aproximadamente un tercio de los pacientes alcanzaba un punto de restricción de la expansión del volumen corriente inducida por la hiperinsuflación, lo que producía un brusco aumento de la disnea, que los demás pacientes no alcanzaban. El hecho de alcanzar el punto crítico de la expansión del volumen corriente se asoció a un aumento abrupto de la disnea y a un cambio en la elección del descriptor predominante, de inspiración laboriosa/con esfuerzo a inspiración dificultosa/insatisfactoria35. Contrariamente, el resto de los pacientes no mostraron ninguna limitación en la expansión del VT y no cambiaron los descriptores elegidos, lo que es indicativo de que el inicio de la limitación de la expansión del volumen corriente representa un punto de inflexión mecánico crítico con consecuencias sensoriales importantes35. Desde una perspectiva clínica, estos datos sugieren que las intervenciones terapéuticas que retrasan la aparición de restricciones del VT con VRI críticamente reducidos deberían disminuir la disnea observada durante la actividad física, incluso en pacientes con asma leve.
Efectos de las intervenciones sobre la disneaLa mejoría de la disnea de esfuerzo es una de las partes más importantes del éxito del tratamiento de pacientes con enfermedades cardíacas y pulmonares. Las estrategias terapéuticas destinadas a mejorar la disnea de esfuerzo en estas patologías habitualmente comprenden intervenciones que: 1)intentan reducir la demanda ventilatoria y/o reducir la pulsión de respirar; 2)mejoran la capacidad ventilatoria; 3)mejoran la mecánica respiratoria durante el ejercicio (reduciendo la carga mecánica); 4)aumentan la capacidad de generar presión de la musculatura ventilatoria, y 5)alteran la dimensión afectiva de la disnea. Los mecanismos fisiopatológicos específicos responsables de la aparición de la disnea en cada paciente deberían orientar la elección de la intervención terapéutica individualizada específica para el paciente evaluado. Sin embargo, en general son necesarias varias intervenciones, que parecen tener efectos sinérgicos.
Algunas de las opciones terapéuticas frecuentes que han demostrado su eficacia en el tratamiento de la disnea de esfuerzo son: los broncodilatadores47,48, el uso crónico de oxigenoterapia durante el ejercicio49, el heliox50, el entrenamiento físico51-53, la electroestimulación biventricular (específica para pacientes con IC)28, el entrenamiento de la musculatura respiratoria54, las técnicas de biorregulación55, la ventilación no invasiva56, la cirugía reductora del volumen pulmonar57 y técnicas endoscópicas relacionadas. En una selección de pacientes, otras intervenciones, como el tratamiento con opiáceos, han demostrado reducir la pulsión respiratoria y alterar favorablemente los componentes emocionales de la disnea58. Además, la furosemida inhalada podría ofrecer propiedades interesantes como modulador de la sensación respiratoria, modificando la información aferente de los receptores vagales pulmonares59. El consejo psicológico y los ansiolíticos60,61 también pueden ejercer una influencia positiva sobre la dimensión afectiva de la disnea crónica.
ConclusionesLa disnea es una experiencia multifacética que se genera por la interacción de factores fisiológicos, psicológicos y ambientales, por lo que su comprensión requiere un enfoque multidisciplinar y multidimensional. A pesar de la importante contribución de los factores mecánicos en la aparición de disnea, sus mecanismos precisos todavía no se han aclarado. Un enfoque para el estudio de este síntoma es identificar sus principales dimensiones cualitativas para intentar desvelar los diferentes mecanismos neurofisiológicos subyacentes. La similitud y solapamiento del espectro de descriptores cualitativos de la disnea utilizados por pacientes con trastornos respiratorios obstructivos y restrictivos (trabajo/esfuerzo, dificultad inspiratoria/inspiración insatisfactoria, avidez de aire, respiración rápida) plantea la posibilidad de que ambos compartan mecanismos subyacentes comunes.
Conflicto de interesesLos autores han declarado no presentar ningún conflicto de intereses.