La poliposis nasal (PN) se trata con glucorticoides (GC) tópicos. En algunos pacientes el tratamiento es ineficaz requiriéndose cirugía endoscópica nasosinusal. Para ejercer su función, el GC precisa unirse al receptor de GC (RG) y este desplazarse al núcleo celular. Nuestro objetivo fue establecer si la pobre respuesta a los GC es debida a una alteración en la translocación del RG al núcleo.
MétodosSe realizaron cultivos celulares de fibroblastos nasales de 7 controles sanos y 12 pacientes con PN y asma. Los fibroblastos se incubaron con budesonida o dexametasona (10-7M) durante diferentes tiempos (30min a 4h) y la translocación del RG se analizó mediante inmunocitoquímica.
ResultadosAmbos GC indujeron translocación del RG en todos los grupos, doblando su concentración en el núcleo (30min) respecto al basal. No encontramos diferencias en la translocación del RG entre controles y pacientes ni relación con la gravedad del asma o la intolerancia a los antiinflamatorios no esteroideos (AINE). En los sujetos atópicos se observó una disminución de la translocación con budesonida (1h, 3h y 4h, p<0,05) y dexametasona (30min y 2h, p<0,05).
ConclusionesLa insensibilidad al tratamiento con GC no parece responder a alteraciones en la translocación del RG al núcleo. Tampoco la gravedad del asma ni la intolerancia a los AINE parecen influir en la translocación del RG. La asociación entre atopía y la alteración en la translocación del RG merece estudiarse más profundamente.
Nasal polyposis (NP) is treated with topical glucocorticoids (GC). Some patients require endoscopic nasal surgery because GC treatment is ineffective. To exert its function, the GC needs to bind with the GC receptor (GR) and the GC-GR complex moves to the cell nucleus. Our aim was to establish whether the poor response to GC is due to an alteration in the translocation of the GR to the nucleus.
MethodsWe performed nasal fibroblast cell cultures from seven healthy controls and 12 patients with NP and asthma. Fibroblasts were incubated with budesonide or dexamethasone (10-7M) for different times (30min to 4h) and GR translocation was analyzed by immunocytochemistry.
ResultsBoth GC induced GR translocation in every group, doubling its concentration in the cell nucleus (30min) compared to baseline. There were no differences in GR translocation between controls and patients, nor differences related to the severity of asthma or intolerance to non-steroidal anti-inflammatory drugs (NSAIDs). Atopic subjects showed a decrease in GR translocation with budesonide (1h, 3h and 4h, P<0.05) and dexamethasone (30min and 2h, P<.05).
ConclusionsThe insensitivity to GC treatment does not appear to be due to an alteration in GR translocation to the nucleus. Neither does the severity of asthma or intolerance to NSAIDs appear to alter GR translocation. The association between atopy and the alteration in GR function deserves further investigation.
La poliposis nasal (PN) asociada a rinosinusitis crónica es tratada habitualmente con glucocorticoides (GC) tópicos con frecuencia asociados al uso continuado o intermitente de GC sistémicos1,2. En un porcentaje elevado de pacientes, el tratamiento médico fracasa, lo que obliga a recurrir a la cirugía endoscópica nasal (CENS). En estos casos los pólipos nasales se pueden considerar representantes de una enfermedad inflamatoria insensible o resistente a los GC. La resistencia a los GC se puede observar en numerosas enfermedades inflamatorias, como el asma, la artritis reumatoide y la colitis ulcerosa.
El asma es una enfermedad inflamatoria de las vías aéreas que se caracteriza por la presencia de obstrucción al flujo aéreo e hiperrespuesta bronquial que varía en severidad a lo largo del espectro de la enfermedad. La mayor parte de los pacientes con asma se diagnostican fácilmente y responden al tratamiento estándar con GC inhalados y β2-agonistas de acción corta a demanda para el control sintomático3.
Sin embargo, existe un subgrupo de pacientes con asma grave, que en algunas series se acerca al 10% del total de asmáticos, que muestran una pobre o nula respuesta al tratamiento habitual y que requieren dosis elevadas de GC para el control de su sintomatología. Estos pacientes presentan mayor morbilidad y peor calidad de vida que aquellos cuya patología está correctamente controlada con tratamiento, consumiendo asimismo el 70% de los recursos dedicados a esta enfermedad4,5.
El hecho de que el asma grave se defina y caracterice por requerir dosis altas de GC inhalados, asociados en ocasiones a los sistémicos, se considera que está relacionado con la presencia de insensibilidad a estos fármacos, pudiendo alcanzar valores extremos en el asma denominada corticorresistente6.
La PN se asocia con frecuencia al asma grave sobre todo en el asma con intolerancia a los antiinflamatorios no esteroideos (AINE)7. Dadas las similitudes en las características de la inflamación presente en la PN y en el asma, se puede inferir que los mecanismos responsables de la pobre respuesta al tratamiento con GC de la enfermedad de las vías áreas superiores (PN y rinosinusitis crónica) deben ser similares a los que se producen en la insensibilidad a estos mismos fármacos en el asma grave.
Los mecanismos implicados en la insensibilidad a los GC son parcialmente conocidos, aunque se supone que en gran parte son adquiridos e inducidos por el proceso inflamatorio, que alteraría el funcionamiento normal del receptor de glucocorticoides (RG) que media la acción biológica de los GC6,8,9.
El RG es un factor de transcripción que pertenece a la familia de receptores esteroideos activados por hormonas8-11. La molécula de GC se une al RG, el cual se encuentra en el citoplasma asociado, entre otras, a 2 subunidades de proteínas activadas por calor (hsp 90). La unión del GC al RG ocasiona la disociación de estas proteínas y la activación del RG, permitiendo la translocación del complejo GC-RG al núcleo, donde se une a secuencias específicas del ADN, denominadas elementos de respuesta de los GC (ERG), localizadas en la región promotora de genes diana. Esta unión, junto con determinados coactivadores, dará lugar a la inducción de la transcripción de genes que codifican para proteínas antiinflamatorias (transactivación)8,9,11-13.
La acción antiinflamatoria de los GC también se puede llevar a cabo a través de interacciones proteína-proteína entre un RG activado y factores de transcripción nuclear, como el AP-1 o el factor nuclear NF-κB, reprimiendo los efectos inflamatorios de estas proteínas (transrepresión)8,9,11-13.
Puesto que la translocación nuclear del RG es un paso imprescindible para que los GC ejerzan sus acciones antiinflamatorias, un posible mecanismo implicado en la insensibilidad al tratamiento con GC en los pacientes con PN podría ser la disminución de la translocación nuclear del RG una vez ha sido activado por la hormona8,9.
El objetivo de nuestro estudio fue investigar si la pobre respuesta a los GC de los PN que requieren tratamiento quirúrgico es en parte debida a una alteración en la translocación del RG. Para ello se utilizaron cultivos de fibroblastos nasales de controles sanos y de pacientes con PN asociada a asma con diferentes grados de gravedad, con y sin intolerancia a los AINE. En los estudios in vitro de respuesta a los GC, el fármaco utilizado habitualmente para su estímulo es la dexametasona, si bien este no es el tipo de GC usado para el tratamiento de la PN y del asma en pacientes. Por este motivo, los fibroblastos nasales también se estimularon con budesonida, uno de los GC empleados en la práctica clínica diaria.
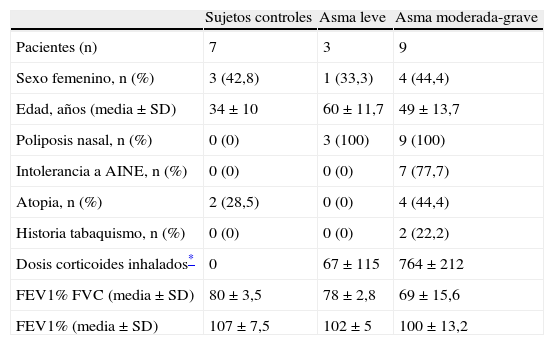
MétodosSujetosSe obtuvieron muestras de las vías respiratorias de 19 sujetos, 7 controles sanos y 12 pacientes con PN y asma. El asma se clasificó en cuanto a su gravedad de acuerdo a los criterios de la GINA3. Las muestras de mucosa nasal se obtuvieron de sujetos sometidos a cirugía nasal correctora (septoplastia nasal o turbinectomía) y los PN de pacientes sometidos a CENS. Todos los pacientes dieron consentimiento informado para la utilización de las muestras de tejidos. El estudio fue aprobado por el Comité Ético del Hospital Clínic (Barcelona, España). Las características de la población a estudio se muestran en la tabla 1.
Características de la población a estudio.
| Sujetos controles | Asma leve | Asma moderada-grave | |
| Pacientes (n) | 7 | 3 | 9 |
| Sexo femenino, n (%) | 3 (42,8) | 1 (33,3) | 4 (44,4) |
| Edad, años (media±SD) | 34±10 | 60±11,7 | 49±13,7 |
| Poliposis nasal, n (%) | 0 (0) | 3 (100) | 9 (100) |
| Intolerancia a AINE, n (%) | 0 (0) | 0 (0) | 7 (77,7) |
| Atopia, n (%) | 2 (28,5) | 0 (0) | 4 (44,4) |
| Historia tabaquismo, n (%) | 0 (0) | 0 (0) | 2 (22,2) |
| Dosis corticoides inhalados* | 0 | 67±115 | 764±212 |
| FEV1% FVC (media±SD) | 80±3,5 | 78±2,8 | 69±15,6 |
| FEV1% (media±SD) | 107±7,5 | 102±5 | 100±13,2 |
Todos los sujetos del estudio fueron sometidos a una evaluación clínica para determinar aquellos con historia compatible con intolerancia a los AINE y a pruebas de alergia cutánea a aeroalérgenos comunes (Dermatophagoides pteronyssinus, Dermatophagoides farinae, Gramíneas, Cynodon, Parietaria, Chenopodium, Artemisia, Plántago, Olivo, Platanero, Ciprés, Alternaria, Cladosporium, Aspergillus, Penicillium, epitelio gato, epitelio perro, Blatella orientalis, Látex) mediante la técnica del Prick-test. En los casos en los que se requirió confirmación diagnóstica de la intolerancia a los AINE se les sometió a una prueba de provocación nasal con salicilato de lisina de acuerdo a un método desarrollado por nuestro grupo14.
Cultivo de fibroblastosLos fragmentos de mucosa nasal y PN se colocaron en placas de cultivo de 6 pozos en presencia de medio de cultivo Dulbecco's Modified Eagle's Medium, Lonza, Bélgica (DMEM), suplementado con 10% de suero fetal bovino (SFB), 100 U/ml penicilina, 100μg/ml estreptomicina y 0,002mg/ml de anfotericina B. Se mantuvieron en un incubador a 37°C y 5% CO2 durante 3 semanas, cambiando el medio de cultivo cada 2 días. Mediante microscopia óptica se confirmó el crecimiento de los fibroblastos y se realizó el primer subcultivo mediante la adición de tripsina-EDTA. Los siguientes subcultivos se realizaron cuando las células alcanzaron una confluencia de aproximadamente el 80% y los experimentos se llevaron a cabo entre los subcultivos 4.° y 8.°. La presencia de otros tipos celulares en los cultivos se valoró por inmunocitoquímica de vimentina (marcador específico de los fibroblastos) y de citoqueratina (marcador de células epiteliales).
Inmunocitoquímica del RGPara el estudio de la función del RG los fibroblastos se cultivaron en portaobjetos de 8 pocillos (BD Falcon) a una densidad de 10.000 células/pocillo en presencia de 500μl de DMEM suplementado al 10% con SFB tratado con carbón-dextrano (SFBcd, Gibco). Este último se utilizó para eliminar el posible efecto del GC y otras hormonas endógenas que pudiera contener el suero, sobre la translocación del RG. Al cabo de 48h del sembrado, las células se incubaron con budesonida (BUD, Sigma) o dexametasona (DEX, Fortecortín®, Merck), ambas a 10-7 M, durante diferentes tiempos (30min, 1h, 2h, 3h y 4h).
Tras la incubación con el GC, las células se lavaron con PBS frío, se fijaron 15min en 4% paraformaldehído en PBS y se lavaron con PBS. Se permeabilizaron durante 15min con Triton X-100 al 0,1% diluido con albúmina de suero bovino (BSA) al 1%. Tras un lavado de 5min con PBS 1%, se procedió a la localización inmunocitoquímica del RG mediante incubación con un anticuerpo específico para el RG (sc-1003, Santa Cruz, EE. UU.) diluido 1/100 en PBS al 1% de BSA, incubándose toda la noche a 4°C (125μl por preparación). Al día siguiente, se procedió al lavado con PBS (2 × 5min) y se aplicó el anticuerpo secundario conjugado a fluorocromo (Alexa 488, Molecular Probes, EE. UU.) diluido a 1/500 con PBS y BSA al 1% (125μl/porta), 45min a 37°C (protegido de la luz). Posteriormente se realizó un lavado con PBS durante 5min y se procedió al montaje de las preparaciones con un medio de montaje acuoso (ProLong Gold, Molecular Probes, Invitrogen, EE. UU.), dejándolo solidificar como mínimo 3h a temperatura ambiente protegido de la luz. La visualización del RG en las muestras se llevó a cabo en un microscopio de fluorescencia (Leica Microsystems, Alemania). Para cada una de las condiciones experimentales se realizó la cuantificación de la translocación del RG de entre 30 y 100 células mediante el análisis de la intensidad media de fluorescencia (IMF) emitida por el RG tras el procesamiento de las imágenes con el sofware Image J. Los resultados se han expresado como la proporción de la IMF del núcleo celular en cada una de las condiciones de análisis respecto a la fluorescencia basal (previa a la incubación con la hormona).
Análisis estadísticoPrevio estudio de las características de la distribución de las variables se ha recurrido a pruebas no paramétricas (Kruskal-Wallis, U Mann-Whitney). Se consideró el valor de p<0,05 como estadísticamente significativo.
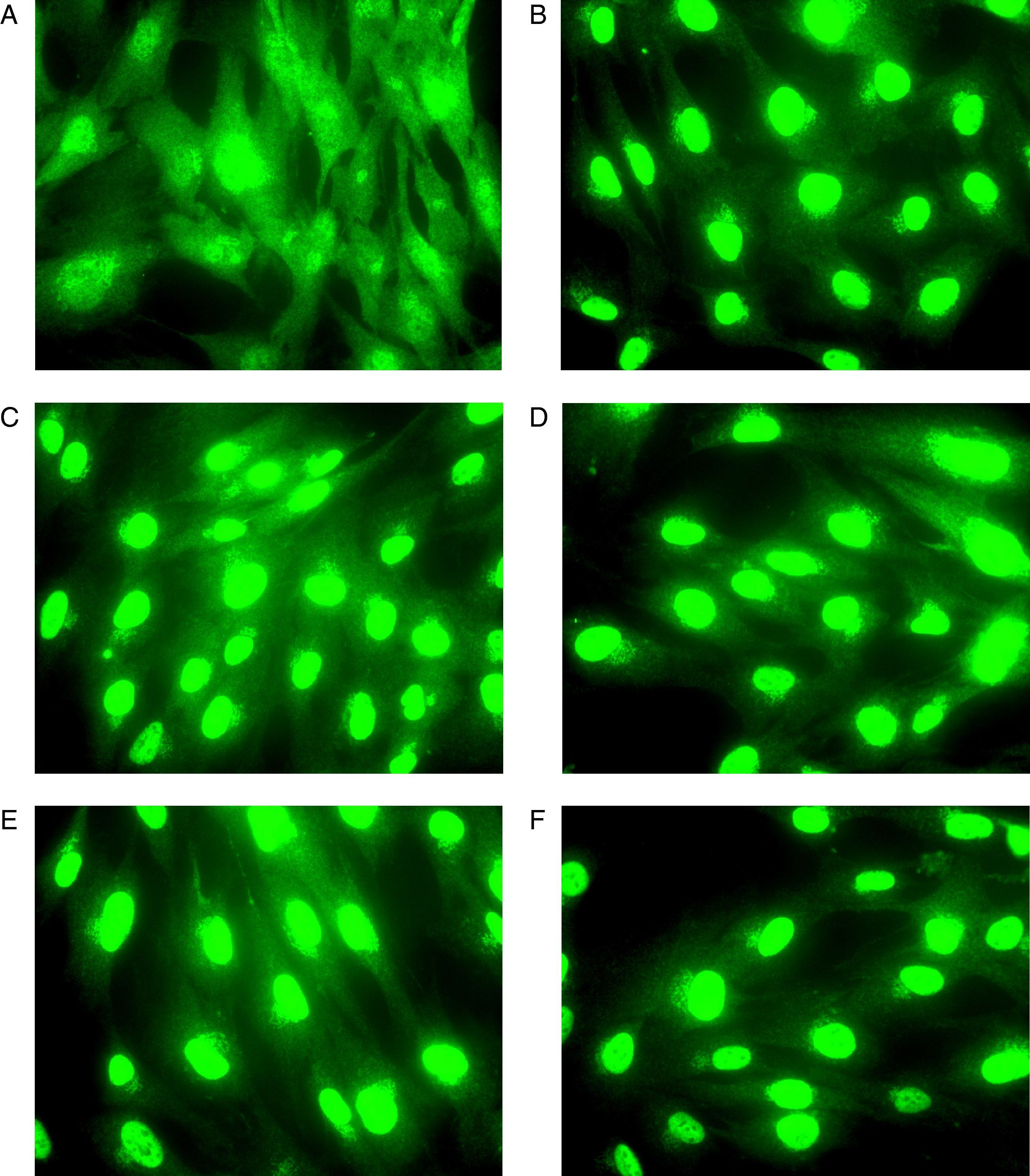
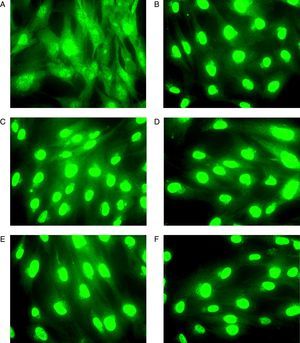
ResultadosEn ausencia de GC comprobamos mediante inmunocitoquímica que el RG presentaba una distribución uniforme en el citoplasma y en el núcleo de los fibroblastos de vía aérea superior de todas las muestras a estudio (fig. 1A).
Imagen representativa que muestra la translocación del RG en fibroblastos de mucosa nasal obtenida mediante microscopía de fluorescencia. Previo a la incubación de los fibroblastos con GC (A) el RG se localiza tanto en el citoplasma como en el núcleo. Tras la incubación el GC (BUD) durante 30min (B), 1h (C), 2h (D), 3h (E) y 4h (F) la inmunofluorescencia correspondiente al RG es detectada en el núcleo de los fibroblastos.
En presencia de GC, los fibroblastos fueron incubados con cada GC (BUD o DEX, 10-7) durante diferentes tiempos (30min, 1h, 2h, 3h y 4h) con la intención de poder establecer la cronología de la translocación del RG al núcleo, confirmándose la precocidad de esta respuesta, detectándose a los 30min de incubación con el GC en todas las muestras analizadas (fig. 1B).
Se observó la presencia de translocación del RG al núcleo en las muestras de los 19 sujetos analizados, tanto tras su estimulación con BUD como con DEX, de forma que la depleción de RG del citoplasma se asoció al correspondiente incremento de acúmulo del RG en el núcleo (fig. 1).
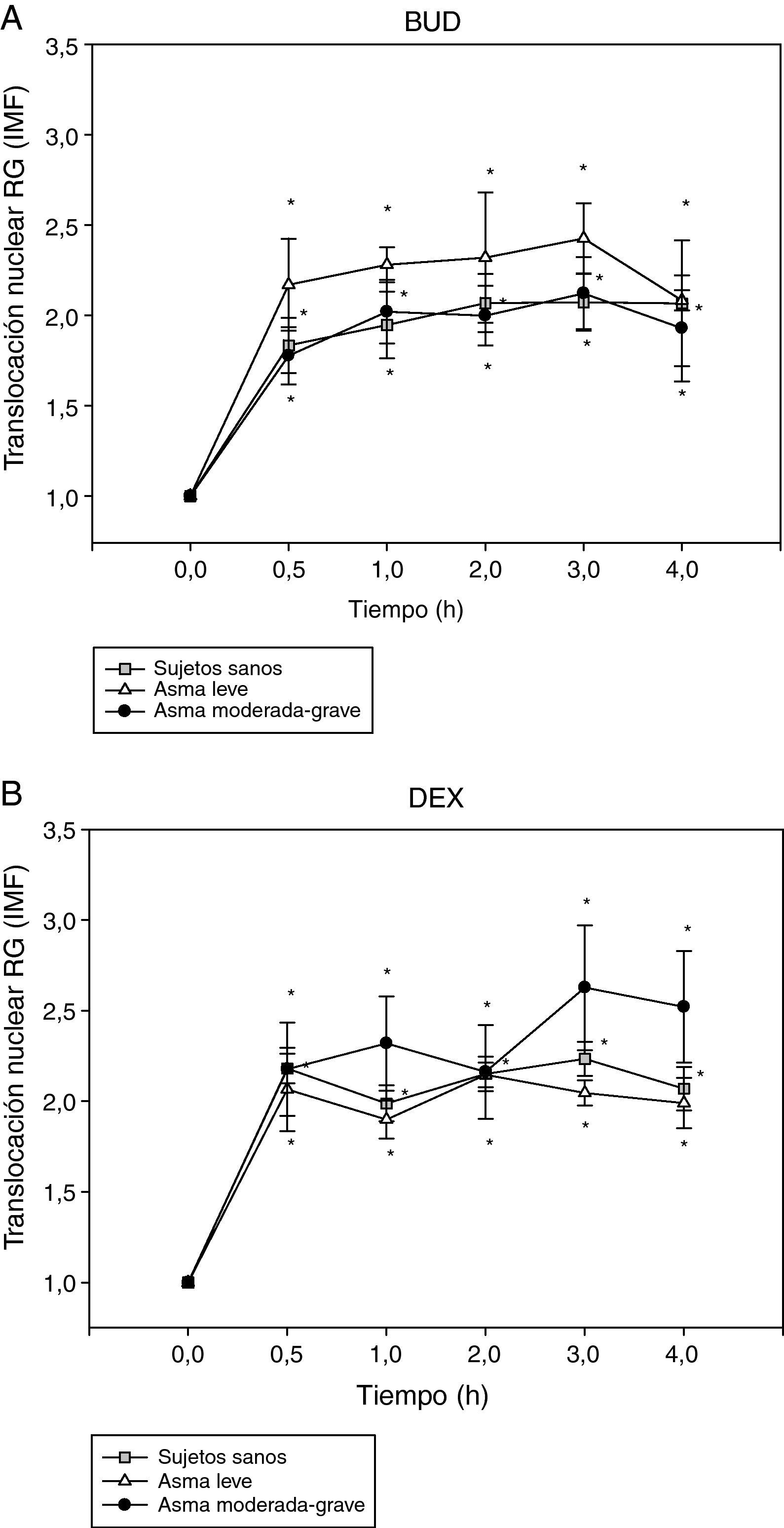
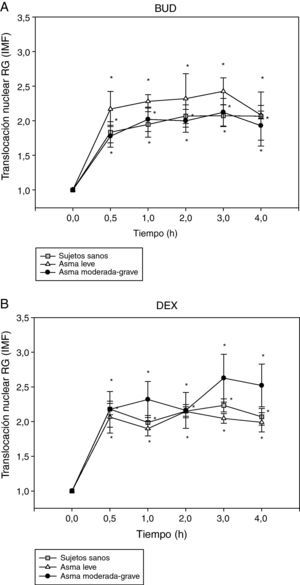
A continuación, se procedió al análisis de la translocación del RG en distintos subgrupos de pacientes. En primer lugar se analizó la translocación del RG de los fibroblastos nasales en función de la gravedad del asma según criterios establecidos por la GINA3 como se observa en la figura 2. La translocación del RG al núcleo es detectada ya a los 30min de administración de BUD (fig. 2A) o DEX (fig. 2B), doblando la intensidad media de fluorescencia (IMF) del núcleo comparado con el basal, y permaneciendo el RG en el núcleo hasta transcurridas 4h de la administración del fármaco en todos los grupos (p<0,05 respecto al basal).
Efecto de la incubación con BUD (A) y DEX (B) en la translocación del RG en fibroblastos de sujetos sanos, pacientes con asma leve y pacientes con asma grave. No se observan diferencias estadísticamente significativas en la translocación del RG inducida por BUD o DEX entre los diferentes grupos de pacientes (*p<0,05 todos los grupos comparado con 0h, Wilcoxon).
No se observaron diferencias en la translocación del RG inducida por BUD (fig. 2A) o DEX (fig. 2B) según la gravedad del asma. En el grupo de pacientes con asma moderado-grave se observó una tendencia a la menor translocación del RG inducida por BUD con respecto al grupo de pacientes con asma leve sin alcanzar significación estadística (fig. 2A).
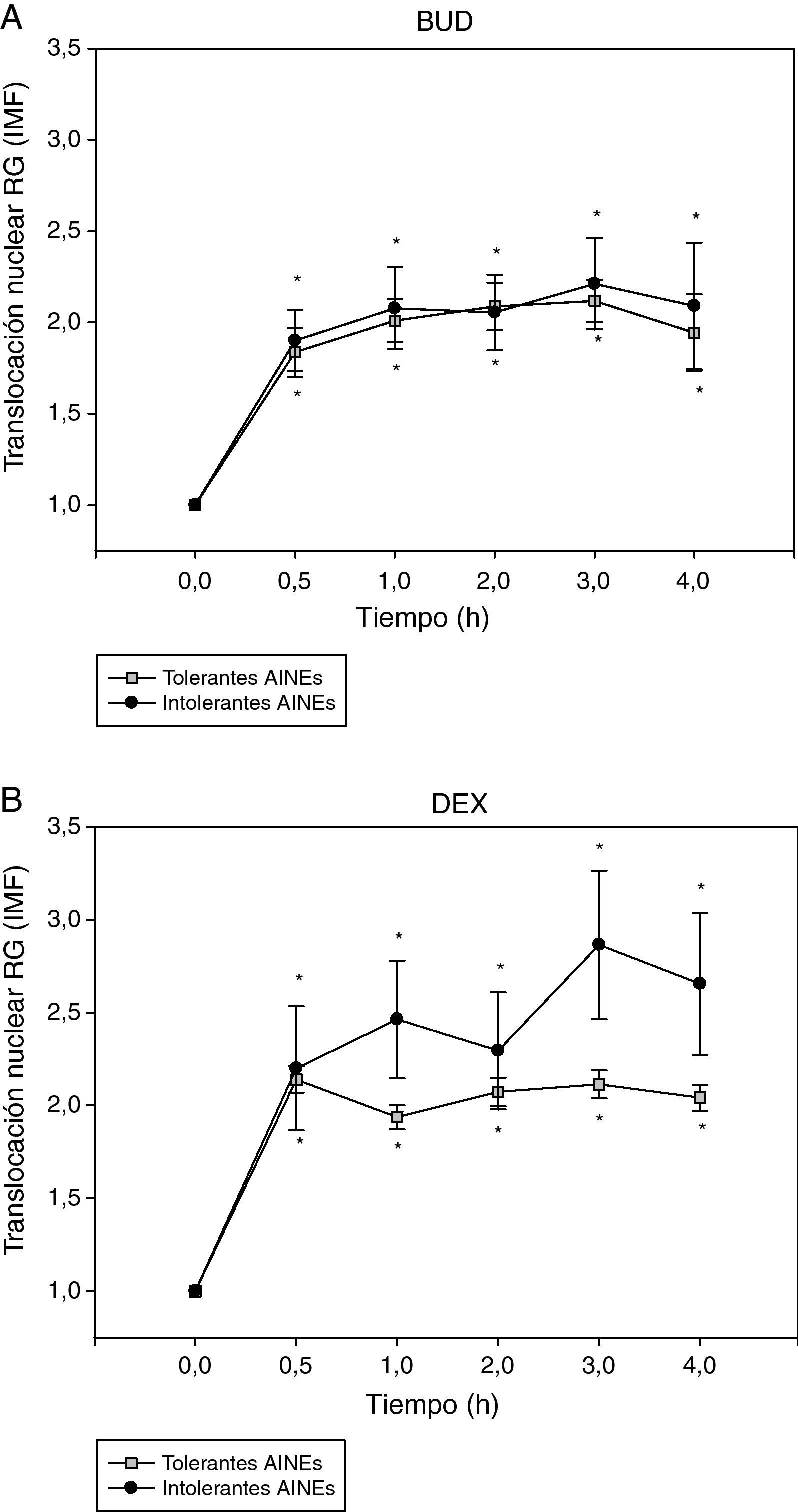
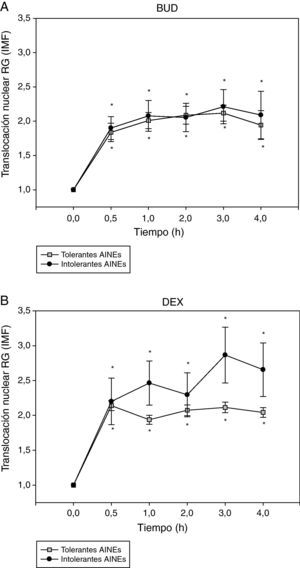
A continuación se analizó la translocación del RG en función de la presencia o ausencia de intolerancia a los AINE (fig. 3). No se observaron diferencias significativas en la cinética de translocación del RG inducida por BUD (fig. 3A) o DEX (fig. 3B) entre los pacientes tolerantes e intolerantes a los AINE.
Efecto de la incubación con BUD (A) y DEX (B) en la translocación del RG en fibroblastos de sujetos tolerantes e intolerantes a los AINE. No se observan diferencias estadísticamente significativas en la translocación del RG inducida por BUD o DEX entre tolerantes e intolerantes a los AINE (*p<0,05 todos los grupos comparado con 0h, Wilcoxon).
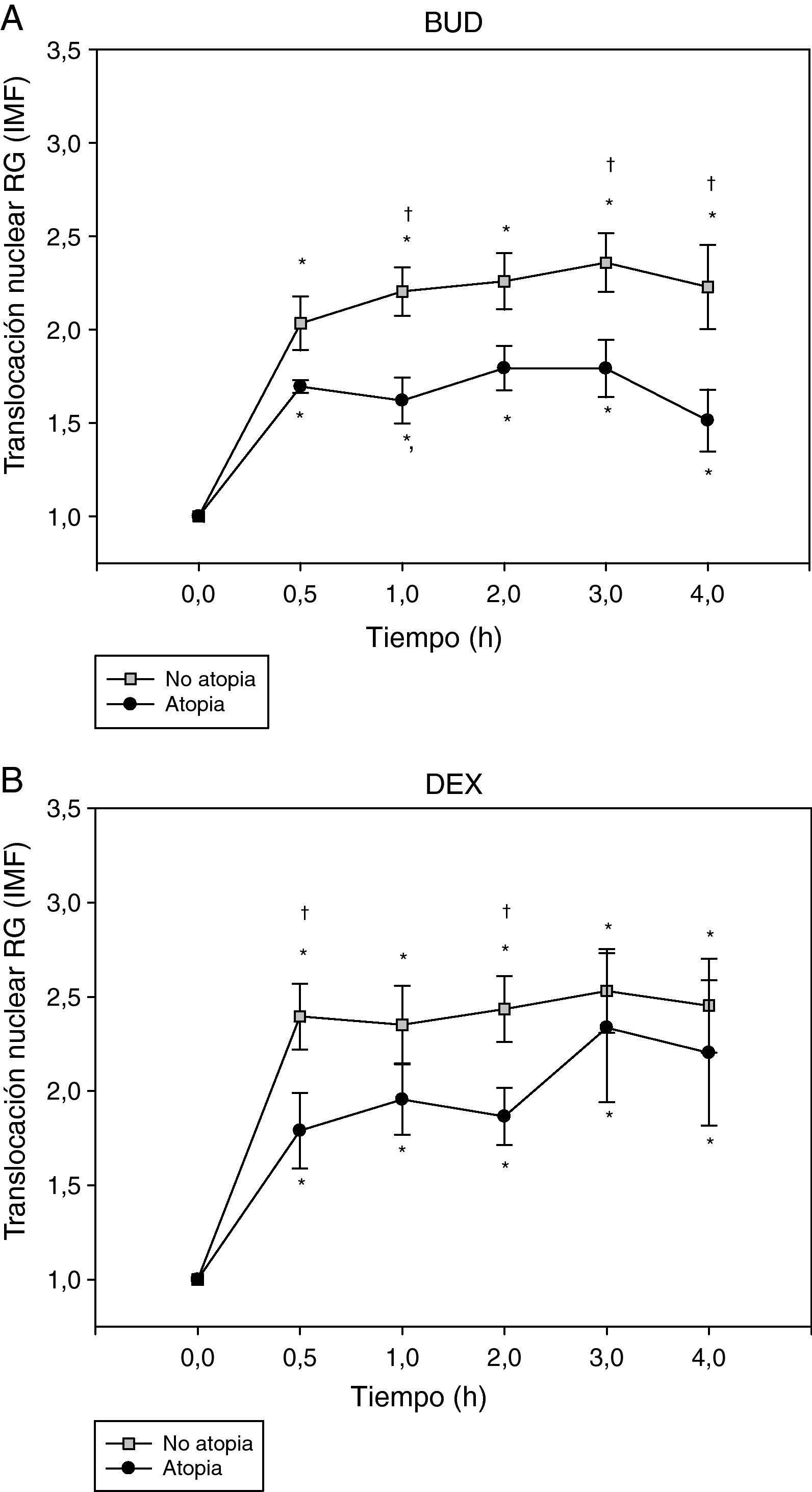
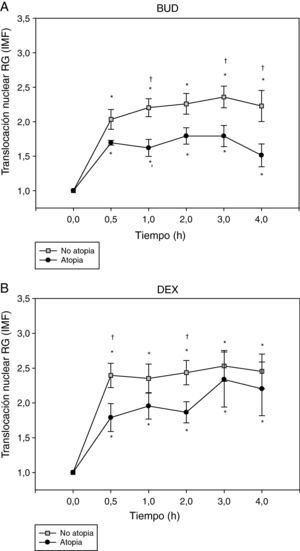
Por último, se analizó la translocación del RG en función de la presencia de atopia como se observa en la figura 4. La translocación del RG, tanto la inducida por BUD (fig. 4A) como la inducida por DEX (fig. 4B), fue menor en los sujetos atópicos comparada con la de los no atópicos.
Efecto de la incubación con BUD (A) y DEX (B) en la translocación del RG en fibroblastos de sujetos atópicos y no atópicos. Se observa una menor translocación del RG, tanto inducida por BUD (A) como por DEX (B), en los sujetos atópicos comparado con los no atópicos en cada uno de los diferentes tiempos de incubación estudiados, alcanzando significación estadística a 1h, 3h y 4h con BUD y 30min y 2h con DEX (†p<0,05 comparado con no atópicos, Mann-Whitney) (*p<0,05 comparado con 0h, Wilcoxon).
El objetivo de nuestro estudio fue profundizar en los mecanismos moleculares implicados en la falta de respuesta al tratamiento con GC en la PN, y en concreto, si en estos pacientes existe una alteración en la activación del RG. Por este motivo, analizamos el comportamiento del RG en la mucosa nasal de sujetos sanos y en PN de pacientes sometidos a cirugía debido al fracaso del tratamiento con GC. Interpretamos en este caso que la necesidad de cirugía revelaba la presencia de insensibilidad o resistencia a los GC. Dado que la PN se asocia con frecuencia con el asma grave y con el asma intolerante a los AINE, también analizamos la activación del RG en función de la gravedad del asma y de la presencia de intolerancia a los AINE.
La unión del GC al RG en el citoplasma induce la formación de un dímero GC-RG que es translocado al núcleo y actúa como un factor de transcripción, activando o inhibiendo la transcripción de genes diana. Así, la translocación del RG al núcleo constituye un paso imprescindible para que los GC ejerzan sus acciones antiinflamatorias8,9,11,12. En nuestro estudio analizamos la translocación del RG en cultivos de fibroblastos obtenidos de mucosa nasal sana y de pólipos nasales de pacientes con asma. La obtención de las muestras durante la cirugía nasal con el paciente bajo anestesia general nos ha permitido minimizar el riesgo que conlleva la realización de biopsias bronquiales o de lavado broncoalveolar mediante fibrobroncoscopia en pacientes con asma, especialmente en el subgrupo de pacientes más grave. El concepto de una única vía, una sola enfermedad, pretende señalar que los mecanismos involucrados en las enfermedades inflamatorias de las vías aéreas superiores (rinitis, sinusitis y poliposis nasal) son similares a los de las vías inferiores (asma). De la misma manera, los tratamientos aplicados a las enfermedades nasales y bronquial son también del mismo tipo, y por ello el fracaso terapéutico se puede dar en los dos procesos y es lógico suponer que los mecanismos responsables del mismo sean similares en ambos lugares de las vías aéreas15. Según esta premisa, el estudio de las células obtenidas de vía aérea superior de nuestros pacientes con asma resulta equiparable a la afectación que estos mismos pacientes presentan en su vía aérea inferior16.
En primer lugar, comprobamos mediante inmunocitoquímica que, en ausencia de GC, el RG presentaba una distribución uniforme en el citoplasma y que también se visualizaba en el núcleo de los fibroblastos de vía aérea superior de todas las muestras a estudio. De acuerdo a estos hallazgos, Usmani et al17 ya evidenciaron la presencia del RG en el núcleo celular (30%) de células epiteliales y macrófagos de pacientes con asma leve previo al estímulo con fluticasona in vivo, atribuyéndolo a un reflejo de la respuesta a los niveles endógenos de cortisol circulante. Para minimizar los efectos del posible cortisol endógeno que pudiera contener el medio de cultivo, en nuestro estudio, todos los experimentos de translocación se llevaron a cabo con un medio de cultivo en el que el SFB estaba tratado con carbón-dextrano. A pesar de ello, también evidenciamos la presencia de RG en el núcleo en todas las muestras. Este efecto podría atribuirse a diferentes causas: una posibilidad sería que el tiempo de lavado con SFBcd fuera insuficiente, lo que justificaría la presencia de GC en el núcleo celular previa a la incubación con BUD o DEX. También podría justificarse por el tipo de anticuerpo utilizado para la detección del RG, ya que usamos un anticuerpo que además del RG funcional, el RGα, también detecta la isoforma β del RG. Puesto que el RGβ parece localizarse únicamente en el núcleo, la localización del RG en el núcleo previa a la adición del GC que nosotros observamos en nuestro estudio podría deberse a la detección del RGβ8. Sin embargo, diversos investigadores han demostrado que los niveles de expresión del RGβ son ínfimos comparados con los del RGα8,9,11,13. De acuerdo con nuestros hallazgos, en ausencia de DEX, Goleva et al18 también observaron la presencia de RG en el núcleo celular de macrófagos procedentes de lavado broncoalveolar de pacientes con asma sensible o insensible a los GC.
De acuerdo a los resultados obtenidos por otros investigadores en células epiteliales y macrófagos conseguidos mediante esputo inducido de sujetos sanos y de pacientes con asma leve19, nosotros también observamos una rápida translocación del RG (30min) en los fibroblastos de nuestros pacientes. Asimismo, también evidenciamos que la incubación prolongada con GC hasta un máximo de 4h no ocasionaba un incremento de la translocación del RG en el núcleo, sugiriendo que una breve exposición a la hormona es suficiente para activar el RG.
No encontramos diferencias en la translocación del RG entre los fibroblastos de mucosa sana y los de PN. Tampoco observamos diferencias entre los fibroblastos procedentes de pacientes con asma leve y asma grave. De la misma manera, no encontramos que la presencia de intolerancia a los AINE tuviera alguna influencia en la translocación del RG. Dado que los mecanismos implicados en la falta de respuesta al tratamiento con GC son múltiples, podemos concluir que el mecanismo responsable de la pobre respuesta de los PN a los GC no es explicable por alteraciones en la translocación del RG al núcleo.
Uno de los posibles sesgos del estudio que justificaría la ausencia de diferencias en la translocación entre los sujetos sanos y los pacientes con asma de diferente gravedad podría estar en relación con las características de nuestra población a estudio. Nuestro grupo de pacientes asmáticos presentaba un correcto control sintomático a pesar de que tuviesen diferentes grados de gravedad del asma, y en el caso de los pacientes con asma moderado-grave, no se trataba de pacientes con gran afectación funcional ni con dosis muy elevadas de tratamiento para su estabilidad. Tal vez exista una alteración de la respuesta del RG en aquellos pacientes con mal control del asma a pesar del tratamiento o con asma de mayor gravedad. Una limitación potencial de nuestro estudio sería el tamaño de la muestra, que podría explicar parcialmente la ausencia de diferencias entre los grupos.
Nuestros resultados contrastan con los obtenidos por Goleva et al18. En macrófagos obtenidos mediante lavado broncoalveolar, estos autores18 describieron una menor translocación del RG inducida por DEX (10-6 M, 3h) en las células de pacientes con asma insensible a GC, comparado con las de los pacientes sensibles a los GC. El hecho de no encontrar diferencias parecidas en nuestros pacientes podría estar en relación con el tipo celular sobre el que se llevó a cabo el estudio. En nuestro estudio se trata de células estructurales, los fibroblastos, que participan en el remodelado de las vías respiratorias. En cambio, Goleva et al18 estudiaron macrófagos alveolares, células implicadas en la activación y el mantenimiento de la inflamación de la vía aérea, y que en el asma, muestran una mayor capacidad presentadora de antígeno20,21.
La prevalencia de alergia en la población de adultos asmáticos oscila entre el 30 y el 40%22. A nivel práctico se considera que los pacientes atópicos son aquellos en los que se demuestra la sensibilización a algún alérgeno mediante una prueba cutánea (Prick-test) o mediante una prueba de radio-alergo absorbencia (RAST). La exposición a alérgenos ha sido ampliamente descrita como un importante factor de riesgo para el desarrollo de asma y de asma grave en particular23,24. Por este motivo, recogimos la sensibilización mediante Prick-test en nuestra población a estudio y evidenciamos que la presencia de atopia se acompañaba de un descenso estadísticamente significativo de la translocación del RG al núcleo, tanto tras incubación con BUD como con DEX. Nuestros hallazgos concuerdan con un estudio previo en el que se examinaron los efectos de los alérgenos sobre la afinidad de unión del GC al RG en células mononucleares de sangre periférica25. Estos autores demostraron que la exposición tanto in vivo como in vitro a un alérgeno disminuía la afinidad de unión del GC al RG en asmáticos alérgicos, con la resultante alteración funcional en la respuesta celular a los GC. El mecanismo por el cual se produciría esta alteración en la afinidad del RG es desconocido. Para algunos autores25 en el caso de la células T esta alteración parecería estar mediada por IL-2 y IL-4, de forma que la exposición al alérgeno ocasionaría una activación del sistema inmune y un incremento en la expresión de estas citoquinas, que incrementarían la expresión de la isoforma β del RG en las células T, lo que se ha visto implicado en una menor respuesta a los GC endógenos y exógenos8,9. En estudios previos, nuestro grupo, sin embargo, no halló diferencias en la expresión del RG-β en pacientes con asma, lo que no apoyaría la hipótesis de su implicación en la falta de respuesta a los GC13,26.
En resumen, en nuestro estudio no hemos encontrado diferencias en la translocación del RG entre fibroblastos de mucosa nasal sana y fibroblastos de PN. Tampoco observamos que la gravedad del asma o la presencia de intolerancia a los AINE tuvieran alguna influencia en ella. Por todo ello, podemos concluir que la falta de respuesta al tratamiento con GC no se puede atribuir a una alteración en la translocación del RG. En cambio, sí hemos demostrado una menor translocación del RG en los pacientes atópicos. El origen de esta asociación es desconocido y requerirá la realización de nuevos estudios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciónEste estudio ha sido financiado en parte por el Premio Emili Letang, Hospital Clínic 2006 y FUCAP 2007.