Las enfermedades pulmonares intersticiales (EPI) se asocian a una baja tolerancia al ejercicio, disnea y disminución de la calidad de vida relacionada con la salud (CVRS). La fibrosis pulmonar idiopática (FPI) es una de las más prevalentes del grupo. Para cuantificar su CVRS, se ha desarrollado una versión específica del cuestionario Saint George (SGRQ-I). Sin embargo, esta herramienta no está actualmente validada en el idioma español. El objetivo fue traducir al idioma español y validar el SGRQ-I en pacientes con FPI.
MétodosSe estudiaron la repetibilidad, la consistencia interna y la validez de constructo del SGRQ-I en español obtenido luego del proceso de traducción reversa.
ResultadosVeintitrés pacientes con FPI completaron 2 veces el cuestionario traducido con 7 días de diferencia cada uno. Encontramos una buena concordancia en el test-retest, con un coeficiente de correlación intraclase (CCI) de 0,96 (p<0,001). En el estudio de la consistencia interna hallamos un coeficiente alfa de Cronbach de 0,9 al incluir al valor total, y de 0,81 al excluirlo (p<0,001), lo cual evidencia una buena interrelación de los diferentes ítems del cuestionario.
El valor total del cuestionario mostro buena correlación con FVC% (r=–0,44; p=0,033), DLCO% (r=–0,55; p=0,011), PaO2 (r=–0,44; p=0,036), disnea escala modificada de Medical Research Council (r=–0,65; p<0,001), y pasos dados en 24 h (r=–0,47; p=0,024).
ConclusiónLa versión en español del SGRQ-I desarrollada por nuestro grupo tiene buena consistencia interna, es reproducible y es válida para evaluar calidad de vida en pacientes con FPI.
Interstitial lung disease (ILD) is associated with low exercise tolerance, dyspnea, and decreased health-related quality of life (HRQL). Idiopathic pulmonary fibrosis (IPF) is one of the most prevalent in the group. A specific version of the Saint George's questionnaire (SGRQ-I) has been developed to quantify the HRQL of IPF patients. However, this tool is not currently validated in the Spanish language. The objective was to translate into Spanish and validate the specific Saint George's Respiratory Questionnaire for idiopathic pulmonary fibrosis (SGRQ-I).
MethodsThe repeatability, internal consistency and construct validity of the SGRQ-I in Spanish were analyzed after a backtranslation process.
ResultsIn total, 23 outpatients with IPF completed the translated SGRQ-I twice, 7 days apart. Repeatability was studied, revealing good concordance in test-retest with an ICC (interclass correlation coefficient) of 0.96 (P<.001). Internal consistency was good for different questionnaire items (Cronbach's alpha of 0.9 including and 0.81 excluding the total value) (P<.001).
The total score of the questionnaire showed good correlation with forced vital capacity FVC% (r=–0.44; P=.033), diffusing capacity of the lungs for carbon monoxide (DLCO%) (r=–0.55; P=.011), partial pressure of oxygen in arterial blood PaO2 (r=–0.44; P=.036), Medical Research Council Dyspnea scale (r=–0.65; P<.001), and number of steps taken in 24hours (r=–0.47; P=.024).
ConclusionsThe Spanish version of SGRQ-Ideveloped by our group shows good internal consistency, reproducibility and validity, so it can be used for the evaluation of quality of life (QOL) in IPF patients.
Las enfermedades pulmonares intersticiales (EPI) se asocian a una baja tolerancia al ejercicio, mayor disnea y a una disminución de la calidad de vida relacionada con la salud (CVRS)1,2. Las herramientas utilizadas para cuantificar estos aspectos son comunes a las utilizadas en otras enfermedades respiratorias, como el test de marcha de 6 minutos (TM6M) para evaluar la tolerancia al ejercicio (entre otros) y el cuestionario Saint George (SGRQ) para medir calidad de vida3-5. Este último es un cuestionario autoadministrado con 3 dominios que exploran diferentes aspectos de la enfermedad, incluyendo uno especial para evaluar los síntomas provocados por la misma6. En estudios realizados recientemente se pone en evidencia que la utilidad de este cuestionario para evaluar la calidad de vida en pacientes con fibrosis pulmonar idiopática (FPI) dista de ser óptima, por encontrar defectos sobre todo en el área que explora los síntomas7. Este hallazgo posiblemente se deba a que esta área del cuestionario interroga sobre síntomas como la presencia de tos, esputo, sibilancias y crisis respiratorias, que no son frecuentes en pacientes con FPI, siendo los síntomas dominantes en otras enfermedades como la enfermedad pulmonar obstructiva crónica (EPOC), asma bronquial, bronquiectasias, etc.6,8,9.
Recientemente se ha publicado la validación de una versión modificada de este cuestionario específica para evaluar CVRS en pacientes con FPI, el SGRQ-I. Este cuestionario mostró buena consistencia interna y correlación con variables pronósticas y de severidad de la enfermedad10. Sin embargo, no hay actualmente ninguna herramienta para evaluar la calidad de vida específica para pacientes con EPI validada en el idioma español.
Dado que los ensayos clínicos realizados hasta este momento no han encontrado fármacos capaces de disminuir la mortalidad en esta enfermedad, mejorar la calidad de vida es un objetivo central en el enfoque terapéutico de estos pacientes11,12. Por lo tanto, es evidente la importancia de contar con una herramienta válida, confiable y reproducible para evaluar la calidad de vida en FPI. El objetivo de este estudio es traducir y validar el SGRQ-I al idioma español.
MétodosTraducción del cuestionarioEl SGRQ es un cuestionario autoadministrado de 50 ítems, divididos en 8 ítems del área de síntomas (S), 16 de actividades (A) y 26 de impacto (I). La integración de estas 3 áreas genera como resultado final un valor total (T). Cada área está compuesta por preguntas con opciones múltiples y del tipo verdadero o falso. El resultado es un valor numérico (0 al 100) en cada área que se expresa como variable continua, teniendo los pacientes con valores más altos peor calidad de vida6. Con el objetivo de generar una herramienta específica para pacientes con FPI, se desarrolló y validó el SGRQ-I, una versión adaptada en la que se eliminaron preguntas (2 de síntomas, 6 de actividades, 8 de impacto) que pudieran ser inadecuadas para evaluar pacientes con FPI y se agruparon las categorías de otras, quedando un remanente de 34 ítems (6 en síntomas, 10 de actividades y 18 de impacto)10.
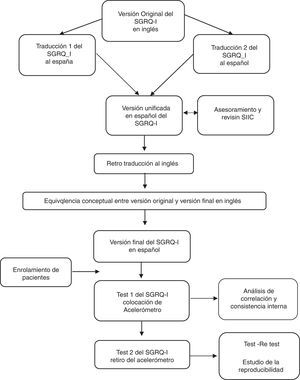
Se obtuvo autorización para realizar la traducción a los propietarios del copyright del cuestionario. Se llevaron a cabo 2 traducciones del cuestionario del idioma inglés al español por 2 profesionales del equipo de salud (entrenados en la utilización de este tipo de herramientas) de nuestra institución. Posteriormente, se logró una versión unificada de ambos cuestionarios. Para lograr una traducción genérica que represente a toda la población de habla hispana y evitar la utilización de modismos locales, se contó con el asesoramiento y la revisión del departamento de lingüística de la Sociedad Iberoamericana de Información Científica (SIIC). Esta versión fue traducida nuevamente al inglés (traducción reversa) por 2 traductoras matriculadas. Finalmente, se compararon ambas versiones en inglés (la original y la traducida) y se comprobó que no había diferencias significativas entre ellas (fig. 1).
Pacientes y medicionesSe enroló consecutivamente a pacientes con diagnóstico de FPI confirmada por el grupo multidisciplinario de especialistas en EPI según criterios ATS/ERS/ALAT 20114 en el período comprendido entre enero del 2016 y enero del 2017. Se solicitó a los pacientes que completen la versión española del SGRQ-I en una primera visita y se volvió a administrar el cuestionario una semana más tarde, período en el cual no se realizó intervención alguna. Se consignaron datos demográficos. Se realizaron pruebas de función pulmonar y se registraron los valores de capacidad vital forzada (FVC) y difusión de monóxido de carbono (DLCO). Se interrogó la disnea habitual a través de la escala modificada de Medical Research Council (mMRC). La tolerancia al ejercicio se evaluó mediante el TM6M y se registró la saturación mínima y los metros caminados. Estas pruebas se realizaron según las recomendaciones de sociedades de referencia13,14. Se extrajo sangre arterial para conocer los valores de PaO2. Se registraron niveles de actividad física durante 6 días (4 días de semana y 2 de fin de semana) utilizando el SenseWear Armband (BodyMedia Inc., Pittsburgh, PA., EE. UU.), un dispositivo multisensor que ha sido ampliamente utilizado en pacientes con EPOC y FPI15-17. Se instruyó a los pacientes a utilizar el acelerómetro las 24 h del día excepto durante los momentos de higiene personal. El estudio fue aprobado por el comité de ética del Hospital de Rehabilitación Respiratoria María Ferrer de Buenos Aires, Argentina. Todos los pacientes dieron su consentimiento por escrito.
Validación del cuestionarioSe evaluó la repetibilidad del cuestionario mediante la técnica de test-retest con una semana de diferencia entre ambas mediciones. Antes de la segunda medición se interrogó a los pacientes acerca de un empeoramiento o aparición de nueva sintomatología en la última semana. Se excluyó a aquellos pacientes que respondieron afirmativamente.
Se evaluó la consistencia interna del cuestionario para conocer la interrelación de los diferentes ítems que componen el SGRQ-I. Se estudió la validez de constructo del cuestionario mediante la correlación con las siguientes variables. Se midió la correlación con FVC % (FVC%), DLCO % (DLCO%), capacidad pulmonar total % (CPT%), PO2 arterial y metros caminados en el TM6M, por tratarse de variables que reflejan la severidad de la enfermedad. Se midió la correlación con la escala de disnea mMRC, por ser la disnea el principal síntoma de la FPI y el que genera mayor limitación de las actividades diarias. Se estudió también la correlación del cuestionario con la cantidad de pasos dados por el paciente durante 24 h, por entender que la limitación de la movilidad está ligada a una peor calidad de vida18.
EstadísticaLas variables continuas se describieron mediante media y desviación estándar, o mediana y rango intercuartil , dependiendo de su distribución. Las variables categóricas se describieron según su frecuencia. Para estudiar la repetibilidad se utilizó el coeficiente de correlación intraclase (CCI) y el gráfico de Bland-Altman. Se consideró una repetibilidad aceptable un CCI igual o mayor de 0,7. Para el estudio de la consistencia interna se utilizó el coeficiente alfa de Cronbach. Se consideró una consistencia interna aceptable a partir de una valor igual o mayor de 0,7 de este coeficiente. Para el análisis de correlación se utilizaron el test de Pearson o el de Spearman, de acuerdo con la presencia o no de distribución normal, respectivamente. Se consideró correlación débil un valor de r menor a 0,3, moderada entre 0,3 y 0,6 y fuerte mayor a 0,67. Se consideró significativo un valor de p menor o igual a 0,05.
Se siguieron las recomendaciones de la iniciativa STROBE para la comunicación de resultados de estudios observacionales19.
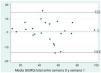
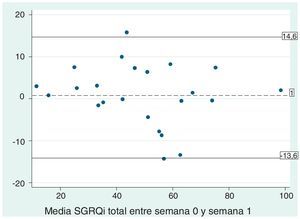
ResultadosSe reclutó a 27 pacientes de forma consecutiva para la administración del cuestionario. Dos pacientes fueron excluidos al no presentarse luego de una semana para contestar nuevamente el cuestionario y se excluyó a 2 pacientes por manifestar un cambio en los síntomas en ese período. Las características de los 23 pacientes que se estudiaron se muestran en la tabla 1. Al estudiar la repetibilidad, encontramos una buena concordancia en el test-retest, con un CCI de 0,96 (p<0,001). En el gráfico de Bland-Altman se observa asimismo buena concordancia entre las 2 mediciones (fig. 2). La media de la diferencia entre los valores del test-retest fue de 0,83, con un valor de p en el T test para muestras pareadas de 0,581 (IC del 95%, 2,25 a 3,92). En consecuencia, confirmamos que el valor no se aleja significativamente de cero, es decir, que al comparar las respuestas de los pacientes en el momento cero y a la semana estas no difieren significativamente.
Descripción de las características demográficas, clínicas y funcionales de pacientes con FPI incluidos para la validación de la versión en español del SGRQ-I
| Variable | Total=23 pacientes |
|---|---|
| Edad en años, media (DE) | 71,9 (6,6) |
| Sexo masculino, n (%) | 18 (78,2) |
| FVC%, media (DE) | 68,9 (15,5) |
| DLCO%, media (DE) | 39,7 (17,8) |
| CPT%, media (DE) | 62,52 (12,9) |
| PaO2 mmHg, media (DE) | 70,6 (13,6) |
| TM6M, media (DE) | 378,5 (92,2) |
| Síntomas SGRQ-I, media (DE) | 58,1 (23,8) |
| Actividad SGRQ-I, media (DE) | 70,5 (18,1) |
| Impacto SGRQ-I, media (DE) | 36 (24,1) |
| Total SGRQ-I, media (DE) | 49,3 (20,1) |
| Pasos, media (DE) | 4720 (3372) |
| Disnea mMRC, mediana (RIC) | 3 (1-4) |
CPT%: capacidad pulmonar total %; DE: desviación estándar; DLCO%: difusión de monóxido de carbono %; FVC%: capacidad vital forzada%; mMRC: escala modificada de disnea de Medical Research Council; PaO2: presión arterial de oxígeno; RIC: rango intercuartil; SGRQ-I: cuestionario de calidad de vida Saint George específico para fibrosis pulmonar idiopática; TM6M: cantidad de metros caminados en el test de marcha de seis minutos.
Gráfico de Bland-Altman para el estudio de la reproducibilidad del SGRQ-I mediante test-retest. Se observa que la media de la diferencia entre ambos puntajes totales del SGRQ-I toma un valor cercano al valor ideal de cero (0,83). Tambien se observan las líneas que coinciden con los valores de 2 desvíos estándar por encima y por debajo de la media (–13,6 y 14,6).
En el estudio de la consistencia interna hallamos un coeficiente alfa de Cronbach de 0,9 al incluir al valor total y de 0,81 al excluirlo (p<0,001), lo cual evidencia una buena interrelación de los diferentes ítems del cuestionario.
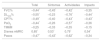
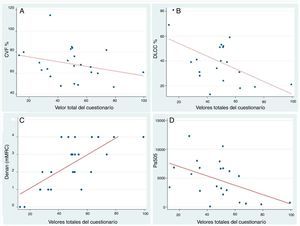
El valor total del cuestionario mostro buena correlación con FVC% (r=–0,44; p=0,033), DLCO% (r=–0,55; p=0,011), PaO2 (r=–0,44; p=0,036), disnea mMRC (r=–0,65; p<0,001) y pasos dados en 24 h (r=–0,47; p=0,024) (fig. 3). La correlación entre los diferentes ítems del cuestionario y todas las variables utilizadas para estudiar la validez de constructo se muestran en la tabla 2.
Gráfico de dispersión con recta ajustada para el estudio de la correlación entre el valor total del SGRQ-I y las variables CVF%, DLCO%, escala mMRC de disnea y cantidad de pasos. A) Correlación entre valor total del cuestionario y CVF% (capacidad vital forzada %) (r= –0,44; p = 0,033; coeficiente beta= –0,22). B) Correlación entre valor total del cuestionario y DLCO% (capacidad de difusión de monóxido de carbono %) (r= –0,55; p= 0,011; coeficiente beta= –0,60). C) Correlación entre valor total del cuestionario y puntaje de la escala de disnea mRMC (r = 0,71; p < 0,001; coeficiente beta= 0,047). D) Correlación entre valor total del cuestionario y los pasos dados por el paciente en 24 horas medidos mediante acelerómetro (r = 0,47; p = 0,024; coeficiente beta= –81,08).
Correlación entre los ítems del cuestionario y las variables utilizadas para la validación del SGRQ-I en español
| Total | Síntomas | Actividades | Impacto | |
|---|---|---|---|---|
| FVC% | –0,44* | –0,45* | –0,42* | –0,35 |
| DLCO% | –0,55* | –0,23 | –0,76* | –0,44* |
| CPT% | –0,49* | –0,40 | –0,43* | –0,43* |
| PaO2 | –0,44* | –0,26 | –0,57* | –0,36 |
| TM6M | –0,25 | –0,33 | –0,35 | –0,15 |
| Disnea mMRC | 0,65* | 0,53* | 0,79* | 0,54* |
| Pasos | –0,47* | –0,43* | –0,62* | –0,34 |
CPT%: capacidad pulmonar total %; DLCO%: difusión de monóxido de carbono %; FVC%: capacidad vital forzada%; mMRC: escala modificada de disnea de Medical Research Council; PaO2: presión arterial de oxígeno; SGRQ-I: cuestionario de calidad de vida Saint George específico para fibrosis pulmonar idiopática; TM6M: cantidad de metros caminados en el test de la marcha de 6 minutos.
En este estudio realizamos la traducción y la validación del cuestionario SGRQ-I para ser utilizado en el idioma español. Demostramos que el cuestionario tiene buena reproducibilidad con un buen CCI en la prueba de test-retest y buena consistencia interna evaluada con el coeficiente alfa de Cronbach. Además, estudiamos la validez de constructo de la herramienta mediante la correlación con variables que traducen la severidad de la enfermedad, la limitación de la actividad diaria y el síntoma dominante (disnea). En todos los casos obtuvimos valores por encima del corte de aceptabilidad establecido previamente.
El trabajo cuenta con algunas limitaciones. En primer lugar, consideramos que hubiera sido ideal estudiar la correlación con otra herramienta validada específicamente para medir la calidad de vida en EPI. Esto no fue posible porque no contamos hasta la realización de este trabajo con una herramienta de estas características en el idioma español. Si bien durante el desarrollo del SGRQ-I en inglés Yorke et al. utilizaron el cuestionario SF-36 para evaluar la validez de constructo, nosotros hemos decidido no utilizarlo por ser un cuestionario que evalúa la salud global del paciente y su resultado puede estar sesgado por algún motivo no respiratorio. En segundo lugar, consideramos que hubiera sido valioso estudiar la variabilidad del cuestionario en el tiempo o ante alguna intervención (p. ej., la rehabilitación pulmonar), para de esta forma estimar su sensibilidad al cambio y determinar el mínimo cambio clínicamente significativo. En tercer lugar, consideramos una limitación el tamaño muestral de nuestro estudio. En este sentido debe considerarse la prevalencia de la FPI, siendo de 14 a 27,9 casos por cada 100.000 habitantes utilizando una definición estricta y entre 42,7 a 63 casos por cada 100.000 personas utilizando una definición más amplia de FPI20. Por otro lado, si bien algunos autores recomiendan entre 30 y 40 pacientes para los trabajos de traducción y validación, otros investigadores han obtenido resultados satisfactorios con tamaños muestrales similares a nuestro trabajo21,22. Creemos que la validación de un cuestionario específico para evaluar la calidad de vida en pacientes con FPI es de vital importancia, dado que las herramientas disponibles hasta este momento fueron diseñadas para otras enfermedades respiratorias y no se adaptan bien a esta enfermedad. Swigris et al. realizaron una revisión de 30 trabajos donde se evaluaban las propiedades psicométricas del SGRQ en pacientes con FPI y mostraron una excelente consistencia interna de las áreas de actividades, impacto y valor total7. Sin embargo, la consistencia interna en el área de síntomas fue moderada, con valores por debajo de 0,7 en gran parte de los estudios que fueron incluidos en la revisión. Esta diferencia probablemente se deba a que este área del cuestionario interroga sobre una serie de síntomas respiratorios (tos, esputo, disnea, sibilancias y crisis respiratorias), algunos de los cuales no son habituales en pacientes con FPI, siendo en cambio los síntomas dominantes en otras enfermedades como EPOC o asma23,24.
Dentro del constructo teórico elaborado para evaluar la validez del cuestionario, incluimos variables que hacen referencia a la severidad de la enfermedad, por entender que aquellos pacientes con formas más severas deberían ver más afectada su calidad de vida25. Hallamos buena correlación entre el puntaje total del SGRQ-I y los valores de FVC%, DLCO y PaO2, con resultados similares a los mostrados por otros estudios7. La revisión antes mencionada muestra valores de r entre –0,30 y –0,66 para estas variables, similares a los hallados por nuestro grupo. Comparando la correlación entre las mismas variables y el área de actividades, nuestros resultados son moderados a fuertes (r de –0,42 a –0,76) al igual que los resultados mostrados en la revisión de Swigris et al. (r de –0,38 a –0,65). En estos trabajos la correlación fue débil a moderada tanto en el área áreas de síntomas (r de –0,21 a –0,46) como el área de impacto (r de –0,24-0,39), similar a los resultados hallados en nuestro estudio7. Nuestro grupo estudió también la correlación del cuestionario con la escala de disnea mMRC, por ser la disnea el síntoma dominante y más limitante en esta enfermedad, con el consiguiente impacto en la calidad de vida de los pacientes26,27. Un grupo de autores que estudió pacientes con EPI secundaria a esclerosis sistémica halló valores moderados en la correlación entre el valor total del SGRQ y el grado de disnea mMRC (r=0,41)28. Si bien nuestros pacientes tienen otro diagnóstico, lo cual dificulta la comparación, nuestros resultados mostraron que esta variable se correlaciona mejor en el valor total y en todas las áreas del cuestionario.
Consideramos que la inclusión de la medición de pasos en el constructo teórico utilizado para la validación de la herramienta es una fortaleza de nuestro estudio por ser original y pertinente. La limitación en la actividad física desarrollada por los pacientes tiene impacto claro en la calidad de vida y la medición de los pasos parece ser una forma fidedigna de medirla29-31. Un grupo de autores que estudió la correlación de los pasos (medidos con el mismo dispositivo utilizado en nuestro estudio) con otras variables clínicas halló valores similares a nuestro grupo al correlacionar con valores de SGRQ total (r de –0,5 y –0,47, respectivamente)18. Los datos reportados por el grupo que desarrolló la versión del cuestionario específica para FPI en idioma inglés (SGRQ-I) no difieren significativamente de los hallados por nuestro equipo en la validación de la versión en español (tabla 3). Es de destacar que en una cantidad importante de áreas del cuestionario encontramos mejor correlación que la hallada por estos autores, lo cual evidencia la validez de esta versión de la herramienta para evaluar la calidad de vida10.
Comparación de coeficientes de correlación obtenidos en la validación de SGRQ-I en inglés y los obtenidos en la validación de la versión en español
| Total | Síntomas | Actividades | Impacto | |||||
|---|---|---|---|---|---|---|---|---|
| SGRQ-I inglés | SGRQ-I español | SGRQ-I inglés | SGRQ-I español | SGRQ-I inglés | SGRQ-I español | SGRQ-I inglés | SGRQ-I español | |
| FVC% | –0,33 | –0,44 | –0,25 | –0,45 | –0,30 | –0,42 | –0,31 | –0,35 |
| DLCO% | –0,37 | –0,55 | –0,25 | –0,25 | –0,33 | –0,76 | –0,36 | –0,41 |
| TM6M | –0,28 | –0,25 | –0,12 | –0,33 | –0,30 | –0,35 | –0,26 | –0,15 |
DLCO%: difusión de monóxido de carbono %; FVC%: capacidad vital forzada %; SGRQ-I: cuestionario de calidad de vida Saint George específico para fibrosis pulmonar idiopática; TM6M: cantidad de metros caminados en el test de la marcha de 6 minutos.
En conclusión, dado que la FPI es una patología progresiva, que posee mal pronóstico y que aún no se han desarrollado fármacos que logren cambiar el curso de la enfermedad, la calidad de vida relacionada con la salud es un parámetro importante a medir tanto en investigación como en la práctica clínica. La versión en español del SGRQ-I desarrollada por nuestro grupo tiene buena consistencia interna, es reproducible y es válida para evaluar calidad de vida en pacientes con FPI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.