Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es una "enfermedad prevenible y tratable", caracterizada por una limitación al flujo aéreo, no totalmente reversible y por lo general progresiva, que se asocia a una respuesta inflamatoria anormal del pulmón a diversos gases y partículas tóxicas, sobre todo al humo del tabaco. Se trata de una enfermedad pulmonar con importantes repercusiones sistémicas1. Según datos de la Organización Mundial de la Salud (OMS), se estima que en el año 2020 la EPOC constituirá la quinta enfermedad más prevalente y la tercera causa de muerte de la humanidad2.
El estudio IBERPOC puso de manifiesto que en la población española de entre 40 y 69 años de edad existía una prevalencia de EPOC de un 9%3. Este porcentaje probablemente se habría incrementado si se hubiese incluido a las personas mayores de 70 años, dado que esta afección aumenta claramente con la edad y la duración del hábito tabáquico. Otro dato relevante del estudio IBERPOC fue que el 78,2% de los enfermos no estaba previamente diagnosticado.
Ante la magnitud del problema, los Institutos Nacionales de Salud de Estados Unidos (US National Heart, Lung and Blood Institute) y la OMS han puesto en marcha el programa GOLD4 (Global Initiative for Chronic Obstructive Lung Disease). Los objetivos del tratamiento y puntos clave para el correcto control de la EPOC han sido revisados recientemente5 y son los siguientes: prevención de la progresión de la enfermedad, alivio de los síntomas, mejorar la tolerancia al ejercicio físico, prevenir y tratar las complicaciones y las exacerbaciones, reducir la mortalidad y mejorar la calidad de vida de los pacientes.
Es obvio que el arsenal terapéutico disponible en la actualidad para el tratamiento de la EPOC no ha podido cumplir hasta la fecha con estos objetivos. Estudios recientes, cada vez más consistentes, con un nuevo anticolinérgico selectivo, el tiotropio, indican que el tratamiento de mantenimiento con este fármaco podría ayudarnos a conseguir una buena parte de los propósitos planteados en los documentos de consenso e iniciativas como GOLD6,7.
Sistema colinérgico
El sistema colinérgico es el principal componente en la obstrucción de las vías aéreas en la EPOC y es la causa de la broncoconstricción y de la hipersecreción mucosa característica en la enfermedad. Además, es potencialmente reversible. Las fibras colinérgicas presinápticas parten del tronco cerebral y, a través del nervio vago, llegan a los ganglios parasimpáticos. Aquí es donde se produce la sinapsis neural y surgen las fibras posganglionares que inervarán la musculatura lisa o las glándulas mucosas. La estimulación del nervio vago provoca la liberación de acetilcolina, que actúa al activar los diferentes receptores muscarínicos8. Se han clonado 5 genes diferentes de receptores muscarínicos en estudios de hibridación molecular. De éstos, se han tipificado farmacológicamente 3, los receptores M1, M2 y M3, que han demostrado poseer funciones fisiológicas distintas. Los receptores M1, localizados en los ganglios parasimpáticos, paredes alveolares y glándulas mucosas, actúan como facilitadores de la neurotransmisión. Los receptores M3 están presentes en el músculo liso y las glándulas submucosas, y son los causantes de la broncoconstricción y la secreción glandular. Por último, los receptores M2 se encuentran en las propias terminaciones nerviosas colinérgicas e inhiben la liberación local de acetilcolina, ejerciendo un feedback negativo en la acción vagal (autorreceptor)9. De todo ello se deduce que la selectividad de un compuesto inhibidor de los receptores M3 y M1 puede presentar claras ventajas farmacológicas e importantes implicaciones terapéuticas.
Tiotropio
Propiedades farmacológicas del tiotropio
El descubrimiento de un nuevo fármaco de acción prolongada y selectiva sobre los subtipos de receptores ha supuesto un gran avance en la farmacología de los compuestos antimuscarínicos10. Como el bromuro de ipratropio, el tiotropio se diferencia químicamente de la atropina por una estructura de amonio cuaternario cargado positivamente que hace que no atraviesen las membranas biológicas y que su absorción intestinal sea muy limitada, con lo que se evitan los posibles efectos secundarios derivados de la difusión sistémica del fármaco. La diferencia estructural entre los compuestos de segunda generación y el tiotropio es la presencia de grupos tiófeno que confieren a la molécula de tiotropio su carácter lipofílico11. Se desconoce aún si estas diferencias estructurales tienen efecto en sí mismas sobre la afinidad por los receptores muscarínicos.
Estudios clínicos preliminares
In vitro, el tiotropio posee un efecto inhibitorio potente frente a la contracción bronquial inducida por vía colinérgica en el músculo liso de la vía aérea y, aunque el inicio de su acción es más lento que el de la atropina o el ipratropio, al ser la disociación de los receptores muscarínicos extremadamente lenta comparada con éstos, sus efectos se mantienen durante más tiempo12. Los resultados de los estudios iniciales que comparaban la cinética de disociación del tiotropio con la de otros antagonistas sobre los receptores muscarínicos fueron esperanzadores. Estos estudios mostraron que, aunque el tiotropio tiene una afinidad similar para los 3 tipos de receptores muscarínicos, la velocidad de disociación de sus receptores es más lenta que la de los otros compuestos (el tiotropio se disociaba unas 100 veces más despacio que el ipratropio) y, además, presenta una velocidad de disociación diferente sobre los receptores M1 y M3 (selectividad dinámica), en los que la disociación es mucho más lenta que la observada sobre los M2 (tabla I)11,13-15. Esto confirma los resultados de los estudios en humanos que indicaban que el bromuro de tiotropio se disocia lentamente de los receptores M3 pero rápidamente de los M216,17. Esta liberación retardada de los receptores M3 (aún más lenta que de los M1) le confiere un efecto broncodilatador mantenido durante 24 h.
Los estudios preclínicos realizados en sujetos sanos (fase I), utilizando dosis únicas o múltiples de bromuro de tiotropio, no mostraron efectos adversos relevantes, como alteraciones en la frecuencia cardíaca y/o respiratoria, presión arterial, pupilometría o alteración de parámetros analíticos. La sequedad de boca se presentó únicamente cuando se administraban dosis altas (superiores a 80 μg). Tras la inhalación de tiotropio se obtiene un pico sérico máximo a los 5 min, que desciende en menos de 1 h hasta alcanzar los valores de 2 pg/ml y desaparece en el plasma en 5-6 días, independientemente de la dosis utilizada. Se observó, además, una disminución de la resistencia de la vía aérea (Raw) de 72 h de duración14,18.
Nos encontramos, pues, ante un compuesto con afinidad selectiva sobre los receptores muscarínicos y con el perfil farmacológico adecuado, lo que le otorga unas cualidades idóneas como agente broncodilatador de larga duración12,19.
Consideraciones generales sobre los ensayos clínicos con tiotropio
Antes de comenzar a detallar estos trabajos, es preciso aclarar una serie de conceptos que aparecerán a lo largo de este artículo o en los gráficos incluidos en él sobre las expresiones espirométricas utilizadas para evaluar la respuesta broncodilatadora del producto. En estos ensayos se analiza la eficacia broncodilatadora del fármaco mediante la realización, tras la administración de las dosis correspondientes, de una serie de espirometrías que permiten construir una curva tiempo-respuesta.
La respuesta máxima o pico constituye el máximo grado de broncodilatación detectado. Puede determinarse el tiempo que tarda en producirse.
La respuesta media de las determinaciones efectuadas en las horas siguientes (3-6 h) a la administración del fármaco informa no sólo de la rapidez con la que se obtiene la respuesta broncodilatadora, sino de su consistencia y persistencia.
La respuesta valle (trough) se obtiene a partir de una espirometría realizada al finalizar el intervalo terapéutico de una dosis e inmediatamente antes de la administración de la siguiente. Este concepto es de gran interés, puesto que nos informa sobre la persistencia del efecto broncodilatador antes de la siguiente dosis.
Los pacientes con EPOC incluidos en estos trabajos cumplían una serie de criterios previamente establecidos: diagnóstico de EPOC según normativa de la American Thoracic Society, edad mayor o igual a 40 años, ser o haber sido fumador de al menos 10 paquetes-año, presentar en la espirometría un FEV1 inferior al 65%, una relación FEV1/FVC menor del 70% y no tener historia de asma, atopia, rinitis alérgica ni presentar en la analítica un recuento de eosinófilos mayor de 400/ml.
En todos los estudios se administró tiotropio una vez al día mediante un inhalador de cápsulas de polvo seco (HandiHaler®). Su mecanismo de acción se basa en la evacuación del polvo contenido en una cápsula, previamente perforada, mediante el flujo inspiratorio del paciente. Estudios in vitro realizados con este dispositivo muestran que flujos inspiratorios de 15 l/min son suficientes para vaciar la cápsula. Estudios realizados con HandiHaler® en un grupo de 26 pacientes con EPOC con grados diferentes de FEV1 (menor o igual al 27%, entre el 28 y el 45%, y entre el 46 y el 65%) concluyeron que todos los enfermos fueron capaces de generar unos flujos inspiratorios suficientes para vaciar las cápsulas de tiotropio y utilizar con eficacia el dispositivo20.
Establecimiento de dosis
El primer ensayo en fase II de auténtico interés en la EPOC lo realizó el Grupo Holandés para el Estudio del Tiotropio21. El objetivo del trabajo de Maesen et al fue investigar la dosis de tiotropio necesaria para conseguir un efecto broncodilatador de larga duración. Se trata de un estudio aleatorizado, doble ciego, controlado y cruzado, en el que cada paciente inhalaba dosis únicas de bromuro de tiotropio de 10 a 80 μg y placebo, considerando un período de lavado del fármaco de 72 h entre las diferentes dosis. Para valorar el efecto del fármaco se analizaron los valores pico, medios y valle del FEV1 en los 35 pacientes incluidos, en intervalos sucesivos hasta llegar a las 32 h después de la inhalación del fármaco o placebo. Se observó una mejoría significativa en los parámetros espirométricos de los pacientes tratados con tiotropio frente a placebo en todas las dosis utilizadas, con un efecto rápido a los 15 min y con un pico del 19-26% de FEV1 sobre el basal obtenido en el rango de 1 a 4 h. La duración del efecto se prolongó hasta las 32 h. En general, el fármaco fue bien tolerado y no se presentaron efectos adversos relevantes21. En las conclusiones se señala que el tiotropio resulta adecuado para su administración una sola vez al día.
Estudio de rango de dosis
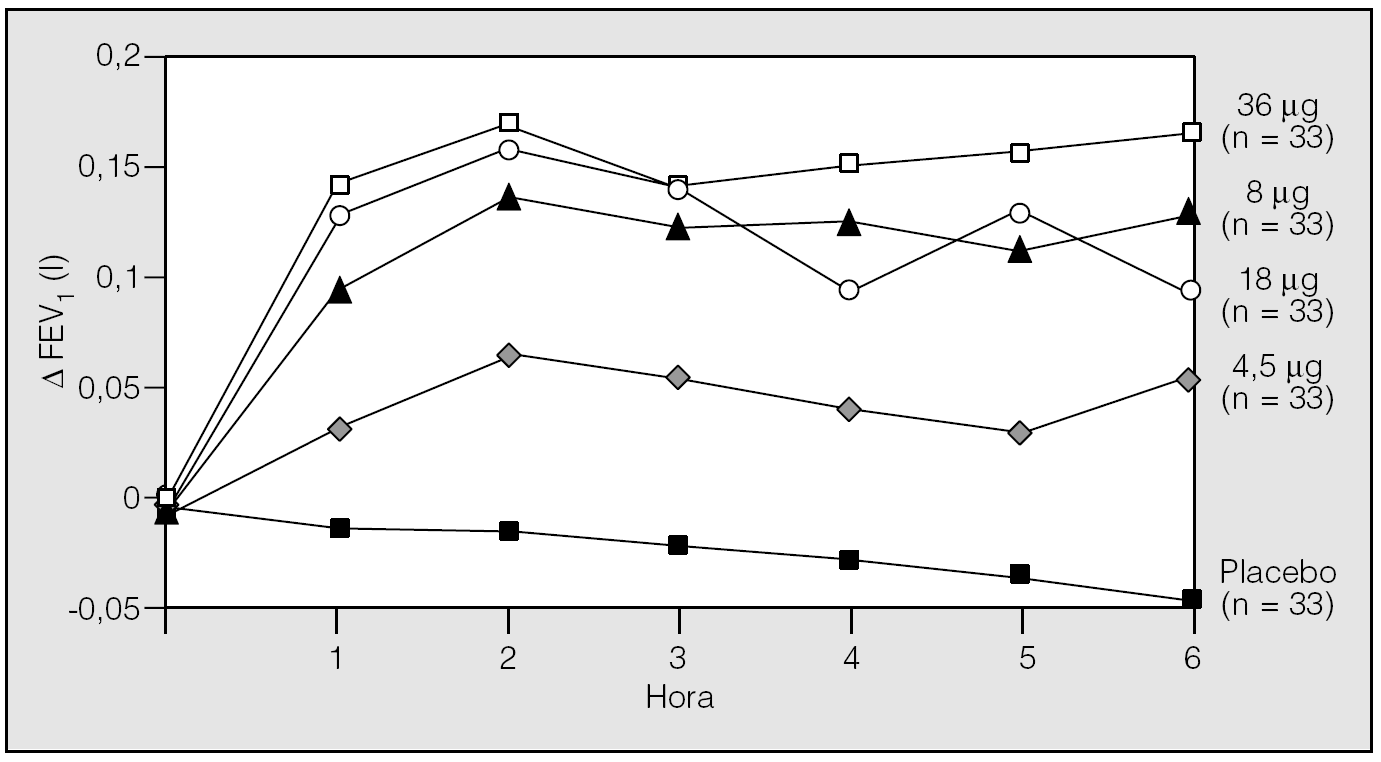
Posteriormente Littner et al22 realizaron un análisis de rango de dosis para evaluar la eficacia de diferentes dosis de tiotropio (0, 4, 5, 9, 18 y 36 μg), administrado una vez al día. En este estudio aleatorizado, doble ciego y controlado con placebo, con grupos paralelos y de 4 semanas de duración, se incluyó a 169 pacientes con EPOC y un FEV1 medio del 44%. Durante todo el período de estudio, período basal (2 semanas), tratamiento (4 semanas) y postratamiento (3 semanas) se programaron visitas semanales en las que se realizaron espirometrías seriadas a diferentes horas (8.00, 10.00 y 12.00 h). Los resultados muestran que con cualquiera de las dosis utilizadas se produce una mejoría significativa del FEV1. El valor promedio del FEV1 valle aumentó en 0,12, 0,09, 0,13 y 0,17 l, respectivamente, en los grupos de 4, 9, 18 y 36 μg de tiotropio, y disminuyó 0,02 l en el grupo placebo. Además, esta mejoría se mantuvo durante todo el período de seguimiento en comparación con placebo. Al no encontrarse diferencias en cuanto a eficacia entre las diferentes dosis utilizadas, se seleccionó como dosis óptima la de 18 μg en función de la eficacia máxima y de su nivel mínimo de efectos adversos. Otro de los hallazgos interesantes fue encontrar que, al interrumpir su administración, el FEV1 volvió lentamente, durante un período de observación de 3 semanas, a los valores previos. Este hecho indica que el fármaco tiene una acción prolongada y, por tanto, que olvidar una dosis no influye en el control de la broncodilatación que produce el tiotropio22. Los trabajos de Littner et al22,23 han permitido seleccionar la dosis de 18 μg, una vez al día, por su seguridad y eficacia (fig. 1).
Fig. 1. Tiotropio: relación dosis-respuesta sobre el volumen espiratorio forzado en el primer segundo (FEV1). (Modificada de Littner et al22,23.)
Estudios de eficacia y seguridad
La eficacia y seguridad del bromuro de tiotropio como broncodilatador en el tratamiento de mantenimiento de la EPOC se han evaluado en varios ensayos clínicos multicéntricos controlados. Entre ellos figuran 6 ensayos cruzados en fase III: 2 de 6 meses y 2 de un año de duración, controlados con placebo, y 2 de un año de duración controlados con bromuro de ipratropio.
Otros trabajos publicados hasta la fecha completan la bibliografía disponible en la actualidad sobre este fármaco. Entre los más interesantes, que se comentarán a continuación, cabe destacar la comparación de tiotropio con un agonista β de acción prolongada, el salmeterol, un estudio que evalúa el efecto de tiotropio sobre los volúmenes pulmonares estáticos, otro que analiza el efecto del fármaco sobre la variación circadiana de la obstrucción al flujo aéreo y uno de los más recientes que respalda el efecto del tiotropio sobre la hiperinsuflación pulmonar, la disnea de esfuerzo y la tolerancia al ejercicio.
Eficacia sobre la función pulmonar
Estudios controlados con placebo. Por su propia naturaleza, la EPOC se caracteriza por limitación al flujo aéreo irreversible o sólo parcialmente reversible y su definición exige un FEV1/FVC posbroncodilatador menor de 0,70. Aun así, muchos sujetos con esta enfermedad muestran reversibilidad parcial y responden a la prueba broncodilatadora con un agonista β de acción corta como el salbutamol, lo que justificaría la utilización en el tratamiento de esta enfermedad de fármacos broncodilatadores. Los broncodilatadores anticolinérgicos, al igual que los agonistas β, producen relajación del músculo liso de las vías respiratorias, aunque por un mecanismo diferente. Por tanto, determinar los efectos de estos fármacos sobre los parámetros espirométricos puede ser de gran utilidad en la valoración de la eficacia del tratamiento broncodilatador15.
Casaburi et al24,25 dirigieron 2 estudios de 3 meses y de un año de duración en los que se evaluó el efecto broncodilatador del tiotropio comparado con placebo. En estos ensayos, la eficacia broncodilatadora del tiotropio se analizó mediante las 3 expresiones diferentes del FEV1 mencionadas con anterioridad: la respuesta valle (trough), la respuesta pico (valor más alto observado entre 0 y 3 h después de una dosis) y el efecto broncodilatador medio a los 180 min de la dosis.
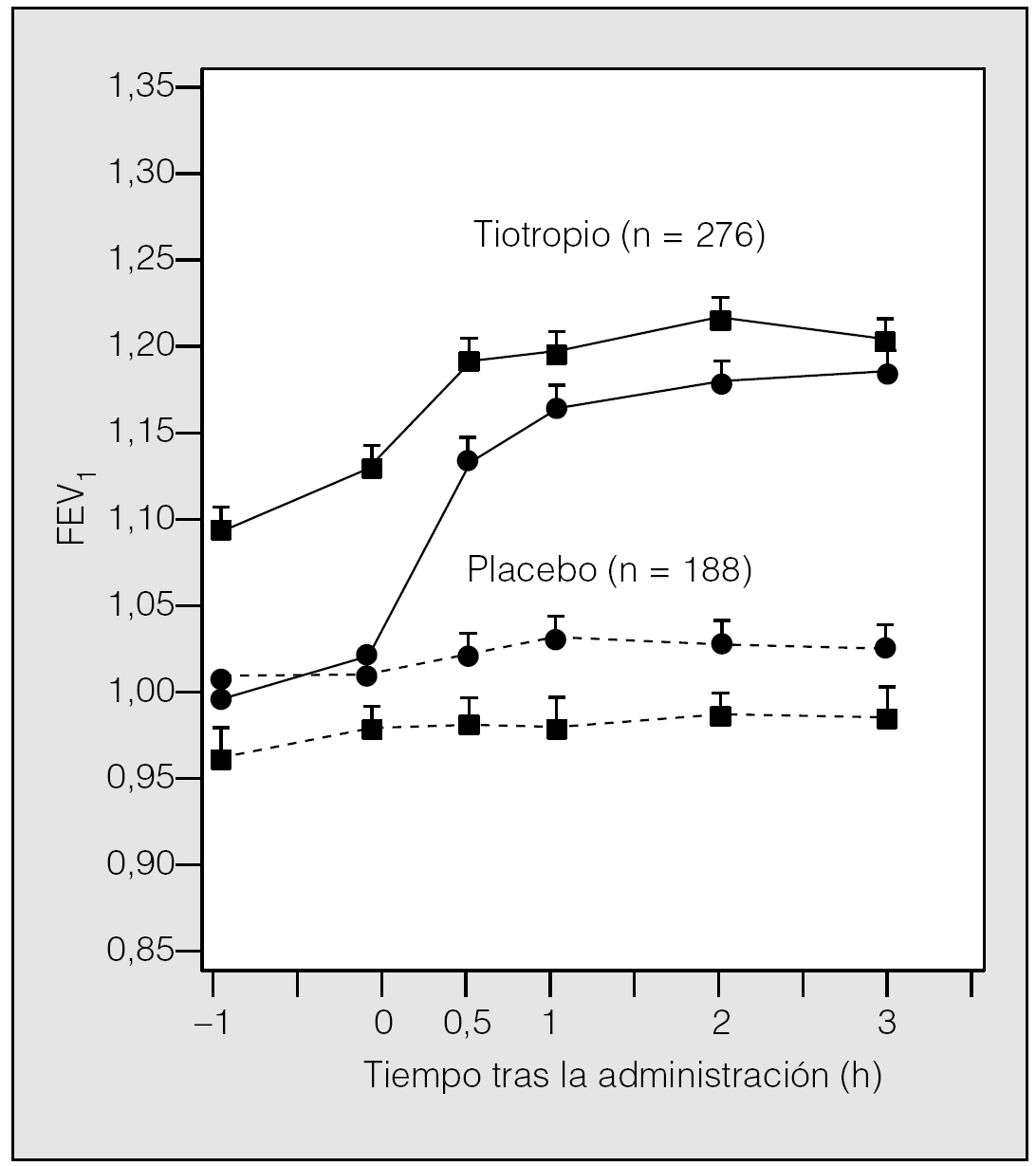
El primer estudio24 comparó el tiotropio inhalado (18 μ/día) con placebo durante 3 meses. Los cambios respecto a placebo fueron aproximadamente de 0,150, 0,220 y 0,220 l en el FEV1 valle, pico y medio, respectivamente. Este efecto beneficioso se mantuvo a lo largo de los 3 meses de estudio. Se observó también una disminución concomitante en la dosis de salbutamol necesaria para el control adicional de los síntomas. En el ensayo de un año, en el que participaron más de 900 pacientes distribuidos en grupos idénticos, se comparó tiotropio a dosis de 18 μg/día (n = 550) con placebo (n = 371). Al igual que en los trabajos anteriores, los resultados mostraron efectos beneficiosos sobre el FEV1 y FVC25. El tiotropio produjo un aumento en el FEV1 valle medio de un 11-13% sobre el valor basal, significativamente superior al placebo (p < 0,01). Estos efectos se mantuvieron a lo largo del período de tratamiento de 12 meses y no se observaron signos de taquifilaxia. Estos ensayos frente a placebo muestran la eficacia y la duración de acción del tiotropio, única en su clase (fig. 2)24,25.
Fig. 2. Efecto de tiotropio sobre el volumen espiratorio forzado en el primer segundo (FEV1). Registro del valor medio del FEV1 tras la inhalación del fármaco o el placebo en el día 1 ( ? ) y en el día 92 ( | ). En ambos casos la diferencia resultó estadísticamente significativa (p < 0,001). (Modificada de Casaburi et al24.)
Estudios comparativos con otros broncodilatadores. Los estudios comparativos entre tiotropio y otros regímenes broncodilatadores de mantenimiento en la EPOC ofrecen una visión de la efectividad broncodilatadora relativa de este fármaco y de su valor añadido. Hasta el momento, el tiotropio en dosis única diaria se ha comparado con ipratropio (anticolinérgico de acción corta administrado 4 veces al día) y con salmeterol (agonista β de acción prolongada administrado 2 veces al día).
Los ensayos de Van Noord et al26 y Vincken et al27 compararon el tiotropio administrado una vez al día (18 μg) con el ipratropio a dosis de 40 μg 4 veces al día. El primer estudio, de 3 meses de duración, mostró un efecto significativamente superior con el tiotropio frente a ipratropio, respecto a los valores valle, máximo y medio del FEV1 y de la FVC. El segundo se basó en datos agrupados de la extensión de 1 año del estudio de Van Noord et al26 y un estudio paralelo. Tras 1 año, el tiotropio fue superior al ipratropio en las respuestas valle del FEV1 (24 h tras tiotropio u 8 h tras ipratropio): +0,12 frente a -0,03 l, respectivamente. Los resultados en la FVC fueron paralelos, pero de mayor magnitud: +0,32 frente a +0,08; la mejoría en la FVC indica que, además del efecto broncodilatador de los anticolinérgicos sobre las vías respiratorias centrales, éstos podrían contribuir a la disminución del efecto de atrapamiento aéreo secundario al cierre tardío de las vías respiratorias de pequeño calibre.
El trabajo de Vincken et al27 se basó en datos agrupados de la extensión de un año de este estudio y un estudio paralelo. Los autores mostraron que al cabo de un año el tiotropio fue superior a ipratropio en las respuestas valle del FEV1 (24 h tras tiotropio u 8 h tras ipratropio): +0,120 l, en comparación con el valor inicial al final del primer año de estudio, y 0,030 l, respectivamente. Los resultados en la FVC fueron paralelos pero de mayor magnitud: +0,32 frente a 0,08 l, respectivamente.
Los resultados combinados al cabo de un año indicaron también una eficacia superior del tiotropio (n = 356) frente al ipratropio (n = 179), eficacia que se mantuvo durante todo el período de tratamiento. Al cabo de un año, en el grupo tratado con tiotropio los valores medios de FEV1 y FVC valle se mantuvieron por encima de los valores basales (el 9,6 y el 11,6%, respectivamente), mientras que en los tratados con ipratropio el FEV1 valle se redujo en un 2,5% y la FVC valle aumentó sólo un 4,2%27.
En un ensayo de 6 meses de duración efectuado sobre 623 pacientes, Donohue et al28 demuestran que el tiotropio administrado una vez al día durante 6 meses fue significativamente superior al salmeterol y placebo en los parámetros de función pulmonar (FEV1). En 2 trabajos posteriores de 6 meses de duración que incluían a 1.207 pacientes con EPOC, Brusasco et al29 compararon la eficacia y tolerabilidad de tiotropio a dosis de 18 μg/día con salmeterol inhalado (50 μg 2 veces al día). Tras la primera dosis de medicación, ambos fármacos mostraban eficacia similar frente a placebo en FEV1 valle, pico y medio. En el último día del estudio, la mejoría media en el FEV1 valle comparada con placebo para tiotropio (a las 24 h de la dosis) y salmeterol (a las 12 h de la dosis) fue de 0,120 y 0,090 l, respectivamente. Ambos efectos fueron significativamente mayores que el del placebo, y el efecto del tiotropio fue significativamente mayor que el del salmeterol. El efecto del tiotropio fue también mayor que el del salmeterol en el FEV1 pico y FEV1 ABC (área bajo la curva) desde 0 a 3 h.
Efectos sobre los volúmenes pulmonares y tolerancia al ejercicio. Como ya se ha comentado, la limitación al flujo aéreo puede valorarse mediante la determinación de una serie de parámetros espirométricos. Valores espirométricos clásicos, como el FEV1 que no siempre están relacionados con la intensidad de la disnea y la tolerancia al ejercicio de los pacientes con EPOC30. Por otro lado, cada vez se tienen más datos sobre la contribución de la hiperinsuflación estática y dinámica del pulmón a la disnea de esfuerzo que presentan los pacientes con EPOC31; hiperinsuflación que puede demostrarse midiendo el aumento del volumen de gas intratorácico, pero también mediante la medición de los volúmenes y capacidades pulmonares, principalmente mediante la determinación de la capacidad inspiratoria (IC), al ser esta medida un marcador de los cambios en el volumen residual pulmonar, siempre que la capacidad pulmonar total no varíe. De lo anterior se deduce que la detección de un aumento de la IC indicaría un descenso correspondiente en el volumen residual pulmonar y, por tanto, supondría una mejoría clínica. De esta forma, la determinación de la IC puede proporcionar información adicional sobre la existencia de hiperinsuflación y sus implicaciones clínicas31. También se sabe que, más allá de su efecto sobre el calibre de la vía aérea, los broncodilatadores pueden reducir los volúmenes pulmonares estáticos en la EPOC (un efecto que podría reducir aún más la sensación de disnea), lo que ha llevado a diversos autores a utilizar como parámetro de eficacia de estos fármacos los cambios encontrados en la medición de los volúmenes pulmonares32.
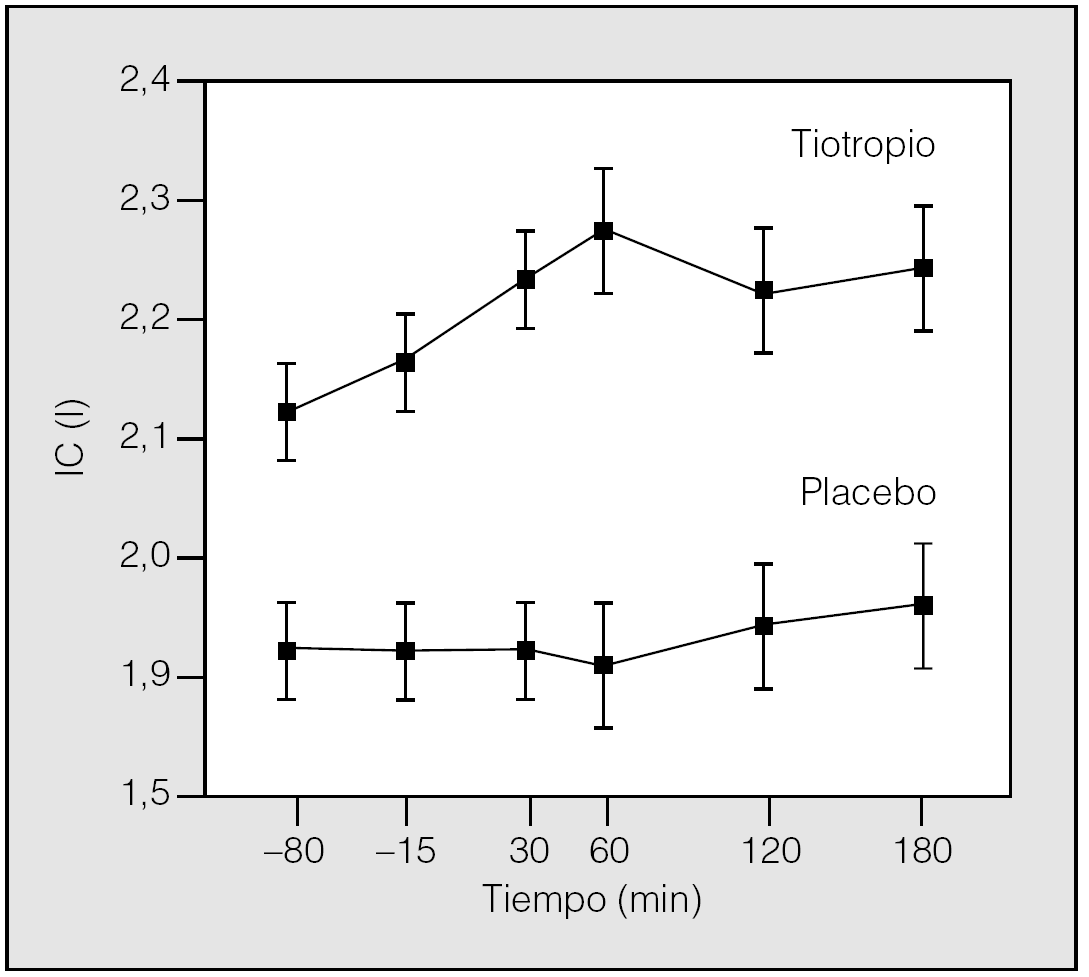
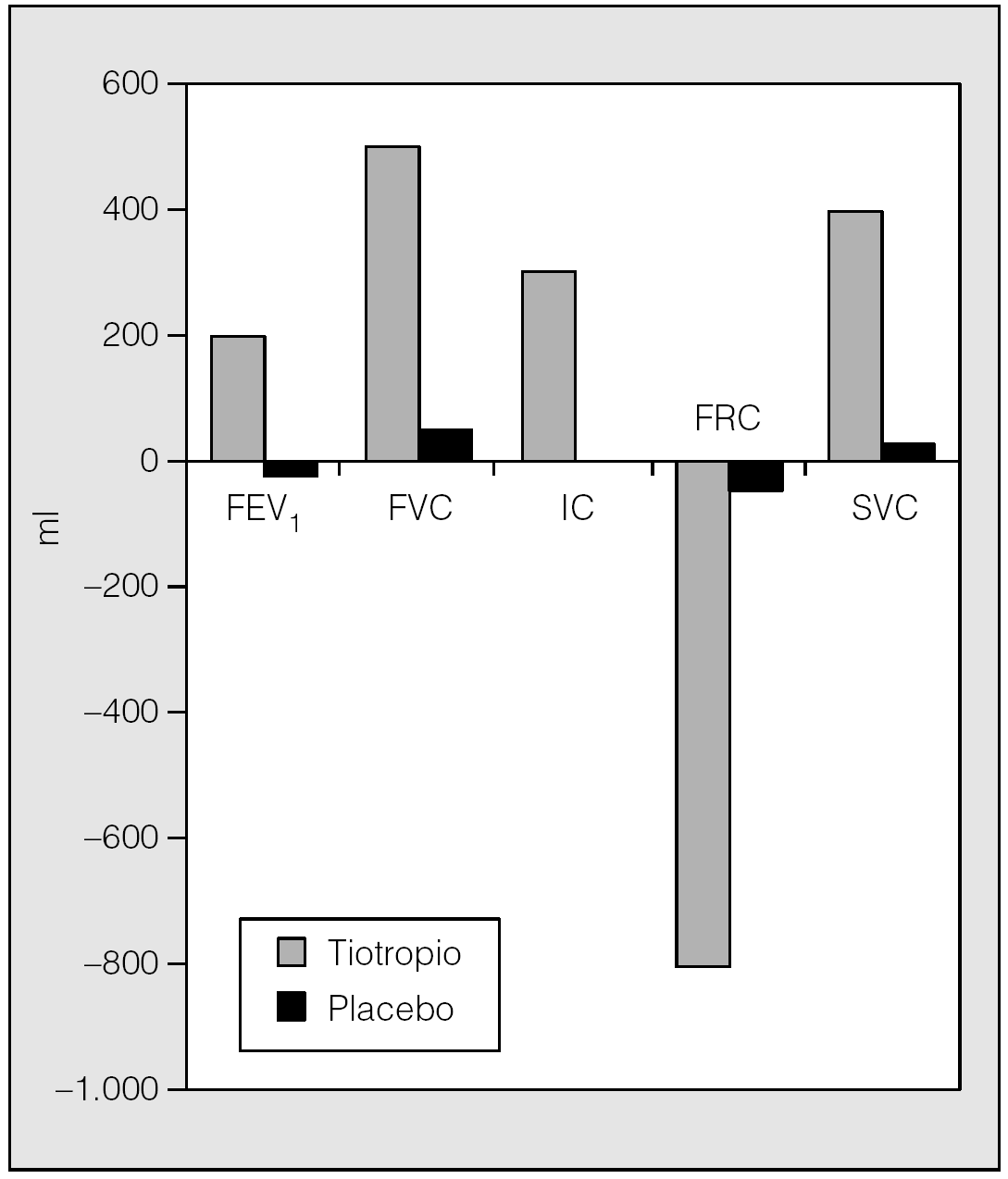
En esta línea de investigación, Celli et al33 han demostrado en un estudio reciente, en el que se incluyeron 81 pacientes con EPOC con hiperinsuflación demostrada en fase estable, que después de 4 semanas de tratamiento el tiotropio aumenta significativamente la IC valle, pico y media, en 0,22, 0,35 y 0,30 l, respectivamente, frente a placebo (fig. 3). El aumento de la IC valle en las 24 h siguientes a una dosis indica que el fármaco produce una reducción sostenida de los volúmenes, que además queda confirmada por el descenso del volumen de gas intratorácico (TGV) medido por pletismografía corporal. Muy probablemente este efecto no debería de ser único para este tipo de broncodilatador. Los resultados de este estudio demuestran que el tiotropio no sólo mejora la función pulmonar determinada mediante valores espirométricos, sino también la hiperinsuflación que presentan los pacientes con EPOC (fig. 4). Estos datos sugieren que el tiotropio puede producir variaciones en la disnea relacionada con la disminución de la hiperinsuflación pulmonar y ayudan a entender los estudios que anteriormente han demostrado la mejoría que sobre la disnea ocasiona este fármaco33.
Fig. 3. Efecto del tiotropio sobre los volúmenes pulmonares estáticos variaciones en la capacidad inspiratoria (IC) durante 3 h después de 4 semanas de tratamiento con tiotropio o placebo. El incremento de la IC con tiotropio indica que su uso da lugar a una reducción sostenida de la hiperinsuflación en reposo. (Modificada de Celli et al33.)
Fig. 4. Variaciones de los volúmenes pulmonares y de la espirometría después de 4 semanas de tratamiento con tiotropio o placebo. FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC: capacidad inspiratoria; FRC: capacidad residual funcional; SVC: capacidad vital lenta. (Modificada de Celli et al33.)
O'Donnell et al34 compararon el tiotropio con placebo para múltiples variables, entre ellas la tolerancia al ejercicio, la hiperinsuflación estática y la dinámica e intensidad de la disnea con el ejercicio, con el objetivo de demostrar que dicho fármaco reduce la hiperinsuflación pulmonar durante el ejercicio y, por tanto, mejora la tolerancia al ejercicio de los pacientes con EPOC. Se estudió a un total de 187 pacientes con EPOC moderada- grave e hiperinsuflación (capacidad residual funcional ≥ 120%). Los autores observaron que, comparado con placebo, el tiotropio se asoció a una reducción significativa de la capacidad residual funcional en reposo determinada mediante pletismografía, a un incremento de la tolerancia al ejercicio que persistía después de 6 semanas de tratamiento y a una reducción de los volúmenes pulmonares en reposo y durante el ejercicio, lo que llevaba a una reducción de la restricción mecánica, un incremento del volumen corriente y una mejoría de la capacidad ventilatoria durante el ejercicio34.
Otro trabajo reciente que evalúa los efectos del tiotropio sobre la función pulmonar es el publicado por Calverley et al35. Los autores diseñaron el estudio para demostrar que el tiotropio podría modificar el cambio nocturno del FEV1 independientemente de la hora a la que se administra el fármaco, partiendo de la base de que este parámetro puede tener una variación circadiana que podría verse influida por el bloqueo anticolinérgico. En el estudio se incluyó a 121 pacientes que recibieron tiotropio, a dosis de 18 μg/día, administrado a las 9.00 h (n = 38) o a las 21.00 h (n = 43), o bien placebo (n = 40). Se realizaron espirometrías cada 3 h durante las primeras 24 h de estudio y a las 6 semanas de tratamiento. Los resultados mostraron que el tiotropio mejora el valor medio del FEV1 (a lo largo de las 24 h) y el FEV1 nocturno (media de 3.00 y 6.00 h) en los grupos de tratamiento por la mañana y por la noche en comparación con el grupo placebo. No hubo diferencias significativas en la magnitud de cambio del FEV1 entre el momento pico y el momento valle. Los resultados indican que el tiotropio produce una broncodilatación sostenida durante 24 h, incluyendo el valor mínimo de los valores espirométricos a primera hora de la mañana, sin que esto afecte a la variabilidad circadiana.
Efectos sobre el estado de salud y calidad de vida
Estudios controlados con placebo. Aunque la pérdida de la función pulmonar es lo que caracteriza a la EPOC y la medida de este deterioro es de vital importancia, los pacientes con EPOC presentan otros efectos sistémicos que determinan su estado de salud agravado siempre por las múltiples reagudizaciones que experimentan. La pérdida de tolerancia al ejercicio y la disnea, junto a otros síntomas generales, serán los determinantes del estado de salud y la calidad de vida de estos pacientes.
Los trabajos publicados hasta el momento han demostrado que el tiotropio se asocia con mejoras significativas y clínicamente relevantes en la disnea valorada a través de cuestionarios, disnea de esfuerzo, tolerancia al ejercicio y estado de salud. En varios de los ensayos antes mencionados21,25,28 se evaluó, además de la eficacia broncodilatadora del tiotropio, el efecto que tiene el uso regular de este broncodilatador de acción prolongada sobre la disnea y la calidad de vida de los pacientes. Así, en el estudio de Casaburi et al25 se pudo comprobar que el tiotropio mejoró significativamente la puntuación focal del índice transicional de disnea (ITD) en todo el estudio comparado con placebo, con rangos de efecto del tratamiento entre 0,8 y 1,1 U. El ITD explora cambios en la disnea en 3 áreas: incapacidad funcional, magnitud de tarea y magnitud de esfuerzo, y da como resultado una "puntuación focal" que suma dichas áreas. La diferencia clínicamente relevante para este instrumento es un cambio de 1 U; así pues, los cambios en la disnea asociados con el tiotropio parecen ser clínicamente relevantes.
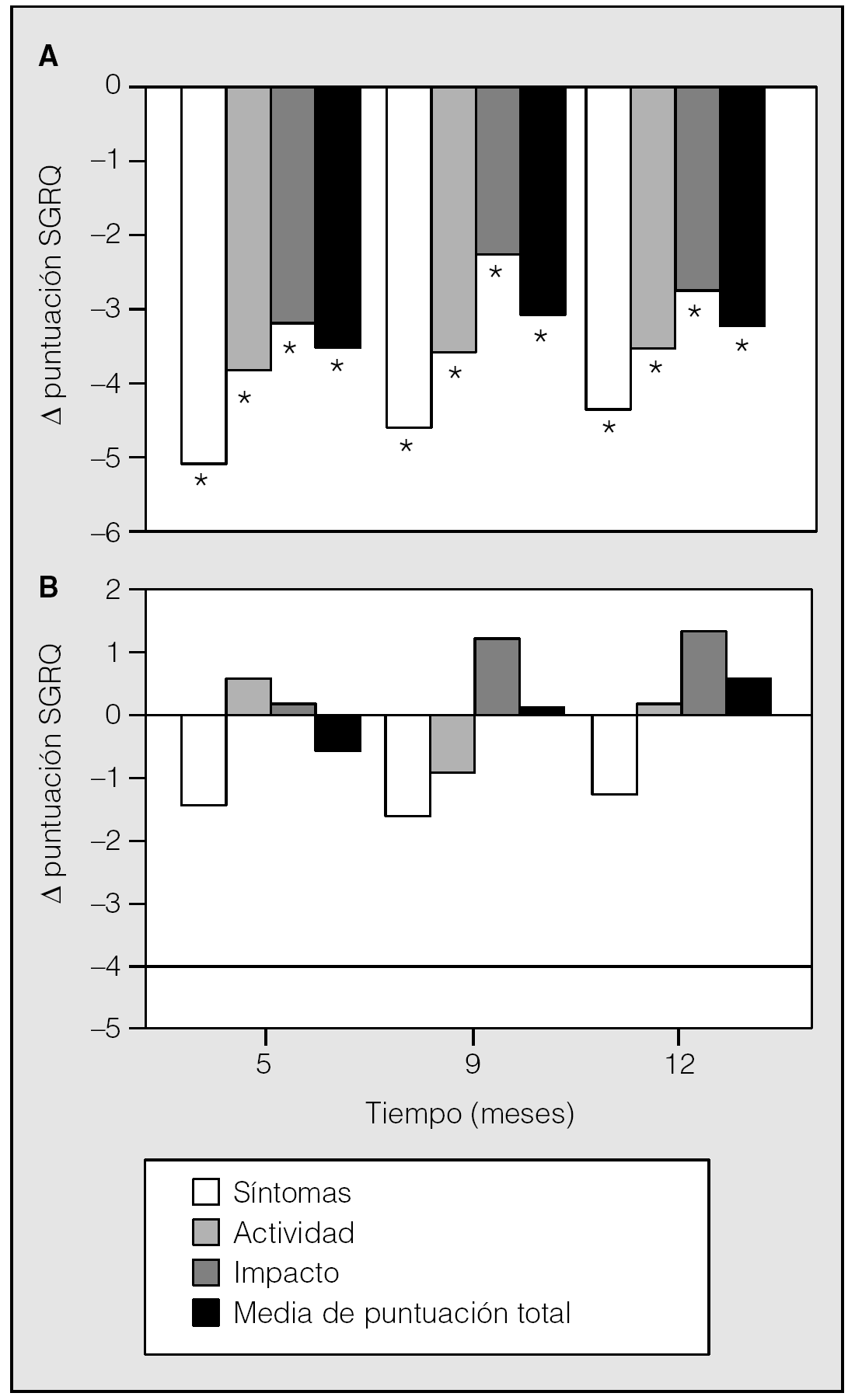
En el mismo estudio, el tiotropio también condujo a descensos significativos en los 3 dominios y la puntuación total del SGRQ (St. George's Respiratory Questionnaire). El SGRQ se utiliza ampliamente como instrumento específico para el área respiratoria; mide el estado de salud en 3 dominios: síntomas, actividad e impacto. Los cambios medios para el dominio síntomas a los 12 meses excedieron la diferencia mínima necesaria para la relevancia clínica (4 U), aunque los dominios de actividad e impacto, así como la puntuación total, cayeron cerca de este intervalo (fig. 5). Un 49% de los pacientes tratados con tiotropio sobrepasaron el intervalo de relevancia clínica para la puntuación total, frente a un 30% de los tratados con placebo25.
Fig. 5. Efecto del tiotropio sobre el estado de salud. Valores reducidos del dominio correspondiente del St. George's Respiratory Questionnaire (SGRQ) y la puntuación total indican mejoría del estado de salud para tiotropio (A) y placebo (B). *p < 0,05 frente a placebo. (Modificada de Casaburi et al25.)
En un análisis agrupado a posteriori de 2 trabajos que comparaban el tiotropio con placebo, Tashkin y Kesten36 demostraron mejoras significativas en la disnea y el estado de salud incluso en pacientes con escasa reversibilidad inicial con el tiotropio, definida como un incremento del FEV1 menor del 12% o de 200 ml con respecto al valor basal tras la primera dosis de tiotropio.
Estudios comparativos con otros broncodilatadores. El estudio de Vincken et al27, diseñado para valorar la eficacia y tolerabilidad del tiotropio frente al ipratropio en pacientes con EPOC, investigó también los efectos de ambos fármacos sobre la calidad de vida. Los autores encuentran que el tiotropio mejora significativamente la puntuación final del IDT y mejora los dominios físicos del cuestionario SF-36 en comparación con el ipratropio. La diferencia en el ITD entre los tratamientos con tiotropio e ipratropio fue de 0,90 U a los 12 meses, lo que indicaba que el anticolinérgico de acción prolongada producía globalmente una mayor mejoría en la disnea; es más, el porcentaje de pacientes que consiguieron un cambio clínicamente relevante en el ITD (1 U) fue significativamente mayor: el 31 frente al 18%, respectivamente (p = 0,004). Respecto al SGRQ, al principio descendió (mejoró) en ambos grupos (ipratropio y tiotropio), pero gradualmente tendió a regresar a la línea de base en el grupo de ipratropio. En el grupo de tiotropio, la mejoría se mantuvo. Al cabo de un año el cambio en la puntuación total del SGRQ fue de 3,74 y 0,44 para tiotropio e ipratropio, respectivamente. Esta diferencia fue estadísticamente significativa, aunque el cambio no alcanzó el intervalo de relevancia clínica de 4 U. El 52 y el 35% de los pacientes tratados, respectivamente, con tiotropio e ipratropio consiguieron el cambio clínicamente relevante al año.
También en el estudio de Donohue et al28 que compara la eficacia del tiotropio y del salmeterol se analizaron parámetros de calidad de vida y estado de salud. Los autores encontraron que el tiotropio fue superior al salmeterol en la mejoría del ITD. Además, una proporción estadísticamente más elevada de pacientes que recibían tiotropio alcanzó al menos 4 U de cambio en el cuestionario de calidad de vida utilizado, el SGRQ, comparado con los pacientes que recibían placebo. Brusasco et al29, sin embargo, encuentran que el tiotropio y el salmeterol producen mejorías significativas comparados con placebo, pero muy similares si se comparan los 2 fármacos según el ITD (1,1 frente a 0,7 U). La puntuación total del SGRQ mejoró en 4,2, 2,8 y 1,5 U en los grupos de tiotropio, salmeterol y placebo, respectivamente.
Prevención de exacerbaciones
La exacerbación de la EPOC tiene un impacto negativo sobre la morbilidad y mortalidad de la enfermedad. Por tanto, las intervenciones que afectan favorablemente la tasa de exacerbaciones o su gravedad son importantes en el manejo global de la enfermedad. En el estudio de un año de duración realizado por Casaburi et al25, la proporción de pacientes que tuvieron al menos una exacerbación fue menor entre los tratados con tiotropio que en los que recibieron placebo (el 36 frente al 42%, respectivamente25). Los pacientes tratados con tiotropio presentaban la primera exacerbación significativamente más tarde que los que recibían placebo. El número de ingresos por exacerbaciones y los días de ingreso hospitalario fueron significativamente menores en el grupo tratado con tiotropio.
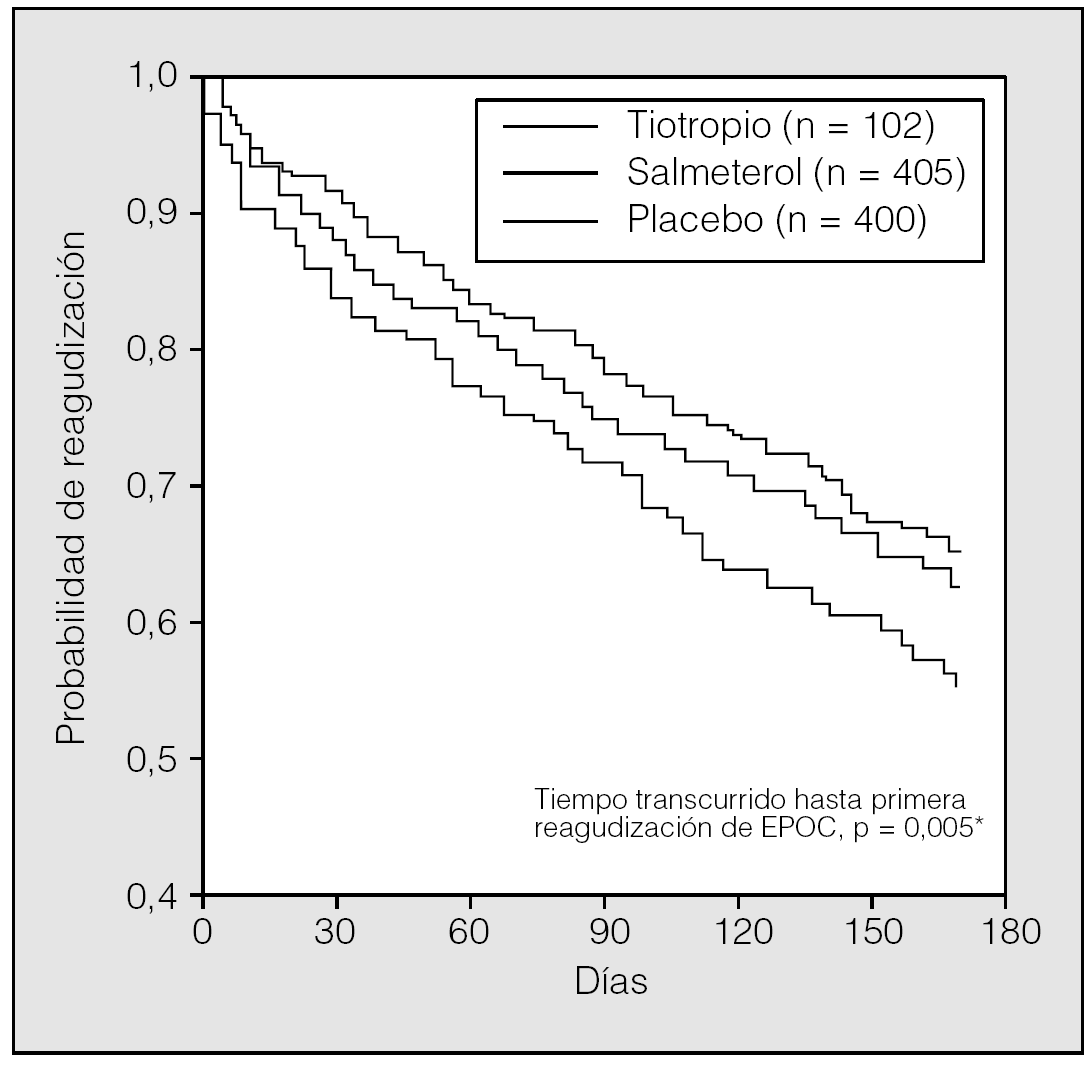
En el estudio de Vincken et al27, la proporción de pacientes con una o más exacerbaciones de EPOC fue significativamente menor en los tratados con tiotropio que en los tratados con ipratropio (el 35 frente al 46%, respectivamente; p = 0,014). Además, el uso de tiotropio se asoció con una prolongación del tiempo transcurrido hasta la primera exacerbación y una reducción del 24% del número de exacerbaciones por paciente y año. Al igual que en los trabajos comentados, en el estudio de Brusasco et al29 el uso de tiotropio redujo el número de exacerbaciones por paciente y año en un 28% y se asoció con un aumento significativo del tiempo hasta la primera agudización de EPOC comparado con placebo, aunque la diferencia entre el tiotropio y el salmeterol no fue significativa. Merece la pena resaltar que los efectos del tiotropio se produjeron en adición a los efectos de los cuidados habituales, que incluían corticoides inhalados en un 60-80% de los casos (fig. 6).
Fig. 6. Efecto del tiotropio sobre la frecuencia de exacerbaciones. *p = 0,005 tiotropio frente a placebo (test de rangos logarítmicos). (Modificada de Brusasco et al29.)
Tashkim y Kesten36 encontraron datos muy similares a los ya comentados sobre las reagudizaciones. Sin embargo, observaron que el grupo que respondía a los broncodilatadores (prueba broncodilatadora positiva) presentó reagudizaciones con más frecuencia que los que no respondieron.
Efectos adversos
Aunque se esperaba que el tiotropio a altas dosis produjera signos y síntomas anticolinérgicos, dosis únicas de 282 μg en 6 voluntarios sanos no consiguieron provocar efectos indeseados. La intoxicación aguda por ingesta inadvertida de cápsulas es muy poco probable, puesto que la formulación del fármaco no tiene una buena absorción sistémica.
El efecto adverso más frecuentemente detectado con tiotropio en los ensayos clínicos fue la xerostomía, entre el 6 y el 16%25-27,29. En el estudio de Brusasco et al29 estuvo presente en un 8,2% de los pacientes tratados con tiotropio, comparado con un 1,7 y un 2,3% de los pacientes tratados con salmeterol o placebo, respectivamente.
Habitualmente la xerostomía fue leve y se resolvió tras continuar el tratamiento. Otras reacciones en pacientes aislados, incluidas en el prospecto, incluyeron estreñimiento, taquicardia, visión borrosa, dificultad miccional y retención urinaria (coherentes con la actividad anticolinérgica del fármaco). Los pacientes con glaucoma de ángulo estrecho, hipertrofia benigna de próstata u obstrucción vesical fueron excluidos de los ensayos clínicos.
Combinación con agonistas β de acción prolongada
Dado que las combinaciones de broncodilatadores de distintas familias en la EPOC han tenido éxito probado, hay razones suficientes para combinar tiotropio con agonistas β de acción prolongada. Hasta hoy sólo se han publicado datos preliminares en forma de resúmenes. Dos estudios de Van Noord37,38 indican que la combinación de tiotropio y formoterol produce una respuesta broncodilatadora incluso mayor que cualquiera de ellos por separado en pacientes con EPOC de moderada a grave. En un primer estudio, se comparó el tiotropio, administrado una vez al día, con 2 grupos: formoterol 2 veces al día y la combinación de ambos fármacos administrada una vez al día, por la mañana. En la semana 6, el cambio medio en el FEV1 a las 12 h de la administración fue de 127, 86 y 234 ml para tiotropio, formoterol y la combinación, respectivamente. Este efecto aditivo de la combinación no está presente en los valores valle peribroncodilatador, lo que indica la duración menor de 24 h de la acción del formoterol. En un segundo estudio, el tiotropio administrado una vez al día se comparó con 2 grupos: tiotropio diario combinado con formoterol administrado una vez al día y tiotropio diario combinado con formoterol 2 veces al día. La adición de la segunda dosis de formoterol en combinación condujo a un incremento del FEV1 en el valor valle y de media a las 24 h, comparado con tiotropio solo o tiotropio más formoterol diario. Así pues, estos datos preliminares apoyan el uso de tiotropio con agonistas β de acción prolongada en la EPOC de moderada a grave.
Conclusiones
A la luz de lo anteriormente expuesto, no cabe duda de que el bromuro de tiotropio representa un avance importante en el tratamiento de mantenimiento de la EPOC. Resulta relevante la broncodilatación y broncoprotección mantenidas a lo largo de más de 24 h con la administración por vía inhalatoria una vez al día, lo que, además, debe mejorar el cumplimiento terapéutico. El fármaco tiene un gran interés desde el punto de vista farmacológico, puesto que posee la propiedad deseada de una selectividad cinética "exquisita" con disociación lenta de los receptores M3 en comparación con los receptores M2.
Los anticolinérgicos son los broncodilatadores de elección para el tratamiento de la EPOC y el tono colinérgico puede ser el único elemento reversible de la obstrucción de las vías aéreas en este proceso. En este punto, los ensayos clínicos realizados en pacientes con EPOC han confirmado que el tiotropio es un broncodilatador eficaz que proporciona un mejor control que el del tratamiento 4 veces al día con bromuro de ipratropio.
Además de su probada potencia broncodilatadora en la EPOC y su acción prolongada, la ausencia de taquifilaxia, la reducción de los volúmenes pulmonares estáticos, la mejora en la disnea, la tolerancia al ejercicio y la calidad de vida, junto con su efecto en la prevención de exacerbaciones y su elevado perfil de seguridad, hacen del tiotropio un fármaco de primera línea en el tratamiento a largo plazo de la EPOC en todo su espectro de gravedad.
¿Podría el tiotropio modificar la pérdida progresiva de función pulmonar en pacientes con EPOC? Creemos que sí. No obstante, los resultados del estudio UPLIFT (Understanding the Potential Long-term Impacts on Function with Tiotropium), ensayo aleatorizado y doble ciego, de 4 años de duración, controlado con placebo, en el que participan 512 centros de 37 países, darán próximamente una respuesta definitiva a esta cuestión.
Correspondencia: Dr. J. Ancochea Bermúdez.
Servicio de Neumología. Hospital Universitario de la Princesa.
Diego de León, 62. 28006 Madrid. España.
Correo electrónico: juli119@separ.es