Muchas de las exacerbaciones del asma se deben a infecciones víricas de las vías respiratorias que inducen una interacción de respuestas inmunitarias entre Th1 y Th2. Sin embargo, las tendencias temporales de estas respuestas durante estos fenómenos no se han estudiado con detalle.
ObjetivoIdentificar los posibles mecanismos subyacentes de la relación entre las infecciones víricas respiratorias y las exacerbaciones del asma.
Pacientes y métodosSeleccionamos 40 adultos, de 21–58 años de edad, en 4 grupos: A, sanos; B, sanos con infección vírica; C, con asma leve o moderada, y D, igual que C pero con infección vírica. Durante el curso de una infección vírica aguda de las vías respiratorias superiores se monitorizaron las citocinas Th1 y Th2 en muestras de esputo inducido en individuos por lo demás sanos y en pacientes asmáticos. La interleucina (IL) 4, la IL-5 y el interferón gamma (IFN-γ) se analizaron mediante un método ELISA. Se monitorizaron las puntuaciones de los síntomas de infección vírica y de gravedad del asma. Las tendencias temporales se analizaron mediante la utilización de modelos mixtos lineales.
ResultadosEn los grupos C y D los valores de IL-4 e IL-5 fueron mayores que en los grupos A y B. En el grupo B, los valores de IFN-γ y las puntuaciones de síntomas de infección vírica fueron máximos en el día 2 y disminuyeron rápidamente en el día 7, mientras que en el grupo D los valores de IFN-γ y las puntuaciones de síntomas de infección vírica y de asma alcanzaron un máximo mucho más tarde (días 3–5) y disminuyeron lentamente. En el grupo D, los cocientes IL-4 e IL-5:IFN-γ fueron significativamente más altos que en el grupo C.
ConclusionesLas exacerbaciones del asma inducidas por las infecciones pueden deberse a un deterioro de las respuestas inmunitarias antivíricas Th1. Parece identificarse un intervalo decisivo de 3–5 días para instaurar una intervención terapéutica.
Many asthma exacerbations are caused by respiratory viral infections that induce the interplay between Th1 and Th2 immune responses. However, the time trends for Th1 and Th2 immune responses during these phenomena have not been well studied.
ObjectiveTo identify possible mechanisms underlying the link between respiratory viral infections and asthma exacerbations.
Patients and methodsWe recruited 40 adults aged 21–58 years for 4 groups. A. Healthy, B. Healthy with viral infection, C. Mild to moderate asthma and D. Same as C, but with viral infection. Th1 and Th2 cytokines in induced sputum samples during the course of acute upper respiratory viral infections in otherwise healthy and asthmatic subjects were monitored. IL-4, IL-5 and IFN-γ were assayed by ELISA. Viral infection symptoms and asthma severity scores were monitored. Time trends were analyzed using linear mixed models.
ResultsIL-4 and IL-5 levels in groups C and D were higher than in groups A and B. IFN-γ levels and viral infection symptoms scores in group B spiked by day 2 and rapidly declined by day 7, while in group D, IFN-γ and symptoms scores for viral infection and asthma peaked much later (days 3–5) and slowly declined. The ratios of IL-4 and IL-5 to IFN-γ in group D were significantly higher than in group C.
ConclusionsInfection-induced asthma exacerbations may be due to impaired anti-viral Th1-immune responses. There appears to be a critical window of 3–5 days for therapeutic intervention.
El asma representa un grave problema de salud pública. En la Global Initiative for Asthma (GINA) se ha descrito que, en todo el mundo, afecta a 300 millones de individuos1. Agrava esta carga el hecho de que muchos pacientes asmáticos pueden experimentar exacerbaciones de los síntomas debido a causas externas a su enfermedad subyacente. En los estudios prospectivos se ha demostrado que hasta un 85% de estas exacerbaciones en niños y cerca de la mitad en adultos se deben a infecciones víricas2,3. De acuerdo con nuestras observaciones clínicas, con frecuencia las exacerbaciones del asma tienen lugar 3–5 días después de que un individuo contraiga una infección vírica de las vías respiratorias superiores4. En la actualidad, los estudios que tratan de determinar los posibles mecanismos de una relación causal entre las infecciones víricas y las exacerbaciones del asma se han centrado en la interacción entre las respuestas inmunitarias Th1 y Th2.
Estos 2 grupos de linfocitos T colaboradores se distinguen por las citocinas que liberan; las células Th1 producen predominantemente interferón gamma (IFN-γ), mientras que las células Th2 producen interleucina (IL) 4 e IL-5. En individuos sanos es muy importante la homeostasia entre Th1 y Th2. Un cambio en la población Th por Th1 tiene tendencia a disminuir la producción de células Th2, mientras que un aumento de las células Th2 suprime la producción de las Th1. Durante una infección vírica respiratoria (predominio del tipo Th1) las respuestas inmunitarias pueden modular la desviación del sistema inmunitario hacia una respuesta Th2, presente en el asma y, de hecho, al contrario, el estado inmunitario establecido en el asma puede alterar el curso de las respuestas antivíricas. Se consideraba que la inhibición de la producción de IL-4 e IL-5 debería ser eficaz para el tratamiento del asma. No obstante, aunque al utilizar esta estrategia se suprimió la eosinofilia, no se ha demostrado que sea útil desde un punto de vista clínico5–7. También se ha descrito la falta de eficacia de la administración de IL-12 o IFN-γ, que suprimen la actividad Th28.
Un problema con el hallazgo de modalidades óptimas de tratamiento es que no se han estudiado con detalle las tendencias temporales de las respuestas inmunitarias Th1 y Th2 durante las infecciones víricas agudas. Entre los diferentes métodos no cruentos para valorar la inflamación de las vías respiratorias, el examen del esputo inducido es una estrategia relativamente simple. La congelación de una muestra de esputo inducido inmediatamente después de su obtención para su procesamiento posterior a conveniencia de los técnicos de laboratorio evita los problemas causados por el contenido enzimático de este fluido corporal, que digeriría los componentes celulares y del fluido si la muestra permaneciera sin congelar. Diferentes equipos de investigación han verificado esta técnica en los últimos años9–12.
En el presente estudio, utilizamos este método para valorar los cambios dependientes del tiempo de IL-4 e IL-5 (citocinas Th2) e IFN-γ (citocina Th1) en muestras de esputo inducido de pacientes asmáticos e individuos de control, sanos, con o sin infecciones víricas respiratorias. Los objetivos del presente estudio fueron establecer los patrones de las respuestas inmunitarias respiratorias antivíricas en ausencia o presencia de respuestas inmunitarias asmáticas e identificar los posibles mecanismos que son la base de la relación entre las infecciones víricas respiratorias y las exacerbaciones del asma.
Individuos y métodosIndividuosEl comité de investigación del Huashan Hospital afiliado a la Fudan University aprobó el estudio y todos los individuos proporcionaron su consentimiento informado por escrito a la participación. Seleccionamos un total de 40 adultos, de 21–58 años de edad (22 hombres y 18 mujeres). Se distribuyeron en 4 grupos (10 por grupo) en función de su estado de salud respiratoria.
El grupo A incluyó a individuos sanos; el grupo B incluyó a individuos con una infección vírica de las vías respiratorias superiores, por lo demás sanos; el grupo C incluyó a individuos con asma leve o moderada, controlada; el grupo D incluyó a individuos con asma leve o moderada, controlada, e infección vírica de las vías respiratorias superiores.
Para todos los grupos, los criterios de exclusión incluyeron lo siguiente: antecedentes de cardiopatías graves, hipertensión arterial, bronquitis crónica, glaucoma, hipertrofia prostática, tiroidopatías, diabetes, anemia o insuficiencia hepática y renal. También se excluyó a las mujeres embarazadas o en período de lactancia. Otros criterios de inclusión/exclusión para cada uno de los 4 grupos fueron los siguientes: en los grupos A y B los individuos no tenían antecedentes de enfermedades alérgicas o inmunológicas, no habían recibido una vacuna vírica durante los 12 últimos meses y no habían participado en un ensayo clínico de un fármaco durante los 3 últimos meses; en el grupo B se incluyó a individuos con un diagnóstico de infección vírica aguda de las vías respiratorias superiores, en función de los signos, síntomas, pruebas de laboratorio sistemáticas y exámenes de detección vírica; en el grupo B se excluyó a los individuos con sospecha de infección bacteriana de acuerdo con los signos, síntomas y pruebas de laboratorio. Como ejemplo, los recuentos de leucocitos eran, como mínimo, de 10,0×109/l, o la proporción de neutrófilos era como mínimo del 80% (mayor que el valor de referencia) o la radiografía de tórax indicaba neumonía, incluida la vírica. Todos los individuos de los grupos A y B formaban parte del personal del Huashan Hospital afiliado a la Fudan University, en Shangai, China. Los grupos C y D eran pacientes ambulatorios asmáticos, seguidos en el Huashan Hospital afiliado a la Fudan University. En los pacientes se había establecido el diagnóstico de asma en función de los criterios desarrollados por la Chinese Society of Respiratory Diseases, clasificada como leve o moderada. Los pacientes recibían tratamiento con regularidad con una pauta establecida por la GINA; se los trataba con budesonida inhalada (Turbuhaler®) (100–400μg) como tratamiento de mantenimiento y se encontraban en remisión. Los pacientes del grupo C y D no habían recibido una vacuna vírica durante los 12 últimos meses y no habían participado en un ensayo clínico de un fármaco durante los 3 meses previos. En los pacientes del grupo B también se estableció el diagnóstico de infección vírica aguda de las vías respiratorias superiores de acuerdo con los signos, síntomas, pruebas de laboratorio sistemáticas y detección de virus. Los pacientes del grupo D se excluyeron si se sospechó una infección bacteriana de acuerdo con los signos, síntomas y pruebas de laboratorio. Los pacientes de este grupo también se excluyeron si los síntomas se deterioraron tras la infección de las vías respiratorias superiores y no pudo efectuarse la inducción del esputo.
Se indicó a los individuos que debían acudir al hospital al cabo de 24h, tan pronto como manifestaran signos de infección vírica de las vías respiratorias superiores. Todos estuvieron de acuerdo en que se les realizaran pruebas de laboratorio sistemáticas y una radiografía de tórax. Se siguió a todos los individuos durante 7 días; el esputo se indujo a diario y las puntuaciones de síntomas de infección vírica de las vías respiratorias superiores y de asma se registraron a diario.
Criterios diagnósticos de infección de las vías respiratorias superiores- 1.
Manifestaciones clínicas: los pacientes contrajeron un resfriado y presentaban fiebre, escalofríos, sudación, malestar, faringitis, rinitis, congestión nasal, estornudos, cefaleas, mal estado general y artralgia. La exploración física indicó eritema e inflamación faríngeos y la auscultación pulmonar no detectó estertores húmedos y secos.
- 2.
Pruebas de laboratorio: hemograma sistemático, recuento de leucocitos inferior o igual a 10,0×109/l o neutrófilos inferior o igual al 80% (o no superior al valor de referencia).
- 3.
Exploración por imágenes: la radiografía de tórax no indicó una condensación pulmonar o signos de infección. Se excluyeron las lesiones antiguas.
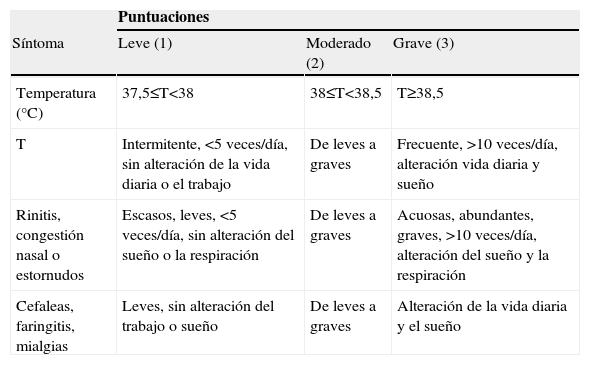
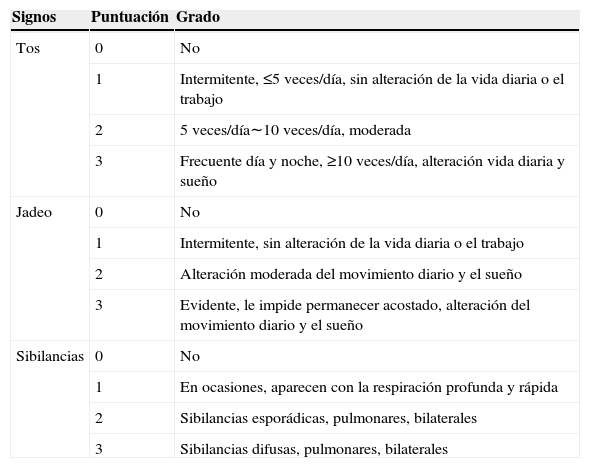
Los síntomas de infección vírica respiratoria se puntuaron del modo siguiente: 1, leves; 2, moderados, y 3, graves. En la tabla 1 se muestran los criterios usados para asignar estas puntuaciones. El diagnóstico, el grado y el tratamiento del asma siguieron los criterios GINA13. La tabla 2 muestra los criterios usados para asignar las puntuaciones de síntomas de asma.
Puntuación de síntomas de la infección vírica de las vías respiratorias superiores
| Puntuaciones | |||
| Síntoma | Leve (1) | Moderado (2) | Grave (3) |
| Temperatura (°C) | 37,5≤T<38 | 38≤T<38,5 | T≥38,5 |
| T | Intermitente, <5 veces/día, sin alteración de la vida diaria o el trabajo | De leves a graves | Frecuente, >10 veces/día, alteración vida diaria y sueño |
| Rinitis, congestión nasal o estornudos | Escasos, leves, <5 veces/día, sin alteración del sueño o la respiración | De leves a graves | Acuosas, abundantes, graves, >10 veces/día, alteración del sueño y la respiración |
| Cefaleas, faringitis, mialgias | Leves, sin alteración del trabajo o sueño | De leves a graves | Alteración de la vida diaria y el sueño |
Puntuaciones de síntomas de asma
| Signos | Puntuación | Grado |
| Tos | 0 | No |
| 1 | Intermitente, ≤5 veces/día, sin alteración de la vida diaria o el trabajo | |
| 2 | 5 veces/día∼10 veces/día, moderada | |
| 3 | Frecuente día y noche, ≥10 veces/día, alteración vida diaria y sueño | |
| Jadeo | 0 | No |
| 1 | Intermitente, sin alteración de la vida diaria o el trabajo | |
| 2 | Alteración moderada del movimiento diario y el sueño | |
| 3 | Evidente, le impide permanecer acostado, alteración del movimiento diario y el sueño | |
| Sibilancias | 0 | No |
| 1 | En ocasiones, aparecen con la respiración profunda y rápida | |
| 2 | Sibilancias esporádicas, pulmonares, bilaterales | |
| 3 | Sibilancias difusas, pulmonares, bilaterales |
El esputo se indujo entre las 8–10 de la mañana a diario durante 7 días, según lo descrito previamente14. En pocas palabras, después de una espirometría basal y un pretratamiento con salbutamol, los individuos inhalaron suero salino hipertónico al 3, al 4 y al 5% durante períodos de 7min. Después de cada período, trataron de expectorar esputo en contenedores de plástico.
Las muestras de esputo se vertieron en placas de Petri inmediatamente después de la inducción. Se seleccionaron los tapones de moco originados a partir de las vías respiratorias inferiores, se introdujeron en tubos de Eppendorf® y se añadieron 100ml de sulfóxido de dimetilo (Merck, Alemania). Los tubos se cerraron herméticamente, se agitaron durante 30s, se codificaron y se almacenaron en un congelador a −70°C.
Un asistente de laboratorio del turno de día procesó las muestras de esputo congelado mediante la utilización de un protocolo descrito previamente15, con ligeras modificaciones. Los tubos de Eppendorf se dejaron descongelar a temperatura ambiente y su contenido se pesó. Se añadió un volumen (μl) de solución de dithiothreitol (Sputolysin, Calbiochem Corp, La Jolla, California, EE. UU.) en una dilución de 1:10 con agua destilada igual a 4 veces el peso del esputo (en mg). Se homogeneizó agitando el mezclador y después se colocó el tubo en banco mecedor. Se añadió un volumen de solución salina de Dulbecco tamponada con fosfatos igual al de la solución de dithiothreitol empleada, y la suspensión se filtró a través de una gasa. La viabilidad celular se evaluó mediante exclusión en azul de tripano. La suspensión de células se centrifugó y el sobrenadante se congeló a 70°C para la detección posterior de IL-4, IL-5 e IFN-γ.
Determinaciones de laboratorioEn el primer día del inicio de los síntomas de infección vírica, para la detección de virus respiratorios se usó un equipo ELISA (Simcere, Nanjing, China) según las instrucciones del fabricante. El espectro vírico que pudo identificarse con este equipo fue de rinovirus, virus respiratorio sincitial, virus de la gripe, virus parainfluenza, adenovirus y coronavirus. Las concentraciones de IL-4, IL-5 e IFN-γ en el sobrenadante se determinaron mediante la utilización de equipos ELISA (Rapid BioLab, Calabasas, CA, EE. UU.). Los resultados se expresaron en pg/ml.
Análisis estadísticoDebido al reducido tamaño de la muestra se utilizó una prueba no paramétrica de Kruskal-Wallis para comparar los 4 grupos. Se determinaron las medias y las desviaciones estándares para la edad y los índices de los exámenes hematológicos. Las distribuciones por sexo (número, porcentaje) se compararon mediante la utilización de la prueba exacta de Fisher. Las citocinas se determinaron en repetidas ocasiones durante 7 días; se utilizó un modelo mixto lineal para probar las tendencias temporales y comparar los grupos. Para las citocinas y los cocientes IL-4/IFN-γ e IL-5/IFN-γ se calcularon las medias y las desviaciones estándares. Si una tendencia temporal o un efecto de grupo fue estadísticamente significativo (análisis posthoc), se utilizó una prueba de Tukey. Se estableció la significación estadística en un valor de p<0,05. Para los análisis se utilizó el programa estadístico SPSS (versión 15.0, SPSS Inc., Chicago, EE. UU.)
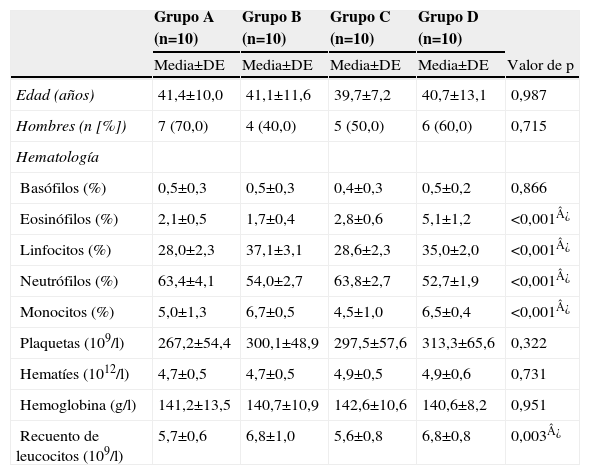
ResultadosCaracterísticas basales de los individuosSe seleccionó un total de 40 individuos, de 21–58 años de edad, incluidos 22 hombres (55%) y 18 mujeres (45%). Según lo descrito en Métodos, se distribuyeron en 4 grupos (A, B, C o D) en función del estado de salud respiratoria (10/grupo). En la tabla 3 se resumen sus características basales. Al comparar los 4 grupos no hubo diferencias significativas para la edad, el sexo, el porcentaje de basófilos, el recuento de plaquetas, el recuento de hematíes o los valores de hemoglobina.
Características basales
| Grupo A (n=10) | Grupo B (n=10) | Grupo C (n=10) | Grupo D (n=10) | ||
| Media±DE | Media±DE | Media±DE | Media±DE | Valor de p | |
| Edad (años) | 41,4±10,0 | 41,1±11,6 | 39,7±7,2 | 40,7±13,1 | 0,987 |
| Hombres (n [%]) | 7 (70,0) | 4 (40,0) | 5 (50,0) | 6 (60,0) | 0,715 |
| Hematología | |||||
| Basófilos (%) | 0,5±0,3 | 0,5±0,3 | 0,4±0,3 | 0,5±0,2 | 0,866 |
| Eosinófilos (%) | 2,1±0,5 | 1,7±0,4 | 2,8±0,6 | 5,1±1,2 | <0,001¿ |
| Linfocitos (%) | 28,0±2,3 | 37,1±3,1 | 28,6±2,3 | 35,0±2,0 | <0,001¿ |
| Neutrófilos (%) | 63,4±4,1 | 54,0±2,7 | 63,8±2,7 | 52,7±1,9 | <0,001¿ |
| Monocitos (%) | 5,0±1,3 | 6,7±0,5 | 4,5±1,0 | 6,5±0,4 | <0,001¿ |
| Plaquetas (109/l) | 267,2±54,4 | 300,1±48,9 | 297,5±57,6 | 313,3±65,6 | 0,322 |
| Hematíes (1012/l) | 4,7±0,5 | 4,7±0,5 | 4,9±0,5 | 4,9±0,6 | 0,731 |
| Hemoglobina (g/l) | 141,2±13,5 | 140,7±10,9 | 142,6±10,6 | 140,6±8,2 | 0,951 |
| Recuento de leucocitos (109/l) | 5,7±0,6 | 6,8±1,0 | 5,6±0,8 | 6,8±0,8 | 0,003¿ |
Grupo A, de control, sano; grupo B, infección de las vías respiratorias superiores; grupo C, asma; grupo D, asma+infección de las vías respiratorias superiores.
DE: desviación estándar; IFN: interferón; IL: interleucina.
No obstante, se identificaron diferencias significativas en los 4 grupos para el recuento de leucocitos y la fórmula leucocitaria. En pacientes con infecciones de las vías respiratorias superiores (grupos B y D) se detectaron mayores recuentos de leucocitos, un aumento del porcentaje de eosinófilos, linfocitos y monocitos y menores porcentajes de neutrófilos que en los individuos sanos (grupo A) o los pacientes con asma sola (grupo C).
Detección de virus en las muestras de esputo inducidoPara la detección de virus en las muestras de esputo inducido se utilizó un equipo ELISA. Como se esperaba, en las muestras de los grupos A y C no se detectaron virus. En el grupo B, en 5 individuos se identificó una infección por rinovirus, en 3 se identificó una infección por virus de la gripe y en 2 se identificó una infección por virus respiratorio sincitial. En el grupo D, en 6 individuos se identificó infección por rinovirus, en 3 se identificó infección por virus de la gripe y en uno se identificó infección por virus sincitial.
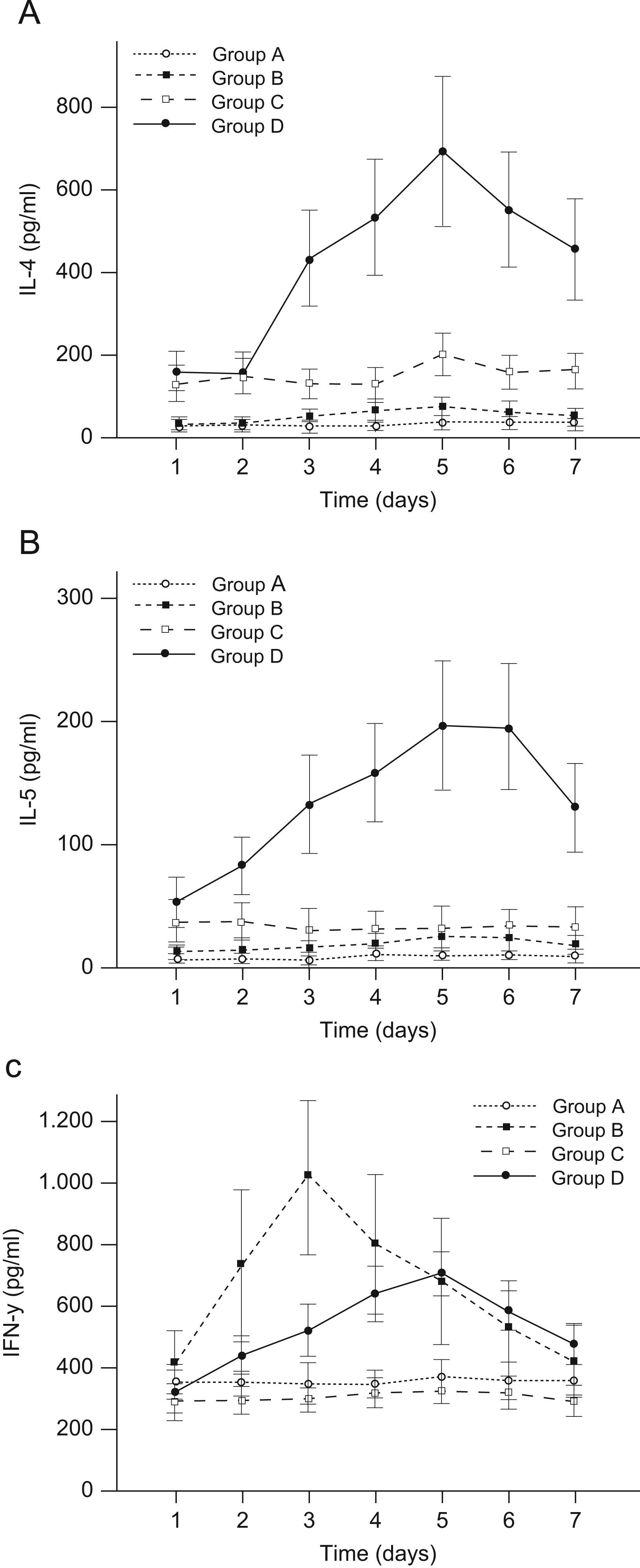
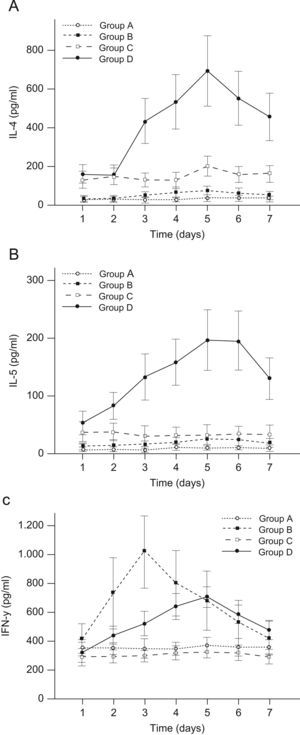
Tendencias temporales de las citocinas Th1 y Th2 en el esputo inducidoEn la figura 1 se muestran las variaciones con el tiempo de las concentraciones de IL-4, IL-5 e IFN-γ en las muestras de esputo inducido. Para los valores de IL-4 (fig. 1A), en comparación con los individuos sanos (grupo A), en pacientes con asma sola (grupo C) o tanto con asma como con infección de las vías respiratorias superiores (grupo D) se identificaron valores más altos durante todo el período de observación. En pacientes con infección exclusiva de las vías respiratorias superiores (grupo B) los valores fueron similares a los de los individuos sanos (grupo A). Por lo que respecta a las tendencias temporales, en los grupos B y D los valores de IL-4 aumentaron en el día 2, y, acto seguido, disminuyeron después del día 5 (ambas p para la tendencia temporal inferiores a 0,001). Para el grupo C, los valores de IL-4 permanecieron estables antes del día 4, aumentaron significativamente el día 5, y, acto seguido, disminuyeron ligeramente hasta el día 7 (p=0,004). En el grupo A no se detectaron cambios significativos (p=0,759).
Tendencias temporales de las citocinas en muestras de esputo inducido durante el período de observación de 7 días. A) Interleucina (IL) 4. B) IL-5. C) Interferón gamma. Grupo A, individuos sanos; grupo B, con infección vírica respiratoria pero, por lo demás, sanos; grupo C, con asma leve o moderada; grupo D, igual que C pero con infección vírica respiratoria (n=10 por grupo). Los resultados son medias±desviaciones estándares. Para analizar las tendencias temporales se usó un modelo mixto lineal. Cuando se encontró una tendencia temporal significativa, para los análisis posthoc se utilizó una prueba de Tukey. Leyendas: 1A) 1, IL-4 (pg/ml); 2, tiempo (días); 3, grupo A; 4, grupo B, 5, grupo C, y 6, grupo D; 1B) 1, IL-5 (pg/ml); 2, tiempo (días); 3, grupo A; 4, grupo B; 5, grupo C, y 6, grupo D; 1C) 1, interferón gamma (pg/ml); 2, tiempo (días); 3, grupo A; 4, grupo B; 5 grupo C, y 6, grupo D.
Para los valores de IL-5 (fig. 1B), tanto en el grupo C como en el grupo D, se identificaron valores mayores que en el grupo A antes del día 3, aunque la diferencia entre el grupo A y el C desapareció después del día 4. Los de los grupos A y C no cambiaron significativamente con el tiempo (ambas p>0,05). En comparación, para los grupos B y D, los valores aumentaron significativamente al cabo de 5 días, no se modificaron hasta el día 6 y, acto seguido, disminuyeron en el día 7 (p=0,06 para el grupo B y p<0,001 para el grupo D).
Para los valores de IFN-γ (fig. 1C), en el grupo C se demostraron valores más bajos que en el grupo A en los días 1 y 2, pero fueron similares después del día 3. Inicialmente, en el grupo D se identificaron valores más bajos que en el grupo A en el día 1; no obstante, en aquel grupo los valores fueron más altos que en el grupo A después del día 2, aunque las diferencias en los días 2 y 7 no fueron estadísticamente significativas. En los grupos A y C, una vez más, los valores no variaron significativamente durante el período de observación (ambas p>0,05).
Es interesante destacar que los valores de IFN-γ del grupo B alcanzaron un máximo el día 3 y, acto seguido, disminuyeron rápidamente; en el día 7 los valores fueron similares a los del día 1. En comparación, en el grupo D los valores máximos de IFN-γ se observaron en el día 5 y, acto seguido, disminuyeron en el día 7, cuando la concentración fue de 477,0pg/ml, similar a los valores del día 3.
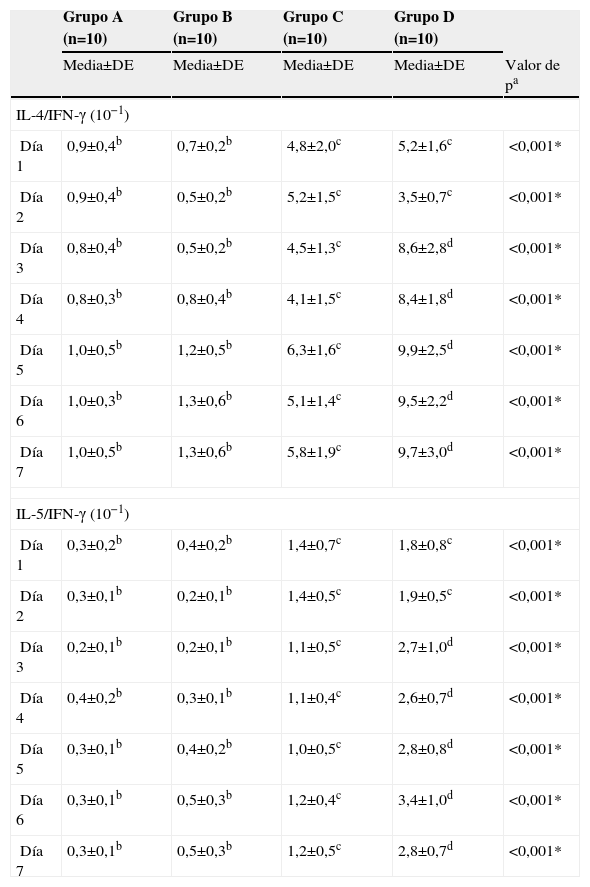
También calculamos los cocientes que reflejan la proporción de citocinas Th2/Th1:IL-4/IFN-γ e IL-5/IFN-γ. En la tabla 4 se muestran los resultados diarios de estos cocientes. Para el grupo A, claro está, fueron significativamente más bajos que para el grupo C y D (todas las p<0,05). Por lo que respecta a las tendencias temporales, se identificaron variaciones significativas de los cocientes en los grupos B y D (p<0,001 para ambos grupos), aunque las tendencias temporales para IL-4/IFN-γ e IL-5/IFN-γ fueron algo diferentes.
Variaciones de los cocientes entre interleucina 4 e interferón-γ y entre interleucina 5 e interferón-γ durante una semana
| Grupo A (n=10) | Grupo B (n=10) | Grupo C (n=10) | Grupo D (n=10) | ||
| Media±DE | Media±DE | Media±DE | Media±DE | Valor de pa | |
| IL-4/IFN-γ (10−1) | |||||
| Día 1 | 0,9±0,4b | 0,7±0,2b | 4,8±2,0c | 5,2±1,6c | <0,001* |
| Día 2 | 0,9±0,4b | 0,5±0,2b | 5,2±1,5c | 3,5±0,7c | <0,001* |
| Día 3 | 0,8±0,4b | 0,5±0,2b | 4,5±1,3c | 8,6±2,8d | <0,001* |
| Día 4 | 0,8±0,3b | 0,8±0,4b | 4,1±1,5c | 8,4±1,8d | <0,001* |
| Día 5 | 1,0±0,5b | 1,2±0,5b | 6,3±1,6c | 9,9±2,5d | <0,001* |
| Día 6 | 1,0±0,3b | 1,3±0,6b | 5,1±1,4c | 9,5±2,2d | <0,001* |
| Día 7 | 1,0±0,5b | 1,3±0,6b | 5,8±1,9c | 9,7±3,0d | <0,001* |
| IL-5/IFN-γ (10−1) | |||||
| Día 1 | 0,3±0,2b | 0,4±0,2b | 1,4±0,7c | 1,8±0,8c | <0,001* |
| Día 2 | 0,3±0,1b | 0,2±0,1b | 1,4±0,5c | 1,9±0,5c | <0,001* |
| Día 3 | 0,2±0,1b | 0,2±0,1b | 1,1±0,5c | 2,7±1,0d | <0,001* |
| Día 4 | 0,4±0,2b | 0,3±0,1b | 1,1±0,4c | 2,6±0,7d | <0,001* |
| Día 5 | 0,3±0,1b | 0,4±0,2b | 1,0±0,5c | 2,8±0,8d | <0,001* |
| Día 6 | 0,3±0,1b | 0,5±0,3b | 1,2±0,4c | 3,4±1,0d | <0,001* |
| Día 7 | 0,3±0,1b | 0,5±0,3b | 1,2±0,5c | 2,8±0,7d | <0,001* |
Grupo A, de control, sano; grupo B, infección de las vías respiratorias superiores; grupo C, con asma; grupo D, asma+infección de las vías respiratorias superiores.
DE: desviación estándar; IL: interleucina; IFN: interferón.
*Indica diferencia significativa, p<0,05.
aSe usó un modelo mixto lineal.
b,c,dLas letras diferentes indican diferencias significativas entre ambos grupos, p<0,017.
En el grupo B el cociente IL-4/IFN-γ en el día 4 o más tarde fue significativamente mayor que los valores detectados el día 3 o previamente (p<0,001); el cociente IL-5/IFN-γ disminuyó ligeramente desde el día 1 al 3; acto seguido, aumentó significativamente desde el día 4 al 6, mientras que en los días 6 y 7 fue similar al del día 1 (p=0,001). En el grupo D, el cociente IL-4/IFN-γ aumentó significativamente después del día 3 (p<0,001); en los días 5 y 6 el cociente IL-5/IFN-γ fue significativamente más alto que en el día 1, pero en el día 7 no fue significativamente diferente del valor del día 1 (p=0,124).
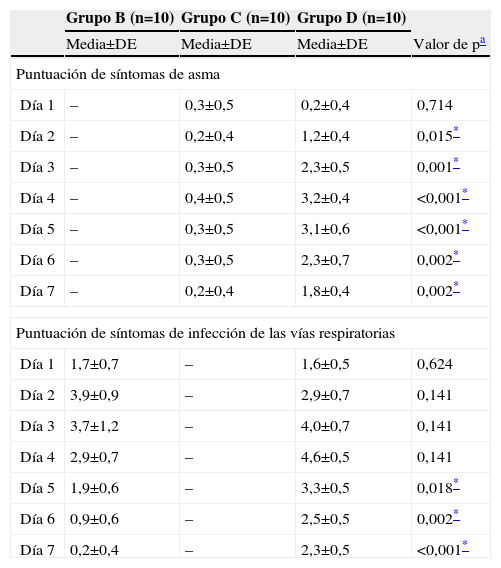
Tendencias temporales de las puntuaciones de los síntomas de infección vírica respiratoria y de asmaLas puntuaciones de síntomas de infección vírica respiratoria (tabla 1) y de síntomas de asma (tabla 2) se registraron a diario para los 30 individuos de los grupos B, C y D, según fue apropiado. La tabla 5 muestra los resultados diarios de estas puntuaciones. Para las puntuaciones de asma, en el día 1, en el grupo D se observaron puntuaciones similares a las del grupo C. Sin embargo, las puntuaciones de asma aumentaron en el grupo D después del día 2, y alcanzaron un máximo en el día 4 (p<0,001). En el grupo D, comparado con el grupo C, se detectaron puntuaciones más altas de síntomas de asma para los días 2–7 (todas las p<0,05). Para el grupo D, las puntuaciones de síntomas de asma en los días 3, 6 y 7 fueron similares.
Variaciones de las puntuaciones de síntomas de asma e infección de las vías respiratorias superiores durante una semana1
| Grupo B (n=10) | Grupo C (n=10) | Grupo D (n=10) | ||
| Media±DE | Media±DE | Media±DE | Valor de pa | |
| Puntuación de síntomas de asma | ||||
| Día 1 | – | 0,3±0,5 | 0,2±0,4 | 0,714 |
| Día 2 | – | 0,2±0,4 | 1,2±0,4 | 0,015* |
| Día 3 | – | 0,3±0,5 | 2,3±0,5 | 0,001* |
| Día 4 | – | 0,4±0,5 | 3,2±0,4 | <0,001* |
| Día 5 | – | 0,3±0,5 | 3,1±0,6 | <0,001* |
| Día 6 | – | 0,3±0,5 | 2,3±0,7 | 0,002* |
| Día 7 | – | 0,2±0,4 | 1,8±0,4 | 0,002* |
| Puntuación de síntomas de infección de las vías respiratorias | ||||
| Día 1 | 1,7±0,7 | – | 1,6±0,5 | 0,624 |
| Día 2 | 3,9±0,9 | – | 2,9±0,7 | 0,141 |
| Día 3 | 3,7±1,2 | – | 4,0±0,7 | 0,141 |
| Día 4 | 2,9±0,7 | – | 4,6±0,5 | 0,141 |
| Día 5 | 1,9±0,6 | – | 3,3±0,5 | 0,018* |
| Día 6 | 0,9±0,6 | – | 2,5±0,5 | 0,002* |
| Día 7 | 0,2±0,4 | – | 2,3±0,5 | <0,001* |
Grupo A, de control, sano; grupo B, infección de las vías respiratorias superiores; grupo C, asma; grupo D, asma+infección de las vías respiratorias superiores.El guión indica que no se determinó.
DE: desviación estándar.
Para las puntuaciones de síntomas de las vías respiratorias superiores, en los grupos B y D se identificaron puntuaciones similares antes del día 4; después de este día, las puntuaciones del grupo B fueron significativamente más bajas que las del grupo D. Las puntuaciones máximas del grupo B se registraron el día 2 y, acto seguido, disminuyeron rápidamente hasta el día 7 (p<0,001). Las puntuaciones para el grupo D aumentaron rápidamente desde el día 1 al 4 y, a continuación, disminuyeron hasta el día 7 (p<0,001); las puntuaciones registradas en los días 6 y 7 fueron similares a las del día 2.
DiscusiónEn el presente estudio, para entender mejor las complejas interacciones entre infección vírica y asma, supervisamos continuamente las concentraciones de citocinas (IFN-γ, IL-4 e IL-5) en muestras de esputo inducido de pacientes asmáticos e individuos de control, sanos, con o sin infecciones víricas respiratorias, y registramos las puntuaciones de síntomas de asma o de infección vírica de las vías respiratorias superiores durante 7 días. Encontramos que los individuos sanos presentaron valores bajos de IL-4, IL-5 e IFN-γ en el esputo inducido, con apenas fluctuaciones durante los 7 días, y que el nivel de IFN-γ en el esputo aumentó rápidamente (en el día 2) hasta valores altos cuando contrajeron la infección vírica de las vías respiratorias superiores. También encontramos que los síntomas de infección vírica se iniciaron precozmente y remitieron rápidamente. Esto demuestra que los individuos sanos tienen una inmunidad antivírica efectiva. En el esputo inducido, el nivel de IFN-γ se correlacionó negativamente con los síntomas, lo que se ha observado en estudios previos16,17.
Encontramos que los individuos con asma, incluso en un estado de remisión, presentaron mayores valores de IL-4 e IL-5 y valores menores de IFN-γ que los individuos sanos, y cocientes más altos de IL-4/IFN-γ e IL-5/IFN-γ (p<0,01). Estos resultados confirman que los individuos asmáticos tienen antecedentes de desviación del sistema inmunitario hacia una respuesta Th2, lo que coincide con los datos de los estudios de investigación en animales y clínicos18–21. Además, durante las exacerbaciones agudas del asma, es evidente una desviación Th2 predominante22. Pruebas recientes indican que esta desviación anormal hacia la actividad Th2 en pacientes asmáticos podría guardar relación con una disminución de la función de otra clase de células Th: las células T reguladoras. Estas células parecen reducir la actividad Th2 en individuos sanos23. La población de linfocitos T agresores naturales también podría desempeñar un papel en la patogenia del asma24.
Los valores de IFN-γ en el esputo inducido de pacientes asmáticos, incluso en un estado de remisión, aumentaron hasta un menor grado y con mucha más lentitud que los de individuos no asmáticos. También obtuvieron puntuaciones más altas de síntomas de infección vírica que los individuos sanos. Se ha argumentado que los pacientes asmáticos no son más vulnerables a las infecciones víricas respiratorias que los no asmáticos, aunque experimentan consecuencias más graves25. Esto indica la posibilidad de que puedan presentar un deterioro de las respuestas antivíricas y, como consecuencia, desarrollen infecciones más prolongadas que den lugar a una obstrucción grave de las vías respiratorias y a sibilancias. Es interesante destacar que la producción de IFN-β, IFN-γ e IFN-λ como respuesta a los virus respiratorios también podría estar deteriorada26–28.
Se dispone de pruebas de que la producción insuficiente de IFN-β en las vías respiratorias de los asmáticos provoca una infección de las células epiteliales por virus. Una vez infectadas, estas células pueden manifestar una respuesta apoptótica ineficiente. En consecuencia, los virus pueden duplicarse rápidamente en estas células e introducirse en las vías respiratorias, de modo que la carga vírica es mucho más alta que la de los pacientes sanos28,29. Además, la secreción de IFN-γ inducida por virus se relaciona positivamente con la función pulmonar en individuos con asma30. En conjunto, estos hallazgos indican que el deterioro de la respuesta de IFN podría favorecer unas manifestaciones clínicas de mayor gravedad de las infecciones respiratorias víricas en pacientes con asma. También encontramos que las puntuaciones de síntomas de asma de estos pacientes fueron mucho más altas que las de pacientes asmáticos sin infección vírica de las vías respiratorias superiores. Estos hallazgos coinciden con un fenotipo «propenso a las exacerbaciones»31,32.
Al mismo tiempo, no encontramos diferencias significativas en los cocientes de IL-4/IFN-γ e IL-5/IFN-γ entre individuos sanos con o sin infección vírica de las vías respiratorias superiores, lo que indica que no hubo un cambio significativo de la homeostasia Th1/Th2. No obstante, detectamos diferencias significativas en estos cocientes entre individuos asmáticos con y sin infección vírica de las vías respiratorias superiores. Esto indica que probablemente hay otros mecanismos que regulan esta homeostasia. Recientemente, en los estudios clínicos se ha prestado atención a los linfocitos T reguladores y se ha encontrado que regulan la homeostasia Th1/Th2 a través de numerosos mecanismos33.
A partir del presente estudio, determinamos que el curso temporal de los cambios de IL-4 e IL-5 en el esputo inducido de pacientes con asma e infecciones víricas respiratorias coincidió con las fluctuaciones de los síntomas de asma, ya que fueron más graves 3–5 días después de contraer la infección. Por lo tanto, concluimos que 3–5 días tras contraer una infección vírica de las vías respiratorias superiores es el intervalo de tiempo en el que empiezan a empeorar los síntomas de la infección en pacientes con asma. Es probable que sea aconsejable administrar el tratamiento lo antes posible durante este intervalo.
El equilibrio de las respuestas inmunitarias Th1/Th2 se inclina hacia las células Th2 en pacientes con asma leve o moderada, incluso en un estadio de remisión. La inmunidad antivírica de las vías respiratorias es menos robusta en estos pacientes y es más débil comparada con individuos sanos. En pacientes asmáticos, la respuesta de las células Th1 inducida por una infección vírica de las vías respiratorias superiores agrava el desequilibrio Th1/Th2. Esto indica la existencia de otro mecanismo mediante el que se controla este equilibrio. Determinamos que el intervalo de tiempo en el que empiezan a agravarse los síntomas de infección en pacientes con asma es de 3–5 días después de contraerla.