El tabaquismo constituye un grave problema de salud pública en todo el mundo. Los modelos animales actúan como un paso intermedio entre los estudios de laboratorio y los estudios en seres humanos. Los modelos aplicados son difíciles de reproducir debido al uso de diferentes tipos de cámaras inhaladoras y principalmente por la falta de una monitorización constante de la concentración del humo del tabaco.
ObjetivoDesarrollar una cámara inhaladora para ratas (con la exposición exclusiva del hocico) en la que pueda mantenerse y monitorizarse constantemente la cantidad de monóxido de carbono (CO).
Material y métodosSe expusieron ratas Wistar macho, de 250g de peso, a 50 partes por millón de CO producido por el humo del tabaco de un cigarrillo sin filtro. Los animales se sometieron a una exposición de 2h y, acto seguido, fueron sacrificados a las 0, a las 4, a las 24 y a las 48h. El grupo de control se dejó libre dentro de pequeñas cámaras perpendiculares y solo recibió 5l/min de aire comprimido.
ResultadosEl modelo fue capaz de aumentar la concentración de carboxihemoglobina inmediatamente después del término de la exposición (p<0,001), observándose una disminución desde las 2h en adelante comparado con la concentración del grupo de control. La concentración plasmática de cotinina aumentó inmediatamente después de la exposición y todavía se detectó a las 2 y a las 4h (p<0,05).
ConclusiónConcluimos que este sistema de cámara inhaladora puede mantener una concentración controlada de CO en un modelo en el que se expone a pequeños animales a la inhalación de humo de cigarrillos, lo que permite estudios adecuadamente controlados, al igual que investigaciones sobre otros gases tóxicos y contaminantes ambientales.
Smoking is a serious worldwide public health problem. Animal models act as a bridge between laboratory and human studies. The models applied are difficult to reproduce because of the use of different types of inhalation chambers and mainly because of the lack of continuous monitoring of smoke concentration.
ObjectiveTo develop an inhalation chamber for rats (with only the nose exposed) in which the amount of carbon monoxide (CO) can be maintained and monitored constantly.
Material and methodsMale Wistar rats weighing 250g were exposed to 50ppm CO produced by the smoke from a filter-free cigarette. The animals were submitted to a single 2-h exposure and then sacrificed at 0, 4, 24 and 48h. The control group was left restrained inside the small perpendicular chambers, receiving only 5L/min of compressed air.
ResultsThe model was able to increase HbCO levels immediately after the end of exposure (p<0.001), with a decrease being observed from 2h onwards when compared to the levels of the control group. Plasma cotinine increased immediately after exposure, and showed still detectable levels at 2 and 4h (p<0.05).
ConclusionWe conclude that the presented inhalation chamber system is able to maintain a controlled CO concentration in a model in which small animals are exposed to the inhalation of cigarette smoke, permitting well-controlled studies, as well as investigations involving other toxic gases and air pollutants.
El tabaquismo constituye un problema grave de salud pública en todo el mundo. En Brasil se estima que es la causa principal de mortalidad de unos 200.000 individuos al año. La enfermedad pulmonar obstructiva crónica es un proceso sistémico cuya fisiopatología no es bien conocida, siendo su principal desencadenante el tabaquismo1,2.
Los modelos animales actúan como un paso intermedio entre los estudios de laboratorio y los efectuados en seres humanos3. Los estudios publicados sobre los modelos animales de inflamación y enfisema pulmonar debidos a intoxicación por el humo de los cigarrillos siguen siendo limitados4. Los modelos aplicados son difíciles de reproducir porque se usan diferentes tipos de cámaras inhaladoras y principalmente debido a la falta de una monitorización constante de la concentración del humo de los cigarrillos. En el presente estudio desarrollamos una cámara inhaladora para ratas (con la exposición exclusiva del hocico), en la que pudo mantenerse y monitorizarse constantemente la cantidad de monóxido de carbono (CO).
Para validar la cámara se analizaron dos parámetros, la carboxihemoglobina (HbCO) y la cotinina. El CO se une en su mayor parte a la hemoglobina, produciendo HbCO, cuya afinidad por la hemoglobina es 220 veces mayor que la del oxígeno. La nicotina presente en el humo de los cigarrillos es metabolizada en el hígado, produciendo cotinina, que es detectable en el plasma utilizando diferentes técnicas5. La enzima responsable de su metabolismo es la isoenzima 2A6 del sistema del citocromo P4506.
El objetivo de la presente investigación fue desarrollar una cámara inhaladora para el estudio de las enfermedades relacionadas con el tabaquismo y la contaminación ambiental, en la que pudo mantenerse constante la concentración del humo de los cigarrillos según lo monitorizado en función de la concentración de CO y en la que las ratas pudieron exponerse de manera uniforme a cantidades conocidas y controladas de CO.
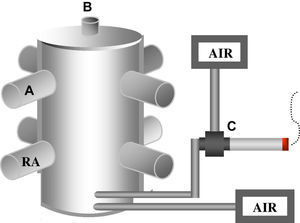
Material y métodosEl estudio fue aprobado por el comité de investigación de la Universidad de São Paulo. Cámara inhaladora: se diseñó una cámara de material acrílico, cilíndrica, de 30cm de diámetro y 50cm de altura (fig. 1), cuya capacidad total era de 35,3l, para la exposición de los roedores a los gases tóxicos. Se insertaron ocho cámaras perpendiculares pequeñas en el cuerpo de la cámara que contenía las ratas (6×25cm), conteniendo cada cámara un émbolo interno para confinar a los animales. Se introdujo un orificio de 1cm de diámetro entre el cuerpo de la cámara y cada cámara individual, de modo que solo se expuso el hocico del animal a la cámara principal. Dicho sistema estaba equipado con una válvula Venturi tridireccional (Intermed, Brasil). En la porción aferente de la válvula (parte generadora de flujo) se conectó aire comprimido con un caudalímetro de alta sensibilidad de hasta 1l/min, con una tasa de flujo que varió desde 50–100ml/min; en la porción lateral se introdujo un cigarrillo encendido sin filtro (aspiración de aire) y con la parte eferente se conectó una extensión que alcanzaba el orificio de la parte lateral e inferior de la cámara principal (porción propulsiva). Este sistema permite la aspiración del humo de los cigarrillos y su conducción hasta la cámara principal. Se inyectó una cantidad adicional de aire comprimido en la cámara a través de otro caudalímetro de baja sensibilidad de hasta 15l/min, con una tasa de flujo de 5l/min, para mantener la concentración deseada de CO. Dentro de la cámara se introdujo un mezclador de aire para la homogeneización del aire comprimido y el humo del cigarrillo con el objetivo de mantener una concentración homogénea del humo dentro de la cámara. La concentración de CO, documentada como partes por millón (ppm), se monitorizó con un cooxímetro (Toxi-Biosystems™, Estados Unidos) que se introdujo en la cámara principal. El humo se produjo constantemente y se expelió a través del borde superior de la cámara principal en el medio.
«Exposición de los animales al humo de los cigarrillos». Se expuso a ratas Wistar macho, cuyo peso era de 250g, al humo del cigarrillo o al aire comprimido. En el grupo expuesto al humo del cigarrillo la concentración objetivo de CO era de 50ppm. Para estandarizar la exposición de los animales, todas se efectuaron con la misma marca de cigarrillo. Cada cigarrillo usado contiene 0,8mg de nicotina, 10mg de alquitrán y 10mg de CO. Los animales se sometieron a una exposición de 2h y, acto seguido, fueron sacrificados a las 0, a las 4, a las 24 y a las 48h. El grupo de control se dejó libre en el interior de pequeñas cámaras perpendiculares y solo recibió 5l/min de aire comprimido.
«Sacrificio de los animales y obtención de las muestras sanguíneas». Después de completar la exposición en los tiempos predeterminados se sacrificó a los animales mediante técnicas estándar de acuerdo con la Guide for the Care and Use of Laboratory Animals (National Academy Press, 1996, Washington, D.C.). Las ratas fueron anestesiadas con pentobarbital (30mg/kg) por vía intraperitoneal de modo que se indujo una anestesia profunda sin depresión respiratoria. Los animales se colocaron en decúbito dorsal horizontal con las patas extendidas mediante fijación con hilo hasta su sacrificio por hemorragia mediante punción de la aorta abdominal para la obtención de sangre a través de una laparotomía. Las muestras de sangre se almacenaron en dos tipos de tubos, uno con anticoagulante y el otro sin anticoagulante. Las muestras usadas para la determinación de cotinina se almacenaron congeladas a −70°C.
«Determinación de HbCO». La concentración de HbCO se determinó por espectrometría diferencial en la región variable según lo descrito por Beutler y por West7. Las muestras sanguíneas heparinizadas se almacenaron en un frigorífico hasta el análisis.
«Determinación de la cotinina». La cotinina plasmática se determinó por duplicado mediante radioinmunoanálisis usando un anticuerpo de acuerdo con el método de Langone8. La reactividad cruzada del anticuerpo anticotinina con otros metabolitos de la nicotina fue inferior al 5%. La variación detectable en la curva de nicotina fue de 0,2–20ng/ml con un coeficiente de variación del 6–10%. Las muestras sanguíneas se mantuvieron a –70°C hasta el análisis.
«Análisis estadístico». Los resultados se documentan como media±error estándar de la media. Las diferencias estadísticamente significativas se determinaron mediante el análisis de la varianza (ANCOVA) y se efectuó un análisis posthoc utilizando la prueba de Dunnet de comparaciones múltiples frente al grupo de control. Se consideró significativo un valor de p<0,05.
ResultadosLos animales permanecieron alojados y relajados en las cámaras individuales durante todo el experimento, no mostrando signos de estrés.
El presente modelo de exposición se probó en 20 ratas y los resultados se compararon con cuatro ratas de control. El modelo aumentó la concentración de HbCO inmediatamente después del término de la exposición (p<0,001), observándose una disminución desde las 2h en adelante, en comparación con la concentración en el grupo de control. La cotinina plasmática aumentó inmediatamente después de la exposición, demostrándose concentraciones detectables a las 2 y a las 4h (p<0,05) y disminuyendo a partir de ese momento (tabla 1). Durante el tiempo de exposición se usaron 4–6 cigarrillos para mantener estable la concentración de CO.
Determinaciones de la concentración plasmática de carboxihemoglobina y de cotinina en diferentes momentos en las ratas expuestas al humo de cigarrillos durante 2h (n=4 en cada grupo)
| HbCO (%) | Cotinina (ng/ml) | |
| Control | 0±0 | 0±0 |
| 0h | 3±0¿ | 17±1,9¿¿ |
| 2h | 0±0 | 12±4,5¿¿ |
| 4h | 0,25±0,25 | 12,7±2,7¿¿ |
| 24h | 0±0 | 0,25±0,25 |
| 48h | 0,25±0,25 | 0,75±0,47 |
HbCO: carboxihemoglobina.
Los valores se expresan como media±error estándar.
En los estudios publicados se han descrito diferentes sistemas de cámaras inhaladoras como modelos de exposición al humo de los cigarrillos, como cámaras cilíndricas9 o cuadradas10, pero no todos los estudios describen la forma de la cámara utilizada. Algunos investigadores hacen referencia a la exposición como un método de exposición exclusiva del hocico, pero no describen detalles adicionales11,12.
La cámara que describimos tiene una forma cilíndrica de modo que los animales pudieron exponerse al humo de la forma más homogénea posible, con cámaras transparentes individuales para las ratas de modo que pudieron visualizarse durante toda la exposición. Los diferentes estudios han descrito cámaras de forma rectangular, alojando a los animales en el interior de la cámara como grupo durante la exposición. Normalmente, estos animales tienen tendencia a formar grupos y pueden permanecer unos sobre los otros, por lo que no reciben la misma cantidad de humo. Además, otro problema de este tipo de exposición es el depósito de productos derivados del tabaco en la piel del animal. Cuando se lamen los animales ingieren los componentes de los cigarrillos y modifican la exposición. En un estudio previo nuestro grupo de investigación utilizó un modelo en el que todas las ratas permanecieron en la misma cámara y se observaron muchos inconvenientes de dicho modelo10. En la presente investigación los animales se alojaron fuera del cuerpo de la cámara principal en una acomodación individual, de tal modo que solo el hocico se expuso al humo del cigarrillo. Dentro de la cámara se adaptó un ventilador para permitir que la mezcla humo-aire fuera lo más homogénea posible.
Con respecto a la generación del humo, los diversos estudios publicados usaron un número fijo de cigarrillos por exposición10,11,13,14, otros determinaron el volumen (ml) del flujo del humo expelido en la cámara y su duración en segundos9,11,13,15–17 o la cantidad (mg) y diámetro (μm) de las partículas generadas11,12,15,16 y, por último, algunos investigadores determinaron la cantidad de CO liberado en determinados tiempos, pero no de modo continuo12,16.
Consideramos que un modelo que genere una concentración constante de CO es el método más eficiente para exponer a los animales al humo de los cigarrillos, puesto que permite el mantenimiento de la misma concentración durante toda la exposición. Durante el período de exposición usamos 8–12 cigarrillos para mantener una concentración de CO de 50ppm. Esta variación se debió a la introducción del humo del cigarrillo en la cámara. Por lo tanto, para estandarizar la exposición al humo monitorizamos la concentración de CO durante toda la exposición. En un estudio preliminar observamos que, durante su combustión, un cigarrillo produce diferentes concentraciones de CO: es más baja al principio de la combustión del cigarrillo y aumenta bruscamente hacia el final (datos no mostrados). Para mantener la misma concentración de CO durante todo el experimento examinamos diversos tipos de bombas, aunque sin resultado práctico. Por último, se desarrolló una válvula de Venturi que, conectada con un tanque de aire sintético y controlada por un caudalímetro de alta sensibilidad, pudo mantener un flujo constante del humo del cigarrillo. Se consiguió el mantenimiento de una aeración adecuada y de la concentración de CO dentro de la cámara principal con un flujo variable de aire sintético a través de un caudalímetro de 15l/min. Para homogeneizar el humo se usó un ventilador dentro de la cámara. Dentro de la cámara se introdujo un cooxímetro, lo que permitió la determinación constante de CO.
En general, la cámara no conserva el olor del humo pero, en el caso de esta eventualidad, el material acrílico que la compone puede limpiarse con facilidad con detergente y agua. No obstante, los técnicos han de tener en cuenta que el uso de productos que contienen éter, acetona o sustancias abrasivas puede afectar a este material acrílico.
El aumento de la concentración de HbCO observada en los animales sacrificados 2h después de la exposición y su disminución ulterior nos permite concluir que las ratas inhalaron el humo del cigarrillo. El objetivo del experimento fue producir un modelo que mimetizara la concentración de HbCO durante la vida diaria de un fumador sin alcanzar valores tóxicos. La concentración elevada de HbCO puede causar la muerte en las ratas debido a la hipoxemia. Además, este modelo de doble flujo permite establecer cualquier concentración de CO en la cámara de exposición tan solo variando la tasa de flujo del caudalímetro de alta sensibilidad y ajustándola a la del caudalímetro de baja sensibilidad. El uso de otro marcador, la concentración plasmática de cotinina, respalda claramente la información de que las ratas habían inhalado el humo del cigarrillo.
La investigación básica con modelos animales puede determinar los mecanismos de las enfermedades, en particular la enfermedad pulmonar obstructiva crónica, y, en este caso, el humo de los cigarrillos puede contribuir a una mayor comprensión de su fisiopatología. El presente modelo de cámara inhaladora nos permite emprender estudios de dosis-respuesta que podrán dar lugar a conocimientos más precisos de estos fenómenos inflamatorios. Examinamos la estabilidad de concentraciones de CO de hasta 500ppm durante el mismo período de tiempo (2h) (datos no mostrados). Para alcanzar estas concentraciones elevadas solo tuvimos que incrementar el flujo de aire a través de la válvula Venturi.
Concluimos que el presente sistema de cámara inhaladora puede mantener una concentración controlada de CO en un modelo en el que se expone a pequeños animales a la inhalación del humo de cigarrillos, lo que permite efectuar estudios adecuadamente controlados, al igual que investigaciones sobre otros gases tóxicos y contaminantes ambientales.
Conflicto de interesesFundação de Amparo á Pesquisa do Estado de São Paulo (FAPESP), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Programa de Apoio a Núcleos de Excelência (PRONEX).
Los autores desean expresar su agradecimiento a Mauricio Levi-Orozco (Hospital del Mar, Barcelona, España), a Carlos Colonell (Hospital del Mar, Barcelona, España) y a Simona Pichini (Laboratorio Di Biochimica Clinica, Istituto Superiore Di Sanità, Roma, Italia) por su ayuda experta y sus contribuciones al estudio.