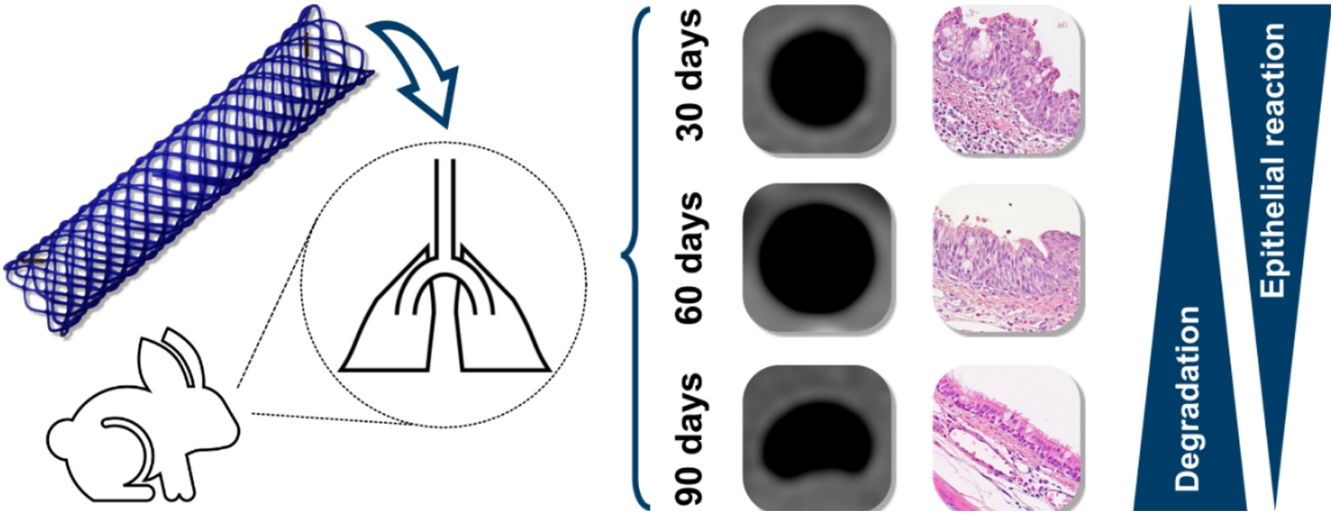
El objetivo de este estudio es evaluar la reactividad traqueal inducida por un stent traqueal biodegradable de polidioxanona.
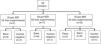
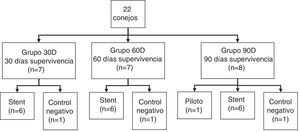
Material y métodosVeintidós conejos se dividieron en 3 grupos con diferentes tiempos de supervivencia (30, 60 y 90días postimplantación). Se implantó un stent biodegradable en cada animal, excepto en uno de cada grupo (control negativo). La implantación se realizó a través de una pequeña traqueotomía y bajo control fluoroscópico. Al finalizar los tiempos de supervivencia programados se realizaron estudios de TC y anatomopatológicos.
ResultadosNingún animal murió durante el procedimiento ni en el seguimiento. El stent había desaparecido en el 100% de los casos a los 90días, en el 50% a los 60días y en ninguno a los 30días.
En los estudios de TC se observó un grosor de la pared traqueal mayor a los 30 que a los 60 y 90días (1,60±0,41mm en la parte central del stent frente a 1,11±0,18 y 0,94±0,11; p=0,007). En el estudio anatomopatológico no se encontraron granulomas. A los 30días se observaba cierto grado de alteración histológica, la cual se reduce a los 60 y 90días. También se encuentran las diferencias, tanto en las TC como en la histología, entre animales con el stent presente y animales con el stent degradado.
ConclusionesLos stents de polidioxanona producen una leve reacción traqueal que revierte con la degradación. El uso de estos stents biodegradables en la patología traqueal benigna es prometedor.
The objective of this study was to evaluate tracheal reactivity induced by a biodegradable polydioxanone tracheal stent.
Materials and methodsTwenty-two rabbits were divided into 3 groups assigned to different survival times (30, 60 and 90days post-implantation). A biodegradable stent was implanted in each animal, except for 1 of each group (negative control). Implantation was performed through a small tracheotomy under fluoroscopic control. CT and histopathological studies were scheduled at the end of survival times.
ResultsNo animal died during the procedure or follow-up. The stent had disappeared in 100% of the cases at 90days, in 50% at 60days, and in none at 30days.
CT studies revealed a greater tracheal wall thickness at 30days than at 60 and 90days (1.60±0.41mm in the central part of the stent versus 1.11±0.18 and 0.94±0.11; P=.007, respectively). No granulomas were observed on histopathology. Some degree of histological changes were noted at 30days, which had reduced at 60 and 90days. Differences were also found in both CT and histology between animals in which the stent was present and animals in which it had degraded.
ConclusionsPolydioxanone stents produce a mild reaction that reverts with tracheal degradation. The use of these biodegradable stents in benign tracheal disease is promising.
Las estenosis traqueobronquiales benignas (ETBB) suponen una disminución del calibre de la tráquea o de los bronquios principales; pueden producir alteraciones del flujo aéreo y conllevan siempre una grave comorbilidad respiratoria. Pueden ser congénitas o adquiridas. La adquirida más frecuente es la secundaria a la intubación endotraqueal, pudiendo existir otros orígenes, como inflamatorios, infecciosos, traumáticos e iatrogénico1. El tratamiento clásico ha sido la cirugía, actualmente considerada por muchos cirujanos como la terapia de elección2,3. En los últimos años han surgido tratamientos endoscópicos con resultados controvertidos, tales como traqueoplastia y broncoplastia con balón, láser, crioterapia, electrocauterio, terapia fotodinámica y tratamientos locales con fármacos (corticoides, 5-fluorouracilo y mitomicinaC)3-6. La alternativa al tratamiento quirúrgico ha sido la colocación de stents de diversa construcción y morfología.
Los stents de silicona7, muy utilizados hasta la actualidad, presentan problemas de migración y acumulación de moco con sobrecrecimiento bacteriano8. Además, requieren broncoscopia rígida con anestesia general para su implantación8,9. Los stents metálicos autoexpandibles (SMA) producen una mejoría inmediata de los síntomas8,10-12, con grandes ventajas a corto plazo: fácil implantación mediante endoscopio flexible o bajo guía fluoroscópica sin necesidad de anestesia general y una gran luz en relación con su diámetro8,9,12. Sin embargo, estos stents presentan importantes complicaciones a largo plazo y su retirada siempre es complicada y peligrosa8,10,13,14. Debido a estas complicaciones, la Food and Drug Administration (FDA) estadounidense advirtió en contra de su uso en la patología benigna15.
Con el fin de solventar algunas de las desventajas de los SMA descubiertos, se han desarrollado stents metálicos autoexpandibles cubiertos (SMAC) de un polímero. Estos presentan las ventajas de los SMA, pudiendo ser extraídos, pero también tienen problemas de sobreinfección14,16,17.
Los stents biodegradables comienzan a ser utilizados en todos los territorios anatómicos bajo el concepto de que actúen mientras son necesarios y desaparezcan después. Estos stents están construidos con metales corrosibles o polímeros biodegradables18,19, siendo la polidioxanona uno de los polímeros más usados por su largo tiempo de degradación20.
El objetivo de esta publicación es estudiar la reactividad traqueal a un stent biodegradable de polidioxanona (SBP) en animal de experimentación sano, realizando un seguimiento clínico, mediante estudio de imagen y anatomopatológico.
Material y métodosSe trata de un estudio experimental realizado con la aprobación del Comité de Ética de Experimentación Animal de la Universidad de Zaragoza y siguiendo la declaración de la iniciativa ARRIVE. El cuidado y el uso de los animales se realizaron de acuerdo con la Política Española de Protección Animal RD 53/2013, que cumple con la Directiva de la Unión Europea 2010/63 sobre la protección de animales utilizados con fines experimentales y otros fines científicos.
Sujetos de estudioEn el estudio se incluyeron 22 conejos (Oryctolagus cuniculus) sanos, hembras adultas de raza neozelandesa (4,61±0,52kg). Los animales eran alimentados ad libitum con un pienso estándar y alojados en jaulas individuales con suelo de rejilla destinadas a la especie, con un ciclo de luz/oscuridad de 12h.
Los animales fueron distribuidos aleatoriamente en 3 grupos con diferentes tiempos de supervivencia (fig. 1). A todos los animales de cada grupo se les implantó un SBP, excepto en uno en cada grupo, que actuó de control negativo.
StentSe estudió un SBP (ELLA-CS sro, República Checa). El stent está construido con un único filamento de polidioxanona de 3,5EP tejido. Las medidas de los stents fueron 8×30mm, tenían forma cilíndrica y presentaban una marca radiopaca (MR) de oro en cada extremo. Los stents eran autoexpandibles y eran suministrados fuera del sistema liberador, por lo que debían cargarse en el mismo inmediatamente antes de la implantación. La polidioxanona es un polímero biodegradable empleado desde los años ochenta en suturas y otras prótesis. Se considera que ocasiona poca reacción tisular y es no antigénico ni pirógeno. Es un poliéster que se degrada por hidrolisis (se acelera en medio ácido), resultando en productos de degradación que pueden ser eliminados por la orina o metabolizados en el ciclo del ácido cítrico. Como sutura tiene un tiempo de absorción de 182-238días21,22.
ProcedimientoPreviamente al procedimiento se hizo un examen clínico de los animales. La implantación se realizó bajo anestesia general, administrándose una combinación de medetomidina (Sedator®, Eurovet Animal Health, Países Bajos) (0,5mg/kg) y ketamina (Imalgene 1000®, Merial, España) (25mg/kg) por vía intramuscular. Los animales se mantuvieron oxigenados mediante una mascarilla laríngea y el mantenimiento anestésico se realizó mediante inyecciones intramusculares de ketamina (0,5mg/kg) cada 20min, siendo monitorizados durante todo el procedimiento.
Con el fin de poder mantener la mascarilla laríngea para controlar la vía aérea, oxigenando y ventilando a los animales durante todo el procedimiento, las implantaciones se realizaron a través de una mini traqueostomía y bajo control fluoroscópico. En cada intervención el animal se posicionó en decúbito supino con el cuello en hiperextensión. Se realizó una pequeña incisión en el cuello y se disecaron los tejidos hasta visualizar la tráquea. Se puncionó la tráquea a nivel inmediatamente caudal al cricoides entre dos anillos traqueales con un trocar plástico periférico de 18G (Introcan® B. Braun, Alemania). A través de la vaina plástica del trocar se administraron 0,15ml de lidocaína 5% (B. Braun, Barcelona, España). Bajo guía fluoroscópica se avanzó una guía teflonada de 0,035” y punta en J (StarterTM Guidewire, Boston Scientific, Irlanda) impregnada en lidocaína. El acceso se dilató con un dilatador 12Fr (12F dilator Cook Medical, min). El sistema liberador con el stent cargado (11,8Fr) se avanzó sobre la guía y se liberó el stent al menos 1cm craneal a la carina. La liberación se realizó bajo guía fluoroscópica visualizando las marcas radioopacas. En los animales control se realizó el mismo procedimiento, pero empleando un liberador vacío.
Antes del procedimiento se administraron 50mg/kg de oxitetraciclina (Terramicina LA, Pfizer, Madrid, España) como cobertura antibiótica y 0,2mg/kg de meloxicam (Metacam®, Boehringer Ingelheim, Alemania) como analgesia posquirúrgica.
Seguimiento clínicoSe definió éxito técnico cuando pudo realizarse el procedimiento sin complicaciones.
Tras la implantación se realizó un seguimiento clínico de los animales durante el periodo de supervivencia predefinido (30, 60 y 90días en función del grupo) en el que se evaluó la condición física y la presencia de síntomas respiratorios. Se consideró éxito clínico cuando los animales sobrevivieron el tiempo programado y no apareció sintomatología que requiriera de terapia adicional.
Estudio de tomografía computarizadaFinalizado el tiempo de supervivencia programado, se realizaron estudios de TC (GE Healthcare Brivo™ CT325 16 slice) bajo sedación en todos los animales (en el piloto se realizó una TC a los 30 y 90días). En los estudios el grosor de corte fue de 1mm con separación entre cortes de 0,5mm y se realizaron reconstrucciones multiplanares.
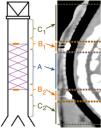
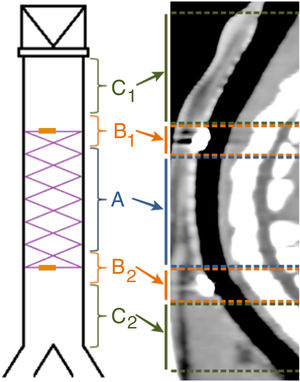
Para facilitar el estudio de las imágenes se dividió la tráquea en 5 secciones, según se muestra en la figura 2. Cuando hubo degradación del stent, se estimó su posición de acuerdo con su ubicación en la fluoroscopia realizada en la implantación.
Se evaluó la presencia de MR y de imágenes compatibles con granulomas; además se midió el grosor de la pared traqueal.
Estudio anatomopatológicoDespués del estudio de TC y aun bajo sedación, los animales fueron sacrificados con pentobarbital sódico (Dolethal®, Vétoquinol, Francia) por vía intravenosa. Se extrajeron las tráqueas para su estudio macroscópico y microscópico.
Las muestras obtenidas se fijaron en formol al 10%, se incluyeron en parafina, se cortaron y tiñeron con hematoxilina-eosina. Las tráqueas se dividieron en 3 porciones (craneal, medial y caudal) para su estudio anatomopatológico. El grado de alteración se evaluó mediante el sistema de puntuación mostrado en la tabla 123.
Sistema de puntuación para evaluar la alteración epitelial en el estudio anatomopatológico
| Parámetro | Clasificación | Puntos |
|---|---|---|
| Engrosamiento epitelial | Sin engrosamiento (≤ 50 μm) | 0 |
| Engrosamiento ligero (> 50-100 μm) | 1 | |
| Engrosamiento moderado (> 100-150 μm) | 2 | |
| Engrosamiento severo (> 150 μm) | 3 | |
| No valorable (epitelio destruido) | − | |
| Engrosamiento subepitelial | Sin engrosamiento (≤ 400 μm) | 0 |
| Engrosamiento ligero (> 400-600 μm) | 1 | |
| Engrosamiento moderado (> 600-800 μm) | 2 | |
| Engrosamiento severo (> 800 μm) | 3 | |
| Alteración epitelial | Sin alteración (30% células caliciformes y 70% células ciliadas) | 0 |
| Alteración ligera (30-50% células caliciformes y 70-50% células ciliadas) | 1 | |
| Alteración moderada (50-70% células caliciformes y 30-50% células ciliadas) | 2 | |
| Alteración severa (> 70% células caliciformes y < 30% células ciliadas) | 3 | |
| Epitelio destruido | 4 | |
| Metaplasia escamosa | Ausencia de focos de metaplasia escamosa | 0 |
| Presencia de focos de metaplasia escamosa | 1 | |
| Neovascularización | Sin alteración de la cantidad (< 5 vasos/campo) | 0 |
| Ligero aumento de la cantidad (5-15 vasos/campo) | 1 | |
| Grave aumento de la cantidad (> 15 vasos/campo) | 2 | |
| Inflamación aguda (neutrófilos) | Sin inflamación aguda | 0 |
| Inflamación aguda ligera (1-10 focos inflamatorios) | 1 | |
| Inflamación aguda moderada (> 10 focos inflamatorios o generalizada a baja concentración | 2 | |
| Inflamación aguda severa (inflamación generalizada a elevada concentración) | 3 | |
| Inflamación crónica (linfocitos e histiocitos) | Sin inflamación crónica | 0 |
| Inflamación crónica ligera (1-10 focos inflamatorios) | 1 | |
| Inflamación crónica moderada (> 10 focos inflamatorios o generalizada a baja concentración | 2 | |
| Inflamación cónica severa (inflamación generalizada a elevada concentración) | 3 | |
| Presencia de granuloma | Sin formación de granuloma | 0 |
| Presencia de granuloma aislado | 1 | |
| Presencia de más de un granuloma | 2 | |
| Puntuación máxima | 21 |
Todos los datos y análisis estadísticos fueron procesados usando SPSS Statistics (IBM SPSS Statistics for Macintosh, version 21.0; IBM Corp., Armonk, NY, EE.UU.). Se estableció un error de 0,05. Las variables cualitativas se expresaron como frecuencias y las cuantitativas se describieron como media ±desviación estándar. Las variables cualitativas se compararon usando la razón de verosimilitud o la prueba exacta de Fisher. Antes de las comparaciones, se evaluó la normalidad de las variables cuantitativas usando el test de Shapiro-Wilk. Si los datos seguían una distribución normal, se utilizó la prueba t de Student para muestras independientes (2 medias) o el análisis de varianza, ANOVA (más de 2 medias). Para las distribuciones no normales se empleó la prueba de U de Mann-Whitney o la prueba de Kruskal-Wallis. Para las muestras pareadas se utilizó la prueba de Wilcoxon.
ResultadosEl éxito técnico y clínico fue del 100%. Durante el seguimiento clínico el estado de salud de los animales fue bueno, sin que se observaran síntomas respiratorios significativos.
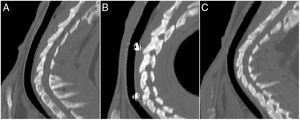
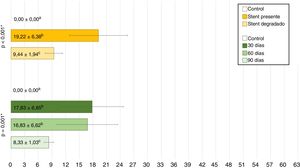
Estudio de TCLas MR estaban presentes en todos los animales implantados a los que se les realizó la TC a los 30días postimplantación (n=7); estaban presentes en el 50% (n=3) de los animales del grupo D60, habiendo desaparecido en el 50% (n=3) restante; en el grupo D90 las MR habían desaparecido en el 100% de los animales (n=7) (p<0,001; V de Cramer: 0,837) (fig. 3).
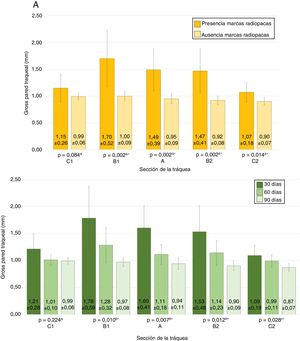
No se observó migración del stent en ninguna de las TC en las cuales las MR estaban presentes. En las TC en las que las MR no se observaron en la tráquea, tampoco se observaron en el pulmón. En 7 TC (30,4%) se hallaron imágenes compatibles con granulomas, conservándose la permeabilidad traqueal en todos los animales. La localización de los posibles granulomas fue: A (n=1), B1 (n=3) y C1 (n=3). En el área C1 se observaron diferencias significativas (p=0,038; Phi: 0,509) en el grosor de la pared traqueal en función de si había presencia (1,37±0,30mm) o ausencia (1,02±0,13mm) de posibles granulomas. No se encontraron diferencias significativas entre controles y animales implantados en ninguno de los parámetros estudiados. Los resultados del grosor de la pared traqueal se muestran en la figura 4.
Estudio anatomopatológicoEn todos los casos en los que las MR estaban presentes en la TC se confirmó la presencia del stent en el estudio de la pieza macroscópica, mientras que en aquellos casos en los que no lo estaban no se encontraron restos del stent en la pieza anatómica.
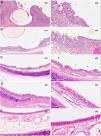
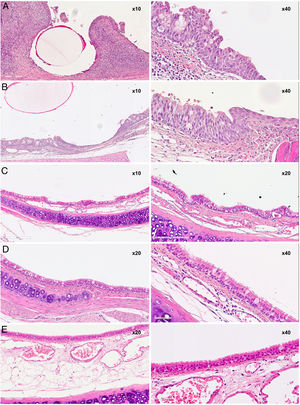
En el estudio histológico no se encontraron granulomas que confirmasen las imágenes observadas en TC. En ningún caso en que el stent aún estaba presente se evidenció una reepitelización del mismo, observándose únicamente impresiones de los filamentos en el epitelio o invaginaciones del mismo sobre los filamentos sin llegar a cubrirlos por completo.
En los animales implantados se encontraron diferencias significativas (p=0,28) en el grado de alteración histológica entre las puntuaciones de la zona A (4,56±2,23 puntos) y las de la zona C1 (5,22±2,60 puntos), no observándose diferencias significativas con la zona C2 (4,56±2,31 puntos).
Las puntuaciones totales se muestran en la figura 5 y las imágenes, en la figura 6.
Puntuaciones medias totales de los estudios anatomopatológicos. Colores amarillos: puntuaciones según stent presente o degradado. Colores verdes: puntuaciones según tiempo postimplantación.
Los valores con el mismo superíndice indican ausencia de diferencias estadísticamente significativas entre ellos, según la prueba de la U Mann-Whitney para valores pareados.
* Significación de la prueba de Kruskal-Wallis.
El estudio evolutivo a 30, 60 y 90días mostró cambios histológicos en los animales implantados. Se observó que en general, con el paso del tiempo, se produjo un ligero aumento del grosor del epitelio, un cambio en las poblaciones celulares del epitelio con un aumento del número de células caliciformes y una disminución de células ciliadas, si bien los cilios en general aparecen conservados. Además, presencia de focos inflamatorios tanto crónicos como agudos, aunque en estos últimos las diferencias no son significativas respecto al grupo control.
En los grupos sacrificados a los 30 y 60días postimplantación se observó un ligero aumento del espesor subepitelial, sin existir diferencias significativas entre grupos. En los casos en que el grosor subepitelial era menor de 400μm (menor al de los animales control), el tejido conjuntivo aparecía más denso.
Los focos de metaplasia escamosa observados aparecen como pequeños focos rodeados por epitelio normal. Las puntuaciones obtenidas en los parámetros metaplasia escamosa y neovascularización alcanzan su máximo en el grupo D30, son más reducidas sin ser significativamente diferentes en el grupo D60, y en el grupo D90 no se observan focos de metaplasia escamosa ni de neovascularización. Existen diferencias significativas entre las puntuaciones de los grupos D30 y D90 tanto en el parámetro metaplasia escamosa (p=0,001) como en el parámetro neovascularización (p=0,006).
Considerando la suma de la puntuación de todos los parámetros se observa una disminución de las puntuaciones a lo largo del tiempo, siendo la media de las puntuaciones del grupo D90 significativamente diferente de las del grupo D30 (p=0,003) y del grupo D60 (p=0,003).
Evolución de la degradaciónDesde la perspectiva de la degradación se encontraron dos situaciones: la completa degradación del stent y la persistencia de este. Se observaron diferencias significativas en las medias de las puntuaciones totales entre los casos en que el stent aún estaba presente y aquellos en los que ya se había degradado (p=0,001). El recuento de las puntuaciones en los parámetros espesor subepitelial, metaplasia escamosa, neovascularización e inflamación aguda fue de 0 en todos los animales en los que el stent se había degradado, mientras que en los animales en los que el stent todavía estaba presente el espesor subepitelial estaba aumentado en 6 de 9 animales (66,67%), existiendo diferencias significativas con el grupo degradado (p=0,004). Además, en los animales en los que el stent no se había degradado aparecían focos de metaplasia escamosa en el 100% de ellos (p<0,001), focos de neovascularización en 8 de 9 animales (88,89%; p<0,001) y focos de inflamación aguda en 7 de 9 individuos (77,78%; p=0,002).
DiscusiónEl tratamiento de las ETBB constituye un auténtico reto. En los casos donde la cirugía está contraindicada o no se puede realizar por otro motivo, los SMA no cubiertos consiguen una rápida y significativa mejoría clínica8,10-12. Sin embargo, su uso está relacionado con importantes complicaciones a largo plazo, problema que se agrava por la dificultad en su retirada debido a que quedan integrados en el epitelio8,10,13,14. Los SMAC permiten su retirada, pero tienen problemas relacionados con el transporte mucociliar16,17. Serrano et al.24 hipotetizaron si el uso de stents liberadores de paclitaxel reduciría la reacción del epitelio y mejoraría los resultados. Sin embargo, los stents liberadores de paclitaxel causaron lesiones importantes, probablemente debidas a que la dosis de paclitaxel debe ser ajustada, ya que el lavado del fármaco en el árbol traqueobronquial es mucho menos intenso que en el sistema vascular y se acumula en el epitelio. Por otro lado, los resultados de los stents de acero fueron también negativos, mientras que los de los stents de nitinol causaron la menor reacción, pero persiste el problema de su retirada24. Recientemente, otros autores25 han comunicado resultados aceptables con SMA en lesiones traqueobronquiales.
Los SMAC no ocasionan problemas de hiperplasia e hiperreactividad en la parte cubierta, pero estos efectos adversos son inevitables en los extremos del stent, sobre todo en aquellos con los extremos descubiertos25-27. Por otra parte, los problemas con la alteración mucociliar, los problemas de migración y la necesidad de broncoscopios de gran calibre constituyen verdaderas limitaciones de este tipo de stent25,27.
Los SBP son autoexpandibles y se adaptan a la pared traqueobronquial, no presentan alteraciones mucociliares importantes y no requieren ser retirados28-30. En el árbol traqueobronquial se han probado SBP con resultados prometedores en el tratamiento de ETBB30,31, trasplantes pulmonares29,32,33, traqueobroncomalacia28,30-32,34 y compresiones externas28,35. Los SBP podrían jugar un papel importante en los pacientes pediátricos debido al desarrollo y crecimiento de la tráquea28. Aunque los SBP no necesiten de una segunda intervención para su retirada, puede ser necesario el uso de varios consecutivos si la degradación se produce antes que la remodelación de la estenosis28,31,32,35.
En nuestro estudio la degradación se completó entre los 30 y 90días, habiendo finalizado a los 60días en el 50% de los animales, lo cual concuerda con el estudio de Novotny en el cual a las 10semanas se había completado la degradación36. Sin embargo, Stehlik et al.30 observaron en pacientes humanos que el inicio de la degradación rápida se producía entre los 85 y los 94días postimplantación. En nuestro estudio las TC mostraron la degradación completa o no del stent en función de la presencia o ausencia de MR. Se suscita el interrogante sobre qué ocurre con las MR: se expulsan con la tos o por el contrario se pierden en el parénquima pulmonar. En todas las TC en las que las MR no se encontraban en su posición inicial, habían desaparecido por completo, no observándose en los bronquios ni en el parénquima pulmonar. Tampoco se encontraron evidencias de que fragmentos del stent migraran distalmente. Estos datos parecen indicar que tanto las MR como los fragmentos de stent pudieran ser expulsados con la tos; de hecho, en pacientes adultos se ha descrito la expulsión de fragmentos de stent al toser, sin complicaciones asociadas y siendo bien tolerado30,32. Por otro lado, Sztanó et al.37, en una serie de tres pacientes pediátricos, describen que los fragmentos producidos durante la degradación pueden comportarse como cuerpos extraños con consecuencias fatales. Estas complicaciones en pacientes pediátricos no han sido descritas por otros autores28,31,34,35. Probablemente, los animales de nuestro estudio no presentaron este problema debido a que eran adultos, sanos y más eficientes expulsando los fragmentos.
Como los SBP son autoexpandibles, pueden ser implantados mediante las mismas técnicas que los metálicos. Sin embargo, el diámetro del sistema liberador, bastante rígido, tiene un diámetro de 11,8Fr. (3,89mm), por lo que se requiere de un canal de trabajo amplio. La estructura de la celda abierta del stent debería permitir el transporte mucociliar. En nuestro estudio el epitelio aparece bien conservado, no se observó destrucción de este, los cilios estaban conservados y había un aumento en la proporción de células caliciformes. Los focos de metaplasia escamosa aparecían como pequeñas áreas de metaplasia rodeadas por epitelio normal, lo cual podría coincidir con las zonas de contacto del stent. Es destacable la ausencia de granulomas en el estudio histológico, ya que los granulomas son una de las principales complicaciones de las stents tanto a nivel experimental como clínico7,24,25,38. Las imágenes de TC compatibles con granulomas no fueron confirmadas por los resultados histológicos, pudiendo deberse a que acúmulos de moco pueden tener una imagen semejante a los granulomas en la TC. Se han observado fenómenos de granulación en estudios experimentales y clínicos con SBP, aunque podrían ser debidos a la existencia de una lesión previa del epitelio30,39. Stehlik et al.30 creen que la hiperplasia de la mucosa inducida por los SBP puede contribuir a estabilizar la estenosis.
Tanto los resultados del seguimiento clínico de los animales como de las TC mostraron que la permeabilidad traqueal se mantuvo. Tampoco se observó ningún caso de migración del stent, a pesar de que tampoco se observó la epitelización de este.
La principal limitación de este estudio es que, al haberse realizado en un animal de experimentación, los resultados no son completamente extrapolables a la especie humana, pese a las semejanzas existentes entre la tráquea del conejo y la humana. Por otro lado, se evalúa la reacción traqueal de una tráquea sana y no de una patológica, como sería el caso del uso de este stent en un paciente real. Al no conocer la fuerza radial del stent, tampoco conocemos si puede vencer una estenosis.
Como conclusión, este estudio muestra que los SBP generan una alteración sin importantes consecuencias del epitelio traqueal, que revierte a un epitelio sano conforme el stent se biodegrada. Estos resultados sugieren que el uso de estos stents podría ser seguro, si bien debería estudiarse su efectividad en un modelo estenótico.
FinanciaciónFinanciado por el Gobierno de Aragón, España (Referencia Grupo B36_17R) y cofinanciado con Feder 2014-2020 “Construyendo Europa desde Aragón”.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A ELLA-CS sro por el suministro de prótesis adaptadas al modelo animal.
Al Dr. Fernando Lostalé por su asesoramiento científico.
Al Centro Clínico Veterinario de Zaragoza S.L. por la realización de las TC.