Los sarcomas primarios de tórax son muy poco frecuentes. Sarcoma sinovial, angiosarcomas, leiomiosarcomas, rabdomiosarcomas y mesoteliomas sarcomatoides son las variantes intratorácicas más comunes. Aunque el sarcoma de Ewing/tumor neuroectodérmico primitivo (PNET) torácico se desarrolla habitualmente en la pared torácica, se ha descrito en la literatura médica algún caso de localización pulmonar primaria.
Presentamos el caso de una mujer de 22 años diagnosticada de sarcoma de Ewing/PNET pulmonar mediante muestra broncoscópica por sus características histológicas, inmunohistoquímicas y técnicas de hibridación in situ. Se excluyó el origen metastásico mediante radiografía, gammagrafía y biopsia de médula ósea. Se inició quimioterapia según el esquema VACD-IE (vincristina, actinomicina D, ciclofosfamida, doxorrubicina, ifosfamida y etopósido), con buena respuesta. En la actualidad acude de forma regular a consultas ambulatorias.
Primary thoracic sarcomas are very rare. The most common intrathoracic variants are synovial sarcoma, angiosarcoma, leiomyosarcoma, rhabdomyosarcoma, and sarcomatoid mesothelioma. Although thoracic Ewing sarcoma/primitive neuroectodermal tumor (PNET) usually develops on the chest wall, there have been reports of primary Ewing sarcoma/PNET of the lung.
We present the case of a 22-year-old woman with Ewing sarcoma/PNET diagnosed following histologic, immunohistochemical, and in situ hybridization studies of a bronchial biopsy specimen. Radiography, ventilation-perfusion scintigraphy, and a bone marrow biopsy confirmed that the tumor was not metastatic. The patient was started on a chemotherapy regimen of vincristine, actinomycin, cyclophosphamide, doxorubicin, ifosfamide, and etoposide and responded well. She is now being seen regularly at our outpatient clinic.
El sarcoma de Ewing intraóseo es el segundo tumor primario de hueso más frecuente después del osteosarcoma1,2. En el momento del diagnóstico, un 24% de los casos presenta enfermedad metastásica, localizada fundamentalmente, por orden de frecuencia, en el pulmón, en otros huesos o en la médula ósea. En la actualidad se incluye dentro de la familia de los tumores de Ewing, que incluye además el tumor neuroectodérmico primitivo (PNET), el tumor de Askin (sarcoma de Ewing de localización costal) y el sarcoma de Ewing extraóseo. Esta agrupación se debe a que sus características anatomopatológicas, inmunohistoquímicas y genéticas son casi indistinguibles. Se origina fundamentalmente en huesos largos del esqueleto axial y afecta de forma preferente a las diáfisis, la edad media de presentación es de 15 años y se observa un ligero predominio masculino; en el tórax se localiza sobre todo en las costillas (tumor de Askin) y la localización pulmonar primaria es extremadamente rara, salvo en el marco de enfermedad metastásica, y con una edad de presentación un poco más tardía, en torno a los 20 años.
La anatomía patológica se caracteriza por un patrón en sábana de células pequeñas, azuladas, de núcleo redondo, con positividad frente a la glucoproteína de membrana p30/32 MIC2 (CD99). En un alto porcentaje de los casos se produce reordenamiento del gen EWS, lo que, unido a lo anterior, resulta patognomónico de la enfermedad.
Las manifestaciones clínicas más frecuentes son el dolor y la hinchazón óseos, y sintomatología general (malestar y fiebre), esto último de forma más frecuente si hay enfermedad metastásica. No hay datos clínicos, analíticos o de imagen que sean patognomónicos, por lo que el diagnóstico de confirmación requiere biopsia y técnicas de inmunohistoquímica y de biología molecular. En un 75% de los pacientes la enfermedad se presenta de modo localizado, con una supervivencia global en torno al 70%, cifra que se reduce a un 26% en caso de enfermedad metastásica. El tratamiento consiste en la cirugía (en los casos que sean operables y resecables) y la quimioterapia coadyuvante.
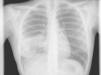
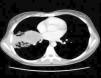
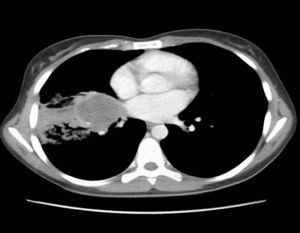
Observación clínicaMujer de 22 años, no fumadora y sin antecedentes de interés, que consultó en el Servicio de Urgencias por síndrome febril de una semana de evolución y dolores musculares generalizados. En la exploración no se detectaron anormalidades, salvo una discreta febrícula (37,6°C). Se realizó una radiografía de tórax (fig. 1), que objetivó una radiopacidad de unos 5cm en el hemotórax derecho, con atelectasia parcial del lóbulo medio y lóbulo inferior derecho, por lo que se decidió su ingreso para estudio. La analítica general con hormonas tiroideas y marcadores tumorales resultó estrictamente normal. Se realizó una tomografía computarizada (TAC) de tórax, abdomen y pelvis (fig. 2) que confirmó la presencia de una masa de 5×4cm en la zona parahiliar derecha, con neumonitis obstructiva distal, sin otras anormalidades. En la fibrobroncoscopia se observó infiltración de la mucosa del bronquio intermediario derecho, con estenosis parcial de los lóbulos medio e inferior derecho.
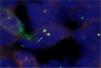
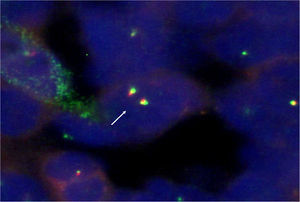
La biopsia bronquial mostró una tumoración de células pequeñas y redondeadas, con escaso citoplasma. Los resultados del estudio inmunohistoquímico fueron los siguientes: CD99, positivo; sinaptofisina, positiva; enolasa neuronal específica (NSE), negativa; S-100, negativo; CD56, negativo; factor de transcripción tiroidea-1 (TTF-1), negativo; cromatogranina, negativa; citoqueratina AE1-AE3, negativa; citoqueratina-7, negativa; citoqueratina-18, negativa, y marcadores linfoides (LC, CD20 y CD3), negativos. El estudio de hibridación in situ fluorescente (FISH) del gen EWS (fig. 3) presentó reordenamiento (separación de la mayoría de los núcleos), lo que implica que el gen está translocado. Todo todos estos datos apuntaban de forma concluyente a un sarcoma de Ewing/PNET.
Se realizó estudio de extensión que incluyó TAC craneal, gammagrafía ósea y biopsia de médula ósea, que resultaron negativas, lo que, unido a la imagen de la TAC torácica, permitió llegar al diagnóstico de sarcoma de Ewing/PNET pulmonar primario. Se trasladó a la paciente a Oncología, donde inició quimioterapia3–5 con el esquema VACD-IE (vincristina, actinomicina D, ciclofosfamida, doxorrubicina, ifosfamida y etopósido)6, con buena respuesta inicial al tratamiento.
DiscusiónEl sarcoma de Ewing es el segundo tumor primario de hueso más frecuente después del osteosarcoma. Se presenta generalmente en la segunda década de la vida, aunque en un 20–30% de los casos el diagnóstico se hace en edades más tempranas. La presentación extraósea primaria es infrecuente, y sus localizaciones principales son la pared torácica, los músculos paravertebrales, las nalgas y el espacio retroperitoneal. Hay además casos anecdóticos en otras localizaciones7, como riñón, mama, tracto gastrointestinal, próstata, endometrio, maxilar, suprarrenales y meninges. En la revisión de la literatura médica mediante MEDLINE y PubMed (1978–2008), utilizando como palabras clave “Ewing's sarcoma” y/o “primitive neuroectodermal tumor”, sólo hemos encontramos 9 casos8–11 con afectación pulmonar primaria, y de ellos únicamente en 2 se dispone de estudio genético12,13. Llama la atención que casi todos han sido publicados por grupos japoneses, sin que hasta la fecha hay ningún caso europeo ni norteamericano.
Nuestra paciente no presentó sintomatología pulmonar, sólo síntomas inespecíficos (febrícula y mialgias). Este dato es común en la mayoría de los otros casos publicados. Las imágenes radiológicas no presentaban ninguna anomalía específica y solamente nos sirvieron para excluir un origen metastásico o de pared torácica, ya que el pulmón es una localización de las metástasis, que se presentan hasta en el 10% de los casos. En cuanto al aspecto macroscópico endobronquial, tampoco encontramos ninguna característica digna de mención que pudiese distinguirlo de otros tumores pulmonares. Sin embargo, es el segundo caso en el que se refiere la existencia de lesión endobronquial y en que la confirmación del diagnóstico se realizó en una muestra de biopsia bronquial. La edad de la paciente y la imagen histopatológica de un tumor de células pequeñas redondeadas fueron datos importantes para sospechar este tipo de tumor y aplicar otras técnicas de confirmación.
El sarcoma de Ewing se caracteriza histológicamente por un patrón en sábana de células pequeñas, azuladas, de núcleo redondo, positivas a la glucoproteína de membrana p30/32 MIC2 (CD99), con anticuerpos monoclonales que incluyen O13, 12E7 y HBA71. Es también inmunorreactivo para la vimentina y la sinaptofisina. Los sarcomas de Ewing más diferenciados (PNET) pueden mostrar inmunorreactividad frente a marcadores de diferenciación neuronal, como son NSE, proteína S-100, Leu-7 y PgP9.5. En un 20% de los casos son positivos para citoqueratinas. A pesar de que el sarcoma de Ewing tiene unas características histológicas y fenotípicas específicas, es preciso hacer un correcto diagnóstico diferencial con otros tumores de células pequeñas y redondas de la infancia, como el neuroblastoma, el linfoma linfoblástico y el rabdomiosarcoma, debido a las diferentes actitudes terapéuticas. Al igual que el sarcoma de Ewing, el neuroblastoma es positivo para NSE, S-100 y Leu-7, pero negativo para la vimentina e inmunorreactivo para proteínas de neurofilamentos. El linfoma linfoblástico es asimismo reactivo para CD99, pero, a diferencia del sarcoma de Ewing, también lo es para marcadores linfoides, antígeno leucocitario común (CD45) y desoxinucleotidil-transferasa terminal (TdT). El rabdomiosarcoma difiere del sarcoma de Ewing en la inmunorreactividad frente a miogenina, myo-D1, desmina y actina. A veces resulta difícil diferenciar un sarcoma sinovial pobremente diferenciado de un sarcoma de Ewing; ambos son positivos para CD99 y citoqueratinas. En nuestro caso, el estudio inmunohistoquímico evidenció positividad para CD99 y sinaptofisina, y negatividad para S-100, CD56, antígeno leucocitario común, TTF-1, cromogranina, citoqueratinas (AE1/AE3; 7; 18), marcadores linfoides (LC, CD20, CD3) y desmina. Los estudios moleculares genéticos con técnicas de FISH o de transcripción inversa y reacción en cadena de la polimerasa permiten el diagnóstico de certeza de las muestras en los casos con características inmunohistoquímicas indeterminadas. La translocación t(11,22) (q24; q12) es patognomónica del sarcoma de Ewing. Se presenta en un 85% de los casos y da lugar a la formación del gen EWS-Flil. En los restantes se producen variantes de esta translocación, como es el caso de 22q12, 21q2 (un 10% de los sarcomas de Ewing) o 7p22, 17q12, 2q36 (<1% de los casos). Además de estas transcripciones, se dan otros cambios estructurales, como la trisomía 8 o 12, deleciones de 9p21, pérdida de heterocigosidad de 17p13, entre otras. En nuestra paciente, el estudio de FISH del gen EWS mostraba reordenamiento (separación en prácticamente la totalidad de los núcleos), lo que significa que el gen estaba translocado. Esto también se objetiva en otros tumores como el sarcoma desmoplásico y el melanoma de partes blandas, pero en estos casos la histología es distinta. Por todo ello, para el diagnóstico es fundamental tener en cuenta varios factores: sospecha, aspecto anatomopatológico, inmunohistoquímica y genética.