Entre las manifestaciones extrapulmonares de la EPOC, la disfunción y la pérdida de peso muscular son las de mayor repercusión en la calidad de vida de los pacientes. Nuestro objetivo fue evaluar los mecanismos moleculares potencialmente implicados en el menor desarrollo de masa muscular en el diafragma y gastrocnemio de ratones con enfisema inducido experimentalmente.
MétodosModelo experimental en ratones, a los que se les indujo un enfisema mediante instilación local de elastasa (n=6), administrándose suero fisiológico en los controles (n=7). Se determinaron los niveles de estrés oxidativo, sistemas de proteólisis, vías de señalización, factores de crecimiento y diferenciación celular (western-blot) en el diafragma y el gastrocnemio de todos los ratones tras 34 semanas.
ResultadosEn los ratones con enfisema respecto de los controles, se observaron los siguientes hallazgos: a) una menor ganancia de peso corporal total y un menor peso del diafragma y del gastrocnemio; b) en el diafragma, los niveles de oxidación proteica estaban aumentados, los sistemas antioxidantes mitocondriales disminuidos, los niveles de miostatina y los de las vías de señalización ERK1/2 y FoxO1 fueron superiores, y el contenido de miosina fue menor (67%), y c) en el gastrocnemio de los ratones enfisematosos, los antioxidantes citosólicos estaban disminuidos, y los niveles de miostatina y los de las vías de señalización JNK y NF-kB estaban incrementados.
ConclusionesLa reducción del contenido en miosina observado en el diafragma de ratones con enfisema podría explicar su menor tamaño. El estrés oxidativo, la miostatina y FoxO podrían estar implicados en la pérdida de esta proteína estructural.
Among the extrapulmonary manifestations of COPD, dysfunction and loss of muscle mass/weight are those that have the greatest impact on the quality of life of patients. Our objective was to evaluate the molecular mechanisms that are potentially implicated in the limited development of muscle mass in the diaphragm and gastrocnemius of mice with experimentally-induced emphysema.
MethodsAn experimental model in mice, in which emphysema was induced by means of the local instillation of elastase (n=6), while saline was administered to the controls (n=7). We determined the levels of oxidative stress, proteolytic systems, signaling pathways, growth factors and cell differentiation (western-blot) in the diaphragm and gastrocnemius of all the mice after 34 weeks.
ResultsUpon comparing the mice with emphysema with the controls, the following findings were observed: (1) lower total body weight and lower weight of the diaphragm and gastrocnemius; (2) in the diaphragm, the levels of protein oxidation were increased, the mitochondrial antioxidant systems reduced, the levels of myostatin and of the ERK1/2 and FoxO1 signaling pathways were higher, and the myosin content was lower (67%); and (3) in the gastrocnemius of the emphysematous mice, the cytosolic antioxidants were decreased and the levels of myostatin and of the JNK and NF-kB signaling pathways were increased.
ConclusionsThe reduction of the myosin content observed in the diaphragm of mice with emphysema could explain their smaller size. Oxidative stress, myostatin and FoxO could be implicated in the loss of this structural protein.
La disfunción muscular, acompañada o no de pérdida de masa muscular, es una de las manifestaciones sistémicas más importantes de la enfermedad pulmonar obstructiva crónica (EPOC) y tiene un fuerte impacto en la calidad de vida de los pacientes1. Aunque la etiología de la disfunción muscular no está todavía bien esclarecida, diversos mecanismos como la inmovilización, la hipoxia, la inflamación sistémica y el estrés oxidativo parecen contribuir en mayor o menor medida2. Cabe destacar que el estrés oxidativo, cuyos niveles se han mostrado sistemáticamente elevados en los músculos respiratorios y periféricos de los pacientes con EPOC3–8, puede también actuar como mecanismo de inducción de pérdida de masa muscular y atrofia9. Desde un punto de vista molecular, esto se traduce en una reducción de la síntesis proteica junto con un aumento de la actividad de los sistemas de degradación proteica muscular en distintos procesos y enfermedades como la caquexia cancerosa y la EPOC10,11.
Diversos mecanismos moleculares contribuyen a la degradación de proteínas en los músculos de los mamíferos como los lisosomas, la autofagia, las calpaínas, la caspasa-3 y el sistema ubiquitina-proteosoma. En este sentido, diferentes estudios han puesto de manifiesto que este último sistema proteolítico participa de manera predominante en la degradación de proteínas musculares en procesos altamente prevalentes como la caquexia cancerosa y la EPOC11. Por lo que respecta a las vías de señalización implicadas en los procesos de catabolismo proteico aumentado, se ha demostrado recientemente que la familia de factores de transcripción fork head box O (FoxO) regula la expresión de atrogin-1 en el cuádriceps de pacientes con EPOC12 y en el diafragma de pacientes ventilados mecánicamente13. Sin embargo, todavía queda por elucidar si otras vías de señalización, especialmente las sensibles a los oxidantes, podrían estar también implicadas en la regulación de la proteólisis muscular en procesos crónicos como la EPOC. Otro aspecto que queda aún por esclarecer es el de la identificación de proteínas musculares susceptibles de ser predominantemente degradadas en los músculos de pacientes portadores de procesos que cursan con pérdida de masa muscular. En este sentido, sería de interés conocer si las proteínas que en estudios previos4,7,8 han mostrado una susceptibilidad elevada a los efectos de los oxidantes serían, a su vez, las mayormente degradadas por los sistemas proteolíticos musculares. Otro aspecto de elevado interés todavía por determinar es si los patrones de expresión de los diversos marcadores de proteólisis son comunes a los músculos respiratorios y periféricos.
En este sentido, nuestra hipótesis fue la de identificar mecanismos moleculares potencialmente implicados en el menor desarrollo de masa muscular en los músculos respiratorios y periféricos en animales portadores de una enfermedad pulmonar crónica de interés como el enfisema. Así, un primer objetivo del presente estudio fue determinar diversos marcadores de estrés oxidativo, sistemas proteolíticos musculares, entre ellos la miostatina, vías de señalización y proteínas musculares susceptibles de ser degradadas (actina, miosina y creatincinasa) en el diafragma y el gastrocnemio de ratones con enfisema inducido experimentalmente tras la administración de elastasa. Un segundo objetivo, más colateral en el estudio, fue el de establecer un modelo animal de enfisema con afectación muscular respiratoria y periférica que permita llevar a cabo en el futuro estudios basados en objetivos distintos, así como evaluar estrategias terapéuticas diversas. Ante los resultados obtenidos en la presente investigación, se puede concluir que el modelo experimental animal también da respuesta a este segundo objetivo.
MétodosPoblación de estudio y grupos experimentalesA fin de evitar problemas ligados al envejecimiento, se estudiaron ratones macho adultos jóvenes (2 meses de edad, 21-23g de peso corporal) de la cepa A/J a los que se les indujo un enfisema, junto con los respectivos ratones control. Se ha utilizado un modelo clásico de enfisema pulmonar mediante una única instilación (aspiración orofaríngea) de elastasa de alta pureza (EC134GI, Elastin Products Company) con una concentración de 0,15mg/100g de peso o el equivalente a 20U de enzima/100g de peso. Se trata de una metodología validada previamente en otros estudios14,15, en la que se han caracterizado adecuadamente las diferentes etapas del daño alveolar. Al inicio del estudio, los ratones fueron asignados aleatoriamente a dos grupos: a) ratones con enfisema que fueron sacrificados a las 34semanas de evolución de su enfermedad (n=6) y b) grupo control, a los que se les instiló exclusivamente suero fisiológico en la cavidad orofaríngea, y que también fueron sacrificados a las 34semanas tras dicha instilación única (n=7). A lo largo del período de estudio de 34semanas, los animales de ambos grupos recibieron diariamente alimento y agua ad líbitum y permanecieron bajo las condiciones ambientales habituales de estabulación. También mantuvieron los niveles de actividad física habituales en este tipo de animales durante todo el período de estudio.
Se trata de un estudio controlado, diseñado de acuerdo con la normativa vigente en nuestra institución para la experimentación en animales y a la convención de Helsinki sobre la utilización y el cuidado de los mismos. También se ha tenido en cuenta lo dispuesto en la normativa legal vigente (Real Decreto 1201/2005 de 10 de octubre) sobre protección de los animales utilizados para experimentación y otros fines científicos. Todos los experimentos fueron aprobados por el Comité Ético de Experimentación del Centro para la Investigación Médica Aplicada (CIMA) en Pamplona (Navarra). Cabe señalar que por razones de índole ético los ratones empleados en la presente investigación se utilizaron también en un estudio previo15 cuyo objetivo fue la cuantificación del grado de enfisema mediante el empleo de metodologías diversas.
Características de los animalesLa confirmación histológica de la presencia de enfisema en los pulmones de los ratones enfermos respecto de los animales control se realizó de forma cuantitativa en un estudio previo15. Por otro lado también se evaluó, en el mismo estudio, en ambos grupos de ratones, la distensibilidad pulmonar previa al sacrificio de los mismos, con la publicación de los datos correspondientes15.
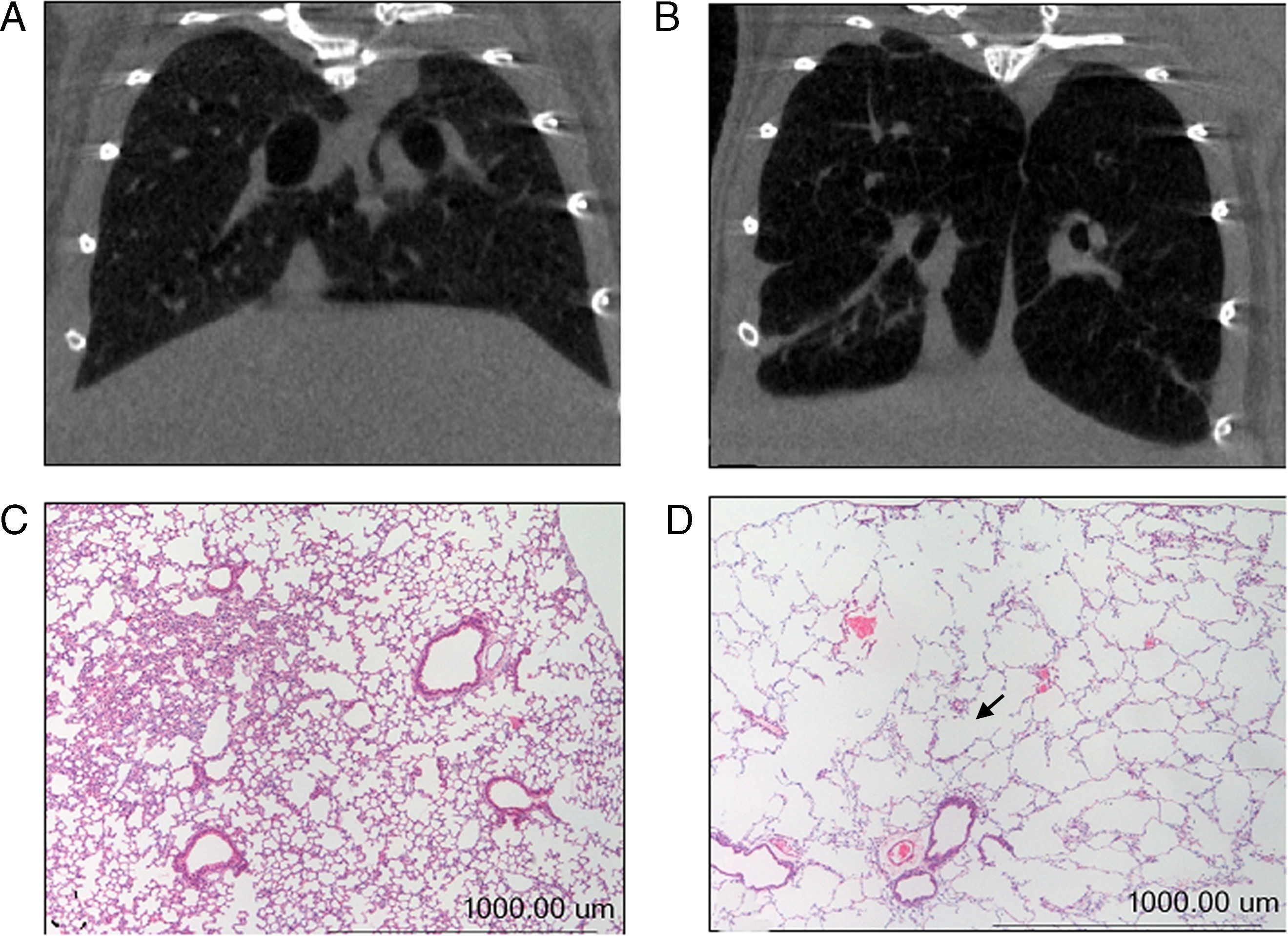
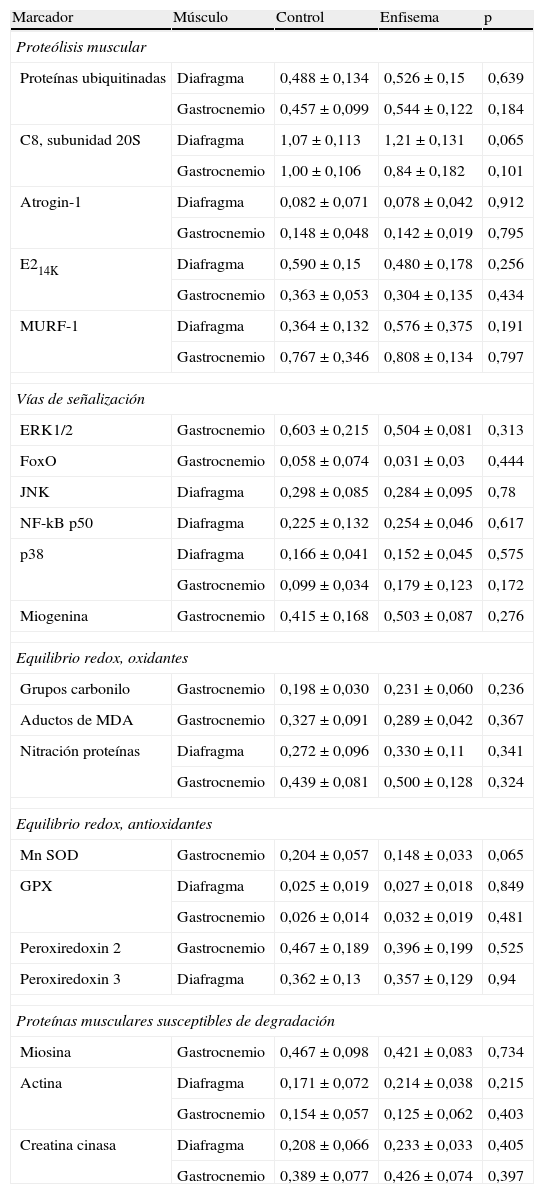
Además, en el presente estudio, en los dos grupos de ratones se procedió, previamente a su sacrificio (semana 34), a la confirmación radiológica de la presencia de enfisema en los animales enfermos mediante tomografía axial computarizada (TAC) (fig. 1A-B). También se determinó el peso de todos los animales: a día 0 e inmediatamente antes de su sacrificio (semana 34). Dada la edad de los animales, la tendencia en todos ellos fue a ganar peso a lo largo del período de estudio. En todos los ratones se ha utilizado como variable de estudio el porcentaje de ganancia de peso corporal a la semana 34 respecto del peso de cada animal al inicio (basal, día 0).
A) Tomografía axial computarizada de pulmón de ratón control. B) Tomografía axial computarizada de pulmón de ratón tratado con elastasa. C) Tinción de hematoxilina/eosina de pulmón de ratón control. D) Tinción de hematoxilina/eosina de pulmón de ratón tratado con elastasa. La flecha señala una zona del parénquima pulmonar en la que se aprecia un aumento del espacio interalveolar.
En los dos grupos de ratones se obtuvieron los músculos diafragma y gastrocnemio y los pulmones. Para ello se administró, previo al sacrificio, pentobarbital sódico 50mg/kg por vía intraperitoneal y, tras comprobar que el animal estaba completamente anestesiado, sin ningún dolor, se procedió a la realización de las extracciones correspondientes, comenzando por el músculo de las extremidades y finalizando por el diafragma y los pulmones. Una vez extraídos los músculos del animal, se procedió a su congelación inmediata con nitrógeno líquido, para su posterior conservación a –80¿C. Los pulmones fueron extraídos y fijados en formol a una presión constante de 20cmH2O, para ser posteriormente incluidos en parafina con el fin de realizar los bloques y cortes histológicos correspondientes15.
Experimentos de biología molecularAnálisis morfológicoTal como se ha mencionado anteriormente, la cuantificación del grado de enfisema en los ratones se realizó mediante diversas metodologías en un estudio previo15. Dado que ya se confirmó claramente la presencia de enfisema en todos los pulmones de los mismos animales utilizados en el presente estudio15, no se procedió a realizar dichas mediciones de nuevo en el trabajo actual, si bien sí se realizaron nuevos cortes histológicos de los pulmones de ambos grupos de animales sobre los que se han practicaron tinciones de hematoxilina-eosina con el fin de evaluar macroscópicamente y de forma cualitativa el aumento de los espacios interalveolares en los pulmones de los ratones con enfisema (fig. 1C-D).
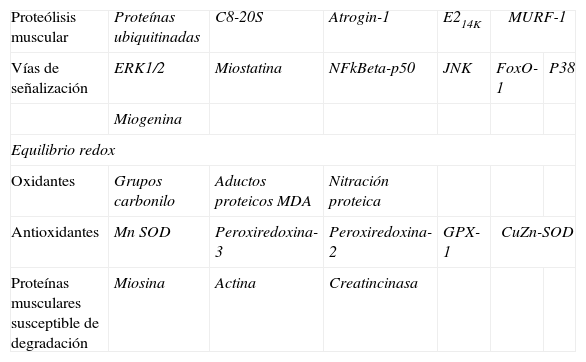
Identificación de marcadores molecularesSe procedió a la determinación de diversos marcadores moleculares de proteólisis, vías de señalización, estrés oxidativo y proteínas musculares en los músculos diafragma y gastrocnemio de los dos grupos de animales mediante la técnica de western-blot, siguiendo exactamente los mismos procedimientos publicados anteriormente por el grupo3–5,7,8. Brevemente, se homogeneizaron las muestras de diafragma y gastrocnemio en un tampón de lisis y se calculó la concentración de proteínas mediante el método de Bradford16. En cada uno de los pozos de los geles se cargó la misma cantidad de proteínas para todas las muestras. Las proteínas fueron sometidas a electroforesis de una dimensión, transferidas a una membrana e incubadas con los anticuerpos primarios descritos a continuación (tabla 1): anti-grupos carbonilo del kit Oxyblot (Chemicon International Inc., Temecula, CA, EE. UU.), anti-nitrotirosina (Invitrogen, Van Allen Way Carlsbad, CA, EE. UU.), anti-aductos proteicos de malondialdehído (MDA, Academy Bio-Medical Company, Inc., Houston, TX, EE. UU.), anti-CuZn-superóxido dismutasa (SOD), anti-Mn-SOD, anti-creatina cinasa, anti-mitogen activated kinase (MAPK), cinasa extracelular (ERK)1/2, anti-fork-head box O (FoxO), anti-c-Jun terminal (JNK), anti-NF-kB p50, anti-MAPK p38, y anti-ligasa atrogin-1 (Santa Cruz Biotechnology, CA, EE. UU.), anti-glutatión peroxidasa-1, anti-peroxiredoxina-2 y anti-peroxiredoxina-3 (AB Frontier, Seúl, Corea), anti-actina (Sigma-Aldrich, St. Louis, MO, EE. UU.), anti-miosina (Upstate, Billerica, MA, EE. UU.), anti-miostatina (Bethyl, Montgomery, TX, EE. UU.), anti-subunidad C8 del complejo 20S del proteasoma (Biomol, Plymouth Meeting, PA, EE. UU.), anti-conjugante E214K y anti-proteínas ubiquitinadas (Boston Biochem, Cambridge, MA, EE. UU.), y anti-ligasa específica muscle ring finger (MURF)-1 (Everest Biotech, Oxfordshire, Reino Unido). Los marcadores analizados en el presente estudio se resumen en la tabla 1. En cada animal y músculo se calcularon las densidades ópticas para cada uno de los parámetros mediante el programa informático Quantity One versión 4.6.5 (Bio-Rad Laboratories, Hercules, CA, EE. UU.). Una vez finalizada la electroforesis de cada marcador, se comprobó la igualdad de carga de proteína para todos los pocillos de los geles mediante la tinción de Coommassie17. En el caso de los marcadores de estrés oxidativo (proteínas carboniladas y nitradas y aductos proteicos de MDA) y de proteólisis (proteínas ubiquitinadas), el valor final en cada uno de los músculos del ratón se obtuvo mediante la suma de las densidades ópticas de todas las bandas proteicas detectadas en cada caso.
Resumen de todos los marcadores analizados en los músculos de los ratones
| Proteólisis muscular | Proteínas ubiquitinadas | C8-20S | Atrogin-1 | E214K | MURF-1 | |
| Vías de señalización | ERK1/2 | Miostatina | NFkBeta-p50 | JNK | FoxO-1 | P38 |
| Miogenina | ||||||
| Equilibrio redox | ||||||
| Oxidantes | Grupos carbonilo | Aductos proteicos MDA | Nitración proteica | |||
| Antioxidantes | Mn SOD | Peroxiredoxina-3 | Peroxiredoxina-2 | GPX-1 | CuZn-SOD | |
| Proteínas musculares susceptible de degradación | Miosina | Actina | Creatincinasa | |||
E214k: enzima conjugante de la ubiquitina E2; ERK1/2: cinasas reguladas por señales extracelulares 2; NF-kBeta p50: factor nuclear kappa beta subunidad p50; JNK: cinasa C-Jun amino terminal que interactúa con la proteína 3; FoxO: fork-head box protein O; MDA: malondialdehído; Mn-SOD: manganeso superóxido dismutasa; GPX: glutatión peroxidasa; CuZn-SOD: cobre-zinc superóxido dismutasa; Atrogin-1: muscle atrophy F-box protein; MURF-1: muscle-specific RING finger protein 1.
Las variables numéricas (porcentajes de cambio de peso y densidades ópticas para cada marcador) se expresan como media y desviación estándar en cada grupo de ratones. La comparación de medias de cada variable entre ambos grupos se realizó mediante la prueba del t-test para muestras independientes. El nivel de significación estadística se estableció a partir de un valor de p<0,05.
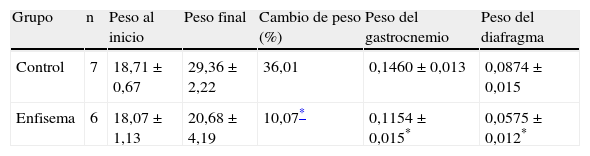
ResultadosCaracterísticas de los animalesEn el presente estudio, la confirmación cualitativa de la presencia de enfisema en los ratones tratados con elastasa respecto de los animales control se realizó mediante técnicas radiológicas (TAC) y la tinción de hematoxilina-eosina (fig. 1A-D, respectivamente). Transcurrido el periodo de estudio (semana 34), la ganancia de peso corporal total de los ratones enfisematosos fue significativamente menor que la ganancia de peso corporal de los ratones control (tabla 2). De igual manera, los pesos de los músculos objeto del presente estudio —diafragma y gastrocnemio— de los ratones enfisematosos fueron también significativamente inferiores a los pesos de los músculos de los ratones control (tabla 2).
Porcentajes correspondientes al cambio en el peso corporal al final del estudio respecto del basal y pesos absolutos de los músculos diafragma y gastrocnemio
| Grupo | n | Peso al inicio | Peso final | Cambio de peso (%) | Peso del gastrocnemio | Peso del diafragma |
| Control | 7 | 18,71±0,67 | 29,36±2,22 | 36,01 | 0,1460±0,013 | 0,0874±0,015 |
| Enfisema | 6 | 18,07±1,13 | 20,68±4,19 | 10,07* | 0,1154±0,015* | 0,0575±0,012* |
n: número de animales.
Los datos se presentan como media±desviación estándar.
En el diafragma y el gastrocnemio de los animales con enfisema, respecto de los animales control, no se observaron diferencias significativas en los niveles totales de proteínas ubiquitinadas, la subunidad C8 del proteasoma, la ligasa E2 atrogin-1, la enzima E214k conjugante de la ubiquitina o la ligasa E3 MURF-1 (tabla 3).
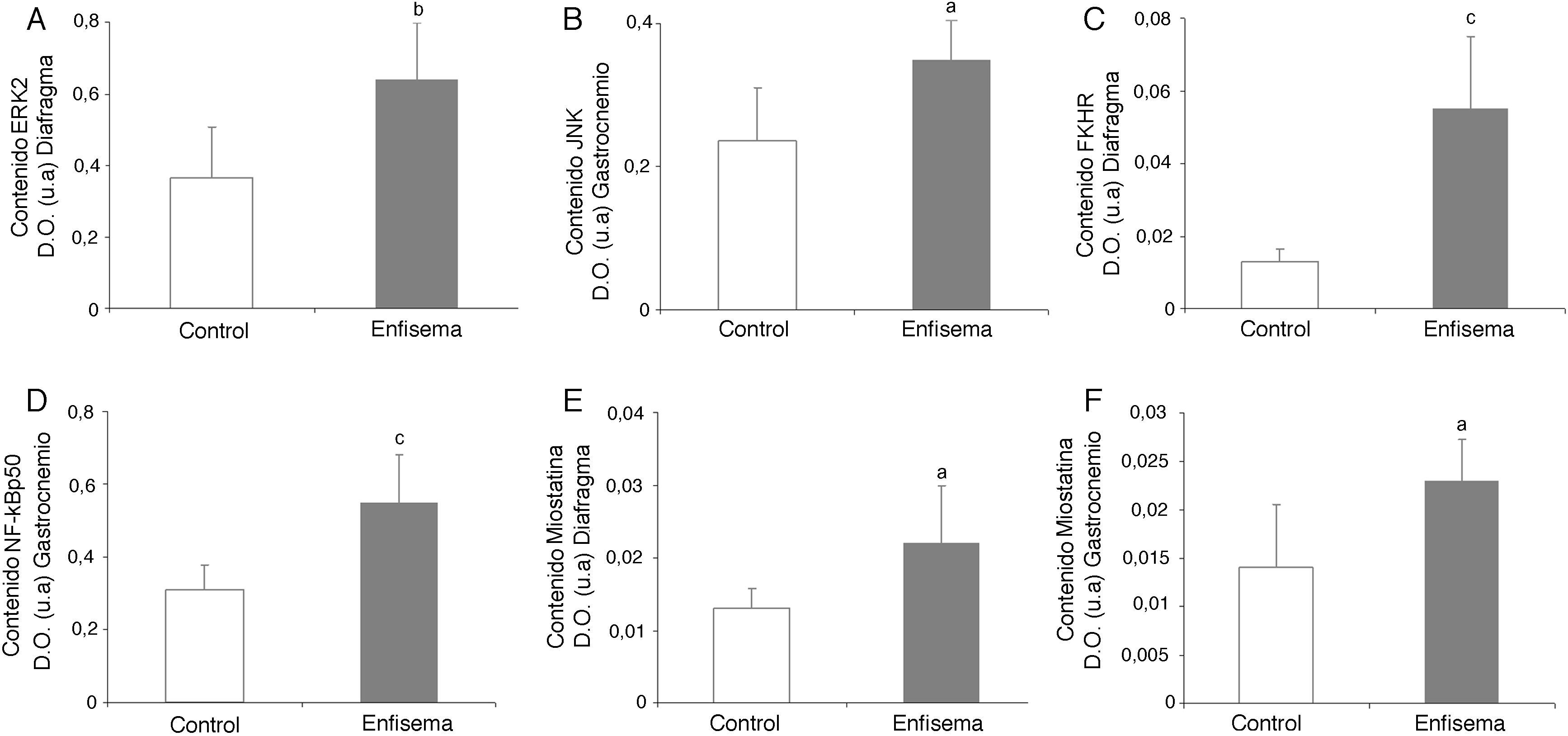
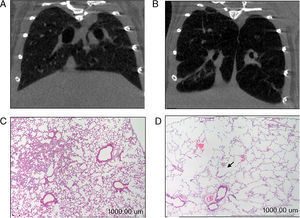
Vías de señalización de proteólisisVía de las MAPKEn el diafragma (fig. 2A), pero no en el gastrocnemio (tabla 3) se observó un incremento significativo de la enzima ERK1/2 en los animales con enfisema respecto de los controles. Los niveles proteicos de la vía JNK fueron superiores en el músculo gastrocnemio de los ratones con enfisema respecto de los controles (fig. 2B), no siendo así en el diafragma (tabla 3). No se detectaron diferencias significativas entre los ratones con enfisema y los controles en ninguno de los músculos por lo que respecta al marcador p38 (tabla 3).
Contenido proteico de marcadores en los músculos de los ratones con enfisema y en los animales control. A) Contenido de cinasas reguladas por señales extracelulares 2 (ERK2) en el músculo diafragma. B) Contenido de forkhead box protein O (FKHR) en el músculo diafragma. C) Contenido de cinasa C-Jun amino terminal que interactúa con la proteína 3 (JNK) en el músculo gastrocnemio. D) Contenido de factor nuclear kappa beta subunidad p50 (NF-kBeta p50) en el músculo gastrocnemio. E) Contenido de miostatina en el músculo diafragma. F) Contenido de miostatina en el músculo gastrocnemio. D.O.: densidad óptica. u.a.: unidades arbitrarias. Valores de media y desviación estándar. ap<0,05; bp<0,01; cp<0,001.
Marcadores moleculares cuyos niveles proteicos no mostraron diferencias significativas entre ambos grupos de animales
| Marcador | Músculo | Control | Enfisema | p |
| Proteólisis muscular | ||||
| Proteínas ubiquitinadas | Diafragma | 0,488±0,134 | 0,526±0,15 | 0,639 |
| Gastrocnemio | 0,457±0,099 | 0,544±0,122 | 0,184 | |
| C8, subunidad 20S | Diafragma | 1,07±0,113 | 1,21±0,131 | 0,065 |
| Gastrocnemio | 1,00±0,106 | 0,84±0,182 | 0,101 | |
| Atrogin-1 | Diafragma | 0,082±0,071 | 0,078±0,042 | 0,912 |
| Gastrocnemio | 0,148±0,048 | 0,142±0,019 | 0,795 | |
| E214K | Diafragma | 0,590±0,15 | 0,480±0,178 | 0,256 |
| Gastrocnemio | 0,363±0,053 | 0,304±0,135 | 0,434 | |
| MURF-1 | Diafragma | 0,364±0,132 | 0,576±0,375 | 0,191 |
| Gastrocnemio | 0,767±0,346 | 0,808±0,134 | 0,797 | |
| Vías de señalización | ||||
| ERK1/2 | Gastrocnemio | 0,603±0,215 | 0,504±0,081 | 0,313 |
| FoxO | Gastrocnemio | 0,058±0,074 | 0,031±0,03 | 0,444 |
| JNK | Diafragma | 0,298±0,085 | 0,284±0,095 | 0,78 |
| NF-kB p50 | Diafragma | 0,225±0,132 | 0,254±0,046 | 0,617 |
| p38 | Diafragma | 0,166±0,041 | 0,152±0,045 | 0,575 |
| Gastrocnemio | 0,099±0,034 | 0,179±0,123 | 0,172 | |
| Miogenina | Gastrocnemio | 0,415±0,168 | 0,503±0,087 | 0,276 |
| Equilibrio redox, oxidantes | ||||
| Grupos carbonilo | Gastrocnemio | 0,198±0,030 | 0,231±0,060 | 0,236 |
| Aductos de MDA | Gastrocnemio | 0,327±0,091 | 0,289±0,042 | 0,367 |
| Nitración proteínas | Diafragma | 0,272±0,096 | 0,330±0,11 | 0,341 |
| Gastrocnemio | 0,439±0,081 | 0,500±0,128 | 0,324 | |
| Equilibrio redox, antioxidantes | ||||
| Mn SOD | Gastrocnemio | 0,204±0,057 | 0,148±0,033 | 0,065 |
| GPX | Diafragma | 0,025±0,019 | 0,027±0,018 | 0,849 |
| Gastrocnemio | 0,026±0,014 | 0,032±0,019 | 0,481 | |
| Peroxiredoxin 2 | Gastrocnemio | 0,467±0,189 | 0,396±0,199 | 0,525 |
| Peroxiredoxin 3 | Diafragma | 0,362±0,13 | 0,357±0,129 | 0,94 |
| Proteínas musculares susceptibles de degradación | ||||
| Miosina | Gastrocnemio | 0,467±0,098 | 0,421±0,083 | 0,734 |
| Actina | Diafragma | 0,171±0,072 | 0,214±0,038 | 0,215 |
| Gastrocnemio | 0,154±0,057 | 0,125±0,062 | 0,403 | |
| Creatina cinasa | Diafragma | 0,208±0,066 | 0,233±0,033 | 0,405 |
| Gastrocnemio | 0,389±0,077 | 0,426±0,074 | 0,397 | |
Los datos se expresan como media±desviación estándar, diferencias entre los dos grupos; densidades ópticas (D.O.) expresadas en forma de unidades arbitrarias (u.a).
E214k: enzima conjugante de la ubiquitina E2; ERK1/2: cinasa reguladas por señales extracelulares; NF-kB p50: factor nuclear kappa beta subunidad p50; JNK: cinasa C-Jun amino terminal que interactúa con la proteína 3; FoxO: fork-head box protein O; MDA: malondialdehído; Mn SOD: manganeso superóxido dismutasa; GPX: glutatión peroxidasa; CuZn SOD: cobre-zinc superóxido dismutasa; Atrogin-1: muscle atrophy F-box protein; MURF-1: muscle-specific RING finger protein 1.
Se observó un incremento significativo de los niveles de FoxO1 en el diafragma de los ratones enfisematosos respecto de los controles (fig. 2C), no resultando ser así en el gastrocnemio (tabla 3).
Vía del NF-kBLos niveles del factor de transcripción p50 fueron superiores en el gastrocnemio de los ratones enfisematosos respecto de los controles (fig. 2D), pero no en el diafragma (tabla 3).
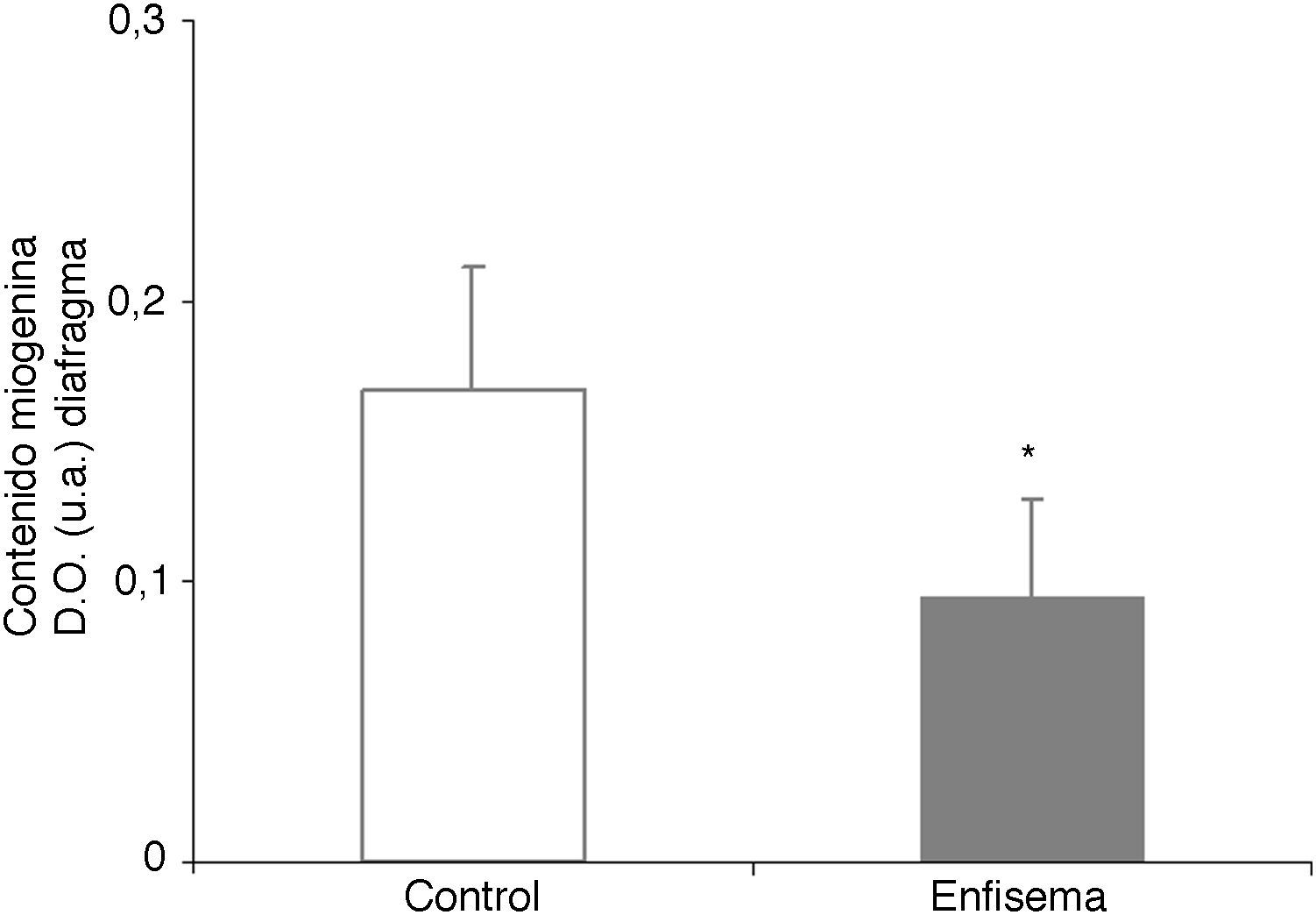
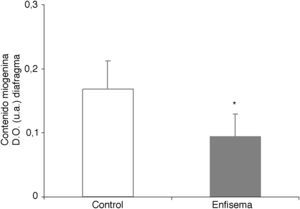
Crecimiento y diferenciación muscularMientras que los niveles proteicos de miostatina fueron superiores en el diafragma y el gastrocnemio de los ratones con enfisema (fig. 2E-F), los niveles del factor de transcripción miogenina resultaron ser inferiores solo en el diafragma (fig. 3), pero no en el gastrocnemio de dichos ratones (tabla 3).
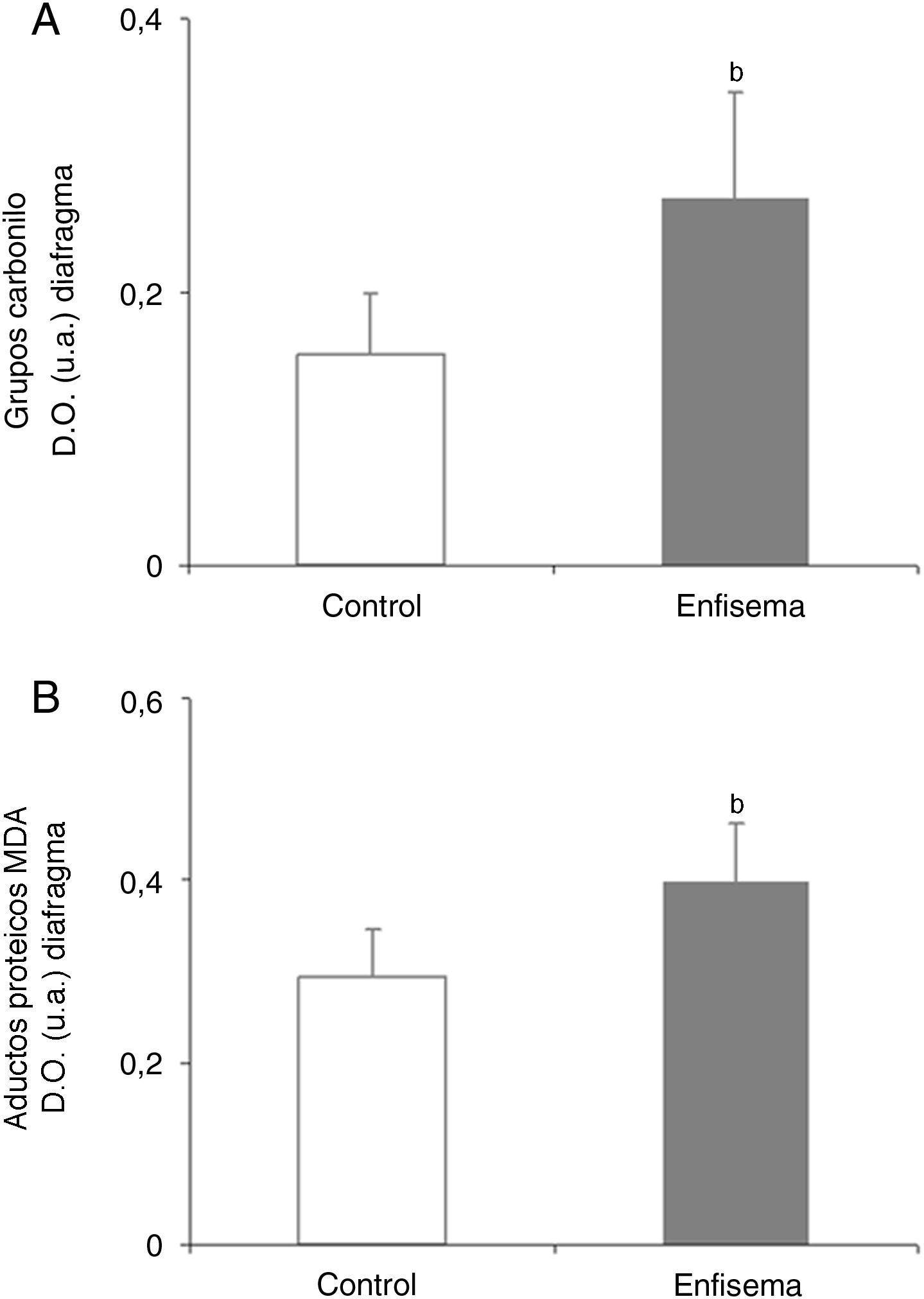
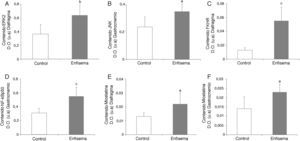
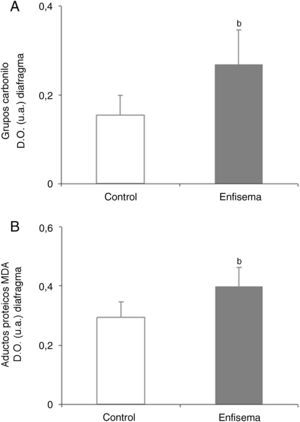
Equilibrio redoxOxidación proteicaLos niveles totales de proteínas carboniladas y de aductos proteicos de MDA fueron superiores en el diafragma de los ratones enfisematosos que en los controles (fig. 4A-B), mientras que no se observaron diferencias en estos marcadores en el gastrocnemio de ambos grupos de animales (tabla 3).
Contenido proteico de marcadores de estrés oxidativo en el diafragma de los ratones con enfisema y en los animales control. A) Contenido de grupos carbonilo en el músculo diafragma. B) Contenido de aductos proteicos de malondialdehído (MDA) en el músculo diafragma. D.O.: densidad óptica. u.a.: unidades arbitrarias. Valores de media y desviación estándar. *p<0,01.
No se observaron diferencias significativas en los niveles de nitración proteica en los músculos diafragma y gastrocnemio entre los ratones con enfisema y los controles (tabla 3).
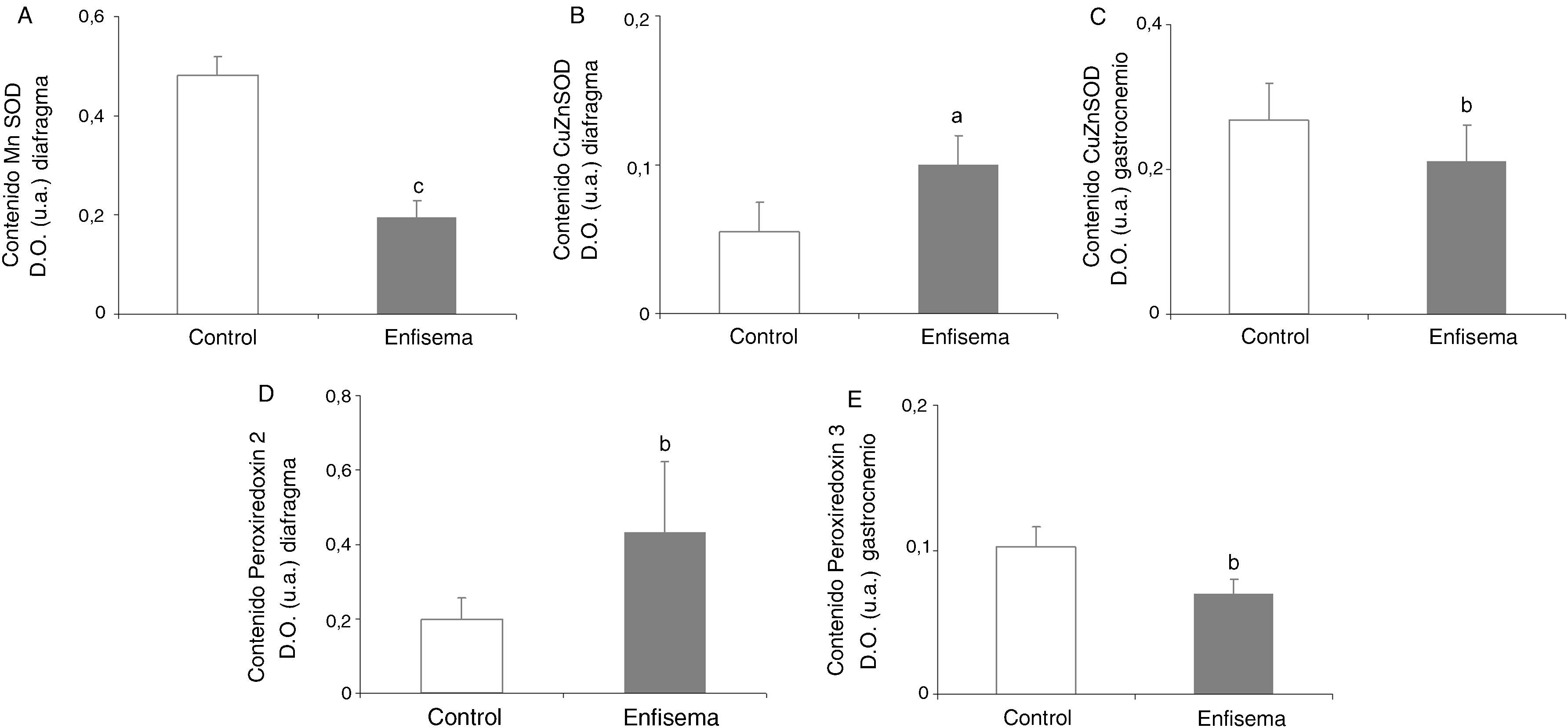
Antioxidantes: superóxido dismutasasSe observó una disminución significativa del contenido de Mn-SOD en el diafragma de los ratones con enfisema respecto de los controles (fig. 5A), sin diferencias entre grupos en el gastrocnemio (tabla 3). Los niveles proteicos de CuZn-SOD fueron superiores en el diafragma de los ratones con enfisema respecto de los controles (fig. 5B), mientras que se observó una disminución significativa en el contenido de dicha enzima en el gastrocnemio (fig. 5C).
Contenido proteico de marcadores de estrés oxidativo en los músculos de los ratones con enfisema y en los animales control. A) Contenido de manganeso superóxido dismutasa (Mn-SOD) en el músculo diafragma. B) Contenido de cobre-zinc superóxido dismutasa (CuZn-SOD) en el músculo diafragma. C) Contenido de cobre-zinc superóxido dismutasa (CuZn-SOD) en el músculo gastrocnemio. D) Contenido de peroxiredoxina 2 en el músculo diafragma. E) Contenido de peroxiredoxina 3 en el músculo gastrocnemio. D.O.: densidad óptica. u.a.: unidades arbitrarias. Valores de media y desviación estándar. ap<0,05; bp<0,01; cp<0,001.
Se observó un aumento significativo de los niveles de la peroxiredoxina-2 en el diafragma de los ratones con enfisema en comparación con los controles (fig. 5D y tabla 3). Los niveles proteicos de peroxiredoxina-3 fueron inferiores en el gastrocnemio de los ratones con enfisema (fig. 5E), pero no en el diafragma (tabla 3). En el diafragma y el gastrocnemio no se observaron diferencias significativas entre ambos grupos de animales en relación a los niveles proteicos de la glutatión peroxidasa-1 (tabla 3).
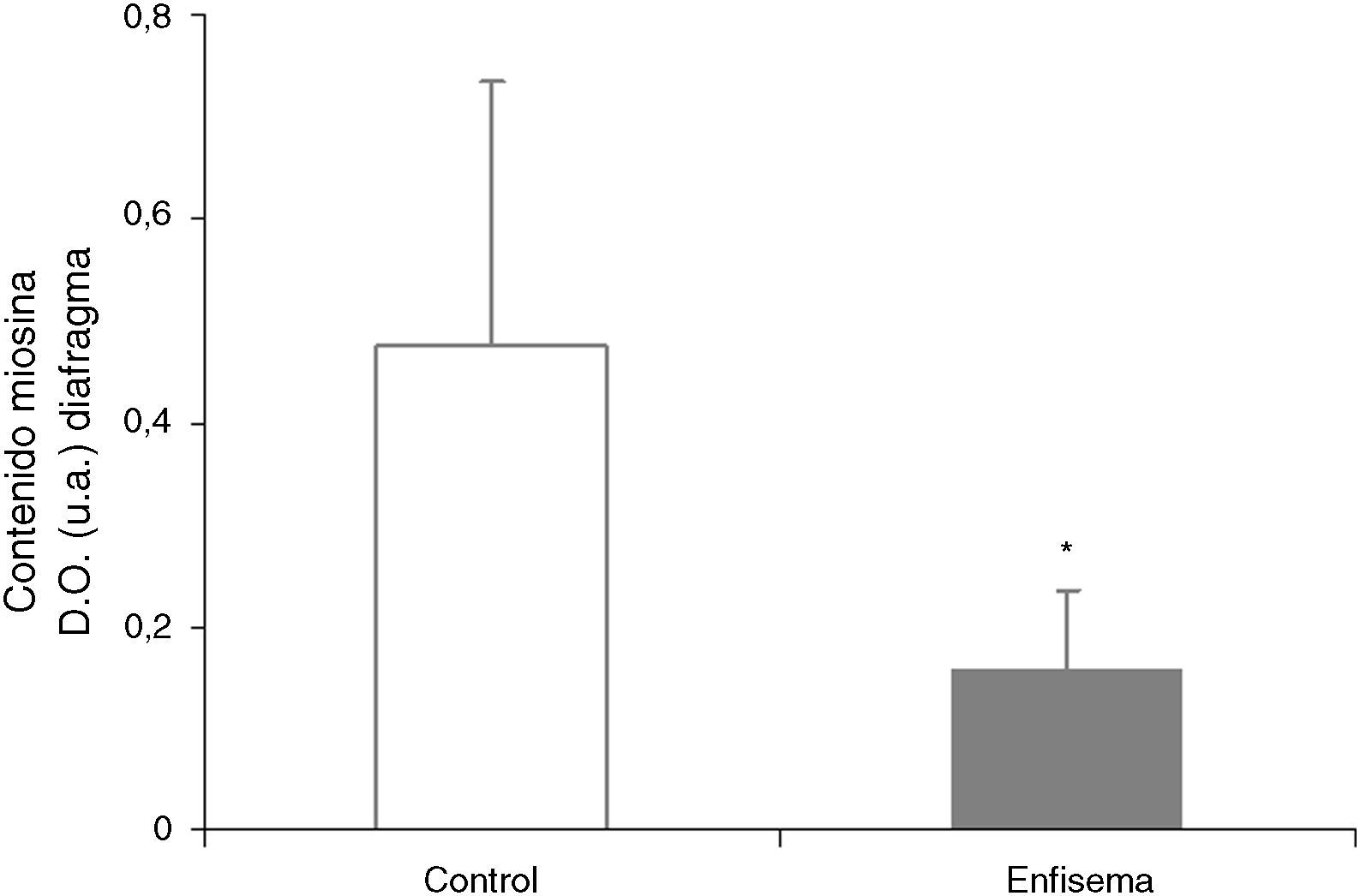
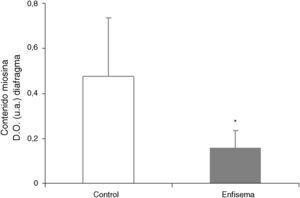
Proteínas musculares susceptibles de degradaciónSe observó una disminución significativa de los niveles de miosina (67%) en el diafragma de los ratones con enfisema respecto de los controles (fig. 6), pero no en el gastrocnemio (tabla 3). Los niveles proteicos de actina y creatincinasa no mostraron diferencias significativas entre ambos grupos de animales en el músculo respiratorio o periférico (tabla 3).
DiscusiónLos hallazgos más destacables de la presente investigación se resumen a continuación. En el diafragma de los ratones con enfisema, respecto de los animales control se observó: a) pérdida del contenido de proteínas estructurales como la miosina; b) incremento de los niveles proteicos de importantes vías de señalización celular como la miostatina, las MAPK y el factor de transcripción FoxO1; c) descenso de los niveles de miogenina, y d) aumento de los niveles de oxidación proteica, una disminución de los antioxidantes mitocondriales y un aumento de los mismos en el citosol. En el músculo periférico los hallazgos más relevantes fueron: a) aumento de factores de transcripción implicados en la atrofia como la miostatina; b) incremento de los niveles proteicos de componentes de las vías de señalización celular JNK y NF-kB, y c) disminución en los niveles del antioxidante peroxiredoxina-3.
El modelo experimental utilizado en el presente estudio podría considerarse como un modelo de enfisema que comparte características, en cierta forma, con la pérdida de masa muscular de los pacientes con EPOC. Así, en los ratones a los que se les había inducido el enfisema mediante la instilación de elastasa, se observó una menor ganancia de peso corporal total a lo largo del período de estudio, respecto de los animales control. Además, los músculos diafragma y gastrocnemio fueron de menor tamaño en los animales enfermos que en los controles. En el presente estudio consideramos de interés identificar los mecanismos moleculares que condujeron a una menor ganancia de peso corporal total y a un menor desarrollo de masa muscular en los ratones con enfisema. Cabe la posibilidad de que los mecanismos moleculares puedan corresponderse con los subyacentes en los músculos de los pacientes con EPOC y caquexia. De ser así, el presente modelo animal podría resultar de gran interés para el diseño de dianas terapéuticas encaminadas a paliar la caquexia de los pacientes con EPOC en un futuro cercano. Tras el análisis de los niveles proteicos de diferentes marcadores que podrían estar involucrados en los mecanismos causantes de esta caquexia en los ratones con enfisema, es posible observar que los músculos diafragma y gastrocnemio presentan diferentes patrones, que se exponen a continuación.
Vías de señalización y proteólisisEn el diafragma de los ratones enfisematosos se ha observado un aumento de los niveles proteicos de FoxO1, factor de transcripción implicado en la vía del IGF-1/AKT y regulador de la expresión de genes implicados en vías de degradación proteica y atrofia muscular, como atrogin-118,19. En un estudio previo20, en el que se generaron ratones transgénicos caracterizados por sobreexpresar FoxO1, se observó una pérdida de peso respecto de los ratones control y una disminución en la masa de diversos músculos de las extremidades20. Así mismo se detectó que la expresión de los genes relacionados con las proteínas estructurales de las fibras tipo I estaba disminuida20. Desde un punto de vista histológico se observó una disminución del tamaño de las fibras tipo I y II, un decremento del porcentaje de fibras tipo I, detectándose además un aumento del catabolismo proteico20. En el diafragma de pacientes con EPOC también se puso de manifiesto un aumento de la expresión de FoxO12, así como en el diafragma de pacientes expuestos a ventilación mecánica prolongada13. Sin embargo, los niveles de FoxO en el músculo periférico de los ratones con enfisema no resultaron ser diferentes de los de los animales control. Se podría concluir que el factor de transcripción FoxO parece jugar un papel relevante en la señalización de una degradación proteica aumentada en el músculo esquelético en modelos murinos experimentales y en los pacientes con EPOC.
Se han descrito 4 subfamilias de la vía de las MAPK: ERK1/2, JNK, ERK5 y p38. Esta vía de señalización está implicada, entre diversas funciones celulares, en la degradación de proteínas21. Respecto de los animales control, los niveles de ERK1/2 fueron significativamente más elevados en los diafragmas de los ratones con enfisema, mientras que los niveles de JNK resultaron ser mayores en el gastrocnemio de los mismos animales. En modelos experimentales se ha implicado tanto a JNK como a ERK1/2 en la señalización de sistemas de proteólisis celular21. Sin embargo, en una investigación reciente de nuestro grupo (observaciones no publicadas) se ha demostrado que la vía señalización de MAPK no estaba alterada en el cuádriceps de pacientes con EPOC avanzada.
Por otra parte, se ha observado también un aumento de los niveles proteicos de la subunidad p50 de la vía del NF-kB en el músculo periférico, no siendo así en el diafragma. La vía del NF-kB/IKKB ha sido ampliamente estudiada y, entre múltiples funciones, se ha descrito su implicación directa en procesos y enfermedades que cursan con una disminución de masa muscular y atrofia22. Así, la pérdida de masa muscular observada en el gastrocnemio de los ratones enfisematosos podría estar también mediada por esta vía de señalización. Estos datos se corresponden con otros publicados en un estudio en el que se demostró un aumento de la señalización mediante la vía del NF-kB en el vasto lateral de pacientes con EPOC grave y pérdida de masa muscular23. Otro trabajo reciente24 también ha puesto de manifiesto un aumento de la expresión del NF-kB en el diafragma de pacientes con EPOC grave. En resumen, esta vía de señalización parece jugar un papel clave en el proceso de proteólisis muscular en modelos experimentales y en los músculos respiratorios y periféricos de pacientes con EPOC avanzada.
En el diafragma, pero no en el gastrocnemio, de los ratones con enfisema respecto de los animales control, los niveles del factor de crecimiento muscular miogenina estaban disminuidos, mientras que los de miostatina estaban aumentados. Estos resultados se corresponden claramente con los obtenidos en un estudio muy reciente24, en el cual se reportó un decremento de los niveles de miogenina y un aumento de los de miostatina en el diafragma de pacientes con EPOC grave y muy grave. La miostatina es un potente inhibidor del crecimiento de la masa muscular y se cree que podría inhibir la proliferación y la diferenciación de las células musculares precursoras, que a su vez podrían tener capacidad para regular positivamente la degradación de proteínas mediante el sistema ubiquitina-proteasoma24–26. Por otra parte, la miogenina es un factor de crecimiento que favorece la proliferación y la diferenciación de las fibras musculares. Datos recientes (observaciones no publicadas) han revelado hallazgos muy similares en el vasto lateral de pacientes con EPOC grave y pérdida de masa muscular por lo que respecta a los niveles de miostatina y de miogenina en dichos músculos. Cabe tener en cuenta, de hecho, que el presente estudio obedece a un modelo de menor aumento del tamaño de peso corporal y de masa de los músculos en los ratones enfermos y no a un modelo de pérdida de peso. En este sentido, el aumento de los niveles del inhibidor del crecimiento muscular miostatina junto con la disminución de los niveles del factor potenciador del crecimiento muscular miogenina parece guardar coherencia con el modelo experimental de menor ganancia de peso y músculo del presente estudio.
Uno de los hallazgos más relevantes de la presente investigación lo constituye la disminución significativa en el contenido de la proteína contráctil miosina del músculo respiratorio —pero no en el periférico— de los ratones con enfisema respecto de sus controles. Cabe añadir también que en los ratones con enfisema, respecto de los controles, el porcentaje de no ganancia de masa muscular en el diafragma fue del 34%, mientras que en el gastrocnemio resultó ser del 21%. Estas diferencias entre ambos músculos, dentro del mismo grupo de ratones, también podrían explicar el porqué de la disminución de los niveles de miogenina y de miosina solo en los músculos respiratorios en los ratones con enfisema respecto de los animales control, hallazgos que no pueden observarse en el músculo periférico.
Por lo que respecta a la ausencia de diferencias en el contenido de otras proteínas estructurales, aparte de la miosina, también analizadas en el presente estudio, cabe señalar que los hallazgos son similares a los descritos en trabajos previos del grupo basados en el estudio del diafragma7 y el vasto lateral (observaciones no publicadas) de pacientes con EPOC grave. De hecho, mediante microscopia electrónica, en los músculos respiratorios y periféricos del paciente crítico recientemente se ha establecido la existencia de una miopatía que afecta exclusivamente a los filamentos gruesos de la estructura de la sarcómera, es decir a los filamentos de miosina, y no a los de actina. Esta entidad se conoce clásicamente como la miopatía de los filamentos gruesos27. Por analogía a la miopatía que afecta en exclusiva a los filamentos gruesos de la sarcómera de pacientes en estado crítico, cabe plantearse que el menor contenido de miosina detectado en el diafragma de los ratones con enfisema del presente modelo está en la misma línea argumental. Si bien en el presente trabajo no se ha tenido acceso al estudio de la estructura muscular por las limitaciones esgrimidas más abajo (véase «Limitaciones del estudio»), cabe pensar que de producirse alteraciones estructurales en el diafragma de los ratones con enfisema, estas afectarían también muy probablemente a los filamentos de miosina.
Es preciso comentar también que en el presente estudio no se han observado diferencias entre los dos grupos de ratones respecto a las vías de proteólisis analizadas (proteínas ubiquitinadas). Conviene destacar que el hecho de no haber observado diferencias en los marcadores de proteólisis analizados en el presente estudio y sí en las vías de señalización conduce a pensar que en los músculos de los ratones con enfisema podrían estar implicados otros mecanismos de degradación proteica, como las proteasas activadas por calcio, los lisosomas y la autofagia. Por razones relacionadas con el tamaño de los especímenes musculares, dichos sistemas de proteólisis no han sido analizados en la presente investigación, si bien podrían ser objeto de estudio en investigaciones posteriores.
Estrés oxidativoEl presente estudio también pone de manifiesto un incremento de los niveles totales de oxidación (proteínas carboniladas y aductos proteicos de MDA) de proteínas musculares en el diafragma, pero no en el gastrocnemio, de los ratones enfermos respecto de sus controles. Estos resultados se corresponden con los obtenidos en estudios previos de nuestro grupo5,7, en los cuales se demostró que los diafragmas de pacientes con EPOC mostraron un aumento de los niveles de oxidación proteica en sus diafragmas5, y que dichas proteínas resultaron ser la creatincinasa, la anhidrasa carbónica III, la actina y la miosina7. Dado que las proteínas carboniladas y los aductos proteicos de MDA son potentes marcadores de estrés oxidativo, cabría concluir que el diafragma de los ratones enfisematosos del presente estudio muestra un claro aumento de los niveles de oxidación proteica. Ello puede obedecer a las contracciones musculares continuadas e intensas a las que se ha visto sometido este músculo en los ratones con enfisema a lo largo de todo el período de estudio. Por otro lado, la relativamente escasa actividad del músculo periférico, por oposición al diafragma, especialmente en los animales portadores de enfisema, podría explicar la ausencia de alteraciones en los niveles de estrés oxidativo en el músculo de las extremidades en dichos animales.
El contenido del antioxidante mitocondrial Mn-SOD estaba disminuido en los diafragmas de los ratones enfermos, concluyendo así que los sistemas antioxidantes mitocondriales se encontraban afectados en el músculo respiratorio. Ello podría contribuir a un incremento en la producción de oxidantes en el compartimento mitocondrial, ya que los sistemas antioxidantes disminuidos no tendrían suficiente capacidad para neutralizar la abundante producción de radicales oxigenados en el diafragma de los ratones con enfisema, sometidos crónicamente a elevadas cargas respiratorias. Esto resultaría, por tanto, en un equilibrio a favor de los oxidantes. Conviene destacar que en pacientes con EPOC, los niveles de Mn-SOD y catalasa no se vieron modificados en el diafragma de pacientes con EPOC grave respecto de los controles sanos5. En el caso de los sistemas antioxidantes citoplasmáticos como son la CuZn-SOD y la peroxiredoxina-2 se observó un aumento de los niveles proteicos de estos en el diafragma de los ratones enfermos. Esto podría ser debido al intento por parte de los sistemas antioxidantes celulares de neutralizar el exceso de oxidantes pero sin lograrlo totalmente, dado que se produjo un aumento final de los niveles de oxidación proteica.
Hay que destacar, por otro lado, que la moderada reducción en el contenido de algunos de los sistemas antioxidantes citosólicos en el gastrocnemio de los animales enfermos no tuvo repercusión en el equilibrio redox final de los músculos periféricos. Estos hallazgos contrastan con los reportados en el cuádriceps de pacientes con EPOC, donde se ha puesto de manifiesto un aumento en el contenido de los enzimas antioxidantes Mn-SOD y CuZn-SOD3,8. Las diferencias en el metabolismo celular y en la actividad muscular entre el modelo murino y los pacientes con EPOC podrían explicar las disimilitudes en el contenido de las diversas enzimas antioxidantes, así como en el equilibrio redox final observado en cada músculo.
Limitaciones del estudioHe aquí las limitaciones más destacables del presente estudio: En primer lugar, debido a la falta —por razones de tamaño de las muestras musculares en el ratón— de preparaciones histológicas de ambos músculos, no ha sido posible analizar las posibles alteraciones estructurales, como la composición fibrilar de cada músculo, así como sus tamaños. En segundo lugar —también por razones logísticas experimentales relacionadas con el tamaño de los animales—, tampoco se ha podido valorar la función muscular de los animales. Dadas las limitaciones del tamaño de los especímenes, en el presente estudio se priorizó de forma absoluta, en una primera instancia, la determinación de forma exhaustiva de los mecanismos moleculares potencialmente implicados en la pérdida de masa muscular en este modelo de enfisema pulmonar experimental. Una vez identificados los mecanismos moleculares más predominantes y verificada la existencia de alteraciones moleculares en los músculos de ratones portadores de un enfisema experimental será posible, en futuros estudios, destinar gran parte de las muestras a describir potenciales alteraciones estructurales presentes en los músculos respiratorios y periféricos en ratones con enfisema.
ConclusionesLa reducción del contenido en miosina observado en el diafragma de ratones con enfisema podría explicar su menor tamaño en estos animales. El estrés oxidativo, la miostatina y otras vías de señalización celular como FoxO parecen estar implicados en la pérdida de esta proteína estructural en el músculo respiratorio. Las diferencias en el metabolismo y la actividad entre el músculo respiratorio, sometido a contracciones continuadas durante todo el período de estudio, y el de las extremidades, con relativa escasa actividad, podrían explicar las disimilitudes encontradas en cuanto al contenido de miosina, los niveles de estrés oxidativo y los de las vías de señalización, así como el grado de pérdida de masa muscular en cada tipo de músculo.
FinanciaciónEl estudio ha sido subvencionado por SEPAR 2009, MTV3-07-1010, 2009-SGR-393, FIS 06/1043, FIS 07/0751 (FIS), CIBERES y RTICC RD06/0020/0066 (ISCIII, Ministerio de Ciencia e Innovación), y UTE-Proyecto CIMA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean agradecer de forma muy especial la inestimable colaboración de los investigadores Prof. Luis M. Montuenga, Dr. David Blanco y Licenciado Gabriel de Biurrun, del Laboratorio de Biomarcadores (Área de Oncología, Centro de Investigación Médica Aplicada, Universidad de Navarra, Pamplona, Navarra) por el desarrollo del modelo experimental, la cesión de las muestras musculares y la lectura crítica del manuscrito.