La ciclooxigenasa 2 (COX-2) está aumentada en la inflamación y en el cáncer. En este estudio se evaluó la expresión de la COX-2 en el pulmón y en el cáncer bronquial de pacientes con EPOC.
MétodosSe estudiaron 44 pacientes varones con cáncer bronquial (27 escamosos y 17 adenocarcinomas). Se obtuvieron muestras del parénquima pulmonar, de la mucosa bronquial adyacente al tumor y del tumor mismo. El tejido pulmonar de 14 pacientes con neumotórax se empleó como control. El ARNm y la proteína de la COX-1 y de la COX-2 se midieron mediante RT-PCR y western blot, respectivamente.
ResultadosLos niveles de ARNm de la COX-1 y de la COX -2 en el parénquima de los pacientes con EPOC fueron superiores a los de los controles. Los niveles del ARNm de la COX-2 en pacientes con EPOC fueron más altos en el parénquima pulmonar que en las vías aéreas y los tumores. No hubo diferencias en los niveles del ARNm de la COX-2 entre escamosos y adenocarcinomas. En contraste, la proteína de COX-2 mostró niveles más altos en los tumores que en el parénquima y las vías aéreas. Los niveles de la proteína de COX-2 fueron más altos en los adenocarcinomas que en los carcinomas escamosos.
ConclusiónEste estudio muestra que en la EPOC la vía de la ciclooxigenasa está activada y asociada a un aumento en la expresión de la COX-2 en los tumores. Cabe la posibilidad de que la COX-2 esté involucrada en la asociación de EPOC y cáncer.
The expression of cyclooxygenase 2 (COX-2) is usually increased in inflammation and cancer. This study examines the expression of COX-2 in the lung of chronic obstructive pulmonary disease (COPD) patients with lung cancer.
MethodsWe studied 44 male patients with bronchial cancer (27 squamous carcinoma and 17 adenocarcinoma). Samples were obtained from the pulmonary parenchyma, from the bronchial mucosa adjacent to the tumor and from the tumor itself. Lung tissue specimens from 14 patients with pneumothorax were used as control. The mRNA and the COX-1 and COX-2 proteins were assessed by RT-PCR and Western blot, respectively.
ResultsCOX-1 and COX-2 mRNA levels were significantly higher in the lung parenchyma of COPD patients than in the control subjects. COX-2 mRNA levels were also higher in the lung parenchyma than in both tumor and airway tissue samples procured from COPD patients. There were no differences in the COX-2 mRNA levels between squamous carcinoma and adenocarcinoma. In contrast, COX-2 protein levels were significantly higher in tumors than in lung parenchyma and airways. COX-2 protein levels were higher in adenocarcinoma compared with squamous carcinoma.
ConclusionThis study shows that in COPD, the pathway of cyclooxygenase is activated and associated with an increase in the expression of COX-2 in lung tumors. These observations suggest that COX-2 is possibly involved in the association between COPD and cancer.
Una abundante información científica avala la existencia de una relación entre inflamación e iniciación y progreso de varios tipos de cánceres, entre ellos el cáncer bronquial1. Es también conocido que la enfermedad pulmonar obstructiva crónica (EPOC) y el cáncer bronquial están estrechamente relacionadas con el hábito tabáquico. El tabaco podría ser el nexo de unión que explicara esta asociación, ya que se considera que es el responsable común de ambos procesos. Sin embargo, varios estudios han mostrado que la gravedad de la obstrucción bronquial, valorada mediante la medida del volumen espirado en el primer segundo (FEV1), es un factor independiente para el desarrollo de cáncer bronquial en los fumadores2-4. Esta observación sugiere que existe una conexión entre las dos enfermedades que podría ser independiente de la acción del tabaco. Dado que el inicio del cáncer está asociado a la inflamación crónica y la EPOC es una enfermedad inflamatoria de las vías aéreas, es posible que el proceso inflamatorio presente en los fumadores que desarrollan obstrucción bronquial sea el nexo de unión entre EPOC y cáncer. Diversos estudios señalan a los mediadores inflamatorios lipídicos entre los posibles responsables de la relación entre inflamación y cáncer.
Los mediadores lipídicos se forman en los procesos inflamatorios a partir del ácido araquidónico (AA). El AA se libera desde los depósitos de fosfolípidos por la acción de la fosfolipasa A2, la cual puede ser activada por diversos estímulos, entre los que se incluyen citocinas, microorganismos y lesiones celulares de diversa índole. El AA puede ser metabolizado por tres vías principales: la de las ciclooxigenasas (COX), la de las lipooxigenasas y la del cromosoma P450, por medio de las cuales se forma una familia de productos denominados eicosanoides. La familia de los eicosanoides incluye a las prostaglandinas (PG) formadas por la acción de las COX. Existen dos tipos de COX que participan en la síntesis de PG: la COX-1 y la COX-2. La COX-1 está normalmente presente en las células y se encarga de funciones fisiológicas; en cambio, la COX-2 suele ser indetectable en situaciones de normalidad, pero es rápidamente inducida en las células cuando son sometidas a estímulos inflamatorios5.
Los prostaglandinas generadas por las dos enzimas COX son la PGD2, la PGE2 y la PGF2α. Todas ellas participan en la regulación de las respuestas inflamatorias5.
La expresión de la COX-2 está aumentada en diversos cánceres humanos, entre ellos el cáncer bronquial. El aumento en la expresión de la COX-2 lleva a un incremento en la producción de PGE2, hecho que se ha demostrado en el cáncer colonorrectal, en el de páncreas y en el del pulmón6. La PGE2 estimula la angiogénesis, la invasión celular, la formación de metástasis y la sobrevivencia celular, esta última inhibiendo la apoptosis6,7.
Estudios previos han demostrado en los pacientes con EPOC un aumento en la producción de PGE2 asociado a una regulación al alza de la COX-28,9. Otra observación interesante es que fumar tabaco también aumenta la expresión de COX-2 y la producción de PGE210,11.
Tomando en cuenta todos estos datos y asociándolos a la conocida interdependencia que existe entre fumar, EPOC y cáncer bronquial, se puede plantear la posibilidad de que la inducción de la COX-2, junto al aumento en la producción de PGE2, pudiera ser el nexo de unión de todos ellos.
En este estudio establecimos la hipótesis de que a los fumadores que presentan una inflamación bronquial asociada a EPOC, la producción aumentada de PGE2 les predispone a desarrollar un cáncer bronquial. Dado que el aumento de la PGE2 se asocia a un incremento en la expresión de la COX-2, nos propusimos estudiar la expresión de esta enzima en el tejido tumoral, en la mucosa bronquial adyacente al tumor y en el parénquima pulmonar distal a la zona de invasión tumoral.
Los objetivos concretos del estudio son: a) Evaluar y comparar la expresión de la COX-2 en el pulmón de pacientes con EPOC y de sujetos no afectados de EPOC. b) Evaluar y comparar la expresión de la COX-2 en el parénquima pulmonar, las vías aéreas y el tejido pulmonar de pacientes con EPOC y cáncer bronquial. c) Analizar y comparar la expresión de la COX-2 en relación al tipo histológico del cáncer bronquial, así como su relación con el grado de extensión del proceso.
MétodosPacientesUn total de 44 pacientes varones, fumadores o ex fumadores, con una edad de 65±6 (media±desviación típica) años y con cáncer bronquial, que eran sometidos a una resección pulmonar, fueron incluidos en el estudio. La clasificación histológica de los tumores y el grado de extensión de estos se llevó a cabo según las normativas establecidas para ello12,13. Veintisiete tumores se clasificaron como escamosos y 17 como adenocarcinomas. El estudio de extensión de los tumores permitió clasificarlos en: estadio IB, 29 pacientes; estadio IIA, 5 pacientes; estadio IIB, 1 paciente; estadio IIIA, 6 pacientes, y estadio IIIB, 4 pacientes. Todos los pacientes presentaban una historia de bronquitis crónica de varios años de evolución. El estudio de la función pulmonar mostró que la mayoría padecían obstrucción bronquial. El FEV1 del conjunto de los 44 pacientes fue de 60±12% del valor teórico. Cuarenta y dos de los 44 pacientes cumplían con los criterios que permitían clasificarlos como afectados de EPOC. Los dos pacientes no diagnosticados de EPOC no fueron excluidos del estudio, dada su historia de broncopatía crónica14.
Como población control se tomó un grupo de 14 pacientes varones no fumadores con una edad media de 34±6 años que fueron sometidos a una intervención quirúrgica con la finalidad de tratar un neumotórax espontáneo recidivante. La edad del grupo control fue significativamente más baja (p<0,05) que el grupo de pacientes EPOC con cáncer bronquial. Ninguno de los sujetos control fueron explorados mediante espirometría, por lo que, aunque muy improbable, no se puede descartar que alguno de ellos sufriera una enfermedad obstructiva no detectada previamente.
El estudio fue aprobado por el Comité Ético de nuestra institución y todos los pacientes firmaron un consentimiento informado en el que aceptaban el uso de las muestras obtenidas para los fines del estudio
Procesamiento de las muestras de tejidosSe obtuvieron muestras del tumor, de la zona adyacente del bronquio libre de cáncer y del parénquima pulmonar más distal posible al tumor. Las muestras tumorales se obtuvieron de zonas sin aspecto necrótico. Las muestras de tejido de los sujetos controles que estaban afectados de neumotórax se obtuvo de la zona pulmonar cercana a la resecada en la intervención. Las muestras se congelaron inmediatamente en nitrógeno líquido y se guardaron a –80¿C de temperatura hasta su procesamiento y análisis.
Aislamiento del ARN, transcripción reversa (RT) y reacción en cadena de la polimerasa (PCR)Las muestras de tejido congelado se homogenizaron y el ácido ribonucleico (ARN) total se aisló mediante un método de extracción comercial (TRI-reagent, MRC, Cincinnati, Ohio). La integridad del ARN y la transcripción reversa del ARN total a ADN se realizó según un método descrito en detalle anteriormente14. La expresión del ARN mensajero (ARNm) de la COX-1 y la COX-2 se analizó mediante RT-PCR semicuantitativa con cebadores y condiciones de reacción publicados anteriormente15.
Western BlottingCincuenta y cinco microgramos de proteína de cada muestra se analizaron en geles de electroforesis de sulfato de poliacrilamida empleando el Novex X-cell II® System y un gel de separación de tris acetato al 7%. Las proteínas, una vez separadas, eran transferidas a membranas de nitrocelulosa. La tinción de las membranas se realizaba mediante Ponceau S (Sigma Chemical, St Louis, MO) con el fin de evaluar la equivalencia en la carga de cada muestra y en la transferencia del gel. Después de bloquear con leche en polvo al 5% disuelta en PBS al 0,05% conteniendo Tween 20 al 1%, las membranas se incubaban con un anticuerpo policlonal de cabra anti COX-1 o COX-2 humanos (Santa Cruz). Las membranas se incubaban con un anticuerpo secundario de cabra para COX-1 y COX-2 conjugado con peroxidasa (Santa Cruz). Posteriormente las membranas se procesaban usando reactivos de detección mediante quimioluminiscencia (Pierce SuperSignal chemiluminescent detection reagents, Pierce Technology, Rockford, IL) de acuerdo a las instrucciones del proveedor y usando una película quimioluminiscente (Hyperfilm NAECL, Amersham). La intensidad de la señal de cada banda en el fluorograma se cuantificó mediante un sistema de escaneado densitométrico (BIO1-D program). La valoración y la comparación de la cantidad de las proteínas se realizaron tras la normalización con los valores densitométricos obtenidos mediante el escaneado de estándares de COX-1 y COX-2 que eran cargados en el mismo momento en que se hacía lo propio con las proteínas de las muestras a estudiar. Los resultados obtenidos se expresan como porcentaje de cambio en la densidad óptica (DO).
Análisis estadísticoLos valores medios de ARNm y proteína de la COX-1 y de la COX-2 de los tres grupos se compararon mediante un test de Kruskal-Wallis: En el caso de mostrarse diferencias estadísticamente significativas, se analizaban las diferencias entre grupos empleando el test de la U de Mann-Whitney. La correlación entre la edad de los pacientes y el FEV1 con los niveles de expresión del ARNm y la proteína de la COX-1 y de la COX-2 se analizaron mediante el test de Spearman. Por su parte, la relación entre el grado de extensión de la enfermedad y los valores del ARNm y la proteína de la COX-1 y de la COX-2 se analizó mediante el test de Pearson. Los datos se muestran como media±desviación típica de la media. Una p<0,05 se aceptó como límite para la significación estadística.
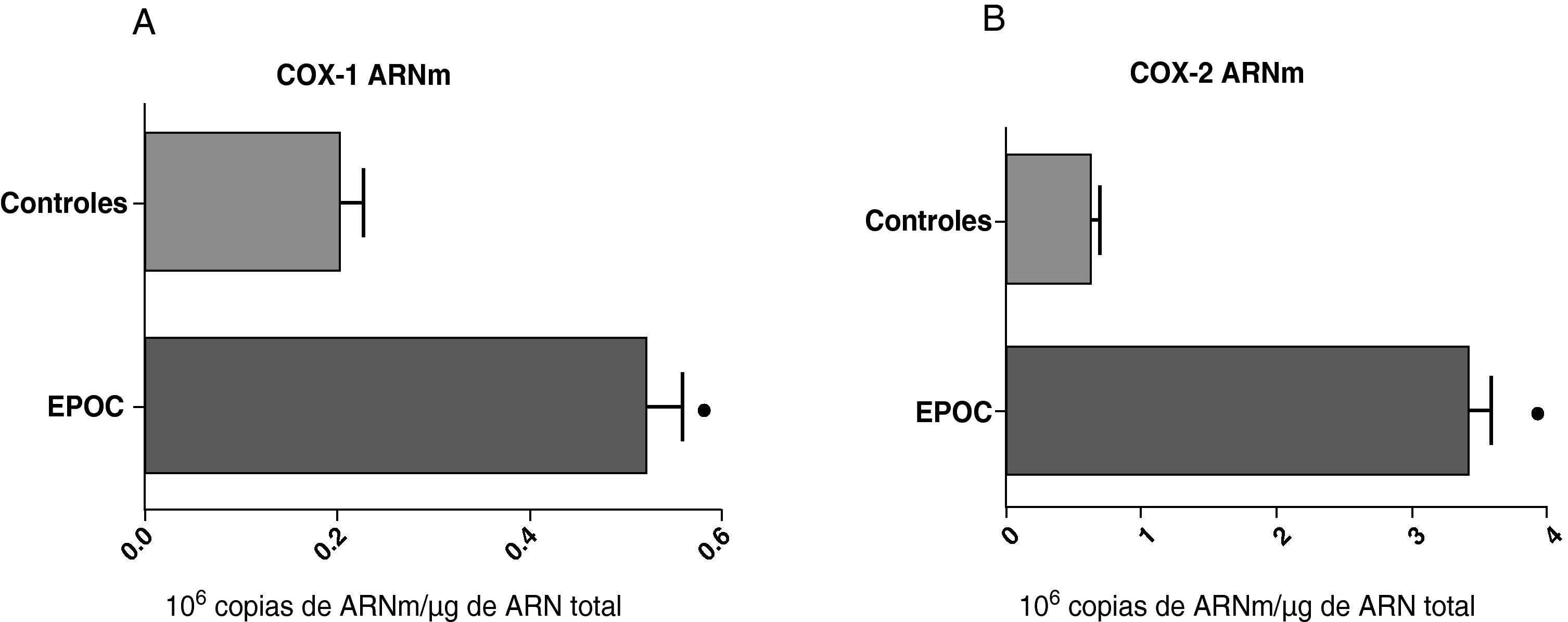
ResultadosExpresión de COX-1 y COX-2 en muestras del parénquima de los pulmones de los controles y de los pacientes con cáncer bronquialLos niveles de expresión del ARNm de la COX-1 y de la COX-2 en el parénquima de los pacientes con cáncer bronquial fue significativamente superior a los encontrados en los sujetos control (fig. 1). Sin embargo, no se observaron diferencias en la expresión de la proteína de COX-1 y COX-2 entre controles y pacientes con cáncer (datos no mostrados). Como el grupo control era más joven que el grupo estudio, se analizó si había correlación entre los niveles de las enzimas y la edad de los pacientes. No se encontró que hubiera correlación entre edad y niveles de expresión de las dos COX (COX-1, r=–0,12; COX-2, r=0,23).
Expresión de la ARNm de la COX-1 (A) y de la COX-2 (B) en el parénquima pulmonar de sujetos controles (n=14) y de pacientes EPOC con cáncer bronquial (n=44). Se representan las medias con los errores típicos de la media. La expresión del ARNm se muestra en forma de número de moléculas con respecto al ARN total. ¿ p<0,01.
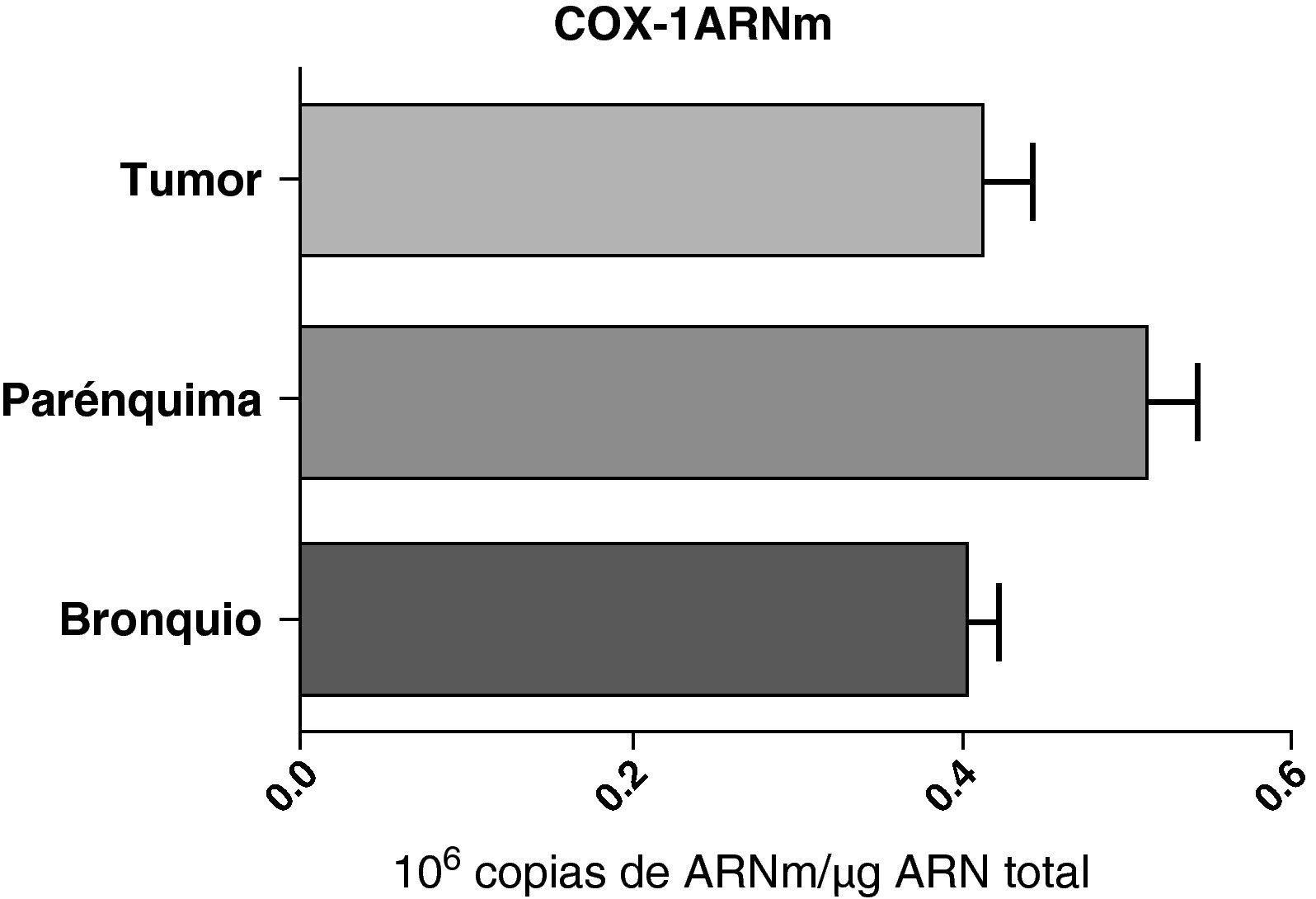
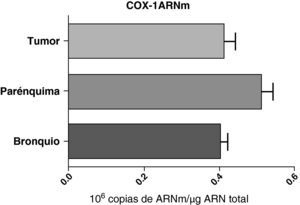
No se encontraron diferencias en la expresión del ARNm de la COX-1 entre las muestras obtenidas de diferentes partes del pulmón: parénquima, vías aéreas y tumor (fig. 2). Tampoco se observaron diferencias cuando las muestras se compararon teniendo en cuenta el tipo histológico del tumor: escamoso o adenocarcinoma (datos no mostrados).
Expresión de la ARNm de la COX-1 en el tumor, el parénquima pulmonar y los bronquios de los pacientes EPOC con cáncer bronquial (n=44). Se representan las medias con los errores típicos de la media. La expresión del ARNm se muestra en forma de número de moléculas con respecto al ARN total. No hubo diferencias estadísticamente significativas.
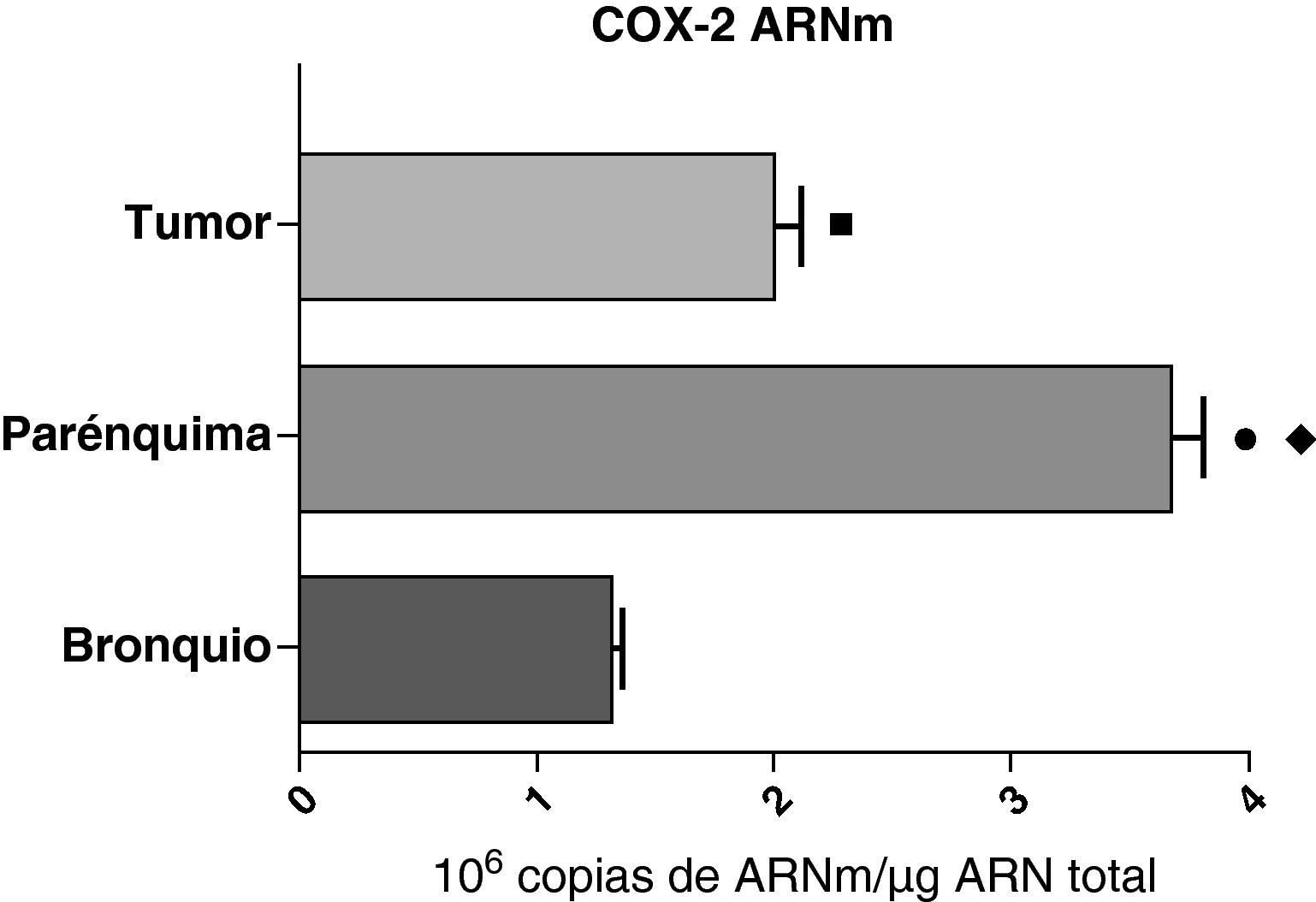
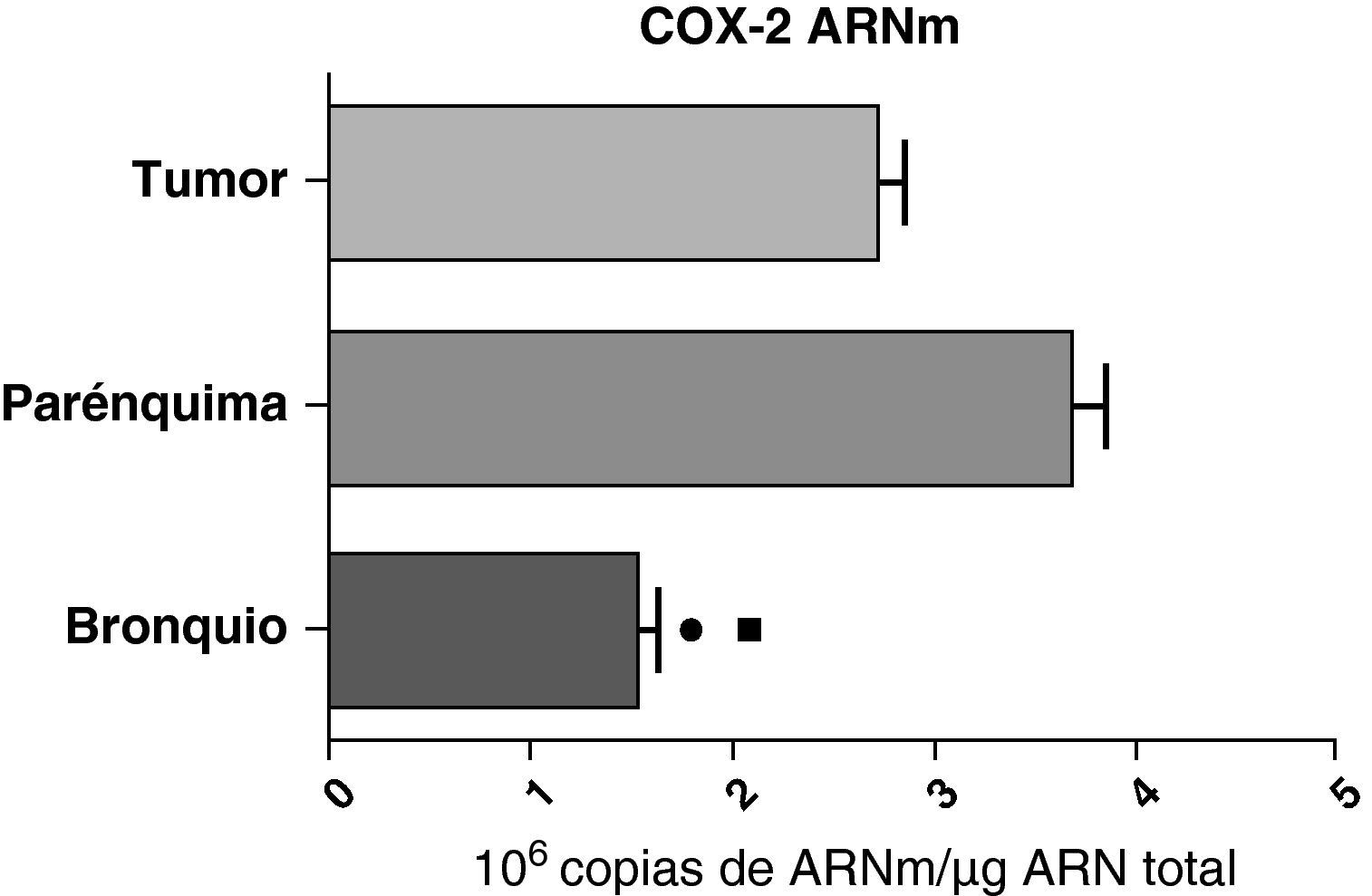
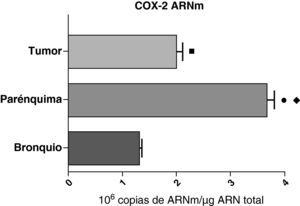
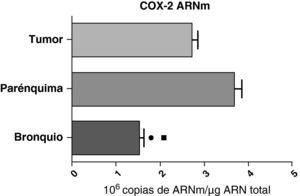
En contraste con el ARNm de la COX-1, los niveles de expresión del ARNm de la COX-2 en pacientes con EPOC fueron estadística y significativamente más altos en el parénquima pulmonar en comparación a los obtenidos en las vías aéreas y en las muestras tumorales, tanto en los pulmones de pacientes con carcinomas escamosos (fig. 3), como en los pacientes con adenocarcinomas (fig. 4). El valor más bajo del ARNm de la COX-2 se encontró en ambos casos en las vías aéreas (figs. 3 y 4). No hubo diferencias en los niveles de expresión del ARNm de la COX-2 entre cánceres escamosos y adenocarcinomas.
Expresión de la ARNm de la COX-2 en el tumor, el parénquima pulmonar y los bronquios de los pacientes EPOC con carcinoma escamoso (n=27). Se representan las medias con los errores típicos de la media. La expresión del ARNm se muestra en forma de número de moléculas con respecto al ARN total. ¿ p<0,001 entre parénquima y tumor. p<0,0001 entre parénquima y bronquio. ¿ p<0,01 entre tumor y bronquio.
Expresión de la ARNm de la COX-2 en el tumor, el parénquima pulmonar y los bronquios de los pacientes EPOC con adenocarcinoma (n=17). Se representan las medias con los errores típicos de la media. La expresión del ARNm se muestra en forma de número de moléculas con respecto al ARN total. ¿ p<0,03 entre bronquio y tumor. ¿ p<0,03 entre bronquio y parénquima. No hubo diferencias estadísticamente significativas entre parénquima y tumor.
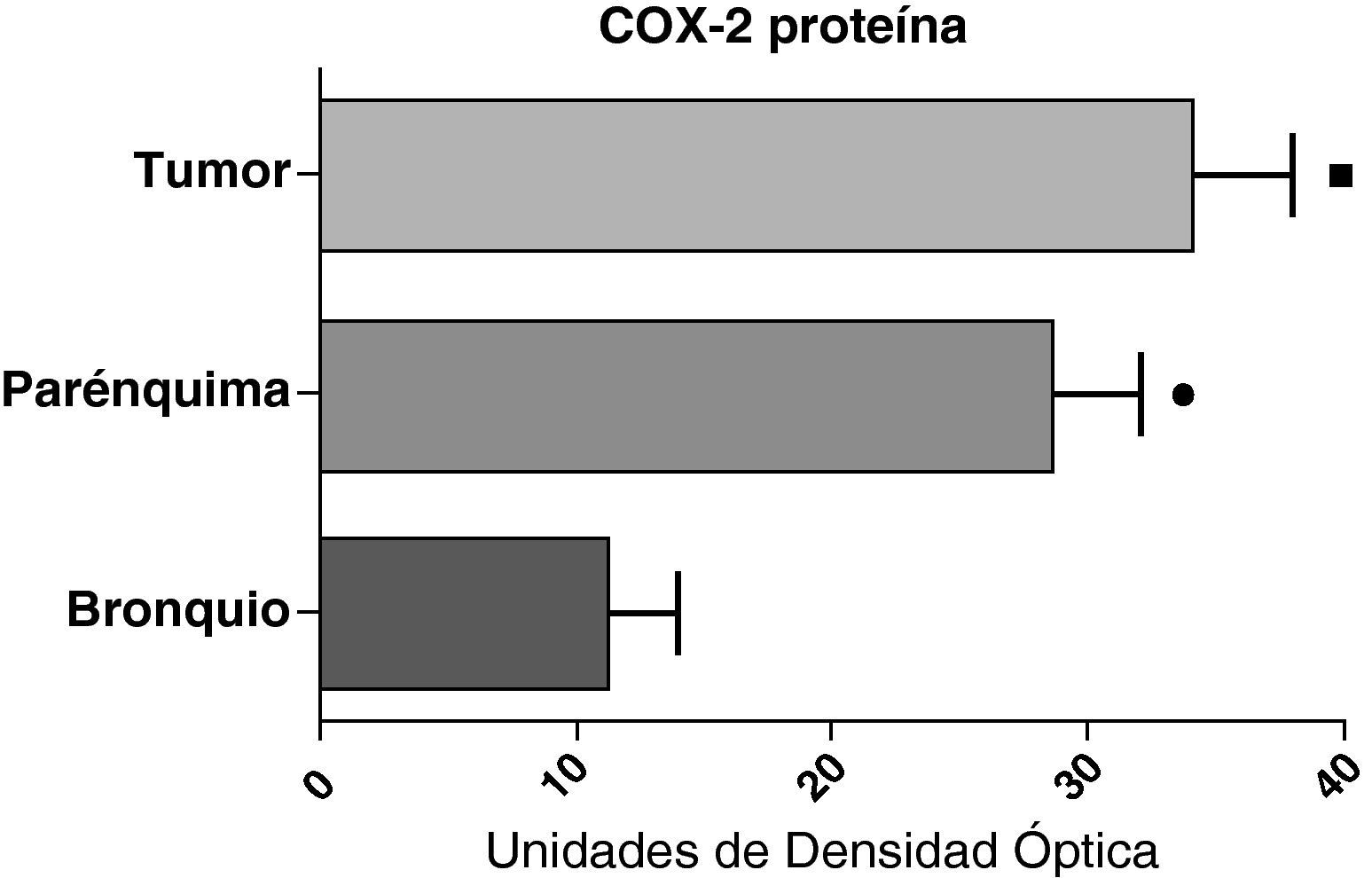
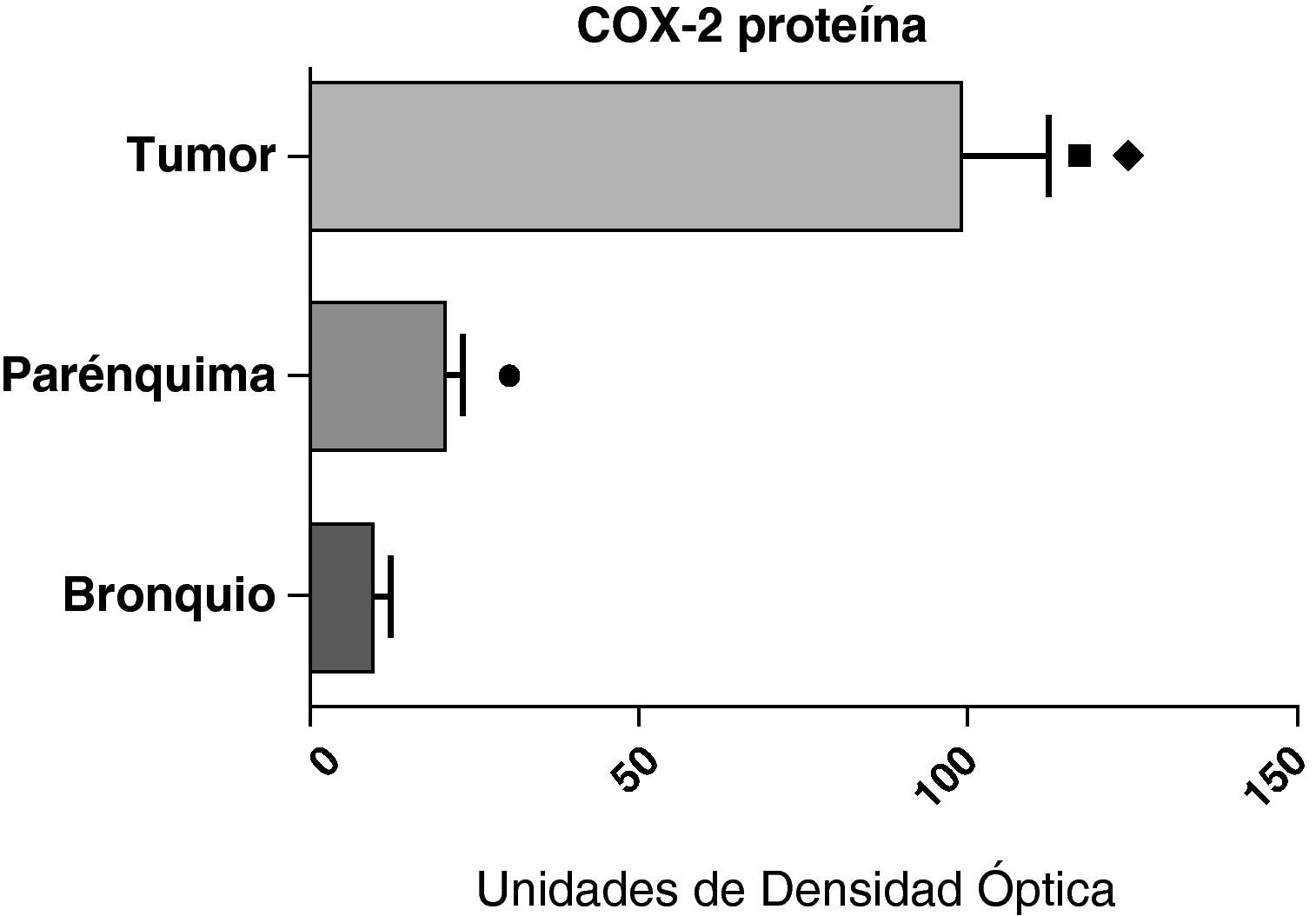
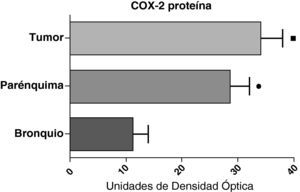
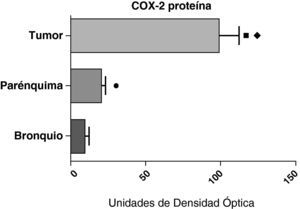
En contraste con los datos obtenidos con el ARNm, el análisis de la proteína de COX-2 mediante western blot mostró niveles significativamente más altos en las muestras tumorales en comparación a los detectados en el parénquima y las vías aéreas. Este resultado se observó tanto en las muestras de tumores escamosos (fig. 5) como en las de pacientes con adenocarcinomas (fig. 6)
Expresión de la proteína de la COX-2 en el tumor, el parénquima pulmonar y los bronquios de los pacientes EPOC con carcinoma escamoso (n=27). Se representan las medias con los errores típicos de la media. La proteína se expresa en forma de unidades de densidad óptica. ¿ p<0,01 entre tumor y bronquio. ¿ p<0,01 entre parénquima y bronquio. No hubo diferencias estadísticamente significativas entre tumor y parénquima.
Expresión de la proteína de la COX-2 en el tumor, el parénquima pulmonar y los bronquios de los pacientes EPOC con adenocarcinoma (n=17). Se representan las medias con los errores típicos de la media. La proteína se expresa en forma de unidades de densidad óptica. ¿ p<0,001 entre tumor y bronquio. p<0,01 entre tumor y parénquima. ¿ p<0,05 entre parénquima y bronquio.
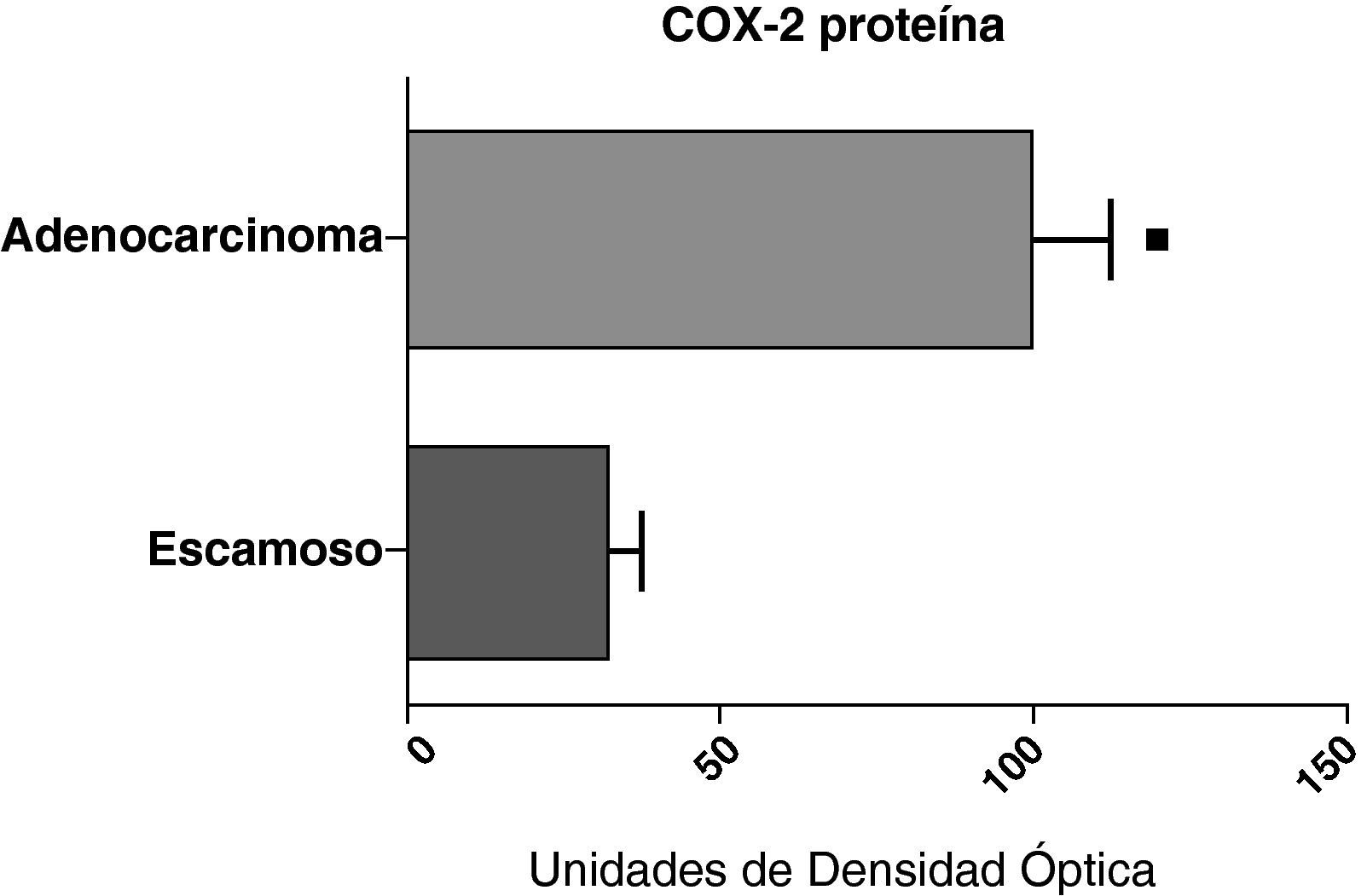
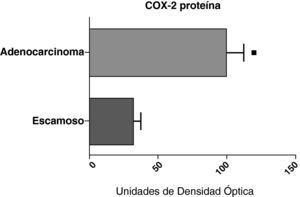
Cuando se compararon los niveles de expresión de la proteína de COX-2 en el parénquima, las vías aéreas y el tejido tumoral de pacientes con distintos tipos histológicos (carcinoma escamoso o adenocarcinoma) se observó que los niveles de la proteína eran significativamente más altos en el tejido tumoral del adenocarcinoma que en el del cáncer escamoso (fig. 7). Sin embargo, no hubo diferencias en la expresión de la proteína entre las muestras de vías aéreas o del parénquima procedentes de los pacientes con los dos tipos de tumores (datos no mostrados).
Expresión de la proteína de la COX-2 en los adenocarcinomas (n=17) y los carcinomas escamosos27. Se representan las medias con los errores típicos de la media. La proteína se expresa en forma de unidades de densidad óptica. ¿ p<0,01.
No se encontraron correlaciones estadísticamente significativas entre los niveles de expresión del ARNm y de las proteínas de la COX-1 y de la COX-2, ni con el FEV1, ni con los resultados de la estadificación del tumor (datos no mostrados).
DiscusiónDado que la COX-2 parece estar involucrada en la regulación de varios procesos celulares de gran importancia en el desarrollo de cánceres, como son la angiogénesis, la progresión del tumor, las metástasis y la resistencia a la quimioterapia antineoplásica16,17, el objetivo del estudio fue investigar la expresión de la COX-2 en el pulmón de pacientes con EPOC afectados de cáncer bronquial, con el fin de analizar la relación entre la expresión de la COX-2 en el tejido pulmonar no afectado por el cáncer y el tejido neoplásico.
Los hallazgos más relevantes de nuestro estudio han sido: a) La expresión de la COX-1 y la COX-2 está regulada al alza en el parénquima de los pacientes con EPOC. b) La expresión del ARNm de la COX-2 es más elevada en el parénquima que en el tejido tumoral, tanto de los adenocarcinomas como de los carcinomas escamosos. c) La expresión de la proteína de COX-2 está aumentada en los tejidos tumorales, en particular en las muestras procedentes de adenocarcinomas.
Este estudio confirma que la EPOC es una enfermedad caracterizada por la presencia de un aumento en la actividad de la vía COX del metabolismo del AA. La expresión aumentada de la COX-2 en la EPOC fue descrita por primera vez por nuestro grupo8 y confirmada más tarde por otros investigadores9. En este estudio se demuestra por primera vez que, al igual que la COX-2, la COX-1 también tiene su expresión aumentada en la EPOC. Esta observación no debe considerarse excepcional, ya que, aunque la COX-1 es una enzima habitualmente involucrada en funciones fisiológicas, lo cierto es que en procesos inflamatorios se pueden producir pequeños cambios en su expresión10,11,18,19. Por lo tanto, es posible que el aumento en la producción pulmonar de PGE2 en pacientes con EPOC sea en parte debido al aumento en la actividad metabólica de la COX-1.
En contraste con lo que ocurría con el ARNm, no fue posible demostrar diferencias en la expresión de la proteína de la COX-1 entre el parénquima pulmonar de los sujetos controles y de los pacientes con EPOC. Este hecho no es excepcional y, cuando ocurre, suele deberse a las diferencias en la precisión y en la sensibilidad de los métodos empleados para medir el ARNm y la proteína sintetizada por los ribosomas celulares. La PCR es una técnica que permite detectar pequeños cambios en la síntesis del ARNm, mientras que el western blot, que es la técnica utilizada para evaluar la cantidad de proteína sintetizada, presenta una precisión y una sensibilidad mucho menores para evaluar diferencias poco marcadas. Otras razones posibles, aunque poco probables, como la presencia de alteraciones en la síntesis proteica o alteraciones en la vida media de las proteínas generadas, podrían explicar la diferencia en los resultados obtenidos con el ARNm y la la proteína de la COX-1.
Al comparar el nivel de expresión de la COX-2 en los tejidos tumorales destacaron dos observaciones: a) Los niveles de proteína estaban marcadamente aumentados, mientras que los de ARNm lo estaban mucho menos. b) Los niveles de proteína eran mucho más elevados en el tejido procedente de adenocarcinomas que en el obtenido de los carcinomas escamosos. Estas observaciones sugieren que, muy probablemente, el aumento en la transcripción del gen (ARNm) de la COX-2 tiene un papel menos relevante que los procesos de traslación (síntesis de la proteína) y postraslacionales (regulación de la vida media de la proteína) en el aumento de la expresión de la proteína de COX-2 en los tumores bronquiales.
Es ampliamente aceptado que la COX-2 desempeña un papel relevante en los procesos inflamatorios, y está también asumido que el aumento de la expresión de esta enzima es el responsable principal del incremento en la producción de PGE2 detectada en pacientes con EPOC9. Dadas las conocidas habilidades de la PGE2 para promover la oncogénesis, se puede pensar que el aumento en la producción de PGE2, como consecuencia de la respuesta inflamatoria, podría contribuir al desarrollo de un cáncer en los pacientes con EPOC20. Una posible secuencia en los eventos que llevan al desarrollo del cáncer en fumadores podría ser la siguiente: el hábito tabáquico pone en marcha un proceso inflamatorio en el pulmón, y el tabaco y la inflamación ocasionan un aumento en la expresión de la COX-2 que conlleva un aumento en la producción de PGE2, la cual, con su conocida capacidad para inducir la oncogénesis y en asociación con otros factores proneoplásicos, finalmente promueve el desarrollo del cáncer asentado sobre un pulmón inflamado.
Si esta hipótesis fuera cierta, cualquier terapia capaz de reducir la síntesis de PGE2 debería tener un efecto preventivo en el desarrollo del cáncer bronquial. Estudios recientes han mostrado que dosis bajas de ácido acetilsalicílico previenen el desarrollo de varios cánceres, entre ellos el cáncer bronquial21,22. Dado que una de las acciones del ácido acetilsalicílico es inhibir las dos enzimas COX, reduciendo con ello de forma drástica la síntesis de PGE2, estas observaciones refuerzan la hipótesis que señala la vía de la COX como el nexo de unión entre la inflamación presente en la EPOC y la predisposición de estos pacientes a desarrollar neoplasias bronquiales.
Un dato llamativo de este estudio es el diferente grado de expresión de la COX-2 dependiendo del tipo histológico. La mayor abundancia de COX-2 en los adenocarcinomas respecto a los carcinomas escamosos ha sido descrita en estudios previos16,23. Dada la capacidad preventiva de dosis bajas de ácido acetilsalicílico para prevenir el desarrollo del cáncer, el hecho de que existan grandes diferencias en los niveles de COX-2 entre escamosos y adenocarcinomas plantea la necesidad de realizar estudios que permitan conocer si los efectos antineoplásicos del ácido acetilsalicílico están relacionados con la dosis empleada del fármaco, el tipo histológico del tumor y su relación con el grado de expresión de la COX-2. La mayoría de los estudios se han realizado en pacientes que recibían tratamiento con dosis bajas de ácido acetilsalicílico con finalidad preventiva de enfermedades cardiovasculares21. Cabe la posibilidad de que dosis más elevadas a las indicadas con la citada finalidad tuvieran una capacidad preventiva del cáncer mucho mayor, en particular en los adenocarcinomas, en los cuales, como demuestra este y otros estudios, la expresión de la proteína de COX-2 está muy elevada.
Merece la pena resaltar que el grado de expresión de la COX puede tener valor pronóstico. Estudios previos han demostrado que la regulación al alza en la expresión de la COX-2 se asocia a una peor evolución del cáncer bronquial19,24,25. Por otro lado, la inhibición de la COX-2 puede tener efectos no solo preventivos sino también terapéuticos, hecho sustentado por los resultados de estudios que han observado que la inhibición de la COX-2 mediante el ácido acetilsalicílico o los inhibidores selectivos de la COX-2 (coxibs) mejora los resultados terapéuticos cuando se asocia a otras terapias antineoplásicas26,27.
En este estudio evaluamos el grado de expresión de la COX-2 en la mucosa bronquial próxima al tumor. Nuestra hipótesis establecía que debería existir una relación entre la inflamación presente en las vías áreas —con el consiguiente aumento de la producción de PGE2 debido a un aumento en la expresión de la COX-2— y el desarrollo posterior del cáncer sobre esta zona inflamada. De acuerdo a la hipótesis, la mucosa bronquial debería ser la zona del pulmón con una mayor expresión de la COX-2. Sorprendentemente, la mayor expresión de la COX-2 la encontramos en el parénquima. Las razones que pueden explicar este hallazgo son por ahora desconocidas. No obstante, debe señalarse que no se pudo comparar el grado de expresión de la COX-2 en la mucosa bronquial de los pacientes EPOC con cáncer y los sujetos control, ya que se pudo disponer de muestras de parénquima de sujetos sin EPOC (afectados por neumotórax), pero, por razones obvias, no fue posible obtener muestras de tejido bronquial de estos mismos individuos. No obstante, estudios previos han demostrado que los niveles de expresión de la COX-2 guardan una relación directa con el grado de malignidad de las lesiones histológicas bronquiales28.
En síntesis, este estudio demuestra que la EPOC se caracteriza por mostrar un aumento en la actividad de la vía de la ciclooxigenasa, hecho que se asocia a un aumento en la expresión de la COX-2 en el tejido tumoral, en especial en el tejido de los adenocarcinomas. En conjunto, estos datos refuerzan la idea de que inflamación y cáncer pueden estar relacionados, y que en esta relación pueden desempeñar un papel relevante los mediadores lipídicos generados por la vía de la COX. La importancia que puede tener la inhibición de la COX-2 para prevenir y tratar el cáncer bronquial en los pacientes con EPOC merece ser evaluada en estudios prospectivos específicamente diseñados para conocer su impacto real.
Este estudio se realizó con la ayuda de una beca de la Asociación Española Lucha contra el Cáncer.