El tratamiento no farmacológico es fundamental en los pacientes con enfermedad pulmonar obstructiva crónica (EPOC), sin embargo, este tratamiento, en ocasiones, no recibe la importancia que merece. Los pacientes diagnosticados de EPOC deberían beneficiarse de servicios de atención integral. Estos servicios son un conjunto articulado de acciones estandarizadas dirigidas a la cobertura de las necesidades de salud del paciente, considerando el entorno y las circunstancias. La rehabilitación pulmonar es uno de los componentes esenciales del tratamiento no farmacológico en los servicios de atención integral en la EPOC. En la Guía española de la EPOC (GesEPOC) 2017 detallamos de forma sistemática la evidencia científica de los programas de rehabilitación pulmonar en fase aguda y estable. Otro aspecto importante del tratamiento no farmacológico es la actividad física y en la guía GesEPOC 2017 describimos los puntos más esenciales sobre su prescripción y revisamos las estrategias más eficaces para su adhesión. GesEPOC 2017 quiere dejar constancia de la importancia del tratamiento no farmacológico como coadyuvante al tratamiento farmacológico.
Non-pharmacological treatment is essential in patients with chronic obstructive pulmonary disease (COPD), but this treatment is sometimes not given the importance it deserves. Patients diagnosed with COPD should benefit from comprehensive care services. These services comprise a protocolized set of actions aimed at covering the health needs of the patient, taking into account their environment and circumstances. Pulmonary rehabilitation is one of the essential components of non-pharmacological treatment in comprehensive COPD care services. In the Spanish COPD Guidelines (GesEPOC) 2017, we provided a systematic report of the scientific evidence for pulmonary rehabilitation programs in acute and stable phase disease. Another important issue in the non-pharmacological treatment of COPD is physical activity, and the most essential considerations regarding prescription are described in the GesEPOC guidelines, along with a review of the most effective strategies to ensure adherence. GesEPOC 2017 aims to underline the importance of non-pharmacological treatment as a co-adjuvant to pharmacological treatment.
La Guía española de la enfermedad pulmonar obstructiva crónica (GesEPOC) define la enfermedad pulmonar obstructiva crónica (EPOC) como una enfermedad respiratoria caracterizada por síntomas persistentes y una limitación crónica al flujo aéreo, causada principalmente por el tabaco1.
El tratamiento farmacológico en los pacientes con EPOC ha generado gran interés a consecuencia de la aparición de nuevos fármacos y dispositivos de inhalación más eficaces y seguros. No obstante, este tratamiento farmacológico debería ir asociado a un tratamiento no farmacológico, que en ocasiones queda relegado a un segundo plano, o incluso ni se menciona.
La GesEPOC actualizada recientemente1 ha hecho hincapié en la importancia del tratamiento integral, incluyendo el no farmacológico, donde la rehabilitación pulmonar (RP) se considera un componente esencial en los servicios de atención integrada (SAI).
La metodología de la guía ha seguido los estándares de calidad para el desarrollo de guías de práctica clínica y se ha descrito en una publicación reciente1. Los aspectos que se van a desarrollar en este artículo corresponden al modelo de atención a los pacientes con enfermedad crónica adaptado a la EPOC. La RP, la actividad física (AF), las estrategias de autocuidado, los programas estructurados de educación terapéutica (ET) y la nutrición serán los aspectos tratados en este documento.
El modelo de atención integrada en la enfermedad pulmonar obstructiva crónica¿Cuáles son sus componentes esenciales?Los actuales sistemas de salud están diseñados para atender episodios agudos orientados a curar, pero no al cuidado integral del paciente. En general, son modelos fragmentados y escasamente multidisciplinares. Se centran en el ingreso hospitalario convencional y el seguimiento en consultas hospitalarias y atención primaria. Las alternativas a la hospitalización convencional, como la hospitalización a domicilio y el seguimiento a domicilio en pacientes complejos, se tienen poco en cuenta a pesar que han demostrado ser coste efectivas. Las guías clínicas por enfermedades no cubren las manifestaciones sistémicas y comorbilidades frecuentes que contribuyen a la carga de la enfermedad. Los pacientes con EPOC presentan necesidades de salud complejas que obligan a un rediseño del sistema de salud.
La complejidad es difícil de definir, medir o predecir. El término complejidad del paciente se aplica a sujetos que pueden presentar al menos una de las siguientes características: a) necesidad de seguimiento por parte de diferentes especialistas; b) fragilidad, que requiere apoyo adicional debido a la disminución funcional y los déficits sociales o situaciones transitorias como el alta hospitalaria, y c) necesidad de atención altamente especializada en el domicilio.
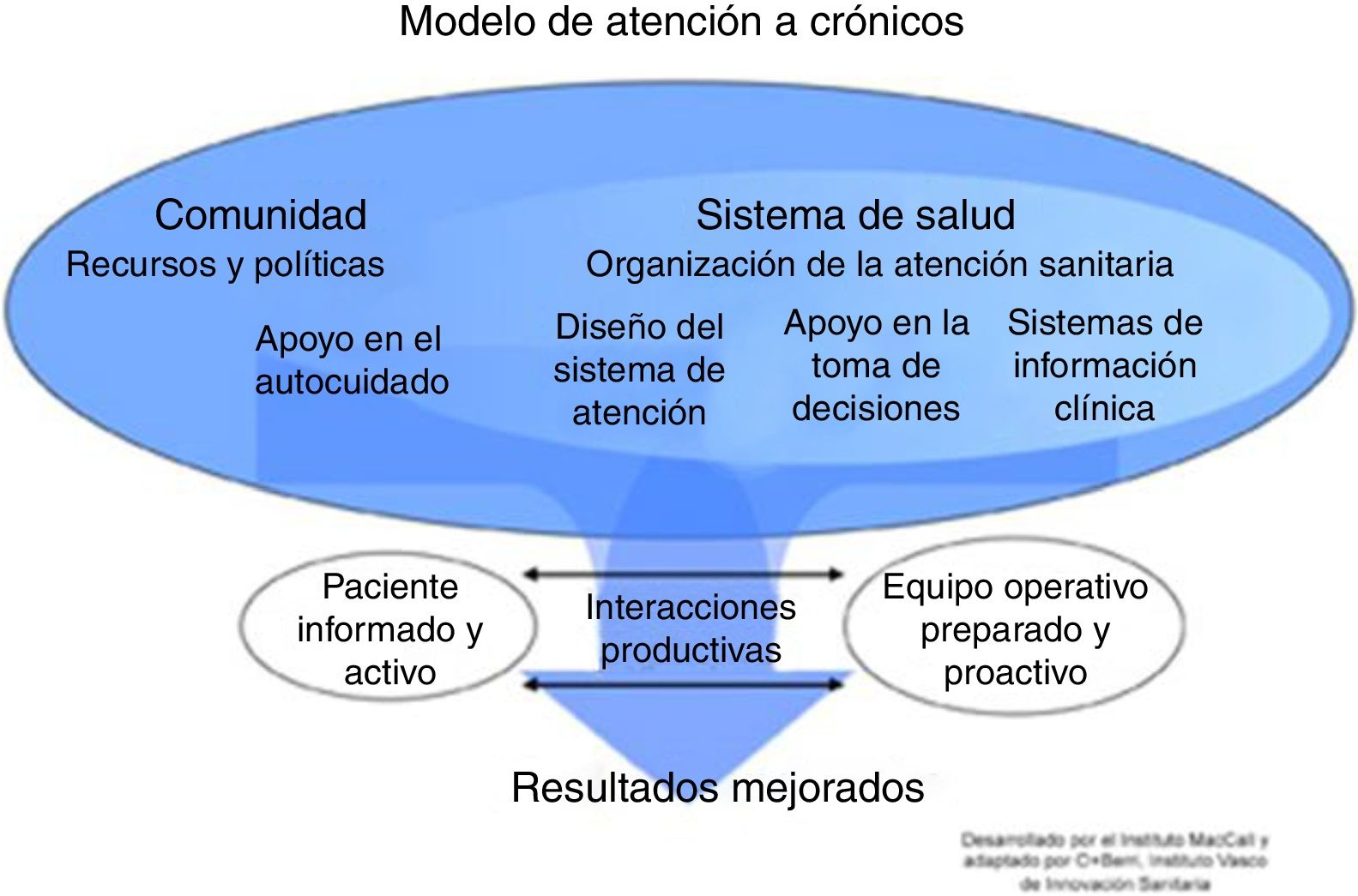
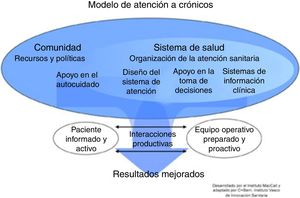
Los pacientes con necesidades complejas a menudo muestran una evolución dinámica, por lo que el tipo de seguimiento y profesionales involucrados pueden variar. Se necesitan servicios innovadores, con soporte tecnológico, que mejoren la eficiencia y contribuyan a entender mejor los mecanismos subyacentes de las enfermedades crónicas2-4. No existe un modelo universal de gestión de enfermedades crónicas, pero sí marcos conceptuales que han demostrado mejores resultados5. El más utilizado es el Chronic Care Model (CCM) propuesto por la Organización Mundial de la Salud (OMS) (fig. 1). Los SAI son uno de sus componentes principales. Sin embargo, la efectividad del CCM en la EPOC es escasa y heterogénea, y depende del tipo de intervenciones realizadas y la experiencia de los profesionales6,7.
Servicios de atención integradaUn SAI es el conjunto articulado de acciones estandarizadas dirigidas a la cobertura de las necesidades de salud del paciente, considerando el entorno y las circunstancias. Plantea objetivos de salud en el marco de un plan global para el paciente, no necesariamente circunscrito a una enfermedad específica. Se basa en el diseño de procesos y tiene un carácter longitudinal con duración específica para cada servicio. El despliegue en la práctica asistencial de los SAI ha demostrado resultados poco concluyentes8. Se requiere la integración de la información procedente tanto de los profesionales como del paciente y de la investigación biomédica con el fin evaluar el riesgo en la prevención o reducción del impacto de la enfermedad. Los desafíos clínicos de la EPOC en los SAI se citan en la tabla 1.
Los desafíos clínicos de la EPOC en un servicio de atención integral
| Diagnóstico precoz y monitorización de la progresión de la enfermedad |
| Pacientes con frecuentes exacerbaciones |
| Alternativas a la hospitalización convencional |
| Prevención de ingresos hospitalarios en el postalta inmediata (transitional care) |
| Comorbilidad y efectos sistémicos |
| Tratamiento y seguimiento de la EPOC avanzada y final de vida |
La OMS9 manifiesta la necesidad de evaluar al paciente mediante 6 dominios (datos sociodemográficos; modelo de salud y tipo de profesionales involucrados, trastornos crónicos y factores de riesgo, tratamiento farmacológico, intervenciones no farmacológicas y dependencia) previamente a plantear cualquier intervención. El despliegue de los SAI debe adaptarse a las características del lugar y seguir un desarrollo por bloques10.
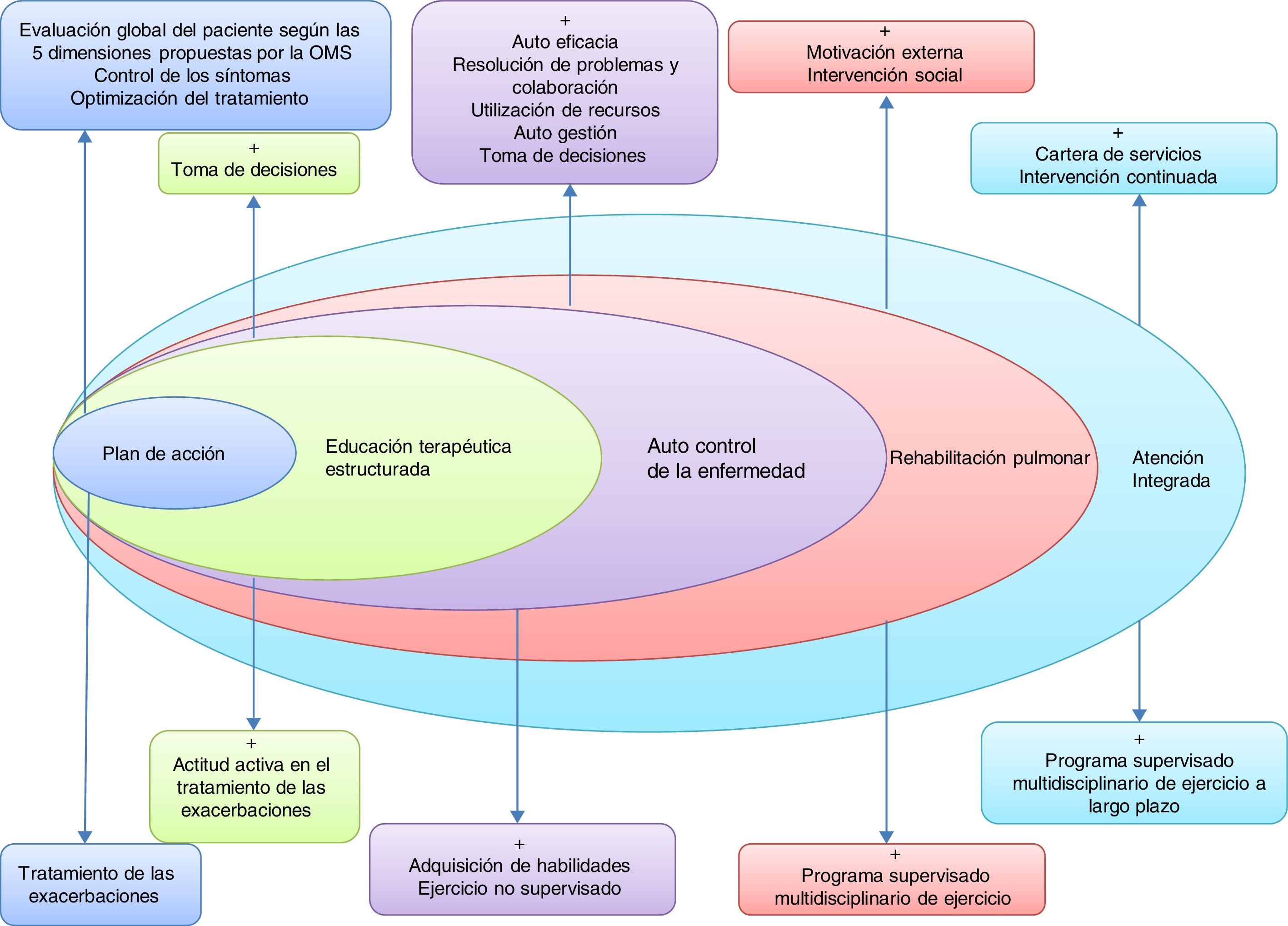
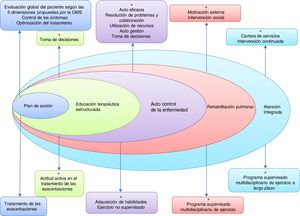
Para ello es necesario desarrollar herramientas de evaluación de riesgo individual, nuevas modalidades de formación de profesionales y herramientas para valorar la aplicación en distintos territorios. En la figura 2 se proponen los componentes básicos de un SAI en la EPOC.
Componentes básicos de un modelo de atención integrada en la EPOC.Adaptada por C. Hernández de Spruit et al.11.
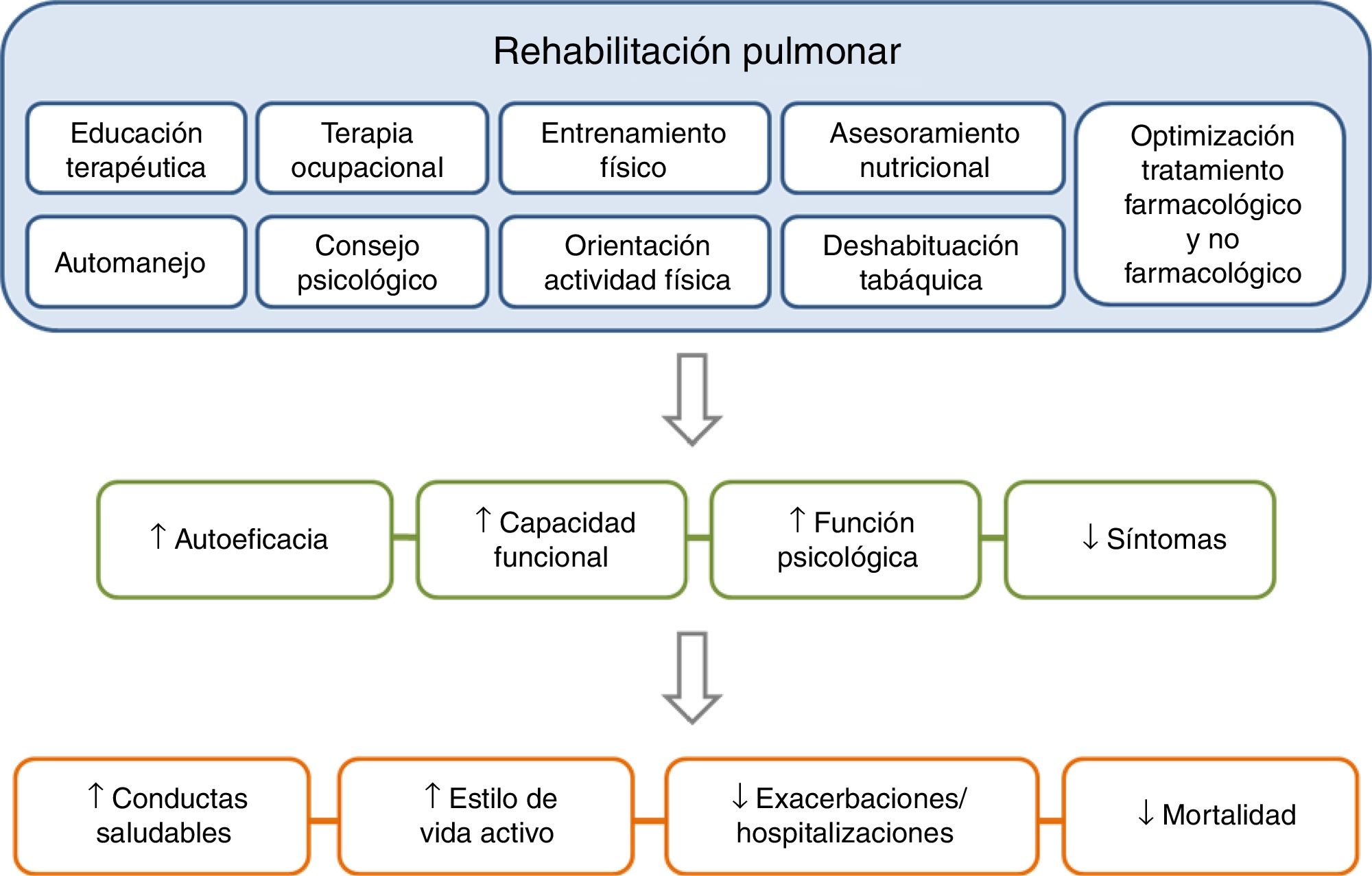
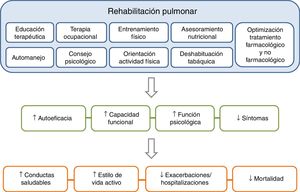
La RP es uno de los componentes esenciales en los SAI en la EPOC y sus efectos están bien demostrados11-15 (fig. 3). Desde la última actualización de la guía GesEPOC en 2014, el concepto de RP consensuado por la American Thoracic Society (ATS) y la European Respiratory Society (ERS) se incorpora con más énfasis como parte central del cuidado integrado del paciente con enfermedad crónica11,16. Asimismo, la ATS y la ERS también han desarrollado una normativa con el objetivo de mejorar la implementación de la RP11,12,17. La nueva definición establece que «la RP es una intervención integral basada en una evaluación exhaustiva del paciente seguida de terapias adaptadas a los pacientes, que incluyen pero no están limitadas al entrenamiento, la ET y el cambio de comportamiento, diseñadas para mejorar la condición física y psicológica de las personas con enfermedad respiratoria crónica y promover la adherencia a largo plazo a los comportamientos que mejoran la salud»11.
Los componentes de un programa de rehabilitación pulmonar completo e integrado tienen un efecto directo y positivo sobre el paciente, tanto a nivel físico como psicológico, favoreciendo que el paciente se vuelva más proactivo hacia su enfermedad, adquiriendo conductas de vida saludable y, por consiguiente, reduciendo el riesgo de exacerbaciones y mortalidad.Adaptada de Spruit et al.27.
A continuación, se resumen las últimas evidencias y recomendaciones para su prescripción:
- –
Resultados de diferentes estudios recomiendan incluir a todos los pacientes con EPOC en un programa de RP como parte del tratamiento12.
- –
Los programas estructurados de ET deben iniciarse en el momento del diagnóstico y hasta el final de la vida. Los programas se adaptarán a las necesidades del paciente y tendrán en cuenta la comorbilidad18.
- –
La prescripción de RP para pacientes con EPOC leve se considera una recomendación débil, a pesar de conseguir mejoras en variables como la calidad de vida y la capacidad de ejercicio19.
- –
El ejercicio físico, iniciado durante o inmediatamente después de una agudización de la EPOC mejora la calidad de vida y la capacidad de ejercicio; sin embargo, la heterogeneidad en el tipo de programa de RP que se ofrece puede explicar los efectos en variables de resultado como las readmisiones hospitalarias y la mortalidad20. Todavía hay dudas acerca del momento idóneo para iniciar un programa de RP y, hasta que no se disponga de información más fiable, se debería evitar el inicio de la RP durante el ingreso hospitalario20.
- –
El acceso limitado a programas de RP para pacientes con EPOC está generando un incremento en el estudio de programas que sean aplicables en la comunidad, con menor necesidad de infraestructura11,21,22.
- –
Las intervenciones de cambio de comportamiento podrían ayudar a mejorar la participación en los programas de automanejo de la EPOC23,24.
- –
El conocimiento sobre los efectos del uso de la tecnología para el entrenamiento físico, la ET, la gestión de la enfermedad, y la AF en el contexto de la RP aún es limitado25-27.
- –
Los factores psicosociales y las propias percepciones de los pacientes pueden contribuir a la adherencia y al mantenimiento a largo plazo de los efectos de la RP23.
- –
La RP es segura, ya que existe una baja incidencia de complicaciones mayores28.
La AF debe plantearse como algo esencial y vital para el paciente EPOC, no obstante, no debe interpretarse como un concepto simple, sino todo lo contrario, ya que está influida por múltiples factores que repercuten sobre el paciente para poder llevarla a cabo. Debemos plantearnos la prescripción de la AF como un cambio de conducta que debe realizar el paciente EPOC.
¿Cómo prescribir actividad física y qué estrategias se pueden utilizar para que el paciente con enfermedad pulmonar obstructiva crónica realice actividad física?La importancia de la prescripción de AF a los pacientes con EPOC viene determinada entre otros factores por: a) la alta morbimortalidad relacionada con la EPOC29; b) la evidencia de que la inactividad física se asocia a un incremento del riesgo de mortalidad y de presentar reagudizaciones30,31; c) si se comparan con individuos sanos de la misma edad, los pacientes con EPOC tiene un nivel de AF más bajo32; d) las comorbilidades que pueden presentar los pacientes con EPOC también mejoran con la práctica regular de AF33; e) la inactividad física está asociada a una progresión de la intolerancia al ejercicio y de la afectación muscular34; f) los niveles bajos de AF se dan incluso en pacientes con EPOC leve, lo que hace pensar en la necesidad de intervenciones tempranas para reducir así el riesgo de presentar comorbilidades futuras y, posiblemente, la progresión de la enfermedad35,36; g) la AF en pacientes con EPOC depende de factores psicológicos y de comportamiento, sociales, ambientales y culturales37, y h) es fundamental que el profesional de la salud esté convencido de que la prescripción de AF debe formar parte del tratamiento de todo paciente con EPOC38.
Hasta la fecha, no se han establecido recomendaciones específicas sobre el grado de AF que deberían mantener los pacientes con EPOC. Sin embargo, en general son bien aceptadas las recomendaciones generales sobre los beneficios de realizar AF moderada un mínimo de 30min al día 5 días por semana (o el equivalente a 1.000kcal/semana), como las del American College of Sports Medicine39.
En la cohorte Phenotype and Course of Chronic Obstructive Pulmonary Disease (PAC-COPD) se observó que los sujetos con EPOC grave y muy grave realizaban sus actividades diarias en períodos más cortos y en menor número que los pacientes en fases leves y moderadas de la enfermedad40. Este patrón debería tenerse en cuenta en el momento de recomendar y prescribir AF a los pacientes más graves, ya que la AF debería realizarse en varios intervalos cortos a lo largo del día, en lugar de recomendar intervalos más largos de 20-30 min seguidos.
La prescripción de AF es un acto complejo porque interviene una combinación de factores individuales, socioculturales y ambientales que habrá que tener en cuenta30,31. En consecuencia, y ante la falta de evidencia y consenso en la prescripción y en las estrategias para aumentar la AF en los pacientes con EPOC, se deben plantear estrategias adaptadas a la vida cotidiana pactadas con el propio paciente.
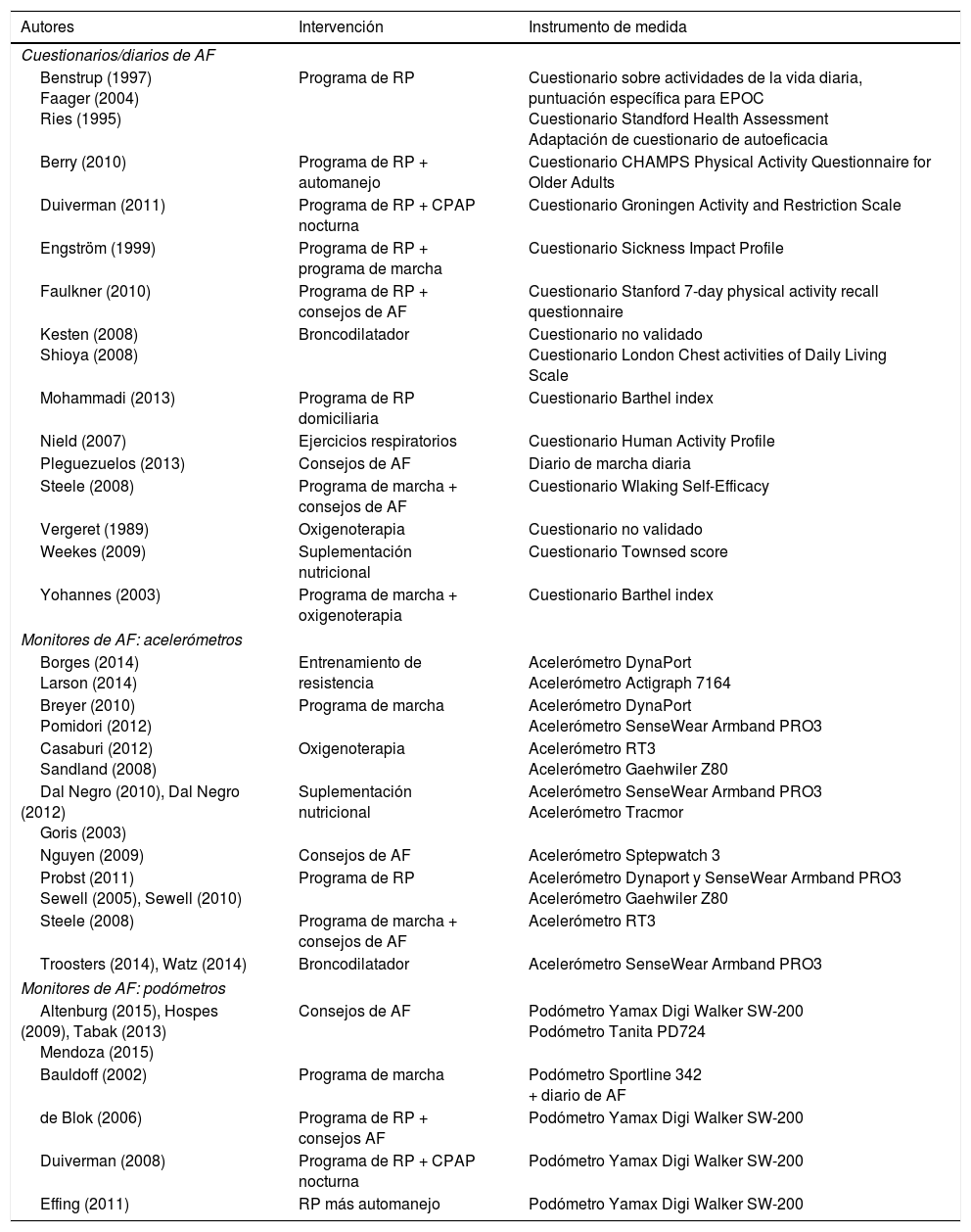
En la tabla 2 se describen ensayos clínicos aleatorizados en los que se realizó una intervención de AF y la variable de medida utilizada para valorar la AF en pacientes con EPOC. En una revisión sistemática reciente realizada por Mantoani et al.41 se concluyó que las intervenciones con programas de RP superior a 12 semanas tienen un impacto positivo en el incremento de la AF.
Ensayos clínicos controlados aleatorizados con relación a diferentes estrategias para incrementar el nivel de actividad física, clasificados por instrumento de evaluación (cuestionario o diario, acelerómetros, y podómetros) y ordenados por autor
| Autores | Intervención | Instrumento de medida |
|---|---|---|
| Cuestionarios/diarios de AF | ||
| Benstrup (1997) Faager (2004) Ries (1995) | Programa de RP | Cuestionario sobre actividades de la vida diaria, puntuación específica para EPOC Cuestionario Standford Health Assessment Adaptación de cuestionario de autoeficacia |
| Berry (2010) | Programa de RP + automanejo | Cuestionario CHAMPS Physical Activity Questionnaire for Older Adults |
| Duiverman (2011) | Programa de RP + CPAP nocturna | Cuestionario Groningen Activity and Restriction Scale |
| Engström (1999) | Programa de RP + programa de marcha | Cuestionario Sickness Impact Profile |
| Faulkner (2010) | Programa de RP + consejos de AF | Cuestionario Stanford 7-day physical activity recall questionnaire |
| Kesten (2008) Shioya (2008) | Broncodilatador | Cuestionario no validado Cuestionario London Chest activities of Daily Living Scale |
| Mohammadi (2013) | Programa de RP domiciliaria | Cuestionario Barthel index |
| Nield (2007) | Ejercicios respiratorios | Cuestionario Human Activity Profile |
| Pleguezuelos (2013) | Consejos de AF | Diario de marcha diaria |
| Steele (2008) | Programa de marcha + consejos de AF | Cuestionario Wlaking Self-Efficacy |
| Vergeret (1989) | Oxigenoterapia | Cuestionario no validado |
| Weekes (2009) | Suplementación nutricional | Cuestionario Townsed score |
| Yohannes (2003) | Programa de marcha + oxigenoterapia | Cuestionario Barthel index |
| Monitores de AF: acelerómetros | ||
| Borges (2014) Larson (2014) | Entrenamiento de resistencia | Acelerómetro DynaPort Acelerómetro Actigraph 7164 |
| Breyer (2010) Pomidori (2012) | Programa de marcha | Acelerómetro DynaPort Acelerómetro SenseWear Armband PRO3 |
| Casaburi (2012) Sandland (2008) | Oxigenoterapia | Acelerómetro RT3 Acelerómetro Gaehwiler Z80 |
| Dal Negro (2010), Dal Negro (2012) Goris (2003) | Suplementación nutricional | Acelerómetro SenseWear Armband PRO3 Acelerómetro Tracmor |
| Nguyen (2009) | Consejos de AF | Acelerómetro Sptepwatch 3 |
| Probst (2011) Sewell (2005), Sewell (2010) | Programa de RP | Acelerómetro Dynaport y SenseWear Armband PRO3 Acelerómetro Gaehwiler Z80 |
| Steele (2008) | Programa de marcha + consejos de AF | Acelerómetro RT3 |
| Troosters (2014), Watz (2014) | Broncodilatador | Acelerómetro SenseWear Armband PRO3 |
| Monitores de AF: podómetros | ||
| Altenburg (2015), Hospes (2009), Tabak (2013) Mendoza (2015) | Consejos de AF | Podómetro Yamax Digi Walker SW-200 Podómetro Tanita PD724 |
| Bauldoff (2002) | Programa de marcha | Podómetro Sportline 342 + diario de AF |
| de Blok (2006) | Programa de RP + consejos AF | Podómetro Yamax Digi Walker SW-200 |
| Duiverman (2008) | Programa de RP + CPAP nocturna | Podómetro Yamax Digi Walker SW-200 |
| Effing (2011) | RP más automanejo | Podómetro Yamax Digi Walker SW-200 |
AF: actividad física; CPAP: presión positiva continua en las vías respiratorias; RP: rehabilitación pulmonar.
Modificado de Mantoani et al.41.
Otras alternativas más específicas —como la intervención dietética en pacientes con caquexia y la ventilación no invasiva nocturna asociada a ejercicio en sujetos con hipercapnia— parecen mejorar los niveles de AF en estos grupos de pacientes41. La oxigenoterapia a largo plazo (≥ 8 semanas) y la electroestimulación muscular no presentan un impacto significativo en los niveles de AF, pero podrían utilizarse como coadyuvantes a otras intervenciones. Por último, los broncodilatadores podrían incrementar los niveles de actividad de la vida diaria en sujetos EPOC41.
Es importante recordar que la AF comporta un comportamiento complejo, y como tal, difícil de modificar. Cambiar la actitud del paciente con EPOC frente la AF requiere una aproximación interdisciplinar en la que se incluyan las ciencias médicas, sociales y del comportamiento, y las intervenciones deben estar basadas en modelos teóricos de cambio de conducta37. La última guía sobre AF en EPOC de la ERS destaca que el papel del soporte social y el uso de técnicas específicas para la modificación de la conducta proporcionan mejor contacto y mayor motivación para el cambio, por lo que constituyen componentes centrales para lograr una mayor efectividad de las intervenciones conductuales37.
En la práctica se debería motivar a los pacientes con EPOC para que incrementen su nivel de AF y transmitirles de forma clara los beneficios que aporta a la enfermedad38. Las estrategias dirigidas a incrementar la motivación para la realización de AF y, por lo tanto, la adherencia a la práctica de AF debería contemplar unos objetivos específicos, medibles, alcanzables, realistas y por escrito, por lo que se debe conseguir que el paciente desempeñe un papel activo en el control de su enfermedad37,38.
Estrategias de autocuidadoLos pacientes con EPOC deberían poder participar en programas de educación encaminados a enseñar las habilidades necesarias en el manejo de la enfermedad. Comprende las actividades orientadas a mantener y mejorar el estado de salud, el bienestar y asegurar una adecuada adherencia y cumplimiento terapéutico. Los aspectos más importantes son42:
- –
Protegerse de las sustancias nocivas del ambiente (mascarillas).
- –
Mantener en el domicilio un ambiente óptimo.
- –
Realizar de forma correcta el tratamiento farmacológico y no farmacológico.
- –
Realizar ejercicio de forma regular.
- –
Asegurar una higiene del sueño: establecer rutinas para acostarse, levantarse y descansar. Evitar la toma de alimentos que contengan cafeína y alcohol.
- –
Realizar adaptaciones para llevar a cabo la higiene personal, en caso en donde la disnea pudiera interferir.
- –
Utilizar ropa holgada, adecuada a cada época del año.
- –
No renunciar a disfrutar y mantener el interés en realizar actividades lúdicos-sociales.
Se dispone de escasa información en relación con la implantación del modelo de atención a crónicos en pacientes con enfermedades respiratorias crónicas, como la EPOC. El grupo de Adams et al.43 demostró que los pacientes con EPOC que recibieron intervenciones con 2o más componentes precisaron menos ingresos hospitalarios por exacerbación grave de la EPOC y un menor tiempo de estancia hospitalaria.
Convivir con una enfermedad crónica no es fácil, y menos cuando el tratamiento autoadministrado es complejo. Conseguir una adecuada adhesión terapéutica es uno de los retos más importantes y una pieza clave en el tratamiento, aunque resulta un proceso complejo al estar influido por múltiples factores: relacionados con el paciente, con el profesional, con el sistema sanitario, con la enfermedad y con los propios fármacos44.
El objetivo de la ET es ayudar al paciente a adquirir los recursos necesarios para gestionar óptimamente su vida, estar informado y participar en la toma de decisiones sobre su salud y su enfermedad compartidas con el profesional sanitario que le atiende44,45.
La OMS aconseja que todo paciente con enfermedad crónica debería tener acceso a programas estructurados de ET y a un plan individualizado de tratamiento, siendo imprescindible que los profesionales de la salud adquieran los conocimientos necesarios para poder desarrollar estos programas, aunque actualmente el nivel de formación en este campo es limitado45.
Para poder planificar un programa de ET individualizado hay que tener en cuenta las prioridades del paciente, la complejidad del tratamiento, los modelos de salud y efectuar una evaluación global del paciente basada en 5 dimensiones: el modelo de salud, los factores socioeconómicos, los factores relacionados con el tratamiento, los relacionados con el paciente y, finalmente, los relacionados con la enfermedad45.
La EPOC presenta una baja adhesión terapéutica que genera un aumento de las exacerbaciones, del número de hospitalizaciones y de la mortalidad46. La ET por sí sola no tiene impacto en la utilización de recursos sanitarios y en el estado funcional del paciente, sin embargo, acompañados de otras intervenciones, los resultados son positivos47.
La revisión Cochrane48 demuestra que las intervenciones de autocuidado en pacientes con EPOC se asocian a una mejoría de la calidad de vida, una reducción de los ingresos hospitalarios y una mejoría en la percepción de disnea. Sin embargo, la heterogeneidad de las intervenciones, la diversidad de las poblaciones estudiadas, los diferentes períodos de seguimiento y la variedad de las medidas de resultado dificultan la formulación de recomendaciones claras con respecto a la forma y el contenido más efectivos de autocuidado en la EPOC, por lo tanto de ET.
El último consenso de expertos de la ERS49 concluye que un programa de autocuidado debe ser estructurado, personalizado y multicomponente con la finalidad de motivar, participar y apoyar a los pacientes para adaptarse de forma positiva a comportamientos saludables y desarrollar habilidades para gestionar mejor su enfermedad y cumplir el tratamiento.
Los estudios publicados no son concluyentes en concretar el programa de ET óptimo para la EPOC, aunque un metaanálisis reciente mostró que la mayor duración de las intervenciones de autocuidados genera una reducción de las hospitalizaciones por todas las causas50.
El grupo de trabajo de GesEPOC propone los componentes esenciales de un programa de ET para la EPOC y los elementos que hay que valorar para determinar el grado de adhesión del paciente (tabla 3). Los materiales de soporte utilizados para el desarrollo de las intervenciones educativas deben basarse en las guías clínicas y deben estar validados51,52.
Aspectos que debería incluir un programa de educación terapéutica
| Conocer la enfermedad |
| Asegurar la administración del tratamiento de forma correcta |
| Saber identificar de forma temprana las exacerbaciones y saber cómo actuar |
| Incorporar y mantener un estilo de vida con los cambios recomendados |
| Evitar comportamientos de riesgo |
| Acudir a las citas programadas |
| Conocimiento y control de las comorbilidades |
| Tener una actitud proactiva |
El mantenimiento de un estado nutricional óptimo en los pacientes con enfermedades respiratorias es crucial. En la repercusión de la desnutrición sobre el aparato respiratorio se ven afectados la musculatura respiratoria, el parénquima pulmonar y el sistema inmunitario53,54.
La valoración del estado nutricional del paciente se convierte en una necesidad para poder detectar de forma temprana a los sujetos con mayor riesgo de desnutrición y establecer el grado de soporte nutricional que se va a aplicar. La valoración de estos pacientes debe incluir: estudio dietético, antropométrico (peso, talla, índice de masa corporal, pliegue cutáneo), estudio hematológico, bioquímico e inmunológico55. Técnicas como la bioimpedancia eléctrica son muy útiles para conocer la composición corporal. En pacientes con déficits nutricionales y sin déficits se deberían seguir las estrategias indicadas en la tabla 4.
Estrategias de alimentación
| Se deben realizar de 5 a 6 comidas al día, repartidas en pequeñas cantidades, comer despacio y masticar bien |
| Consumir al menos 5 raciones de frutas y verduras, que debería cubrir 600g de frutas y hortalizas al día |
| Consumir pescado de 2 a 3 veces en semana, considerando que al menos 2sean de pescado azul (sardina, boquerón, bonito, caballa, salmón) |
| Disminuir el consumo de grasa animal |
| Usar preferentemente aceite de oliva virgen para cocinar y condimentar |
| No consumir alimentos muy fríos o muy calientes, ya que pueden provocar sensación de tos o ahogo |
| Tomar abundantes líquidos (aproximadamente 1,5. 2 litros), siempre que no haya contraindicación al respecto |
| No se recomienda el consumo de bebidas alcohólicas por el riesgo establecido de producir otras enfermedades |
La obesidad es otro aspecto importante y cada vez más frecuente en la EPOC. Puede limitar la capacidad de ejercicio, producir restricción respiratoria y agravar la disnea. En estos casos, es esencial el consejo dietético. Un hecho importante es valorar la disfagia en pacientes con enfermedad respiratoria crónica para minimizar complicaciones56,57.
Hemos descrito en este artículo los puntos más importante que debemos tener en cuenta desde el punto de vista del tratamiento no farmacológico en pacientes EPOC y que hemos resumidos de forma muy sintetizada en la tabla 5. Remarcamos, la importancia de este artículo para señalar la importancia del tratamiento no farmacológico para el correcto manejo de los pacientes.
Puntos clave en el tratamiento no farmacológico del paciente EPOC
| La rehabilitación pulmonar mejora la disnea, la capacidad de ejercicio y la calidad de vida |
| Los programas de rehabilitación pulmonar son seguros |
| Actualmente, deberíamos evitar el inicio de la rehabilitación pulmonar durante el ingreso hospitalario |
| La aplicación de programas domiciliarios de mantenimiento es una alternativa válida a la rehabilitación realizada en el hospital desde las fases iniciales de la enfermedad |
| Evitar el sedentarismo y estimular la actividad y el ejercicio físico cotidiano es beneficioso para el paciente con EPOC y debe recomendarse de forma generalizada |
| La prescripción de AF debe ser individualizada y debe tener en cuenta la capacidad de ejercicio, la morbilidad o discapacidad, el entorno familiar y social, y los factores de comportamiento y culturales del paciente con EPOC |
| La atención integrada y el papel activo del paciente son básicos en el manejo de las enfermedades crónicas |
| Todo paciente crónico debe tener acceso a programas estructurados de educación terapéutica y un plan individualizado de tratamiento |
| Un programa de autocuidado debe ser estructurado, personalizado y multicomponente |
| La valoración del estado nutricional del paciente se convierte en una necesidad, para evitar desnutrición y obesidad |
Marc Miravitlles ha recibido honorarios por impartir conferencias de Boehringer Ingelheim, Chiesi, Cipla, Menarini, Rovi, Bial, CSL Behring, Grifols y Novartis; honorarios por asesoría científica de Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Bial, Gebro Pharma, CSL Behring, Laboratorios Esteve, Mereo Biopharma, Verona Pharma, pH Pharma, Novartis y Grifols, y fondos para investigación de GlaxoSmithKline and Grifols, aunque ninguno guarda relación con el artículo presentado.
El resto de autores declaran no tener ningún conflicto de intereses.
ANEXO. Organización de GesEPOCCoordinador: Marc Miravitlles, Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Integrantes del grupo de trabajo: Myriam Calle, Borja García-Cosío, Juan Antonio Riesco, Eusebi Chiner, Ciro Casanova y Juan José Soler-Cataluña (SEPAR). Joan B. Soriano (SEPAR-epidemiología). Julio Ancochea, coordinador científico de la estrategia en EPOC del SNS (SEPAR). Pere Almagro, Sociedad Española de Medicina Interna (SEMI). Elena Gimeno (SEPAR-Fisioterapia). Eulogio Pleguezuelos, Sociedad Española de Rehabilitación y Medicina Física y Sociedad de Rehabilitación Cardio-Respiratoria (SERMEF/SORECAR). José Antonio Quintano, Sociedad Española de Médicos de Atención Primaria (SEMERGEN). Juan Antonio Trigueros, Sociedad Española de Médicos Generales y de Familia (SEMG). Jesús Molina, Sociedad Española de Medicina de Familia y Comunitaria (SemFYC). Pere Simonet, Sociedad de Respiratorio en Atención Primaria (GRAP). Pascual Piñera y Adolfo Simón, Sociedad Española de Medicina de Urgencias y Emergencias (SEMES). Carme Hernández y Carmen Mata (SEPAR-Enfermería). Leopoldo Palacios y Carlos Verdejo, Sociedad Española de Geriatría y Gerontología (SEGG). María Emilia Carretero Díaz, Foro Español de Pacientes (FEP). David Rigau y Ena Pery Niño de Guzman Quispe, Centro Cochrane Iberoamericano (Barcelona).